Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Неметаллы
Содержание
- 1. Неметаллы
- 2. Классификация элементов МеталлыНеметаллыТвёрдые, имеют металлический блеск, тепло- и электропроводны, ковкие и пластичные.Газы, жидкости, твёрдые вещества.
- 3. 23 неметалла
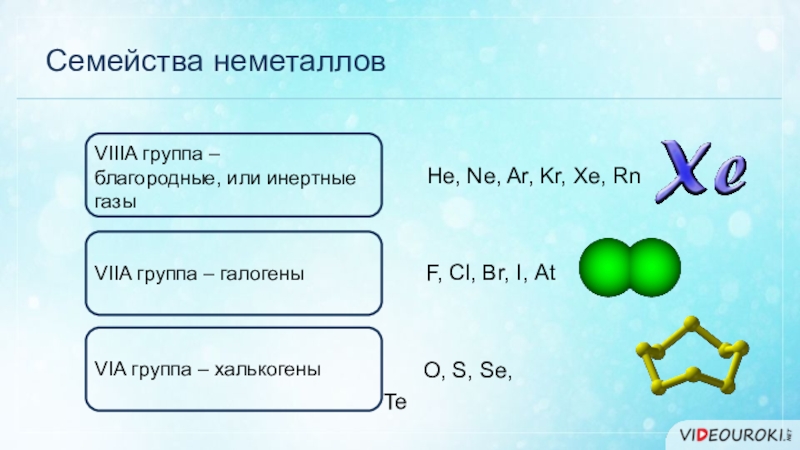
- 4. Семейства неметалловVIIIA группа – благородные, или инертные
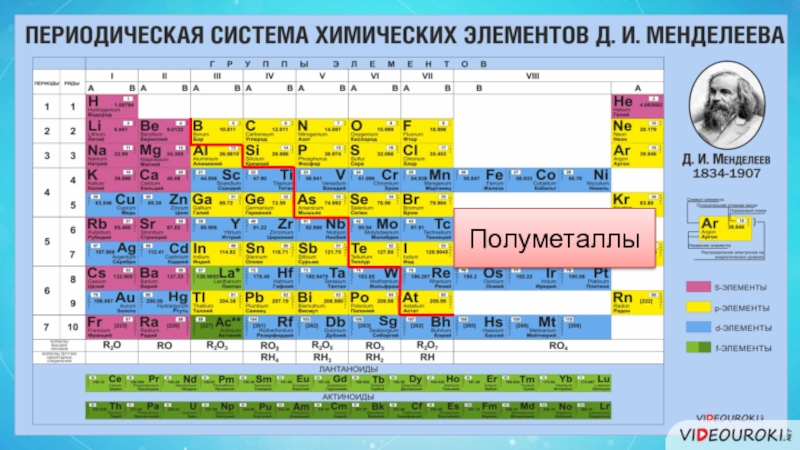
- 5. Полуметаллы
- 6. Строение атомов неметаллов1Н ─ водород1s12Не ─ гелий1s25В
- 7. Слайд 7
- 8. Электроотрицательность Cs0,8Na0,9Mg1,2Al1,6B2,0H2,1S2,5Cl3,0O3,5F4,0Электроотрицательность неметаллов гораздо выше, чем металлов. Э + nē → Эn-
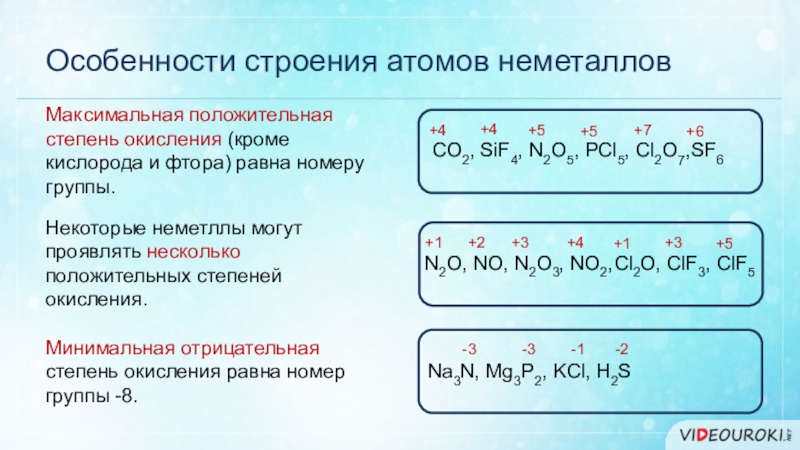
- 9. Особенности строения атомов неметалловМаксимальная положительная степень окисления
- 10. Характерные степени окисленияОтрицательныеПоложительныеВ соединениях с атомами металлов,
- 11. Нахождение неметаллов в природеМассовая доля неметаллов во
- 12. Нахождение неметаллов в природеОРГАНОГЕННЫЕ ЭЛЕМЕНТЫС, O, H, N, P, SSe, Br, I являются жизненно необходимыми элементами
- 13. Селен оберегает клетки от вредного воздействия ультрафиолетового
- 14. В природе неметаллы встречаются как в виде
- 15. Особенности молекул и атомов неметалловМолекулыАтомыОдноатомными (благородные газы);
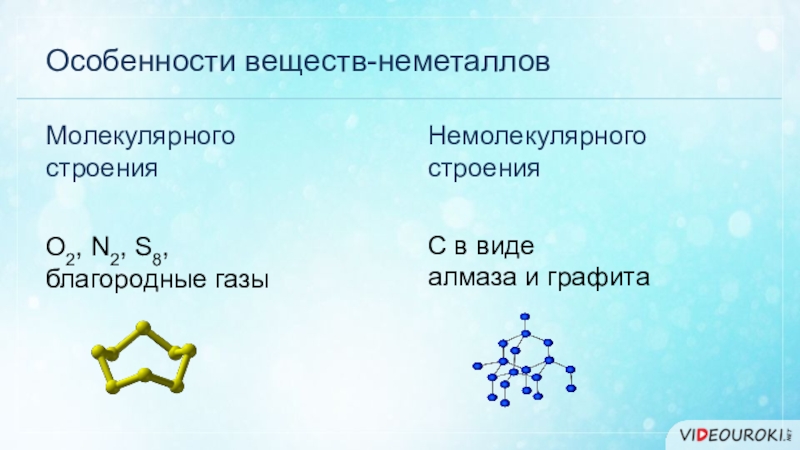
- 16. Особенности веществ-неметалловМолекулярного строенияНемолекулярного строенияO2, N2, S8, благородные газыС в виде алмаза и графита
- 17. Физические свойства неметалловГазы: кислород, водород, азот, фтор,
- 18. Физические свойства неметалловТемпература плавления графита составляет 3850
- 19. Радиоактивный радон используется в медицине для лечения опорно-двигательного аппарата, сердечных и нервных заболеваний.«радоновая проблема»
- 20. Явление аллотропииАллотропия (от греч. аллотропия – другое
- 21. В природе озон образуется при грозовых разрядах.
- 22. Озон образуется при окислении смолы хвойных деревьев.
- 23. Озон в верхних слоях атмосферы образует озоновый слой, который защищает живые организмы от ультрафиолетового излучения.
- 24. Небольшое количество озона в воздухе оказывает целебное
- 25. Явление аллотропииГрафитАлмазУглерод встречается в нескольких аллотропных модификациях:
- 26. Химические свойства неметалловНаиболее химически активны галогены и
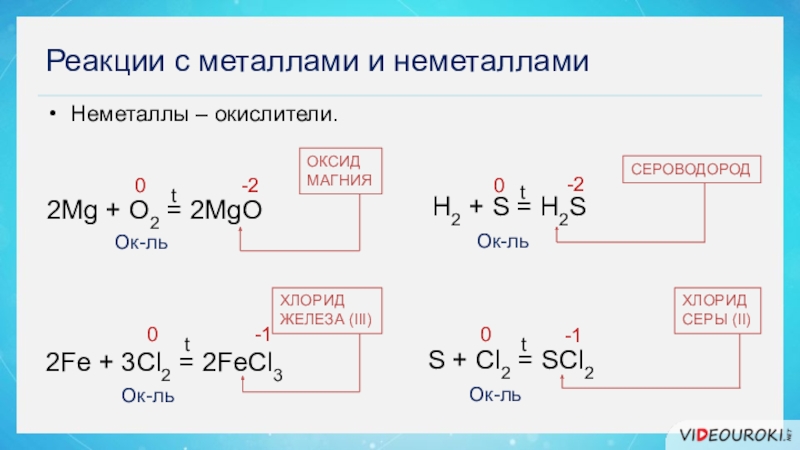
- 27. Реакции с металлами и неметалламиОКСИДМАГНИЯХЛОРИДЖЕЛЕЗА (III)2Fe +
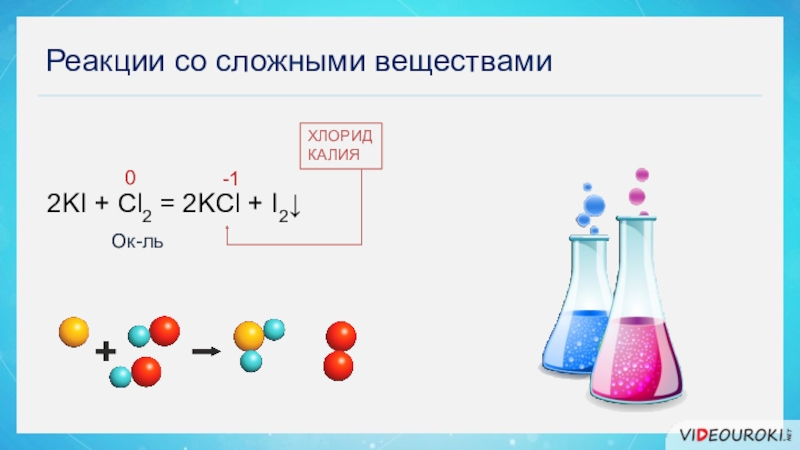
- 28. Реакции со сложными веществамиХЛОРИДКАЛИЯ2KI + Cl2 = 2KCl + I2↓0-1Ок-ль
- 29. Реакции с простыми и сложными веществамиОКСИДСЕРЫ (IV)Неметаллы
- 30. Все неметаллы являются элементами главных групп. Атомы
- 31. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Классификация элементов
Металлы
Неметаллы
Твёрдые, имеют металлический блеск, тепло- и электропроводны, ковкие
и пластичные.
Слайд 4Семейства неметаллов
VIIIA группа –
благородные, или инертные
газы
VIIA группа –
галогены
VIA группа – халькогены
He, Ne, Ar, Kr, Xe, Rn
F, Cl,
Br, I, AtO, S, Se, Te
Слайд 6Строение атомов неметаллов
1Н ─ водород
1s1
2Не ─ гелий
1s2
5В ─ бор
2s22р1
У атомов
большинства неметаллов на внешнем энергетическом уровне от 4 до 8
электронов.6С ─ углерод
2s22р2
14Si ─ кремний
3s23р2
7N ─ азот
2s22р3
15Р ─ фосфор
3s23р3
Число электронов на внешнем уровне численно равно номеру группы.
Слайд 8Электроотрицательность
Cs
0,8
Na
0,9
Mg
1,2
Al
1,6
B
2,0
H
2,1
S
2,5
Cl
3,0
O
3,5
F
4,0
Электроотрицательность неметаллов гораздо выше, чем металлов.
Э + nē
→ Эn-
Слайд 9Особенности строения атомов неметаллов
Максимальная положительная степень окисления (кроме кислорода и
фтора) равна номеру группы.
Некоторые неметллы могут проявлять несколько положительных
степеней окисления. Минимальная отрицательная степень окисления равна номер группы -8.
CO2, SiF4, N2O5, PCl5, Cl2O7,SF6
+4
+4
+5
+5
+7
+6
Cl2O, ClF3, ClF5
N2O, NO, N2O3, NO2,
+1
+2
+3
+4
+1
+3
+5
Na3N, Mg3P2, KCl, H2S
-3
-3
-1
-2
Слайд 10Характерные степени окисления
Отрицательные
Положительные
В соединениях с атомами металлов, водорода и других
менее электроотрицательных элементов.
В соединениях с более электроотрицательными элементами.
NaCl, H2S, NH3,
CH4HClO, SO2, NO2
-1
-2
-3
-4
+1
+4
+4
Благородные газа – ксенон и криптон – в своих соединениях со фтором и кислородом также способны проявлять положительные степени окисления +2, +4, +6 и +8.
Исключение составляет фтор, который в соединениях может проявлять только степень окисления -1.
Слайд 11Нахождение неметаллов в природе
Массовая доля неметаллов во Вселенной достигает 99%.
О – 49%
На долю брома, йода, селена и теллура приходится
сотые доли процента.Si – 28%
Слайд 12Нахождение неметаллов в природе
ОРГАНОГЕННЫЕ ЭЛЕМЕНТЫ
С, O, H, N, P, S
Se,
Br, I являются жизненно необходимыми элементами
Слайд 13Селен оберегает клетки от вредного воздействия ультрафиолетового и радиоактивного облучения.
Употребление продуктов, содержащих селен в больших количествах, больше 5 мг
на 1 кг пищи, приводит к острому отравлению организма человека.Слайд 14В природе неметаллы встречаются как в виде простых веществ (N2,
O2), так и в виде сложных соединений.
Слайд 15Особенности молекул и атомов неметаллов
Молекулы
Атомы
Одноатомными (благородные газы);
двухатомными (галогены, О2,
N2 и H2);
содержащие большее число атомов (О3, Р4, S8).
Атомы углерода
образуют цепи неограниченной длины;атомы кремния образуют недлинные цепи (до шести атомов).
Слайд 16Особенности веществ-неметаллов
Молекулярного
строения
Немолекулярного
строения
O2, N2, S8,
благородные газы
С в виде
алмаза и графита
Слайд 17Физические свойства неметаллов
Газы: кислород, водород, азот, фтор, хлор ,благородные, или
инертные газы;
жидкость – бром;
остальные неметаллы – твёрдые вещества,
которые имеют атомную кристаллическую решётку, как у B, Si, так и молекулярную, как у I2, P4, S8.Многие неметаллы обладают окраской: графит – серо-чёрный, бром – красно-бурой, сера – жёлтой, хлор – жёлто-зелёной, йод – фиолетово-чёрной.
Слайд 18Физические свойства неметаллов
Температура плавления графита составляет 3850 0С, у гелия
-272 0С;
самая маленькая плотность у водорода (0,09 г/дм3), а
самая большая – у радона (9,73 г/дм3);в воде неметаллы нерастворимы или малорастворимы;
галогены, сера лучше растворяются в органических растворителях, а белый фосфор – в сероуглероде.
большинство неметаллов – это изоляторы.
графит – проводник электрического тока, кремний, селен и теллур –полупроводники.
твёрдые неметаллы не обладают пластичностью;
Слайд 19Радиоактивный радон используется в медицине для лечения опорно-двигательного аппарата, сердечных
и нервных заболеваний.
«радоновая
проблема»
Слайд 20Явление аллотропии
Аллотропия (от греч. аллотропия – другое свойство) явление существования
элементов в виде нескольких простых веществ.
Кислород, О2
Озон, О3
Газ без цвета
и запаха;Газ светло-голубого цвета с резким характерным запахом;
различия в температурах плавления и кипения, в реакционной способности.
Слайд 23Озон в верхних слоях атмосферы образует озоновый слой, который защищает
живые организмы от ультрафиолетового излучения.
Слайд 24Небольшое количество озона в воздухе оказывает целебное действие на людей
с заболеванием лёгких.
Источником озона служат работающие ксероксы, лазерные принтеры, источники
ультрафиолетового и рентгеновского излучения.Слайд 25Явление аллотропии
Графит
Алмаз
Углерод встречается в нескольких аллотропных модификациях: графит, алмаз, карбин,
фуллерен.
Мягкое серо-чёрное вещество;
хорошо проводит электрический ток.
Прозрачный кристалл;
самое твёрдое природное вещество;
является
изолятором. Слайд 26Химические свойства неметаллов
Наиболее химически активны галогены и кислород;
сера, фосфор, углерод
и кремний вступают в химические реакции, как правило, только при
нагревании;для неметаллов характерны и восстановительные, и окислительные свойства;
способность неметаллов проявлять те или иные свойства определяется положением их в ряду электроотрицательности.
F → O → Cl → N → Br → S → C → H
Слайд 27Реакции с металлами и неметаллами
ОКСИД
МАГНИЯ
ХЛОРИД
ЖЕЛЕЗА (III)
2Fe + 3Cl2 = 2FeCl3
Неметаллы
– окислители.
t
t
СЕРОВОДОРОД
ХЛОРИД
СЕРЫ (II)
t
2Mg + O2 = 2MgO
t
0
-2
0
-1
Ок-ль
Ок-ль
H2 +
S = H2S0
-2
Ок-ль
S + Cl2 = SCl2
0
-1
Ок-ль
Слайд 29Реакции с простыми и сложными веществами
ОКСИД
СЕРЫ (IV)
Неметаллы – восстановители.
t
t
t
0
+4
0
+4
В-ль
В-ль
0
-2
0
-1
S +
O2 = SO2
2Fe2O3 + 3C = 4Fe + 3CO2↑
Реакции диспропорционирования.
6KOH
+ 3S = 2K2S + СУЛЬФИД
КАЛИЯ
СУЛЬФИТ
КАЛИЯ
+4
H2O + Cl2 ↔ HCl + HClO
+1
+ K2SO3 + 3H2O
Слайд 30Все неметаллы являются элементами главных групп.
Атомы неметаллов могут проявлять
как отрицательные, так и положительные степени окисления.
Простые вещества неметаллы существенно
различаются между собой физическими и химическими свойствами. Для неметаллов характерно явление аллотропии.
В химических реакциях неметаллы могут проявлять окислительные и восстановительные свойства.