Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Обмен нуклеотидов Матричные биосинтезы
Содержание
- 1. Обмен нуклеотидов Матричные биосинтезы
- 2. Актуальность темыНуклеотиды и их производные выполняют многообразные
- 3. План лекцииОбразование фосфорибозилдифосфата (ФРДФ) – ключевой момент
- 4. Цель лекцииЗнать:Основные метаболические пути превращения пуриновых и
- 5. Вспомните самостоятельно из курса химии, используя слайды
- 6. Строение нуклеиновых кислотФункция: хранение, передача, реализация наследственной
- 7. Пентозы в структуре нуклеиновых кислот
- 8. Первичная структура НК: последовательность нуклеотидовХимические связи:1 -
- 9. Вторичная структура ДНК: двойная спиральПравозакрученная спираль
- 10. Третичная структура ДНК: нуклеопротеидные комплексы (хромосомы)Гистоновые белки:
- 11. Структура нуклеосом
- 12. Пространственная структура РНКОдноцепочечнаяШпильки – спирализованные участки (водородные
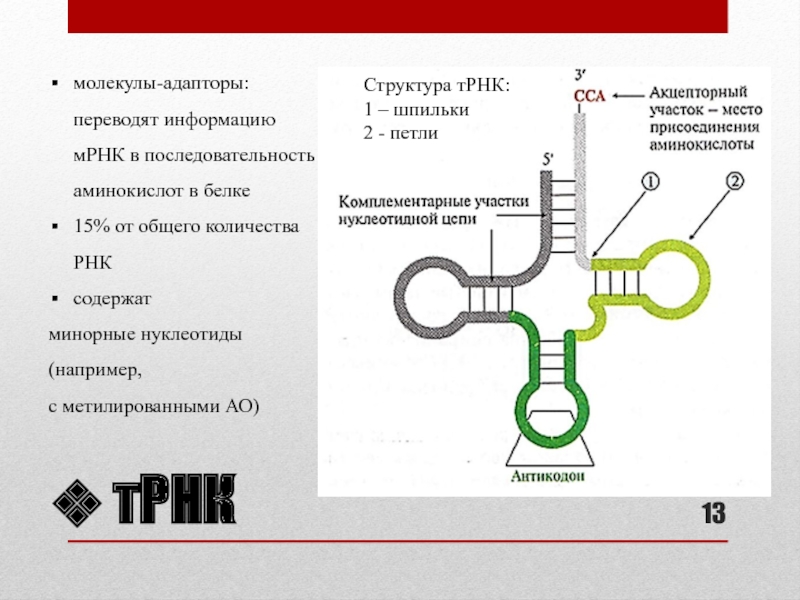
- 13. тРНКСтруктура тРНК:1 – шпильки2 - петлимолекулы-адапторы: переводят
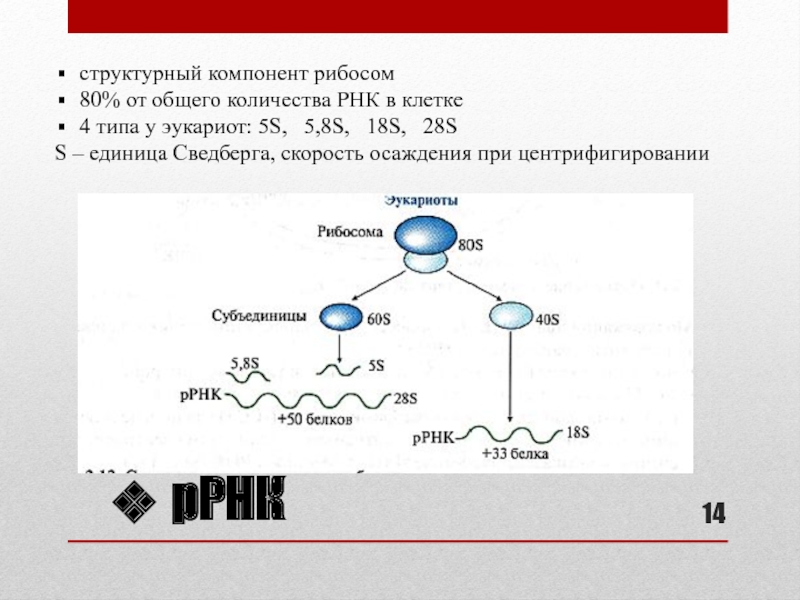
- 14. рРНК структурный компонент рибосом80% от общего количества
- 15. Образование фосфорибозилдифосфата (ФРДФ)Продукты расщепления нуклеиновых кислот тканей
- 16. Синтез пуриновых нуклеотидов: основные этапы (см. схему
- 17. Слайд 17
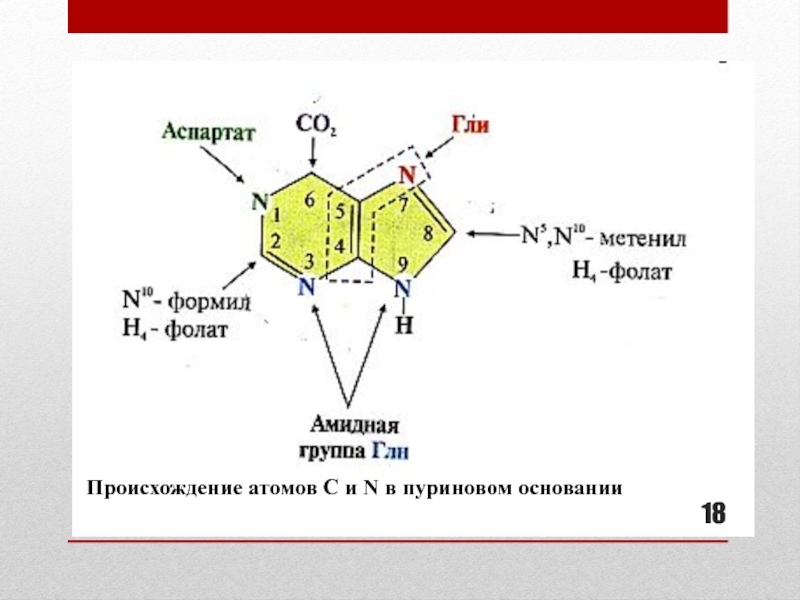
- 18. Происхождение атомов С и N в пуриновом основании
- 19. Образование АМФ и ГМФ из ИМФ Образование
- 20. Слайд 20
- 21. Ферменты синтеза АМФ И ГМФ: подписи к
- 22. Регуляция синтеза пуриновых нуклеотидовАллостерические ферменты:ФРДФ-синтетазаамидофосфорибозилтрансферазаИМФ-дегидрогеназаАденилосукцинатсинтетазаОтрицательные эффекторы: АМФ, ГМФ
- 23. Запасные пути синтеза пуриновых нуклеотидов : роль
- 24. Пути спасения в синтезе пуриновых нуклеотидов
- 25. Ферменты «пути спасения» в синтезе пуриновых нуклеотидов К слайду 24:1 – гипоксантин-гуанинфосфорибозилтрансфераза2 – аденинфосфорибозилтрансфераза3 - аденозинкиназа
- 26. Катаболизм пуриновых нуклеотидовОтщепление фосфата, аминогруппы, рибозы с
- 27. Схема реакций катаболизма пуриновых нуклеотидов
- 28. Ферменты катаболизма пуриновых нуклеотидовК слайду 27:1 –
- 29. Нарушения обмена пуриновых нуклеотидовДефект генов ферментовгиперактивация или
- 30. Синтез пиримидиновых нуклеотидовОсновные этапы синтеза:Формирование пиримидинового кольца
- 31. Образование оротата и УМФ глутамин + СО2
- 32. Нарушения образования оротатаМутация в гене УМФ-синтазы приводит
- 33. Фосфорилирование УМФ и образование ЦТФФосфорилирование УМФ: образование
- 34. Регуляция синтеза пиримидиновых нуклеотидовАллостерическая регуляция по механизму
- 35. Катаболизм пиримидиновых нуклеотидовОтщепление остатков фосфорной кислоты и
- 36. Образование дезоксирибонуклеотидовОбразование дНДФ (А, Г, Ц, У)
- 37. «Работа» рибонуклеотидредуктазы
- 38. Регуляция активности рибонуклеотидредуктазного комлпексаАллостерический ферментОтрицательные эффекторы: дНТФдАТФ
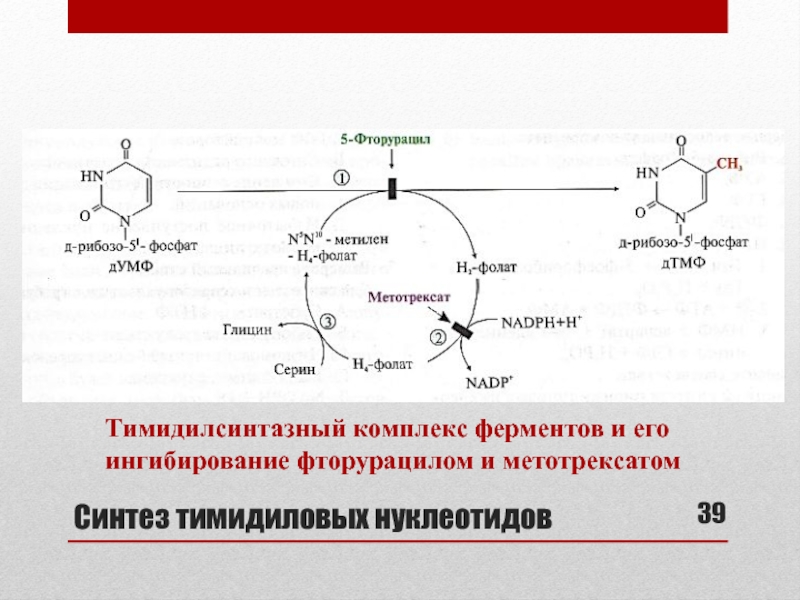
- 39. Синтез тимидиловых нуклеотидовТимидилсинтазный комплекс ферментов и его ингибирование фторурацилом и метотрексатом
- 40. Тимидилсинтазный комплекс ферментов1- Тимидилсинтаза (включение одноуглеродного радикала
- 41. Задание для самостоятельной работыИзучить информацию по теме:
- 42. Заключение «Обмен нуклеотидов»Большая часть используемых в клетках
- 43. Литература по теме «Обмен нуклеотидов»1. Биохимия с упражнениями
- 44. Матричные биосинтезыРепликацияТранскрипцияТрансляция
- 45. РЕПЛИКАЦИЯ: синтез ДНКПротекает в ядре в S-фазу
- 46. 1 этап репликации: инициацияФормирование репликативной вилки:ДНК-топоизомераза гидролизует
- 47. Схема инициации репликации
- 48. 2 этап репликации: элонгацияСинтез новых цепей ДНКЛидирующая
- 49. 3 этап репликации: терминацияИсключение праймеровЗавершение формирования отстающей
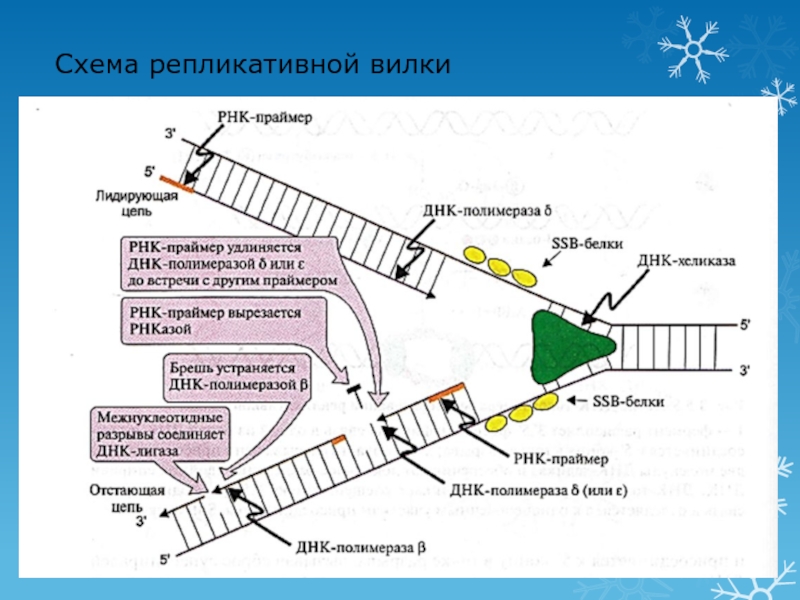
- 50. Схема репликативной вилки
- 51. Репарация ошибок и повреждений ДНКПричина повреждений ДНК:действие
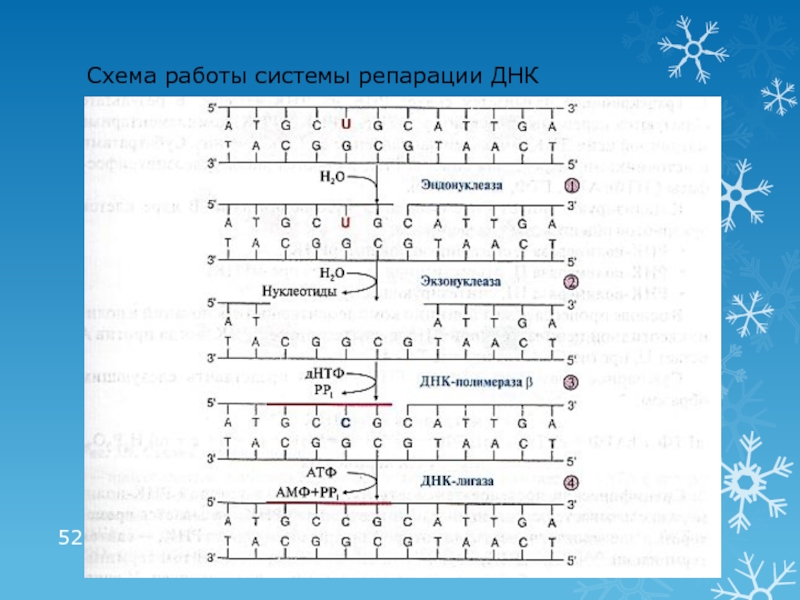
- 52. Схема работы системы репарации ДНК
- 53. Роль системы репарацииРепарация необходима для сохранения генома
- 54. ТРАНСКРИПЦИЯ: синтез РНКПротекает в ядре вне зависимости
- 55. 1 этап транскрипции: инициацияПромотор – последовательность ДНК
- 56. 2 этап транскрипции: элонгация и терминацияЭлонгация: рост
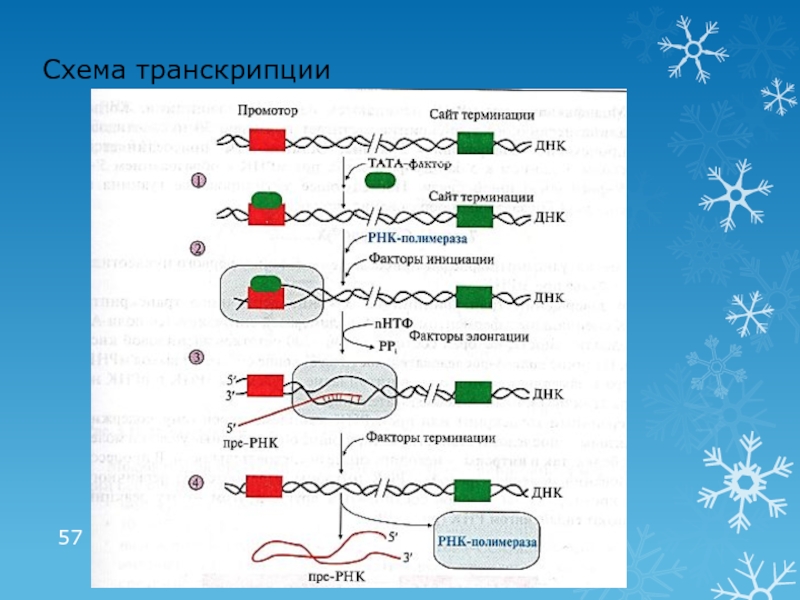
- 57. Схема транскрипции
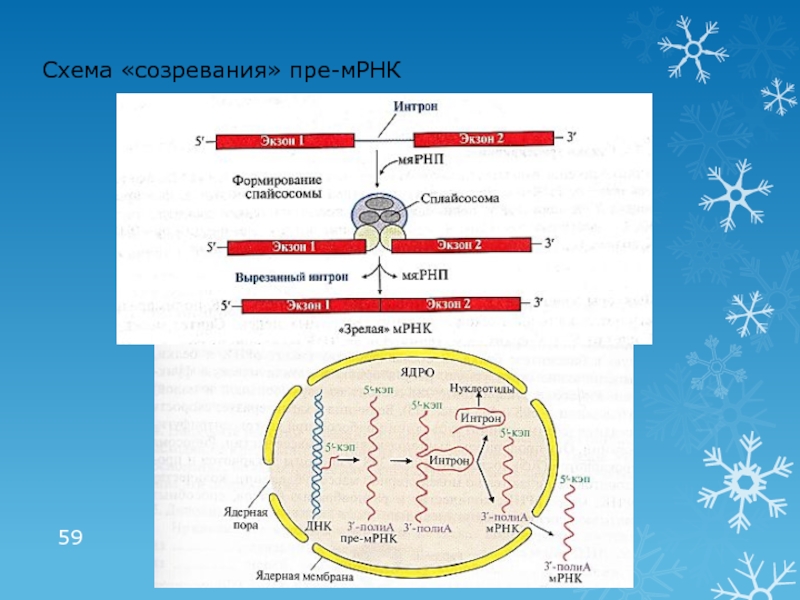
- 58. Посттранскрипционные модификации пре-РНК «Созревание» пре-мРНК«Кэпирование» на
- 59. Схема «созревания» пре-мРНК
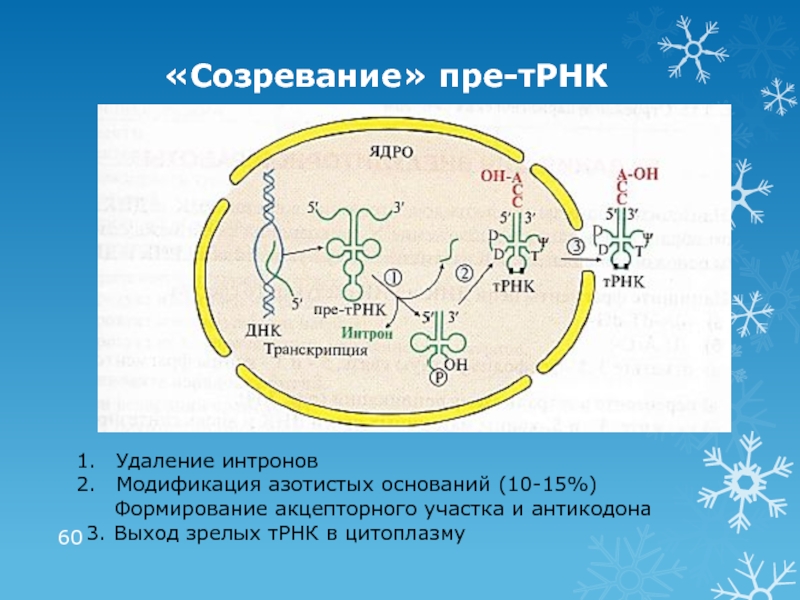
- 60. «Созревание» пре-тРНКУдаление интроновМодификация азотистых оснований (10-15%)
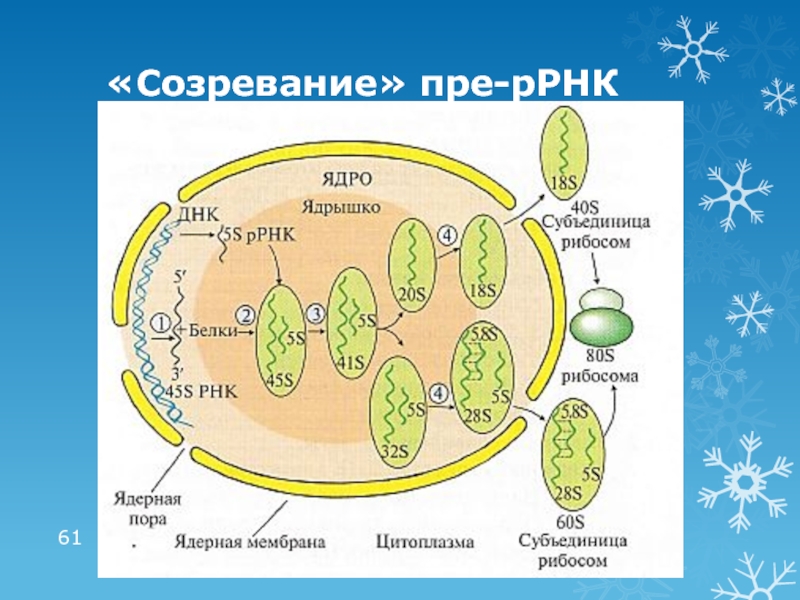
- 61. «Созревание» пре-рРНК
- 62. ТРАНСЛЯЦИЯ: синтез белкаМесто синтеза: рибосомы
- 63. Свойства биологического кодаТриплетностьНаличие терминирующих кодонов (UAA, UAG, UGA)СпецифичностьВырожденностьУниверсальностьОднонаправленностьКолинеарность
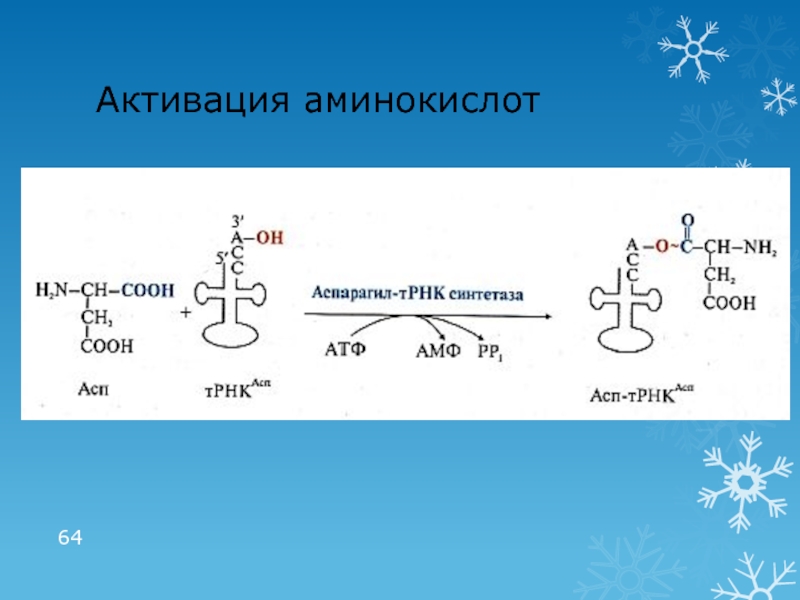
- 64. Активация аминокислот
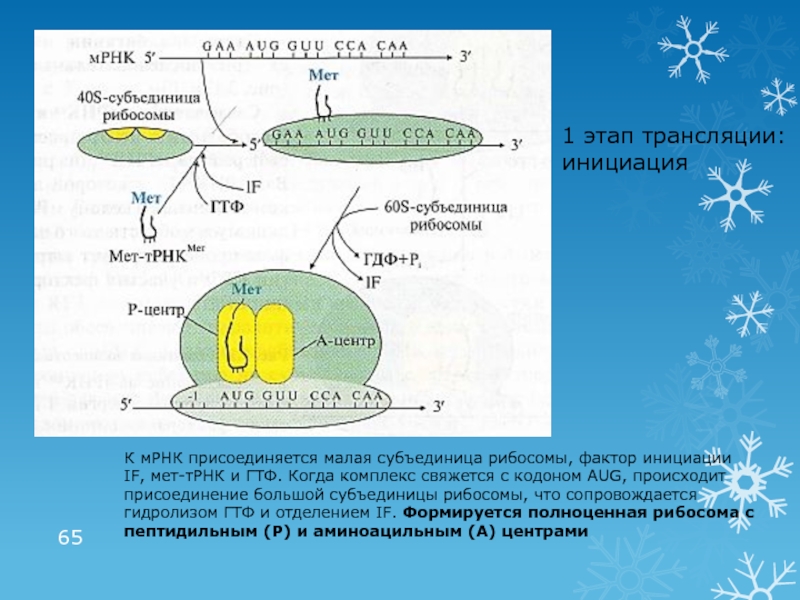
- 65. 1 этап трансляции: инициацияК мРНК присоединяется малая
- 66. 2 этап трансляции: элонгация (рост пептидной цепи)Стадии
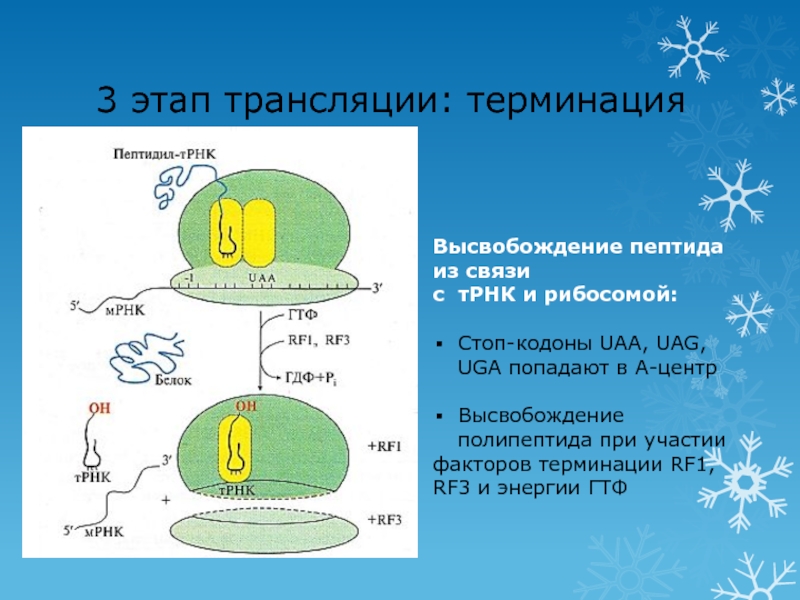
- 67. 3 этап трансляции: терминацияВысвобождение пептида из связис
- 68. Посттрансляционные модификации белков – образование функционально активных
- 69. Регуляция матричных биосинтезовЭкспрессия генов — процесс, в
- 70. Адаптивная регуляция обеспечивает изменение скорости экспрессии генов
- 71. Примеры ингибиторов матричных биосинтезовТоксин белой поганки аманитин
- 72. Задание для самостоятельной работыИзучить информацию по теме:
- 73. Заключение «Матричные биосинтезы»Процессы репликации, транскрипции, трансляции (матричные
- 74. Литература по теме «Матричные биосинтезы»Биологическая химия: учебник
- 75. Скачать презентанцию
Актуальность темыНуклеотиды и их производные выполняют многообразные функции в организме человека: участвуют в синтезе нуклеиновых кислот, нуклеотидных коферментов (NAD, NADP, FAD, FMN), участвуют в образовании активных форм углеводов (УДФ-глюкоза), аминокислот (SAM),
Слайды и текст этой презентации
Слайд 1Лекция 8.
Обмен нуклеотидов
Матричные биосинтезы
Дисциплина: С.2.Б.5 биологическая химия, биохимия полости
рта
Слайд 2Актуальность темы
Нуклеотиды и их производные выполняют многообразные функции в организме
человека: участвуют в синтезе нуклеиновых кислот, нуклеотидных коферментов (NAD, NADP,
FAD, FMN), участвуют в образовании активных форм углеводов (УДФ-глюкоза), аминокислот (SAM), «энергетических молекул» (АТФ, ГТФ), участвуют в передаче сигнала гормонов в клетку (цАМФ, цГМФ).Нарушение процессов обмена нуклеотидов лежит в основе патогенеза некоторых заболеваний человека (подагра, мегалобластная анемия, иммунодефицитные состояния).
Нуклеиновые кислоты – биомолекулы, участвующие в хранении и передаче наследственной информации. Синтез нуклеиновых кислот и белков (матричные биосинтезы) – основа роста организма.
Методы молекулярной биологии – основа современной диагностики и терапии (ПЦР-анализ, генная терапия).
В основе механизма действия ряда противовирусных и противоопухолевых препаратов лежит ингибирование процессов синтеза нуклеотидов и нуклеиновых кислот.
Слайд 3План лекции
Образование фосфорибозилдифосфата (ФРДФ) – ключевой момент в синтезе нуклеотидов
Синтез
и катаболизм пуриновых нуклеотидов: ход процесса, регуляция, «запасные» пути синтеза.
Нарушения обмена пуриновых нуклеотидовСинтез и катаболизм пиримидиновых нуклеотидов: ход процесса, регуляция. Нарушения обмена пиримидиновых нуклеотидов
Образование дезоксирибонуклеотидов
Матричные биосинтезы: репликация, транскрипция, трансляция
Синтез нуклеотидов и матричные биосинтезы – мишень действия противоопухолевых, противовирусных и антибактериальных лекарственных препаратов (задание для самостоятельной работы, см. слайд 41 и 72 )
Слайд 4Цель лекции
Знать:
Основные метаболические пути превращения пуриновых и пиримидиновых нуклеотидов
Химико-биологическую сущность
процессов репликации, транскрипции, трансляции
Использовать знания об обмене нуклеотидов, синтезе нуклеиновых
кислот и белков для понимания механизмов роста и сохранения генома, механизмов возникновения заболеваний, связанных с нарушением изучаемых процессов, механизма действия противоопухолевых, противовирусных и антибактериальных лекарственных препаратов Слайд 5Вспомните самостоятельно
из курса химии, используя слайды 6-14
Пуриновые и пиримидиновые
азотистые основания
Структура пуриновых и пиримидиновых нуклеотидов. Виды химических связей в
нуклеотидахСтроение и роль нуклеиновых кислот (ДНК и РНК) Виды РНК и особенности их строения
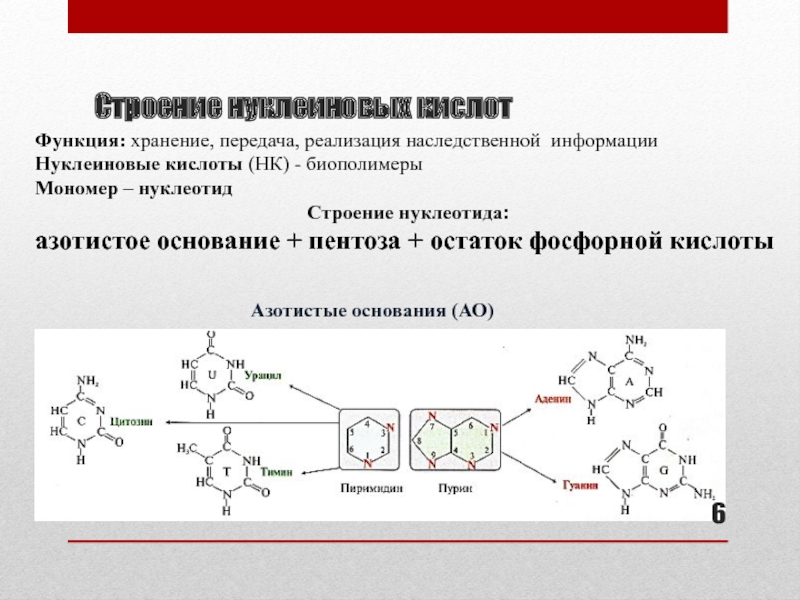
Слайд 6Строение нуклеиновых кислот
Функция: хранение, передача, реализация наследственной информации
Нуклеиновые кислоты (НК)
- биополимеры
Мономер – нуклеотид
Строение нуклеотида:
азотистое основание + пентоза + остаток
фосфорной кислотыАзотистые основания (АО)
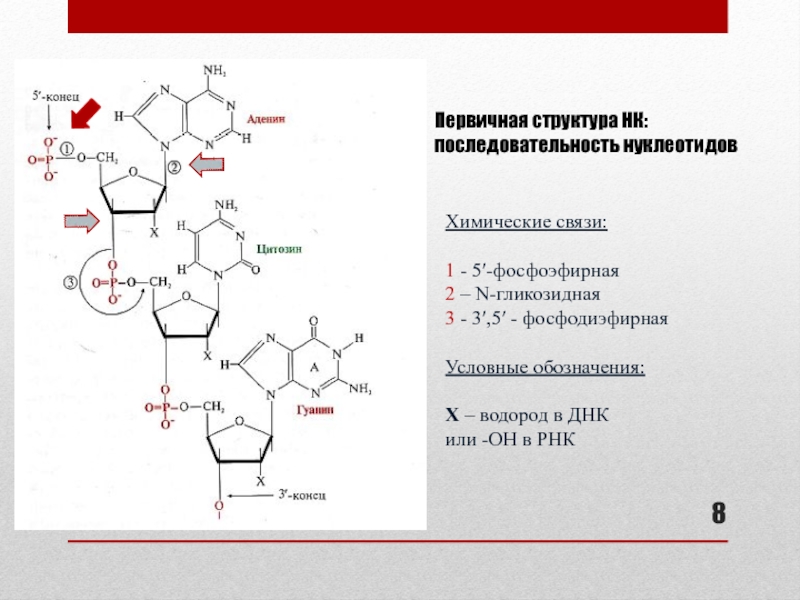
Слайд 8Первичная структура НК: последовательность нуклеотидов
Химические связи:
1 - 5′-фосфоэфирная
2 – N-гликозидная
3
- 3′,5′ - фосфодиэфирная
Условные обозначения:
Х – водород в ДНК
или -ОН
в РНК
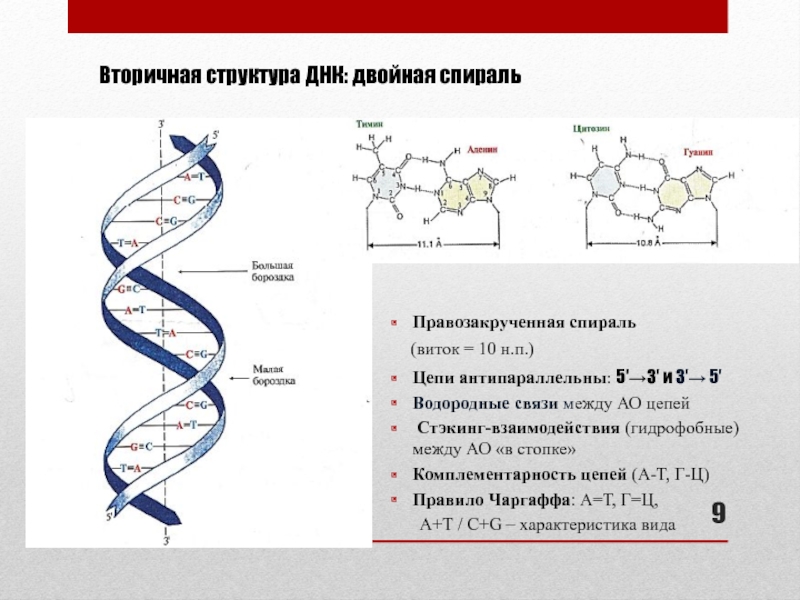
Слайд 9Вторичная структура ДНК: двойная спираль
Правозакрученная спираль
(виток =
10 н.п.)
Цепи антипараллельны: 5′→3′ и 3′→ 5′
Водородные связи между АО
цепей Стэкинг-взаимодействия (гидрофобные) между АО «в стопке»
Комплементарность цепей (А-Т, Г-Ц)
Правило Чаргаффа: А=Т, Г=Ц,
А+Т / C+G – характеристика вида
Слайд 10Третичная структура ДНК: нуклеопротеидные комплексы (хромосомы)
Гистоновые белки: белки с высоким
содержанием лиз и арг
5 типов: Н1, Н2А, Н2В, Н3, Н4
Негистоновые
белки: белки и ферменты, участвующие в матричных биосинтезахРоль белков: обеспечивают суперспирализацию и компактизацию ДНК
Нуклеосома
ДНК (≈146 н.п.) + 8 молекул гистонов (Н2А, Н2В, Н3, Н4)2
Структура удерживается ионными связями между лиз, арг и остатками Н3РО4
Линкерные участки
Участок ДНК (≈30 н.п.) между нуклеосомами, с которым связаны молекулы гистона Н1
Гетерохроматин – «компактный» хроматин, транскрипционно неактивный
Эухроматин – деспирализованный хроматин с низким содержанием гистонов и высоким содержанием негистоновых белков (период транскрипции)
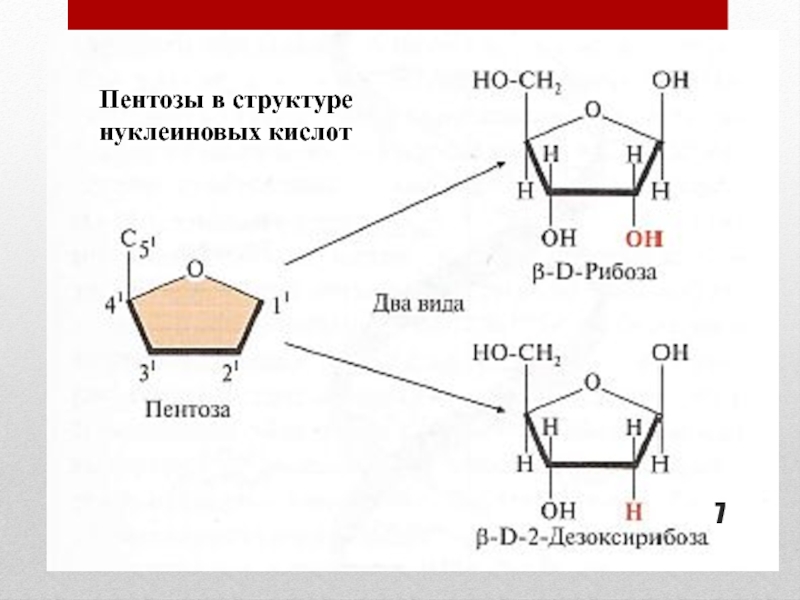
Слайд 12Пространственная структура РНК
Одноцепочечная
Шпильки – спирализованные участки (водородные связи)
Не соблюдается правило
Чаргаффа
Виды РНК:
мРНК
матрица в синтезе белка
2-4% от общего количества РНК, разнообразная
первичная структура5′ - «кэп»-конец: 7-метил ГТФ (защита от нуклеаз, участие в инициации трансляции)
3′ - поли(А)-«хвост»: 150-200 остатков АМФ (выход из ядра, защита от нуклеаз)
Слайд 13тРНК
Структура тРНК:
1 – шпильки
2 - петли
молекулы-адапторы: переводят информацию мРНК в
последовательность аминокислот в белке
15% от общего количества РНК
содержат
минорные нуклеотиды
(например,
с метилированными
АО)Слайд 14рРНК
структурный компонент рибосом
80% от общего количества РНК в клетке
4 типа
у эукариот: 5S, 5,8S, 18S, 28S
S –
единица Сведберга, скорость осаждения при центрифигированииСлайд 15Образование фосфорибозилдифосфата (ФРДФ)
Продукты расщепления нуклеиновых кислот тканей и пищи используются
повторно в незначительной степени.
Почти все клетки способны к синтезу нуклеотидов.
Образование
ФРДФ – центральное место в синтезе пуриновых и пиримидиновых нуклеотидовИсточник образования ФРДФ: рибозо-5-фосфат
(продукт ПФП окисления глюкозы)
рибозо-5-фосфат + АТФ → 5-фосфорибозил-1-дифосфат + АМФ (ФРДФ синтетаза)
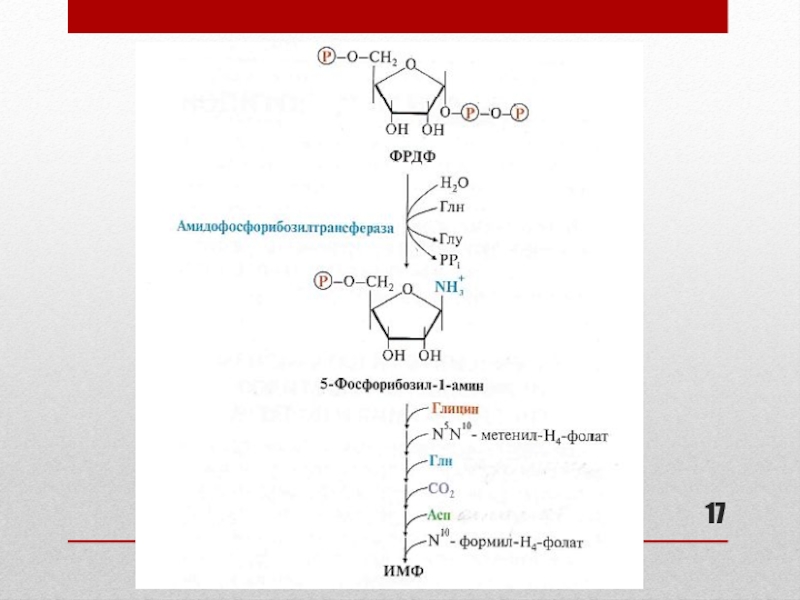
Слайд 16Синтез пуриновых нуклеотидов: основные этапы (см. схему реакций на слайде 17)
Сборка пуринового гетероциклического основания осуществляется на ФРДФ при участии глицина,
глутамина, аспартата, СО2 и одноуглеродных производных Н4-фолата в цитозоле:формирование 5-членного кольца
формирование 6-членного кольца
образование первого пуринового нуклеотида – инозинмонофосфата (ИМФ)
Синтез ИМФ включает 10 стадий и требует затрат 6 АТФ
образование АМФ и ГМФ
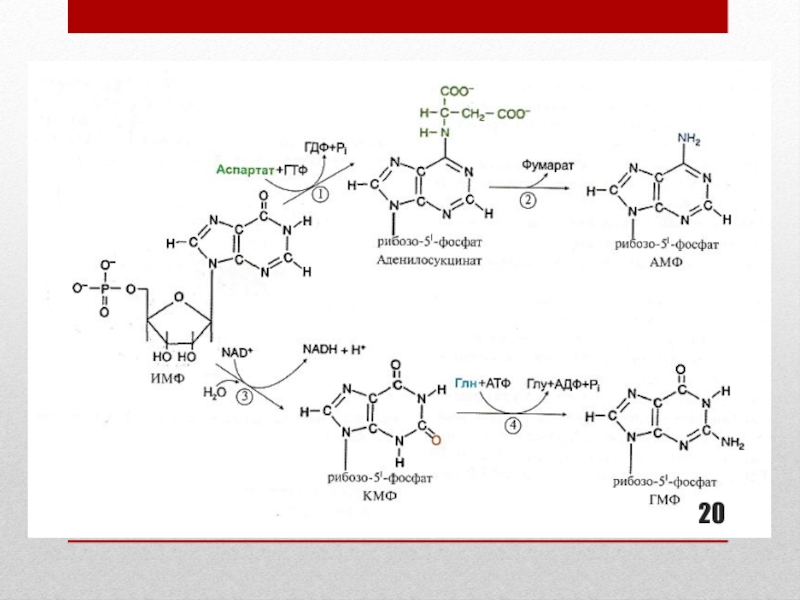
Слайд 19Образование АМФ и ГМФ из ИМФ
Образование АДФ, ГДФ, ГТФ
В образовании
АМФ из ИМФ участвует аспартат
В образовании ГМФ из ИМФ
участвует глутаминСхема реакций представлена на слайде 20.
Нуклеозидди- и трифосфаты синтезируются при участии АТФ и киназ:
АМФ + АТФ ↔ 2АДФ (аденилаткиназа)
ГМФ + АТФ → ГДФ + АДФ (гуанилаткиназа)
ГДФ + АТФ → ГТФ + АДФ
Внимание! Образование АТФ происходит только путем субстратного и окислительного фосфорилирования
Слайд 21Ферменты синтеза АМФ И ГМФ:
подписи к схеме слайда 20.
В синтезе
АМФ из ИМФ участвуют ферменты:
1 – аденилосукцинатсинтетаза
2 – аденилосукциназа
В синтезе
ГМФ из ИМФ участвуют ферменты:3 – ИМФ-дегидрогеназа
4 – ГМФ-синтетаза
КМФ – ксантозин-5-монофосфат
Слайд 22Регуляция синтеза пуриновых нуклеотидов
Аллостерические ферменты:
ФРДФ-синтетаза
амидофосфорибозилтрансфераза
ИМФ-дегидрогеназа
Аденилосукцинатсинтетаза
Отрицательные эффекторы: АМФ, ГМФ
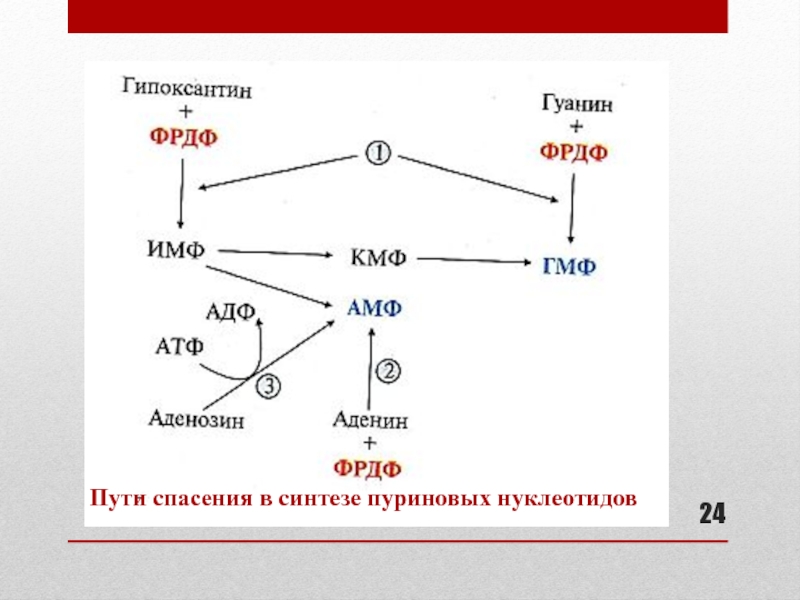
Слайд 23Запасные пути синтеза пуриновых нуклеотидов : роль «пути спасения»
В период
активного роста тканей синтез пуриновых нуклеотидов из простых предшественников не
способен полностью обеспечить нуклеиновые кислоты субстратами, поэтому в этих условиях важную роль играют «пути спасения»Слайд 25Ферменты «пути спасения» в синтезе пуриновых нуклеотидов
К слайду 24:
1
– гипоксантин-гуанинфосфорибозилтрансфераза
2 – аденинфосфорибозилтрансфераза
3 - аденозинкиназа
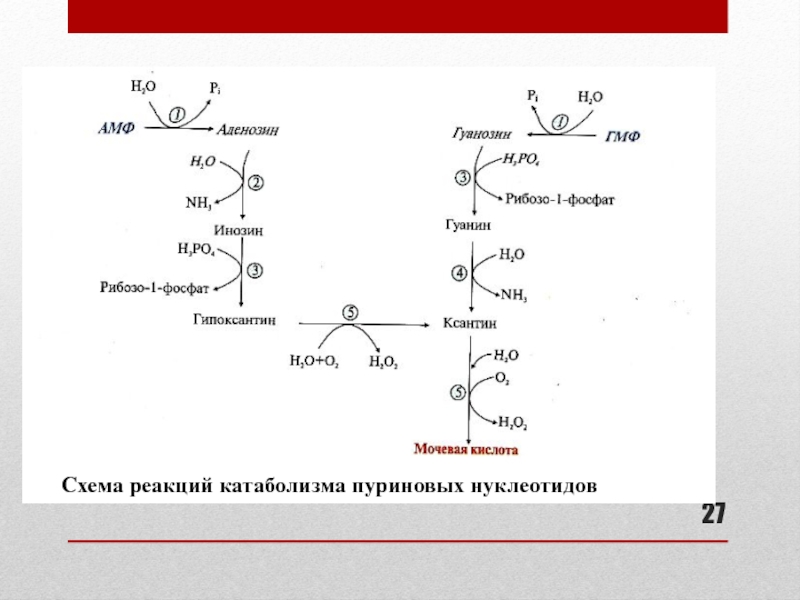
Слайд 26Катаболизм пуриновых нуклеотидов
Отщепление фосфата, аминогруппы, рибозы с образованием азотистых оснований
гипоксантина и ксантина (см. схему реакций на слайде 27)
Терминальный фермент
катаболизма: ксантиноксидаза (аэробная дегидрогеназа)Кофакторы: Fe 3+, Мо 2+, FAD
Конечный продукт: мочевая кислота
образуется в основном в печени и кишечнике
выводится с мочой и через кишечник
слабая кислота: в биологических жидкостях находится в комплексе с белками или в виде натриевой соли (ураты)
в крови: 0,15 – 0,47 ммоль/л (3-7 мг/дл)
выводится в сутки: 0,4 – 0,6 г мочевой кислоты и уратов
Слайд 28Ферменты катаболизма пуриновых нуклеотидов
К слайду 27:
1 – фосфатаза (нуклеотидаза)
2 –
аденозиндезаминаза
3 – пуриннуклеозидфосфорилаза
4 – гуаназа
5 - ксантиноксидаза
Слайд 29Нарушения обмена пуриновых нуклеотидов
Дефект генов ферментов
гиперактивация или устойчивость ФРДФ-синтетазы к
аллостерическим ингибиторам
снижение активности гипоксантин-гуанинфосфорибозилтрнасферазы (уменьшается повторное использование пуринов)
Подагра (гиперурикемия, отложение
мочевой кислоты в суставах)Аллопуринол (лекарственный препарат) – структурный аналог гипоксантина, используется в лечении подагры.
Каков механизм действия препарата?
Катаболизм пуринов останавливается на стадии гипоксантина, который лучше растворяется в жидкостях организма, чем мочевая кислота.
Слайд 30Синтез пиримидиновых нуклеотидов
Основные этапы синтеза:
Формирование пиримидинового кольца (оротата) из глутамина,
аспартата, СО2
Взаимодействие оротата с ФРДФ с образованием УМФ
Фосфорилирование УМФ
Образование ЦТФ
из УТФСлайд 31Образование оротата и УМФ
глутамин + СО2 + 2 АТФ
+ Н2О → карбамоилфосфат + 2 АДФ + Рi (карбамоилфосфатсинтетаза
II)присоединение аспартата (образование карбамоиласпартата), отщепление воды (образование циклического дигидрооротата)
Данные реакции катализирует мультиферментный комплекс КАД-фермент:
карбамоилфосфатсинтетаза
аспартаттранскарбамоилаза
дигидрооротаза
окисление дигидрооротата при участии NAD-дегидрогеназы с образованием оротата
реакция с ФРДФ: перенос фосфорибозила на оротат и декарбоксилирование оротидинфосфата с образованием УМФ (УМФ-синтаза: трансфераза и декарбоксилаза)
Слайд 32Нарушения образования оротата
Мутация в гене УМФ-синтазы приводит к нарушению образования
УМФ их оротата и вызывает наследственное заболевание, которое сопровождается оратацидурией
Клинические
проявления: мегалобластная анемия, нарушение работы ЖКТ, сердца, интеллектуальной и двигательной активностиПричина проявлений: «пиримидиновый голод»
Слайд 33Фосфорилирование УМФ и
образование ЦТФ
Фосфорилирование УМФ: образование УТФ
УМФ + АТФ →
УДФ + АДФ
УДФ + АТФ → УТФ + АДФ
Реакции
катализируют киназыОбразование ЦТФ:
УТФ + глутамин + АТФ → ЦТФ + глутамат + АДФ +H3PO4
(ЦТФ синтетаза)
Слайд 34Регуляция синтеза пиримидиновых нуклеотидов
Аллостерическая регуляция по механизму отрицательной обратной связи:
УТФ
ингибирует КФС II в составе КАД-фермента
УМФ и ЦМФ ингибируют УМФ-синтазу
ЦТФ
ингибирует ЦТФ-синтетазуСлайд 35Катаболизм пиримидиновых нуклеотидов
Отщепление остатков фосфорной кислоты и рибозы (аналогично катаболизму
пуриновых нуклеотидов)
Пиримидиновые основания разрушаются ферментными системами: например
Цитозин → СО2 +
NH3 + бета-аланинБета-аланин включается в состав карнозина и ансерина (мышечные пептиды)
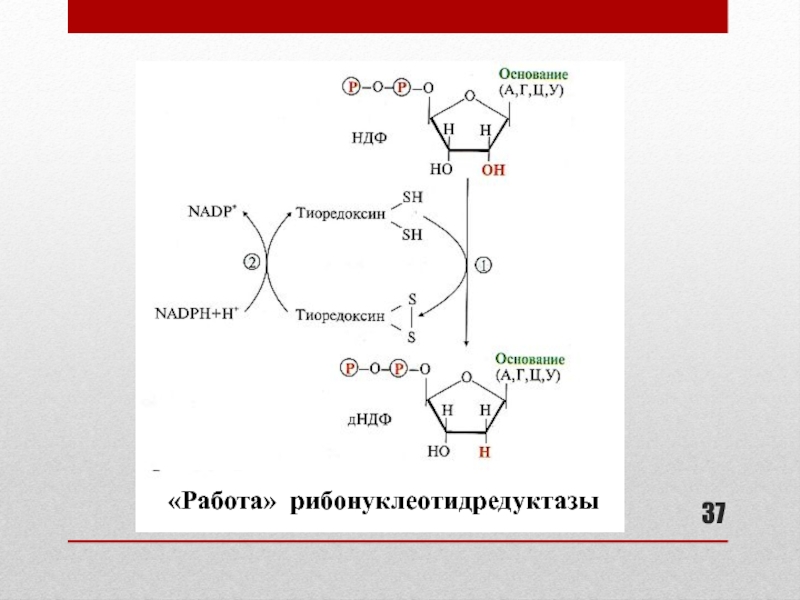
Слайд 36Образование дезоксирибонуклеотидов
Образование дНДФ (А, Г, Ц, У) из НДФ
Образование дТМФ
из дУМФ
Внутриклеточная концентрация дезоксирибонуклеотидов низкая
Активность процесса их образования повышается
перед делением клеток во время репликации2 ферментных комплекса:
рибонуклеотидредуктаза (восстановление рибонуклеотидов с образованием дезоксипроизводных):
рибонуклеотидредуктаза
белок-восстановитель тиоредоксин
тиоредоксинредуктаза
тимидилсинтаза
Слайд 38Регуляция активности рибонуклеотидредуктазного комлпекса
Аллостерический фермент
Отрицательные эффекторы: дНТФ
дАТФ – ингибитор восстановления
всех рибонуклеотидов
Иммунодефициты: накопление дАТФ, связанное со снижением активности аденозиндезаминазы (фермент
реакции гидролитического дезаминирования аденозина) приводит к ингибированию рибонуклеотидредуктазы и лишает клетки-предшественники В и Т-лимфоцитов образования дезоксирибонуклеотидов и синтеза ДНКСлайд 39Синтез тимидиловых нуклеотидов
Тимидилсинтазный комплекс ферментов и его ингибирование фторурацилом и
метотрексатом
Слайд 40Тимидилсинтазный комплекс ферментов
1- Тимидилсинтаза (включение одноуглеродного радикала в дУМФ)
2- Дигидрофолатредуктаза
3-
Сериноксиметилтрансфераза (перенос оксиметильной группы с серина на Н4-фолат с образованием
метилен-Н4-фолата)Слайд 41Задание для самостоятельной работы
Изучить информацию по теме: «Ферменты синтеза нуклеотидов
– мишени действия противоопухолевых и противовирусных препаратов» (см. список литературы)
Составить
таблицу (препарат – механизм действия – область применения) и охарактеризовать препараты: фторурацил, метотрексат, ацикловир, азидотимидинСлайд 42Заключение «Обмен нуклеотидов»
Большая часть используемых в клетках нуклеотидов синтезируется de
novo из простых предшественников (с участием аминокислот, производных фолиевой кислоты).
Центральное место в синтезе нуклеотидов занимает образование фосфорибозилдифосфата.«Запасные» пути синтеза (из имеющихся в клетке азотистых оснований и нуклеозидов) играют важную роль в образовании пуриновых нуклеотидов.
Нарушение катаболизма пуриновых нуклеотидов лежит в основе патогенеза подагры. Нарушение синтеза пиримидиновых нуклеотидов лежит в основе патогенеза мегалобластной анемии.
Механизм действия ряда противовирусных и противоопухолевых лекарственных препаратов связан с нарушением синтеза нуклеотидов (задание для самостоятельной работы).
Слайд 43Литература по теме «Обмен нуклеотидов»
1. Биохимия с упражнениями и задачами: учебник
для студентов ВУЗов / ред. С. Е. Северин. - М.: ГЭОТАР-Медиа,
2010. - 384 с. (С. 183-191, для выполнения самостоятельной работы «Лекарственные препараты-ингибиторы синтеза нуклеотидов» см. С. 189)2. Березов Т. Т. Биологическая химия: учебник для студ. мед. вузов / Т. Т. Березов, Б. Ф. Коровкин. - 3-е изд., перераб. и доп. - М.: Медицина, 2004. - 704 с. (глава 13, С. 470-478)
Слайд 45РЕПЛИКАЦИЯ: синтез ДНК
Протекает в ядре в S-фазу клеточного цикла перед
митозом
Стимулы: гормоны, ростовые факторы, белки-циклины
Матрица: обе нити ДНК, образуются 2
репликативные вилкиНаправление синтеза новых цепей: 5′ - 3′ по принципу комплиментарности и антипараллельности
Участки синтеза – ориджины репликации
Участок ДНК между соседними ориджинами - репликон
Этапы репликации: инициация, элонгация, терминация
Субстраты и источники энергии: дАТФ, дГТФ, дТТФ, дЦТФ
Кофактор: Mg2+
Полуконсервативный процесс синтеза: каждая дочерняя молекула ДНК содержит одну родительскую нить и одну синтезированную
Образуется идентичная молекула ДНК (клетка 4n)
Слайд 461 этап репликации: инициация
Формирование репликативной вилки:
ДНК-топоизомераза гидролизует 3′,5′-фосфодиэфирную связь в
одной из цепей ДНК и присоединяется к 5′-концу в точке
разрыва2. ДНК-хеликаза, используя энергию АТФ, разрывает водородные связи и обеспечивает локальное разделение двойной спирали ДНК
ДНК-топоизомераза восстанавливает 3′,5′-фосфодиэфирную связь и отделяется
SSB (single strand binding)–белки связываются с одноцепочечными участками, препятствуя комплементарному скручиванию цепей
Слайд 482 этап репликации: элонгация
Синтез новых цепей ДНК
Лидирующая цепь: 3′ -
5′ (синтез непрерывный по ходу движения репликативной вилки)
Отстающая цепь: 5′
- 3′ (рост этой цепи начинается после того, как на лидирующей цепи синтезируется участок из ≈200 нуклеотидов, синтез идет против движения репликативной вилки в виде фрагментов Оказаки)Синтез цепей начинается с образования «затравки» (РНК-праймера из ≈10 нуклеотидов)
Ферменты:
ДНК-полимераза α синтезирует РНК-праймер и небольшой участок ДНК
ДНК-полимераза δ удлиняет лидирующую цепь
ДНК-полимераза δ или ε удлиняют отстающую цепь
Слайд 493 этап репликации: терминация
Исключение праймеров
Завершение формирования отстающей цепи ДНК
Эндонуклеаза (РНКаза)
удаляет РНК-праймер
ДНК-полимераза β заполняет «брешь»
ДНК-лигаза объединяет фрагменты, затрачивая энергию АТФ
Слайд 51Репарация ошибок и повреждений ДНК
Причина повреждений ДНК:
действие факторов окружающей и
внутренней среды
Повреждение ДНК происходит с частотой от нескольких сотен до
1000 случаев в каждой клетке, каждый часВиды повреждений:
дезаминирование АО (цитозин превращается в урацил), метилирование АО
депуринизация, депиримидинизация
образование пиримидиновых димеров (действие УФО)
разрыв цепей, ковалентные сшивки между цепями
ошибки репликации
Система репарации – ферменты (нуклеазы, полимеразы, лигазы)
Слайд 53Роль системы репарации
Репарация необходима для сохранения генома и возможна благодаря
существованию 2-х цепей ДНК
Снижение активности ферментов репарации приводит к накоплению
мутацийПолагают, что от 80 % до 90 % всех раковых заболеваний связаны с нарушением репарации ДНК
ПРИМЕР: пигментная ксеродерма – наследственное заболевание, связанное с мутацией генов системы репарации ДНК; УФО таких больных приводит к накоплению мутаций в клетках кожи и развитию рака
Слайд 54ТРАНСКРИПЦИЯ: синтез РНК
Протекает в ядре вне зависимости от фаз клеточного
цикла
Матрица: нить ДНК 3′ - 5′
Субстраты и источники энергии: АТФ,
ГТФ, ЦТФ, УТФНаправление синтеза: 5′ - 3′ по принципу комплиментарности и антипараллельности
Этапы: инициация, элонгация, терминация
Участвуют факторы инициации, элонгации и терминации
Образуются комплиментарные матрице продукты: мРНК, тРНК, рРНК
Ферменты:
РНК-полимераза I (синтез пре-рРНК)
РНК-полимераза II (синтез пре-мРНК)
РНК-полимераза III (синтез пре-тРНК)
Слайд 551 этап транскрипции: инициация
Промотор – последовательность ДНК (ТАТА), с которой
связывается РНК-полимераза
Сайт терминации – участок завершения синтеза РНК
Транскриптон – участок
ДНК ограниченный промотором и сайтом терминации«Активация» промотора с помощью ТАТА-фактора
Взаимодействие промотора с РНК-полимеразой и факторами инициации
Факторы инициации обеспечивают расплетение двойной нити ДНК длиной в один виток (10 н.п.)
Слайд 562 этап транскрипции:
элонгация и терминация
Элонгация: рост нити пре-РНК
Факторы элонгации (E,
H, F) повышают активность РНК-полимеразы и облегчают расхождение цепей. Один
ген может одновременно транскрибироваться несколькими молекулами РНК-полимеразыТерминация: прекращение транскрипции
Факторы терминации облегчают отделение пре-РНК и РНК-полимеразы от матрицы ДНК
Слайд 58
Посттранскрипционные модификации пре-РНК
«Созревание» пре-мРНК
«Кэпирование» на стадии элонгации
Образование поли(А)- «хвоста» после
транскрипции
Сплайсинг – удаление интронов (некодирующих последовательностей) и соединение экзонов
Участвуют
малые ядерные рибонуклеопротеины (мяРНП), образующие комплексы – сплайсосомыВыход «зрелой» мРНК в цитоплазму
Альтернативный сплайсинг – механизм образования различных видов «зрелой» мРНК из одной и той же молекулы пре-мРНК в разных тканях
В результате в разных тканях при считывании информации с одного и того же гена образуются различные мРНК, а соответственно и различные белки
Слайд 60«Созревание» пре-тРНК
Удаление интронов
Модификация азотистых оснований (10-15%)
Формирование акцепторного участка
и антикодона
3. Выход зрелых тРНК в цитоплазму
Слайд 62ТРАНСЛЯЦИЯ: синтез белка
Место синтеза: рибосомы Матрица:
мРНК
Субстраты: аминокислоты (АК) Адапторы: тРНК
Источники энергии: АТФ, ГТФ
Кофактор: Mg
2+ (стабилизирует структуру рибосом)Факторы инициации (IF), элонгации (EF), терминации (RF)
Активация АК: связывание с тРНК (аминоацил-тРНК-синтетазы)
Инициирующая аминоацил-тРНК (аа-тРНК): мет-тРНК
Инициирующий кодон мРНК: AUG
Этапы: инициации, элонгации, терминации
Образуется колинеарный матрице продукт – белок (последовательность АК соответствует последовательности кодонов мРНК)
Биологический код: запись информации о последовательности АК в белке с помощью последовательности нуклеотидов
Из школьного курса биологии вспомните и объясните свойства биологического кода!
Слайд 63Свойства биологического кода
Триплетность
Наличие терминирующих кодонов (UAA, UAG, UGA)
Специфичность
Вырожденность
Универсальность
Однонаправленность
Колинеарность
Слайд 651 этап трансляции: инициация
К мРНК присоединяется малая субъединица рибосомы, фактор
инициации IF, мет-тРНК и ГТФ. Когда комплекс свяжется с кодоном
AUG, происходит присоединение большой субъединицы рибосомы, что сопровождается гидролизом ГТФ и отделением IF. Формируется полноценная рибосома с пептидильным (Р) и аминоацильным (А) центрамиСлайд 662 этап трансляции: элонгация (рост пептидной цепи)
Стадии элонгации:
Связывание аа-тРНК в
А-центре при участии фактора элонгации EF1 и с затратой энергии
ГТФОбразование пептидной связи между АК Р-центра и АК А-центра при участии пептидилтрансферазы
Перемещение рибосомы по мРНК (транслокация) в направлении от 5′- к 3′-концу с использованием энергии ГТФ и при участии фактора элонгации EF2
Многократное повторение стадий
Слайд 673 этап трансляции: терминация
Высвобождение пептида из связи
с тРНК и рибосомой:
Стоп-кодоны
UAA, UAG, UGA попадают в А-центр
Высвобождение полипептида при участии
факторов терминации
RF1, RF3 и энергии ГТФСлайд 68Посттрансляционные модификации белков – образование функционально активных белков
Частичный протеолиз
Фолдинг –
формирование пространственной структуры (II, III) при участии белков-шаперонов
Модификация аминокислот (гликозилирование,
фосфорилирование, ацилирование, метилирование……)Образование дисульфидных связей (цистеин-цистеин)
Присоединение простетической группы (сложные белки)
Сборка протомеров в олигомерные белки (формирование IV структуры)
Слайд 69Регуляция матричных биосинтезов
Экспрессия генов — процесс, в ходе которого наследственная
информация от гена (последовательности нуклеотидов ДНК) преобразуется в функциональный продукт
— РНК или белокГены белков «домашнего хозяйства» (конститутивные) экспрессируются с постоянной скоростью и обеспечивают жизнеспособность клеток (например, гены ферментов энергетического обмена)
Слайд 70
Адаптивная регуляция обеспечивает изменение скорости экспрессии генов в ответ на
меняющиеся условия среды (индуцибельная экспрессия). Осуществляется при участии:
регуляторных белков, взаимодействующих
с участками ДНК индукторов (стимулируют экспрессию) или корепрессоров (подавляют экспрессию)
Индукторы или корепрессоры стимулируют присоединение регуляторных белков к регуляторным участкам ДНК
В качестве индукторов и корепрессоров выступают гормоны, ростовые факторы, продукты метаболических путей
Регуляторные участки ДНК:
Энхансер – «усилитель» транскрипции
Сайленсер – «тушитель» транскрипции
ПРИМЕР:
ХОЛЕСТЕРИН (как корепрессор) → БЕЛОК-РЕГУЛЯТОР → САЙЛЕНСЕР → ПОДАВЛЕНИЕ ЭКСПРЕССИИ ГМГ-КоА-РЕДУКТАЗЫ (ключевой фермент синтеза холестерина) → СНИЖЕНИЕ СИНТЕЗА ХОЛЕСТЕРИНА
Слайд 71Примеры ингибиторов матричных биосинтезов
Токсин белой поганки аманитин ингибирует РНК-полимеразу II
(синтез мРНК)
Энтеротоксин возбудителя дифтерии ингибирует трансляцию, модифицируя фактор элонгации EF2
и нарушая транслокацию рибосомИнтерфероны (гликопротеины лимфоцитов и макрофагов, обладающие противовирусной активностью):
активируют РНК-азу, расщепляющую мРНК и рРНК
стимулируют синтез протеинкиназы, которая фосфорилирует и тем самым инактивирует фактор инициации трансляции IF2
прекращается синтез белков в инфицированных клетках человека, клетка погибает, но останавливается размножение вирусов
Слайд 72Задание для самостоятельной работы
Изучить информацию по теме: «Лекарственные препараты -
ингибиторы синтеза нуклеиновых кислот и белка» (см. список литературы)
Составить таблицу
(препарат – механизм действия – область применения) и охарактеризовать препараты: доксорубицин, циклофосфан, фторхинолоны, рифамицины (ингибиторы репликации и транскрипции), тетрациклин, эритромицин, левомицетин (ингибиторы трансляции)Охарактеризовать метод ПЦР-диагностики (см. список литературы)
Слайд 73Заключение «Матричные биосинтезы»
Процессы репликации, транскрипции, трансляции (матричные биосинтезы) лежат в
основе «производства» белков и ферментов, функционирование которых является основой жизни
Регуляция
данных процессов лежит в основе адаптации организмаНарушение данных процессов приводит к развитию заболеваний
Знания о нуклеиновых кислотах и механизмах матричных биосинтезов являются основой создания лекарственных препаратов, методов диагностики с использованием ДНК-технологий (ПЦР-диагностика) и методов терапии (генная терапия)
Слайд 74Литература по теме «Матричные биосинтезы»
Биологическая химия: учебник для студ. мед.
вузов / Т. Т. Березов, Б. Ф. Коровкин. - 3-е
изд., перераб.и доп. - М.: Медицина, 2004. - 704 с. (глава 3, 13 и 14)Биохимия с упражнениями и задачами: учебник для студ. мед. вузов / ред. Е. С. Северин. - М. : ГЭОТАР-Медиа, 2010. - 384 с. (раздел 3, С. 54-79; для выполнения самостоятельной работы «Лекарственные препараты-ингибиторы матричных биосинтезов» и «ПЦР-диагностика» см. С. 70, 73-77)