Слайд 1Общая характеристика металлов
Физические свойства
Металлический блеск.
Высокая отражательная способность в видимой части
спектра.
Непрозрачны даже в очень тонких слоях.
Плотная структура.
Пластичность, ковкость. Структуры
металлов нежесткие, сдвигаются друг относительно друга (кроме Sb, Bi).
Высокие тепло- и электропроводность
Классификация
1. По удельной плотности (тяжелые, легкие)
2. По температурам плавления (тугоплавкие, легкоплавкие)
3.По твердости(самый мягкий – Li, самый твердый – Cr).
Слайд 2Нахождение металлов в природе
содержание некоторых металлов в земной коре :
Al—
8,2%
Fe — 4,1%
Ca — 4,1%
Na — 2,3%
Mg — 2,3%
K -
2,1 %
В МОРСКОЙ ВОДЕ:
Na — 1,05%, Mg — 0,12%.
Организм человека на 3 % состоит из металлов. В клетках Са (в костях) и Na выступают в роли электролитов в межклеточной жидкости и цитоплазме. Mg -накапливается в мышцах и нервной системе, Cu — в печени, Fe — в крови.
Слайд 3Нахождение металлов в природе
Металлы с высоким ПИ находятся как в
виде соединений, так и в свободном состоянии (Au). Активные металлы
только в виде малорастворимых соединений, устойчивых к выветриванию.
Металлы I и II групп ПС в виде солей (но не оксидов).
Ti, Mn, Cr, Fe, Cu, Zr, Th, Al – в виде оксидов, т.к. они не растворимы в воде и не взаимодействуют с углекислым газом.
Hg, Cd, Zn, Sn, Sb, Bi, Ni, Co, Fe – в виде сульфидов.
Руды представляют в основном смеси минералов или сложных химических соединений.
Слайд 4Способы обогащения руд
1. Сепарация руд по удельной массе (Fe, Pb
–тяжелые, Al, Mg – легкие). Используют суспензии на основе кварцевого
песка.
2. Магнитная сепарация ( В основном для Fe-Ni-Co руд). Основана на магнитной восприимчивости.
3. Флотация. Основана на различной смачиваемости.
Слайд 5Способы получения металлов
1. Пирометаллургический
ЭО + С = СО
+ Э
(вместо С можно СО).
Так получают чугун,
сталь, Bi, Sn, Pb, Zn, Cu.
Если руда сульфидная, то вначале обжигают.
2. Металлотермия
ЭХ + М → МХ + Э
Х = Hal, O, M = Mg, Al, Na
Так получают Cr, Ti, U, Th, РЗЭ
3. Гидрометаллургический (извлечение М из руд в виде их соединений водными растворами реагентов с последующим выделением).
Используют в цветной металлургии (Au, Ag, Cu).
4. Электрометаллургический (электролиз растворов и расплавов). Получают Na, K, Al, Ti, Nb, Ta.
5. Порошковая металлургия
а. Восстановление соединений М водородом с последующим пресованием до слитка.
б. Термическое разложение карбонилов металлов.
Получают Ni, Co, Mn, Mo, Nb, Ge.
Слайд 6Физико-химический анализ
Сущность ФХА состоит в изучении какого-либо физического свойства системы
как функции состава или внешних условий.
Термины и понятия ФХА.
Система –
это совокупность тел (или 1 тело) в ограниченном объеме.
Различают гомогенные и гетерогенные системы.
Фаза – совокупность гомогенных частей системы с одинаковым составом и свойствами, отделенных от других частей системы поверхностями раздела. Сохранить фазу можно только при определенных условиях.
Компонент – химически однородная часть системы, которая при выделении из системы может существовать самостоятельно без изменения.
Число степеней свободы – число независимых переменных, которые можно изменять без нарушения состояния равновесия (без изменения числа фаз, количество каждой фазы изменяется). Переменные: давление (Р), температура (Т), концентрация компонента (с).
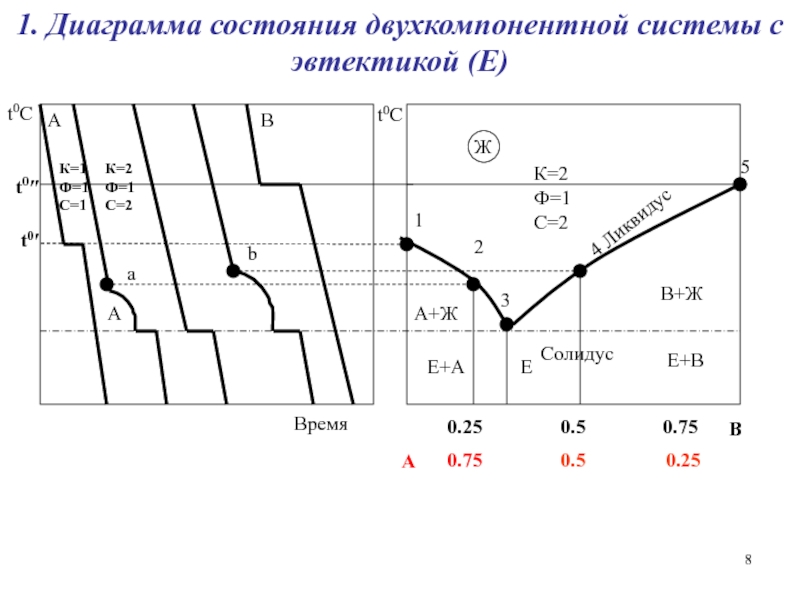
Слайд 7 Эвтектика – расплав, находящийся в равновесии с двумя или более
твердыми фазами. Это смесь мелких кристаллов компонентов, которые обычно плохо
растворяются друг в друге в твердом состоянии. Эвтектика характеризуется более низкой температурой плавления по сравнению с компонентами.
Правило фаз Гиббса:
Ф + С = К + 2.
Применимо к равновесным системам.
С = 0 - система нонвариантна (инвариантна)
С = 1 - система моновариантна
С = 2 - система бивариантна
Если компоненты не летучи, то Ф + С = К + 1
Физико-химический анализ
Слайд 81. Диаграмма состояния двухкомпонентной системы с эвтектикой (Е)
Время
A
B
4 Ликвидус
Солидус
К=2
Ф=1
С=2
А+Ж
В+Ж
Е+А
Е+В
Ж
Е
К=2
Ф=1
С=2
К=1
Ф=1
С=1
A
а
b
В
t0C
t0C
t0″
t0′
A
1
5
3
2
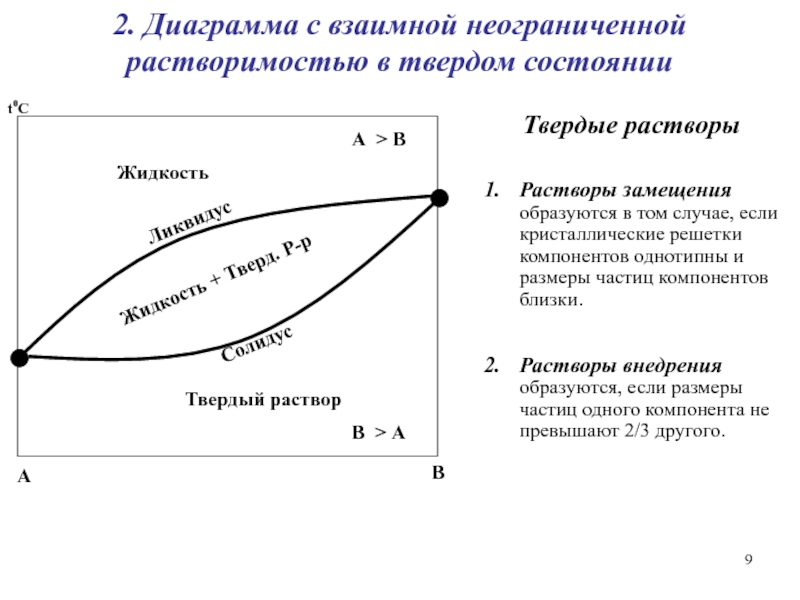
Слайд 9Ликвидус
Солидус
Жидкость + Тверд. Р-р
Твердый раствор
Жидкость
t0C
A
B
В > А
А > В
2. Диаграмма
с взаимной неограниченной растворимостью в твердом состоянии
Твердые растворы
Растворы замещения образуются
в том случае, если кристаллические решетки компонентов однотипны и размеры частиц компонентов близки.
Растворы внедрения образуются, если размеры частиц одного компонента не превышают 2/3 другого.
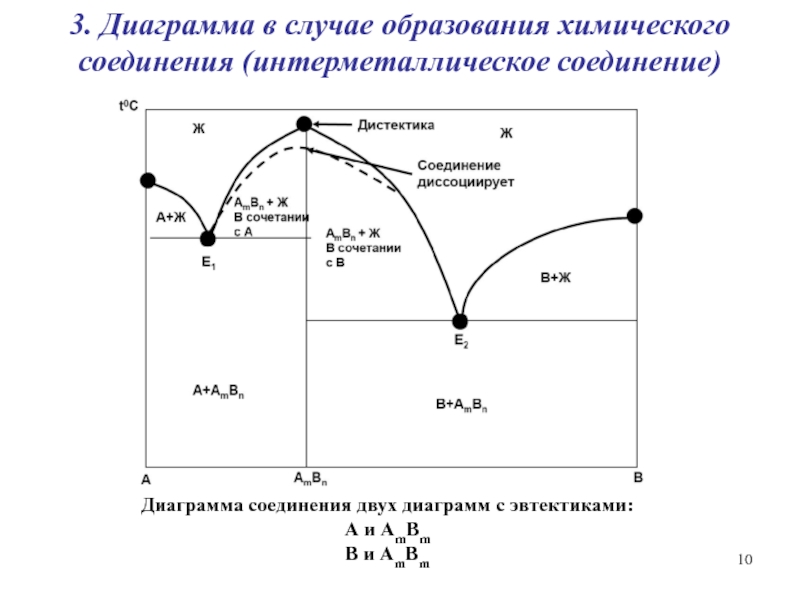
Слайд 103. Диаграмма в случае образования химического соединения (интерметаллическое соединение)
Диаграмма соединения
двух диаграмм с эвтектиками:
А и AmBm
B и AmBm
Слайд 11Металлохимия
На основе анализа диаграмм можно выделить несколько типов металлов:
1. М
взаимно растворяются в жидком состоянии, а в твердом образуют эвтектику
(Е).
2. М не взаимодействуют друг с другом ни в жидком, ни в твердом состояниях.
3. М образуют друг с другом жидкие и твердые растворы любого состава.
4. М образуют между собой одно или несколько металлических соединений (ИМС).
В основе геометрического анализа диаграмм лежат два принципа:
Принцип непрерывности. При непрерывном изменении параметров системы изменяются непрерывно свойства фаз и системы в целом (не возникают новые фазы и не исчезают старые).
Принцип соответствия. Каждой фазе, фазовому равновесию на диаграмме соответствует определенный геометрический образ.
Слайд 12Элементы I А подгруппы
Щелочные металлы
Электронная конфигурация – ns1
,
с.о. = 0, +1
Ионизация Э0 - е
= Э+
облегчается сверху вниз в подгруппе.
ПИ уменьшается от Li к Cs.
Пары ЩМ имеют характерное окрашивание:
лития – красное,
натрия – желтое,
калия – фиолетово-розовое,
рубидия – светло-розовое,
цезия – фиолетово-розовое.
Катионы ЩМ (Э+) не могут образовывать ковалентные связи, т.к. имеют оболочку инертного газа (n-1)s2p6ns1, кроме Li 1s22s1. Поэтому в гетероатомных соединениях преобладает ионный тип связи.
ЭОН + Н2
Li - спокойно, Na - горение, K -
горение со взрывом
Э + О2 Li2O (Na2O2) (нагревание),
Оксид Пероксид
ЭО2 (загораются самопроизвольно)
Надпероксиды (Э = K, Rb, Cs)
Э + Нal2 = 2 ЭHal (галогениды)
6 Э + N2 = 2 Э3N (нитриды)
2 Э + S = Э2S (сульфиды)
Элементы I А подгруппы
Слайд 14Гидроксиды – сильные основания
(LiOH – средней силы)
Соли: средние
и кислые, многие хорошо растворимы.
Малорастворимы: Li2CO3, Li2SiO3, Li3PO4, LiF.
В противоположность
Li и Na соли K, Rb, Cs следующего состава труднорастворимы:
ЭClO4, Э2PtCl6, Э3[Co(NO2)6]
Промышленное значение имеют:
Na2CO3 – сода,
NaHCO3 – питьевая сода,
K2CO3 - поташ
Элементы I А подгруппы
Слайд 15Элементы II А подгруппы
Электронная конфигурация – ns2 ,
с.о. = 0, +2
Ионизация: Э0 –
2е = Э2+ (n-1)s2(n-1)p6
(конфигурация инертного газа)
Ве амфотерен:
Ве + 2 Н3О+ + 2 Н2О = [Be(H2O)4]2+ + H2
Be + 2 OH- + 2 H2O = [Be(OH)4]2- + H2
В концентрированных кислотах Ве пассивируется (HNO3, H2SO4).
«Бериллиевые» лучи: 94Be + 42He = 10n + 126C.
Слайд 16Соединения с кислородом:
Э + О2
ВеО, MgO, CaO (оксиды),
BaO2, SrO2 (пероксиды).
Гидроксиды: растворимость возрастает от магния к барию.
Гидроксид магния не выпадает в осадок в присутствии солей аммония.
Соли однозарядных анионов растворимы хорошо или удовлетворительно, двух- и трехзарядных – плохо.
В присутствии солей аммония:
Be2+ + 2 (NH4)2CO3 = (NH4)2[Be(CO3)2] + 2 NH4+
Реакцию используют для отделения Ве2+ от Al3+
Be2+ + Na2CO3 xBe(OH)2yBeCO3
Соединения элементов II А подгруппы
Слайд 17Магний образует основный, средний и кислый карбонаты.
Для получения MgCO3
надо понизить рН до 8-9:
MgCl2 + 2 NaHCO3 = MgCO3
+ 2 NaCl + H2O + CO2
MgCO3 + H2O + CO2 = Mg(HCO3)2
Ca2+, Sr2+, Ba2+ не образуют основных карбонатов.
В ряду Ве – Ва растворимость сульфатов убывает, понижается энергия гидратации, поэтому Ca, Sr , Ba образуют безводные сульфаты.
В природе:
CaSO4 (ангидрит),
CaSO42H2O (гипс),
CaSO40.5H2O (алебастр).
Соединения элементов II А подгруппы
Слайд 18«Аномальные» электронные конфигурации
Элемент
Ожидаемые
Наблюдаемые
конфигурации конфигурации
Cr [Ar]3d44s2 [Ar]3d54s1
Mo [Kr]4d45s2 [Kr]4d55s1
Cu [Ar]3d94s2 [Ar]3d104s1
Ag [Xe]4d95s2 [Xe]4d105s1
Au [Xe]4f145d96s2 [Xe]4f145d106s1
Наиболее энергетически стабильными оказываются электронные конфигурации с наполовину или полностью заполненными d- или f-орбиталями.
Химия d-элементов
Слайд 19 В атомах La (5d16s2) и Ac(6d17s2) последний электрон занимает 5d
и 6d-орбитали.
В следующих за ними лантаноидах и актиноидах происходит
последовательное заполнение 4f- или 5f-орбиталей, а 5d (6d)-орбитали остаются свободными.
Группы лантаноидов (актиноидов) вклиниваются между двумя d-элементами La и Hf (Ac и Rf). Поэтому формально лантаноиды и актиноиды относятся к III В подгруппе.
Слайд 20Примеры нарушения последовательности заполнения одноэлектронных орбиталей связаны с близостью для
d(f)-элементов значений энергий ns-,
(n-1)d-, (n-2)f-орбиталей.
Определенную роль при формировании электронной конфигурации играет межэлектронное взаимодействие.
Энергия межэлектронного взаимодействия (Еээ) равна:
Еээ = Ротт + Робм
Ротт > 0, достигает максимального значения для пары электронов на одной атомной орбитали, приводит к повышению общей энергии атома.
Робм < 0 для электронов с одинаковым направлением спинов. Приводит к уменьшению полной энергии атома.
Робм = - Рсп (для 2-х электронов)
Слайд 21Если в электронной оболочке атома имеется более 2-х электронов, то
для расчета Робм необходимо определить общее число пар электронов с
одинаковыми направлениями спинов:
где ni – число электронов с одинаковым направлением спинов: i = 1 (), i = 2 () .
В этом случае обменная энергия электронов на nl-оболочке равна:
Конфигурации с наполовину заполненными электронными nl-оболочками характеризуются теми же значениями обменной энергии, что и конфигурации, в которых одна из орбиталей полностью заполнена (d6, f8).
2
Bi = [∑ ni(ni – 1)] /2
i=1
Слайд 22d5
d6
d4:
[(5 × 4) + (0 × 0)]
2
B1 =
Pобм =
– 10 Pсп
= 10
[(5 × 4) + (1 × 0)]
2
B2 =
Pобм = – 10 Pсп
= 10
Pобм = – 6 Pсп
5 4
ΔE = Pобм – Pобм = – 10 Pсп + 6 Pсп = – 4 Pсп (< 0)
В связи с тем, что Pобм стабилизирует электронную оболочку, выгоден переход от d4 к d5:
Слайд 23Магнитные свойства
Электрон – заряженная частица. При его вращении «вокруг собственной
оси» создаётся электрический ток, который обуславливает собственный магнитный момент:
Количественной характеристикой
магнитных свойств атомов (ионов) служит магнитный момент:
Чем больше µэфф, тем больше сила с которой частица втягивается во внешнее магнитное поле.
Слайд 24Δo
Δo'
eg
t2g
[CoF6]3-
[Co(CN)6]3-
Высокоспиновый,
парамагнитный
Δo < Р СП
Низкоспиновый,
диамагнитный
Δo' > Р СП
Δo < Δ o'
Магнитные свойства зависят
не только от природы металла, но и лиганда.
Спектрохимический ряд:
I-
< Br- < Cl- < SCN- < F- < OH- < H2O < NCS- < NH3 < NO2- < CO < CN-.
В случае слабого поля (небольшая энергия расщепления) энергетически более выгодным оказывается равномерное распределение электронов на всех d-орбиталях (правило Гунда):
Слайд 25Оптические свойства соединений d-элементов:
На основании ТКП можно упрощенно объяснить не
только магнитные свойства КС переходных металлов, но и их окраску.
В КС [Ti(H2O)6]3+ ион Ti3+ имеет один d-электрон. В невозбужденном состоянии этот электрон находится на t2g-орбитали.
При затрате энергии = 238 кДж/моль электрон возбуждается и переходит на eg – орбиталь. Длина волны света, поглощаемого при этом переходе, равна 500 нм. Это обуславливает фиолетовую окраску.
Слайд 26КС Cu+, Ag+, Zn2+, Cd2+,Hg2+ бесцветны (d10).
t2g
eg
[Ti(H2O)6]3+
Ti3+ (3d1)
Δ=238
кДж/моль
400
500
600
пропускание
поглощение
пропускание
А
λ, нм
Слайд 27Элементы III В подгруппы
В эту подгруппу входят 32 элемента: 17
РЗЭ, Ас и 14 актиноидов (РЗЭ: Sc, Y, La +
14 лантаноидов).
La и Ас – предшественники Ln и An
Лантаноиды и сходные с ними элементы скандий, иттрий и лантан образуют группу редкоземельных элементов (в литературе её обозначают сокращённо РЗЭ). Такое название объясняется тем, что все эти элементы встречаются редко и дают тугоплавкие, нерастворимые в воде окислы, по старинной терминологии, — «земли». Редкоземельные элементы входят в побочную подгруппу III группы периодической системы
Слайд 28Лантаноиды весьма сходны между собой, что объясняется строением электронных оболочек их
атомов: по мере увеличения заряда ядра структура двух внешних электронных
оболочек не меняется, т.к. происходит заполнение электронами 3-й снаружи оболочки — глубоколежащего 4f-уровня. Максимально возможное число электронов на f-уровне равно 14, что определяет число элементов семейства
Лантаноиды подразделяются на 2 подгруппы:
1 – цериевую (La + церий Се, празеодим Pr, неодим Nd, прометий Pm, самарий Sm, европий Eu)
2 - иттриевую (Y + гадолиний Gd, тербий Tb, диспрозий Dy, гольмий Но, эрбий Ег,тулий Tm, иттербий Yb, лютеций Lu)
Слайд 29Gd и Lu в невозбужденном состоянии не являются f-элементами, т.к.
следующий электрон занимает 5d-подуровень.
21Sc 2s23p63d14s2
39 Y 4s24p64d15s2
57 La 5s25p65d16s2
58Ce 5s25p64f15d16s2
59
Pr 4f3
60 Nd 4f4
61 Pm 4f5
62 Sm 4f6
63 Eu 4f7
64Gd 4f75d1
65 Tb 4f95d0
66 Dy 4f10
67 Ho 4f11
68 Er 4f12
69 Tm 4f13
70 Yb 4f14
71 Lu 4f145d1
Лантаноиды (Ln)
Подгруппа Скандия
Подгруппа Церия
Подгруппа Иттрия
Слайд 30В семействе An формальный подход требует не распространять понятие «f-элемент»
на Th и Lr, в атомах которых застраивается d-подуровень.
3 -
элементы, следующие за ураном, называют трансурановыми.
Актиноиды (An)
89Ac 6d17s2
90 Th 6d27s2
91 Dy 5f26d17s2 или 5f16d27s2
92 U 5f47s2
93 Np 5f57s2
94 Pu 5f67s2
95 Am 5f77s2
96 Cm 5f76d17s2
97 Bk 5f97s2
98 Cf 5f107s2
99 Es 5f117s2
100 Fm 5f127s2
101 Md 5f137s2
102 No 5f147s2
103 Lr 5f146d17s2
1- подгруппа Тория
2 - подгруппа Берклия
Слайд 31Деление внутри семейства Лантаноиды названия подгрупп возникло исторически.
В 1788 в шведском селении Иттербю был
найден минерал иттербит
(позднее переименованный в гадолинит).
В нём Ю. Гадолин обнаружил в 1794 новую
«землю», названную иттриевой.
В 1803 И. Я. Берцелиус и В. Гизингер (1766—1852) и независимо от них М. Клапрот (1743—1817) в «тяжёлом камне из Бастноса» открыли цериевую«землю» (названную по малой планете Церере).
Первоначально обе эти «земли» считались окисями неизвестных прежде металлов — иттрия и церия.
В 1843 шведский химик К. Г. Мосандер (1797—1858) разложил иттриевую «землю» на собственно иттриевую, эрбиевую и тербиевую (все три названия — от Иттербю).
Ж. Мариньяк (1878) выделил из эрбиевой «земли» ещё иттербиевую, а шведский химик П. Т. Клеве (1879) — гольмиевую (от Holmia — латинское название Стокгольма) и тулиевую (от Thúlë — древне-греческое название стран, лежащих на Крайнем Севере).
В 1886 П. Э. Лекок де Буабодран разделил гольмиевую «землю» на собственно гольмиевую и диспрозиевую (от греческого dysprósitos — труднодоступный).
В 1907 французский химик Ж. Урбен (1872—1938) нашёл в иттербиевой «земле»лютециевую (от Lutetia — латинское название Парижа).
В 1839—41 Мосандер разложил цериевую «землю» на лантановую (от греческого lanthánö — скрываюсь), дидимовую (от греческого dídymos — близнец) и собственно цериевую «земли».
Лекок де Буабодран, исследуя дидимовую «землю», полученную из уральского минерала самарскита [названного так в 1847 Генрихом Розе (1795—1864) в честь начальника штаба Корпуса горных инженеров В. Е. Самарского-Быховца (1803—70), от которого Розе получил значительное количество этого минерала], выделил из неё в 1879 самариевую «землю», а в 1886 — гадолиниевую (по имени Гадолина); она оказалась тождественной с «землёй», которую Мариньяк открыл в 1880 в самарските.
В 1885 австрийский химик К. Ауэр фон Вельсбах (1858—1929) разделил дидимовую «землю» на празеодимовую (от греческого prásios — светло-зелёный) и неодимовую (от греческого néos — новый).
В 1901 французский химик Э. Демарсе (1852—1904) разделил самариевую«землю» на собственно самариевую и европиевую.
Так, к первым годам 20 в. были открыты все Лантаноиды за исключением радиоактивного элемента с атомным номером 61, который в природе не встречается. Его получили только в 1947 американские физики Дж. Маринский,Лантаноиды Гленденин и Ч. Кориелл из осколков деления урана в ядерном реакторе и назвали прометием

Слайд 32Физические свойства.
Лантаноиды — металлы серебристо-белого цвета (некоторые слегка желтоваты, например Pr иNd).
Лантаноиды высокой чистоты пластичны
и легко поддаются деформации (ковке, прокатке). Мехапические свойства сильно зависят
от содержани примесей, особенно
кислорода, серы, азота и углерода.
Слайд 33Подгруппа скандия
Валентные электроны: (n-1)d1ns2, CO = +3
КЧ: Sc – 6,
Y – 8,9, La – 9
В ряду Sc – Y
– La – Ac усиление признаков металличности (усиливаются основные и ослабевают кислотные свойства).
Э(III) очень активные металлы (напоминают Mg, Ca).
Cоединения Sc с водой не реагирует (пассивируется).
La разлагает воду:
2 La + 6 H2O = 2 La(OH)3 + 3 H2.
Э легко реагируют с разб. кислотами (азотную кислоту восстанавливают до нитрата аммония).
Sc + HNO3 = Sc(NO3)3 + NH4NO3 + H2O
Нитраты, сульфаты, галогениды (кроме ЭF3) растворимы. (Растворимость сульфатов уменьшается сверху вниз в п/г.)
Не растворимы гидроксиды, карбонаты, фосфаты, сульфиты, фториды. Sc(OH)3 - слабое основание с признаками амфотерности
Sc(OH)3 + 3 NaOH = Na3[Sc(OH)6]
La(OH)3 - сильное основание (напоминает гидроксид кальция).
Ti3+
Слайд 34Подгруппа титана (IVB)
Ti, Zr, Hf, Rf (изучен мало)
Валентные электроны: (n-1)d2
s2.
r(M0) и r(M+): Ti < Zr > Hf (лантанидное сжатие)
Степени
окисления: Ti(+3,+4), Zr(+4), Hf(+4) .
Образование Э4+ связано с достаточно большой затратой энергии. Стабильны в основном в кристаллических структурах.
У элементов, имеющих под валентными электронами оболочку типа благородного газа, с ростом радиуса уменьшается поляризующее действие и у Zr и Hf валентные электроны удерживаются менее прочно, чем у Ti.
С увеличением r уменьшается поляризующее действие и валентные электроны удерживаются менее прочно.
Слайд 35На поверхности металлов образуется тонкая и прочная пленка оксидов (малоактивны
на холоду).
Ti, Zr, Hf образуют твердые растворы замещения (V, Cr),
а также ИМС (Fe, Co, Ni, Cu, Zn).
Введение Ti и Zr в сплавы увеличивает их твердость.
Слайд 36Растворение металлов IV B подгруппы
2 Ti + 6
HClгор = 2 TiCl3 +
3 H2
Ti + 6 HF = H2[TiF6] + 2 H2
(Э = Zr, Hf Условие: окисление, образование анионных КС)
Э + 5 H2SO4 (конц) = H2[Э(SO4)3] + 2 SO2 + 4 H2O
3 Э + 4 HNO3 + 18 HX = 3 H2[ЭХ6] + 4 NO + 8 H2O (X = F-, Cl-)
При наличии F- - ионов все Э постепенно реагируют даже со слабыми кислотами:
Э + 4 СН3СООН + 6 NH4F = (NH4)2[ЭF6] + 4CH3COONH4 + 2H2 ↑
Ti растворим в концентрированных щелочах (Zr и Hf - нет)
Ti + 2 NaOHконц + Н2О = Na2TiO3 + 2 H2 ↑
титанат
Слайд 37Бинарные соединения элементов IV B подгруппы
с О, Н, С,
N, Si имеют переменный состав (их формулы условны).
ЭО2 с Н2О истинных растворов не образуют.
В кислотах и разбавленных щелочах ЭО2 не растворяются (полимеризация, коллоидные растворы).
Гидроксиды ЭО2nH2O тоже имеют переменный состав.
Ti(OH)4 - -форма
TiO(OH)2 - -форма (результат старения).
Гидроксид титана растворим в конц. щелочи, а цирконий и гафний нет.
Слайд 38Гидратированные ионы Ti4+, Zr4+, Hf4+ вследствие большого заряда в растворах
не существуют.
Склонность к гидролизу Э4+ снижается в ряду Ti4+ >
Zr4+ > Hf4+.
При взаимодействии оксидов и гидроксидов с кислотами образуются не средние соли, а оксо- и гидроксопроизводные:
Ti(OH)4 + 2 HCl = TiOCl2 + 3 H2O.
хлорид титанила
ЭО2+ (титанил, цирконил, гафнил) можно представить как результат дегидратации дигидроксокомплекса [Э(ОН)2]2+, как промежуточного продукта гидролиза ЭХ4 (Х = Cl-,Br-):
H2[TiCl4(OH)2] = [Ti(OH)2]2+ + 4 Cl- + 2 H+
[Ti(OH)2]2+ = TiO2+ + H2O.
Слайд 39Строгих доказательств существования катиона титанила не получено ни для растворов,
ни для кристаллических веществ типа TiOCl2×8Н20. Группировки [TiO(H20)n]2+ и [Ti(OH)2]2+
практически не различаются методами структурного анализа, т.к. положение протона рентгеновский анализ не фиксирует.
Слайд 40В твердых соединениях, содержащих ЭО2+, имеется сложная система водородных связей
и связей Э(IV) - О - Э(IV) (полимеры).
Цирконилхлорид ZrOCl2×8H2O
включает структурные единицы:
[Zr4(OH)8(H2O)16]8+ (тетрамер)
Слайд 41При нагревании TiO2 с концентрированной серной кислотой получается не средний
сульфат, а производное титанила TiOSO4 (титанилсульфат). При растворении в воде
это соединение в воде дает кислую реакцию. Кристаллизующийся из воды TiOSO4 × H2O не содержит локализованного титанил-иона, а состоит из цепей (TiO)n2n+, соединенных SO42- .
Слайд 42В серной кислоте могут также присутствовать Ti(OH)3HSO4 и [Ti(OH)2HSO4]+.
При увеличении рН происходит полимеризация, гидролиз, образование коллоидных растворов TiO2
.
Слайд 43Цирконий и гафний меньше, чем титан, подвергаются гидролизу. В сильнокислой
среде можно выделить негидролизованные кристаллогидраты сульфатов
Э(SO4)2× 4H2O, которые
при растворении в воде вследствие гидролиза переходят в
ЭОSO4× mH2O или Э(ОН)2SO4× (m-1)Н2О.
Слайд 44Негидролизованный безводный сульфат титана (IV) можно получить только в отсутствие
воды в среде сульфурила
SO2Cl2 :
TiCl4 + 6SO3 = Ti(SO4)2
+ 2 S2O5Cl2 или сплавлением с пиросульфатом:
TiO2 + 2K2S2O7 = 2 K2SO4 + Ti(SO4)2
Слайд 45Гидролиз тетрахлорида Ti(IV)
TiCl4× 2H2O гидролизуется с последующим отщеплением HCl:
Ti Cl4×2H2O + 4Н2О → Ti(H2O)2(OH)4
+ 4HCl
На последующих стадиях гидролиза реализуется механизм «оляция – оксоляция». Равновесие смещено вправо. Этому способствуют: повышение температуры, щ.ср., длительное стояние раствора. Дальнейшая полимеризация может привести к образованию TiO2 × nH2O.
Слайд 46Соединения Ti(III) получают химическим или электрохимическим восстановлением соединений Ti(IV).
12000 C
2 TiO2 + H2 Ti2O3 + H2O
4 TiCl3 + O2 + 2 H2O = 4 TiOCl2 + 4 HCl
Реакции диспропорционирования:
4000 C
2 TiCl3 TiCl2 + TiCl4 (жидкость при комн.t)
> 4000 C
2 TiCl2 Ti0 + TiCl4
= 2 H[VF6] +
5 H2
V + 6 HNO3 гор = VO2NO3 + 5 NO2 + 3 H2O
2 V + 6 H2SO4 конц = (VO2)2SO4 + 5 SO2 + 6 H2O
3 V + 5 HNO3 + 3 HCl = 3VO2Cl + 5 NO + 4H2O
Подгруппа V B
(n-1)d3ns2
Растворение металлов
Слайд 48С увеличением атомов кислорода растет доля ковалентной связи
Растворение Nb и
Та
(химическая устойчивость связана с тонкой оксидной пленкой)
2 Э
+ 12 HF = 2 H[ЭF6] + 5 H2
Э + 5 HNO3 + 7 HF = H2[ЭF7] + 5 NO2 + 5 H2O
Оксиды
ЭnО ЭО Э2О3 ЭО2 Э2О5
Мет. Мет.блеск, электропроводность п/п, кластер д/э
Слайд 49Диаграмма Латимера для V
+1.0
+0.36
-0.26 -1.19
VO2+ VO2+ V3+ V2+ V0
V2O5 + 2 NaOH = 2 NaVO3 + H2O (Na3VO4)
Соединения V(V) - сильные окислители
V2O5 + 6 HClконц = 2 VOCl2 + Cl2 + 3 H2O
4 NaVO3 + 18 HClконц + Pt = H2[PtCl6] + 4 VOCl2 + 4 NaCl + 8H2O
Nb2O5, Ta2O5
- химически инертны, не реагируют с Н2О, кислотами и щелочами.
Слайд 50
В схеме не учтены промежуточные изополисоединения, предшествующие выпадению в кислой
среде V2O5nH2O.
Ванадиевые кислоты, ванадаты и изополиванадаты
V2 O5nH2O,
HVO3, VO2+ (ванадин-ион)
В кислом растворе в зависимости от конц. кислоты присутствуют:
Метаванадиевая (HVO3), пированадиевая (H4V2O7) и ортованадиевая (H3VO4) кислоты являются стехиометрическими аналогами мета-, пиро- и ортофосфорных кислот.
Кислоты ванадия в твердом виде не выделены.
Схему кислотно-основного равновесия можно представить следующим образом:
+ OH- - H+
VO2+ HVO3 VO3-
- OH- +H+
Слайд 51В растворах в зависимости от рН существуют сложные равновесия:
VO43-
+ H+ = HVO4-
2 HVO42- =
H2O + V2O74-
2 V2O74- + 4 H+ = 2 H2O + V4O124-
5 V4O124- + 8 H+ = 2 H2O + 2 V10O286-
V10O286- + 16 H+ = 10 VO2+ + 8 H2O
H6V10O28 V2O5nH2O (красный осадок)
Слайд 52Соединения V(IV):
VO2, в растворах образуется ванадил-ион VO2+.
2 NaVO3
+ Zn + 4 H2SO4 =
2 VOSO4 + ZnSO4 + Na2SO4 + 4 H2O
син.
2VOSO4 + Zn + 2 H2SO4 = V2(SO4)3 + ZnSO4 + 2 H2O
зел.
V2(SO4)3 + Zn = 2 VSO4 + ZnSO4
фиол.
V(II) в этой системе является самым сильным восстановителем. В отсутствие восстановителя окисляется даже водой:
2 V(OH)2 + 2 H2O = 2 V(OH)3 + H2
Обратный переход V(II) V(V) возможен, если по каплям добавлять KMnO4.
Слайд 53В кислой среде для V(IV) характерна катионная форма VO2+.
В щелочной
среде V(IV) в форме ванадатов (IV) различного состава:
VO32-
(мета-), V2O52- (пиро-), VO44- (орто-), V4O92- (тетра-).
VO2+ в ходе реакций сохраняется и входит в комплекс [VO(H2O)5]2+.
Слайд 54Соединения Nb, Ta.
Ta2O5 + 5 PCl5
= 2 TaCl5 + 5 POCl3
Ta2O5 + 5 Cl2 + 5 C = 2 TaCl5 + 5 CO
ЭHal5 - легкоплавкие, легколетучие, легко гидролизуются
Образование КС:
KF + ЭF5 = K[ЭF6] (Э = V, Nb, Ta)
Nb2O5 + 4 KF + 6 HF = 2 K2[NbOF5] + 3 H2O
Ta2O5 + 4 KF + 10 HF = 2 K2[TaF7] + 5 H2O
V(IV, V), Nb(IV), Ta(IV) - 6 (4,5)
Nb(V), Ta(V) - 6, 7 (8)
Слайд 55
При высоких температурах взаимодействуют с:
O2
Cr2O3, MoO3, WO3
F2
CrF4, MoF6, WF6
Cl2 CrCl3, MoCl6, WCl6
спл.
Э + Na2CO3 + O2 Na2ЭО4 + СО2
Подгруппа VI B
(n-1)d5ns1 (Cr, Mo), (n-1)d4s2 (W)
Растворение металлов:
2Cr + 6HClразб (H2SO4 разб) = 2CrCl3 + 3 H2 (пассивируется в конц. H2SO4, HNO3).
Э + 8 HF + 2 HNO3 = H2[ЭF8] + 2 NO + 4 H2O (Э = Мо, W)
(Мо в смеси HCl + HNO3).
Слайд 56Снижение силы кислоты:
H2SO4 >
H2CrO4 > H2MoO4 > H2WO4.
В ряду
Cr(VI) > Mo(VI) > W(VI) наблюдается ослабление окислительных и кислотных свойств.
Увеличение с.о. приводит к усилению кислотных свойств:
Cr(OH)2 - слабое основание, Cr(OH)3 - очень слабое основание (амфотерен), H2CrO4 -сильная кислота (CrO3 – ангидрид).
Усиление кислотности с увеличением с.о. означает рост ковалентности связи.
Слайд 57С.о. +3 наиболее характерна для хрома.
Cr2O3 - тугоплавкое вещество, растворяется
только при сплавлении со щелочами.
Cr2(SO4)3 + 6
NaOH = 2 Cr(OH)3 + 3 Na2SO4
Cr(OH)3 + 3 HCl = CrCl3 + 3 H2O
Cr(OH)3 + NaOH = Na[Cr(OH)4] (хромиты, изумрудно-зеленые)
Cr(OH)3 + 3 NaOH = Na3[Cr(OH)6]
спл.
Cr(OH)3 + NaOH = NaCrO2 + 2 H2O (метахромит)
Минерал хромистый железняк Fe(CrO2)2 (FeOCr2O3).
Соли хромистых кислот гидролизуются.
Соединения Cr(III), Mo(III), W(III).
Слайд 58Для солей хрома(Ш) характерна гидратная изомерия.
Соли хрома(Ш) с анионами
слабых кислот в водных растворах гидролизуются:
Cr2(SO4)3 + 3 Na2S
= Cr2S3 + 3 Na2SO4
Cr2S3 + 6 H2O = 2 Cr(OH)3 + 3 H2S
Cr2(SO4)3 + 3 Na2CO3 + 3 H2O = 2 Cr(OH)3 + 3 Na2SO4 + 3CO2
Характерно образование квасцов:
KCr(SO4)212H2O, NaCr(SO4)212 H2O
Окисление:
2Na[Cr(OH)4] + 3Br2 + 8NaOH = 2Na2CrO4 + 6NaBr + 8H2O
Cr2(SO4)3 + 3Na2S2O8 + 7H2O = Na2Cr2O7 + 2Na2SO4 + 7H2SO4
Mo(III), W(III) окисляются кислородом воздуха.
Слайд 59K2Cr2O7 + H2SO4 конц = 2CrO3 +
2KHSO4 + H2O
t
2Э + 3О2 2ЭО3 (Мо – белый, W – желтый, устойчивы в воде)
ЭО3 + 2NaOH = Na2ЭО4 + Н2О
ЭО3 - ангидриды: CrO3 + H2O = H2CrO4
Na2ЭO4 + 2HCl = H2ЭО4 + 2NaCl (Э = Мо, W)
ЭО3 Н2О склонны к коллоидообразованию и не способны давать истинные растворы в воде и кислотах (а только в щелочах). Полимерное строение обусловлено водородными и оловыми связями, а также оксомостиками.
Соединения Cr(VI), Mo(VI), W(VI)
Слайд 60 ПОЛИКИСЛОТЫ
Изополикислоты - содержат остатки одной
и той же кислоты
[CrO3
- O - CrO3]2- H2[CrO4CrO3] (Cr, Mo, W)
2K2CrO4 + H2SO4 = K2Cr2O7 + K2SO4 + H2O
3K2Cr2O7 + H2SO4 = 2K2Cr3O10 + K2SO4 + H2O
4K2Cr3O10 + H2SO4 = 3K2Cr4O13 + K2SO4 + H2O
t
K2Cr2O7 + 14HCl 2CrCl3 + 3Cl2 + H2O + 2HCl
Степень полимеризации ниже, чем V, Mo, W, из-за меньшего размера Cr.
t
(NH4)2Cr2O7 N2 + Cr2O3 + 4H2O (вулкан)
Слайд 61Гетерополикислоты (ГПК) - остатки разных кислот Н3[P(Mo3O10)4] (Mo, W)
Основные
формы изополимолибдатов:
рН > 7 MoO42-
- молибдат
рН = 5-7 Мо7О246- - гептамолибдат (парамолибдат)
рН < 5 Мо8О264- - октамолибдат
Анализ на содержание фосфора
7H3PO4 + 12(NH4)6Mo7O24 + 51HNO3 7(NH4)3[PMO12O40]nH2O + 51NH4NO3 + (36-7n)H2O ( Й.Берцелиус, 1826 г.)
В щелочной среде ГПС разрушаются до МоО42- или WO42-.
Слайд 62Подгруппа VII B
(n-1)d5ns2
Степень окисления: II
(Mn), III, IV, V, VI, VII (Mn, Tc, Re)
Растворение металлов
Mn:
в разбавленных кислотах, реагирует с Hal2, с О2
(при нагревании) и с др.неметаллами.
Re, Tc: 3Э + 7HNO3 = 3HЭO4 + 7NO + 2H2O
t
Э + О2 Э2О7 (Э = Tc, Re)
MnO Mn2O3 MnO2 MnO3 – неизвестен Mn2O7
Mn(OH)2 Mn(OH)3 Mn(OH)4 H2MnO4 HMnO4
Марганцоватистая Марганцовистая Марганцевая
(основные) (амф.) (кислоты)
Слайд 63Соединения Mn(II)
Окисление:
3MnSO4 + 2KClO3
+ 12KOH = 3K2MnO4 + 2KCl + 3K2SO4
+ 6H2O
2MnSO4 + 5PbO2 + 6HNO3 = 2HMnO4 + 3Pb(NO3)2 + 2PbSO4 + 2H2O
Mn(CN)2 + 4 KCN = K4[Mn(CN)6]
MnF2 + 4 KF = K4[MnF6]
Слайд 64Соединения Mn(IV), Tc(IV), Re(IV)
2MnO2 + 2H2SO4
= 2MnSO4 +
O2 + 2H2O
[O]
ReO2 {Re(OH)4} ReO3 H2ReO3 (соли рениты)
H2MnO3 (метамарганцоватистая кислота, соли манганиты)
H2ReO3 (соли рениты), Н2ТсО3 (соли технетиты),
Tc(IV) устойчивее Mn(IV), Re(IV)
Кластеры [Re3Cl12]3- (межатомное расстояние 2.47 А, в металле 2.75 А)
6 дважды заполненных связывающих МО, расположенных вдоль трех сторон треугольника, что эквивалентно трем двойным связям.
Слайд 65Соединения Mn(VI), Tc(VI), Re(VI)
H2MnO4 (соли манганаты), H2ReO4 (ренаты), H2TcO4 (технетаты)
Диспропорционирование:
3 H2MnO4 = 2 HMnO4 +
MnO2 + 2 H2O
Получение манганатов:
MnO2 + NaNO3 + 2KOH = K2MnO4 + NaNO2 + H2O
В случае Re используют ReO3, Tc - TcO2.
+ 1.5
-
+0.56 +2.26 +0.95 +1.51 -1.18
MnO4- MnO42- MnO2 Mn3+ Mn2+ Mn0
+1.70 +1.23
Слайд 66Соединения Mn(VII), Tc(VII), Re(VII)
Кислая среда:
MnO4- + 8H+ + 5e =
Mn2+ + 4H2O
Нейтральная среда: MnO4- + 2H2O + 3e = MnO2 + 4OH-
Щелочная среда: MnO4- + e = MnO42-
HMnO4 разрушается в растворах с концентрацией выше 20%:
4HMnO4 = 4MnO2 + 3O2 + 2H2O (в тв. виде выделяется при низкой t).
Диспропорционирование манганатов происходит уже при разбавлении водой конц. щелочных растворов (гидролиз): 3MnO42- + 2H2O = 2MnO4- + MnO2 + 4OH-.
Неустойчивость MnO42- объясняет наличием электрона на *- орбитали.
Слайд 67Интенсивную окраску MnO4- можно объяснить следующим образом:
Это тетраэдр: t =
4/9 o. Поэтому d-d-переход осуществляется более легко, чем в случае
Mn(II) (октаэдр).
2. (Mn) < (Tc) < (Re), т.к. протяженность электронных облаков возрастает.
3. Тетраэдрическое строение снимает запрет по спину и по четности с d–d – переходов, характерного для октаэдрического строения.
4. Вносит вклад перенос заряда четырех -электронов каждого из атомов кислорода. Перенос заряда освобождает переход электронов от запрета по спину.
Слайд 68VIII B - подгруппа
Семейство Fe
(Fe, Co, Ni)
Cемейство Pt
(Ru, Rh, Pd,
Os, Ir, Pt)
Fe VI, III, II, 0 Fe Co Ni
E0 -0.44 -0.27 -0.23
Co III, II, 0
Ni II, 0 3d64s2 3d74s2 3d8s2
Слайд 69Растворение металлов
Fe0 + H2SO4 разб
= FeSO4 +
H2
2Fe + 6H2SO4 конц = Fe2(SO4)3 + 3SO2 + 6H2O
С конц. HNO3 и 100% H2SO4 на холоду Fe пассивируется. С разб. HNO3 реагирует:
Fe0 + 4HNO3 = Fe(NO3)3 + NO + 2H2O.
В обычных условиях не взаимодействует со щелочами. С гор. конц. NaOH Na2[Fe(OH)4] + H2.
Слайд 70Соединения Fe(II): Соли растворимы в воде, кроме Fe3(PO4)2, FeS,
FeCO3.
На воздухе Fe(II) устойчиво в составе соли Мора:
(NH4)2[Fe(SO4)2] и
K4[Fe(CN)6].
Другие соли окисляются кислородом воздуха. Гидроксид тоже окисляется:
2Fe(OH)2 + ½ O2 + H2O = 2Fe(OH)3
Fe(OH)2 + 4NaOH = Na4[Fe(OH)6]
Катионные разрушаются в воде:
[Fe(NH3)6]Cl2 + 2H2O = Fe(OH)2 + 2NH4Cl + 4NH3
Анионные КС более устойчивы, чем катионные:
[Fe(CN)6]4- - желтая кровяная соль (наиболее устойчива), реактив на Fe(III).
Слайд 71ТКП прогнозирует, что КС Fe(II) с L
слабого поля должны значительно различаться по т/д устойчивости.
В сильном поле
(CN-) Fe(II) t2g6eg0 (н/с),
В слабом поле (SCN-) Fe(II) t2g4eg2 (в/с).
Для [Fe(CN)6]4- ЭСКП = 2.4 0, lg6 = 37
[Fe(SCN)6]4- ЭСКП = 0.4 0, lg6 = 2
Слайд 72 Энергетическая диаграмма [Fe(CN)6]4-
Слайд 73Соединения Fe(III). [Fe(H2O)6]3+ в Н2О
Fe(OH)3 имеет переменный состав:
Fe2O3nH2O3.
Галогениды: FeCl3, FeF3, FeBr3 (Fe3+ + 2I- = Fe2+ +
I2).
Соли слабых кислот гидролизуются. Из-за гидролиза растворы солей железа(Ш) имеют кислую реакцию (рН = 2-3):
[Fe(H2O)6]3+ = [Fe(H2O)5)OH]2+ + H+
[Fe(H2O)5OH]2+ = [Fe(H2O)4(OH)2]+ + H+.
Добавление сильных кислот (до рН < 1) подавляет гидролиз. В щелочной среде гидролиз усиливается. По способности гидролизоваться соли Fe(III) сходны с солями Cr(III), Al(III), Fe(II) c Mg(II).
Слайд 74Координационные соединения Fe(III)
Катионные КС малоустойчивы, например, [Fe(NH3)6]Cl3.
Анионные КС более устойчивы,
чем у Fe(II):
K3[Fe(OH)6], K3[Fe(CN)6], K3[FeF6]
Na2[Fe(NO)(CN)5]2H2O - нитропруссид натрия (для
разделения РЗЭ).
Известны ферриты, которые получают сплавлением:
Fe2O3 + Na2CO3 = 2NaFeO2 + CO2.
Соединения Fe(VI):
спл.
Fe2O3 + 3KNO3 + 4KOH 2K2FeO4 + 3KNO2 + 2H2O
t
4K2FeO4 + 10H2O 4Fe(OH)3 + 3O2 + 8KOH
Слайд 75Соединения Co (II,III), Ni(II).
Металлы растворяются в разбавленных кислотах. В щелочах
устойчивы.
3000
2 Со + О2 2СоО Нерастворимы в щелочах, но растворимы в
кислотах
5000 Оксиды образуются также при термическом
2 Ni + O2 2NiO разложении гидроксидов и карбонатов.
Со(ОН)2 и Ni(OH)2 растворяются в кислотах (преобладают основные свойства).
В избытке аммиака образуются координационные соединения [Co(NH3)6]Cl2, [Ni(NH3)6]Cl2.
Аммиакат Со(П) со временем разлагается водой:
[Co(NH3)6]Cl2 + 2H2O = Co(OH)2 + 4NH3 + 2NH4Cl.
Аммиакат Со(П) легко окисляется кислородом воздуха за счет перехода в н/с КС Со(Ш).
Слайд 76Октаэдрическая (t2g5eg2) и тетраэдрическая (eg4t2g3) конфигурации практически равновероятны.
Например, розовый раствор [Co(H2O)6]2+ изменяет окраску при действии избытка щелочи
или кислоты на светло-синюю в результате образования тетраэдрического КС [Co(OH)4]2- или [CoX4]2- (X – Cl-, Br-, I- и др.).
Co(SCN)2 + 2NH4SCN = (NH4)2[Co(SCN)4] (уст. в смеси амил.сп. с эфиром).
В воде устойчив аммиакат Со(Ш): [Co(NH3)6]Cl3 (ж.цв.) t2g6eg0 (н/с). Устойчив даже в конц. НСl. Разрушить можно H2S, NaOH.
Co(III) образует также достаточно устойчивые анионные КС:
Na3[CoF6], Na3[Co(CN)6], Na3[Co(NO2)6] (соли калия и аммония плохо растворимы).
Слайд 77Ряд Ирвинга-Уильямса
М: Mn(II) < Fe(II) < Co(II)
< Ni(II) < Cu(II) > Zn(II)
ЭСКП: 0
0.4 0.6 0.8 0.6 0
Слайд 78Металлические радиусы близки. Это обеспечивает сходство в физических и химических
свойствах. В рудах присутствуют совместно.
Потенциалы процессов Э2+ → Э0
сдвинуто вправо, в сторону металла. Это соответствует их положению в ряду напряжений (после водорода). Характеризуются высокими значениями ПИ.
d-Элементы VIII группы.
Металлы платиновой группы (МПГ).
Ru, Rh,Pd, Os, Ir, Pt
Осмий имеет самую высокую удельную плотность (22.7 г/см3). Это объясняется образованием большого числа ковалентных связей М – М. Плотная упаковка характерна также для триады платины.
Слайд 79 Pd + HNO3 (p) = Pd(NO3)2 + 2 NO2
+ 2 H2O (80 0C)
Pt (Pd) + 4 HNO3 +
18 HCl = 3 H2[PtCl6] + 4 NO + 8 H2O
Ru, Os (Э):
tспл
Э + 3 KNO3 + 2 KOH = К2ЭО4 + 3 KNO2 + H2O
Растворение платиновых металлов
Rh, Ir в раствор можно перевести хлорированием при нагревании:
2 Rh + 3 Cl2 + 6 NaCl = 2 Na3[RhCl6]
Ir + 2 Cl2 + 2 NaCl = Na2[IrCl6]
Слайд 80Химические свойства металлов платиновой группы
МПГ в обычных
условиях малореакционноспособны. При высоких температурах взаимодействуют с большим числом простых
и сложных веществ.
Окисляются кислородом с образованием соответствующих оксидов рутения(IV), осмия(VIII), иридия(IV), родия(Ш), палладия(П).
Os +2O2 = OsO4
Ru + O2 = RuO2
2Pd + O2 = 2PdO
Платина не реагирует с кислородом ввиду низкой термической нестабильности соответствующего оксида.
Слайд 81При нагревании образуются галогениды, халькогениды, фосфиды, бориды, силициды, но не
гидриды платины.
Pt + Cl2 = PtCl2
Os + 2Cl2 = OsCl4
2Ru
+ 3Cl2 = 2RuCl3
Слайд 82Комплексообразование металлов платиновой группы
В растворах платиновые металлы существуют только в виде комплексных
соединений.
Способность к образованию КС выражена сильнее, чем у элементов семейства
железа. Валентные орбитали МПГ имеют большую протяженность, что способствует донорно-акцепторному взаимодействию и увеличению расщепления d-орбиталей кристаллическим полем лиганда. Вследствие этого значительная часть КС МПГ (даже с лигандами слабого поля) являются низкоспиновыми.
Слайд 83Э(0): карбонилы
Для МПГ одной подгруппы ПС КС одинаковы по
составу, свойствам и строению (тригональная бипирамида):
Fe(CO)5, Ru(CO)5, Os(CO)5.
Полиядерные КС:
Os6(CO)18, Э3(СО)12.
Pd(0), Pt(0) в отличие от Ni(0)
образуют [Э(СО)2]n, а не Э(СО)4.
Слайд 84Э(IV) : реализуется в соединениях всех соединений МПГ. Но особенно
характерно для соединений платины.
H2[PtCl6] - реактив на щелочные
М
в растворе – желтого цвета
в кристалле - красно-коричневого цвета
Э(VI): проявляется в комплексах, которые ряду с ацидолигандами содержат кислород
Ru, Os наряду с ацидолигандами содержат кислород
Na4[OsO4F2]
Слайд 85Э(VIII): характерно для оксидов осмия и рутенияOsO4, RuO4 (оранж.).
Оксид
осмия(VIII) образует при взаимодействии с фторидом калия комплекс :
OsO4 + 2 KF = K2[OsO4F2]
(крас.-кор. осадок)
Слайд 86Особенностью координационных соединений МПГ является их кинетическая инертность.
Инертность возрастает в
ряду
никель(II) → палладий(II) → платина(II).
Это связано
с увеличением ∆ КП лигандов и увеличением прочности ковалентной связи металл – лиганд вследствие повышения деформируемости электронных оболочек у МПГ, а также проявления эффекта дополнительной поляризации.
Слайд 87Разница в кинетических характеристиках семейства железа и МПГ увеличивается еще
и потому, что реализуются разные симметрии одного и того же
состава: [NiCl4]2- - тетраэдр, а [ЭCl4]2- (Э = МПГ) – квадрат.
При больших энергиях расщепления кристаллическим полем в октаэдрических комплексах два электрона оказываются сильно разрыхляющих молекулярных орбиталях σd*, поэтому выгодна их потеря и переход в состояние окисления +4 или перерождение октаэдрического комплекса в плоскоквадратный.
Слайд 88 В 1926 г. советский химик И.И.Черняев на примере координационных соединений
платины(II) установил правило, согласно которому каждый лиганд в координационном соединении
характеризуется определенным влиянием на другой внутрисферный лиганд, находящийся в тарнсположении. Сила этого влияния увеличивается в ряду:
Ряд дает возможность делать важные предсказания о направлении реакций замещения лигандов во внутренней координационной сфере.
С помощью этой закономерности легко объяснить установленные ранее правила замещения лигандов в комплексных соединениях платины(II).
H2O < OH– < NH3 < F– < Cl– < Br– < SCN– < I– < NO2– < CO < C2H4 < CN–
Слайд 89Pt
Cl
Cl
Cl
Cl
K2
+
NH3
Pt
Cl
Cl
Cl
NH3
K
+
KCl
Pt
Cl
Cl
Cl
NH3
K
+
NH3
Pt
Cl
NH3
Cl
NH3
+
KCl
Взаимодействие аминов и комплексных ионов типа [PtX4]2-,
где Х =
Cl-, Br-, I-, SCN-, CN-, NO2-,
приводит к образованию диаминов
[PtA2X2] цис-конфигурации. Стереохимическую трактовку это правило получило в работах А.Вернера.
Слайд 90Pt
H3N
NH3
H3N
NH3
Cl2
NH3
Pt
Cl
NH3
Cl
+
H3N
H3N
NH3
Pt
Cl
NH3
+
H3N
Cl
Pt
Cl
NH3
Cl
H3N
H3N
Взаимодействие галоидоводородной кислоты и комплексных ионов типа [PtA4]2-, где А
– амины, приводит к образованию диаминов [PtA2X2] транс-конфигурации.
Слайд 91+
–
–
–
–
+
+
+
X'''
X'
X''''
X''
+
–
–
–
–
+
+
+
X'''
X'
X''''
Y
–
+
Слайд 92Схема объяснения трансвлияния в комплексных соединениях двухвалентной платины по Чатту
и Оргелу
Орбитали, образующие σ–связи, заштрихованы.
а – лиганд L1 не
образует π–связь с комплексообразователем
б – лиганд L1 образует π–связь с комплексообразователем
Слайд 93IB группа
Подгруппа меди
Электронная конфигурация ( n-1)d10ns1
Cu
+1,
+2
Ag +1, +2
Au +1, +3
Минералы: СuFeS2 - медный колчедан (халькопирит)
Cu2S - медный блеск
Cu2O - куприт
(СuOH)2CO3 - малахит
t
O2 → CuO
→ Cu2O
t
S → Cu2S , Ag2S
t
Hal2 → Cu и Ag , Au → Cl2 , I2
Подгруппа IB:
Cu (II, I) < Ag (I, II) < Au (III, I)
инертность
Слайд 95 Растворение
Cu + HNO3 →
Cu(NO3)2
(Ag, Cu - растворимы в конц. НNO3 и
конц. H2SO4).
Можно в соляной кислоте растворить, но в присутствии
Cu + 4 HCl + ½ O2 → 2[CuCl4] + H2O
Au растворимо в горячей селеновой кислоте (более сильный окислитель, чем азотная и серная кислоты) и в царской водке:
Au + 4 HCl + HNO3 → H[AuCl4] + NO + 2 H2O,
а также в насыщенном растворе соляной кислоты хлором:
2 Au + 3 Cl2 + 2 HCl → 2 H[AuCl4]
Слайд 96Соединения Cu(I), Ag(I), Au(I)
Cu(I) - образует диамагнитные соединения (d10s0).
Является не
только Ϭ-акцептором, но и π-донором электронных пар.
Прочность π-дативной связи увеличивается
в ряду:
Cu(I) → Ag(I) → Au(I). КЧ = 2,4, а для Ag(I) - 6
AкваКС для Э(I) неустойчивы.
Слайд 97Гидроксиды ЭОН тоже неустойчивы:
2AgOH → Ag2O + H2O
Устойчивее [Cu(NH3)2]OH
в результате снижения поляризующего действия Э+ на ионы ОН- за
счет экранирования молекулами NH3
Соединения Cu(I), Ag(I) растворяются за счет комплексообразования в растворах аммиака:
CuCl + 2 NH3 = [Cu(NH3)2]Cl
AgCl + 2 NH3 = [Ag(NH3)2]Cl
Слайд 98Галогениды растворяются в избытке реактива:
CuCl +
HCl = H[CuCl2]
AgCl +
KI = K[AgI2]
Растворимость уменьшается в ряду: ЭF → ЭCl → ЭBr → ЭI
Галогениды склонны к диспропорционированию.
Кислородсодержащие соли устойчивы в случае:
AgNO3, AgClO4, AgClO3 (растворимы)
Ag2SO4, Ag2CO3 (малорастворимы)
Кислотная природа бинарных соединений Э(I) проявляется при реакциях с основными партнерами:
Cu2O + 2 NaOH + H2O → 2 Na[Cu(OH)2] (купрат)
Слайд 99КС Э(I) наиболее устойчивы с цианид-ионами:
[Cu(CN)2]- → [Ag(CN)2]-
→ [Au(CN)2]-
(усиление π-дативного взаимодействия).
Соединения меди(I) и золота(I)
окисляются кислородом воздуха.
Соединения Э(I) светочувствительны.
Слайд 100 Cоединения меди(II)
t
Cu(OH)2 → CuO + H2O
t
4 CuO → 2 Cu2O + O2
При растворении оксида в кислотах и солей меди(II) в воде образуется акваКС [Cu(H2O)6]2+ синего цвета.
Если в координационную сферу входят другие лиганды цвет может быть другим, например, зеленым в случае хлорида.
Слайд 101Гидролиз солей меди(II) ведет к образованию малорастворимых основных солей:
Cu(NO3)2•3Cu(OH)2.
Cu(OH)2 обладает слабой амфотерностью:
Cu(OH)2 + 2 NaOHконц
→ Na2[Cu(OH)4]
Cu(OH)2 + 4 NH3 + 2 H2O → [Cu(NH3)4(OH2)2](OH)2
Растворимость галогенидов в воде уменьшается в ряду:
CuF2 → CuCl2 → CuBr2 → CuI2.
Растворяются в избытке реактива.
Слайд 102Катионные КС меди(II):
[Cu(H2O)6]2+ -
светло-синий (800 нм)
[Cu(NH3)4(H2O)2]2+ - синий
(600 нм)
[Cu(en)2(H2O)2]2+ - интенсивно синий (400 нм)
Сила поля лиганда увеличивается в ряду:
H2O → NH3 → en
CuSO4 - бесцветный, т.к. сульфат-ион является лигандом очень слабого поля (d-d – переходы отвечают поглощению в ИК-области)
Слайд 103Энергия перехода электронов определяется параметром расщепления Δ
Δ= Е×NA ,
где E - энергия фотона или энергия поглощаемого
кванта света, NA – число Авогадро
Если Е = h ν, где h- постоянная Планка
ν – частота излучения ( с-1)
При ν = с/λ , где с – скорость света (3×108 м/с)
λ - длина волны поглощаемого света ( нм)
То Δ = NA × h × с/λ
Слайд 104Анионные КС меди(II):
[Cu(CN)4]2- , [CuCl4]2- , [Cu(OH)4]2-,
[Cu(CO3)]2- - купраты
Соединения меди(III), серебра(III) и золота(III):
Золото(Ш) 5d8: квадратные
КС
Из бинарных соединений растворимы в воде:
AuCl3 и ABr3 существуют в виде полимеров.
Слайд 105Оксид и гидроксид золота(III) амфотерны с преобладанием кислотных признаков:
Au(OH)3
+ NaOH = Na[Au(OH)4]
Au(OH)3
+ 4 HNO3 = H[Au(NO3)4] + 3H2O
H[Au(CN)4], H[Au(SO4)2], H[AuS2]
Исходный продукт для получения других соединений AuCl3
2000C
Au + Cl2 → AuCl3
Слайд 106Cu(III) и Ag(III) - известны фторпроизводные:
K3[CuF6] и
K[AgF4]
При окислении Cu(OH)2 в щелочной среде образуются гидрооксокупраты(III)
K[Cu(OH)4]
Cu(III) и Ag(III) - сильные окислители
Zn (II) < Cd (II) < Hg (II)
Рост поляризующего действия из-за увеличения деформируемости электронной оболочки.
Hg (II) < Cd (II) < Zn (II)
Рост поляризующего действия из-за уменьшения радиуса атома.
Hg (I) : [-Hg-Hg-]2+
Слайд 108Подгруппа цинка
Zn(II), Cd(II), Hg(II) - nd10, отсутствует
эффект стабилизации КП (ЭСКП = 0)
Деформируемость электронной d-оболочки увеличивается
сверху вниз в подгруппе, что увеличивается, что увеличивает ковалентность связи в соединениях ртути.
Цинк тоже образует ковалентные соединения (МОС). Кадмий уступает цинку и тем более ртути по степени ковалентности в соединениях.
Слайд 109Провал ковалентности в случае кадмия объясняется тем, что поляризующее действие
в ряду Zn - Cd - Hg нерегулярно:
Zn →
Cd → Hg - рост поляризующего действия из-за увеличения деформируемости электронной оболочки.
Hg → Cd → Zn - рост поляризующего действия из-за уменьшения радиуса атома.
Немонотонный рост поляризующего действия в подгруппе цинка проявляется в изменении строения и свойств оксидов,гидроксидов, галогенидов, КС и МОС. Для ртути известны соединения Hg(I) c группировкой [H2O – Hg – Hg – OH2]2+.
Слайд 110Из диаграмм Латимера следует, что термодинамическая вероятность реализации С.О. +2
и +1 для ртути примерно одинакова:
+0.92 +0.79
Hg2+ → Hg22+ → Hg0
+0.85 B
Слайд 111Растворение металлов
Защитная пленка на поверхности Zn и Сd
делает невозможным вытеснение этими металлами водорода из Н2О. Однако при
нагревании протекает реакция:
t
Zn + H2O → ZnO + H2
Zn и Cd растворяются в разб. HCl и H2SO4, a Hg нет.
Э + 2 HCl = ЭCl2 + H2 (Cd – медленно)
Э + H2SO4 = ЭSO4 + H2
Слайд 112В кислотах-окислителях растворяются все 3 металла:
Э (Cd,Hg2+) + 2
H2SO4конц → ЭSO4 + SO2 +
2 H2O
4 Zn + 5 H2SO4 конц → 4 ZnSO4 + H2S + 4 H2O
Zn + 4 HNO3 конц → Zn(NO3)2 + 2 NO2 + 2 H2O
3 Zn + 8 HNO3 (30%) → 3 Zn(NO3)2 + 2 NO + 4 H2O
4 Zn + 10 HNO3 (5%) → 4 Zn(NO3)2 + NH4NO3 + 3 H2O
Hg + 4 HNO3 конц → Hg(NO3)2 + 2 NO2 + 2 H2O
3 Hg + 8 HNO3 разб. → 3 Hg(NO3)2 + 2 NO + 4 H2O
6 Hg + 8 HNO3 разб → 3 Hg2(NO3)2 + 2 NO + 4 H2O
Слайд 113Цинк растворяется в аммиаке:
Zn + 4 NH3H2O = [Zn(NH3)4](OH)2
+ H2 + 2 H2O
Цинк - амфотерен:
Zn(OH)2 +
2 NaOH = Na2[Zn(OH)4]
В сильнощелочной среде цинк является сильным восстановителем:
E0 [Zn(OH)4]2-/Zn0 = -1.22 B
4 Zn + NaNO3 + 7 NaOH + 6 H2O = 4 Na2[Zn(OH)4] + NH3
Слайд 114Устойчивы КС с π-акцепторными лигандами (CN-):
Э2+ + 2 KCN =
Э(CN)2 + 2 K+
Э(CN)2 + 2
KCN = K2[Э(CN)4]
Вследствие усиления способности к π-дативному взаимодействию в ряду
Zn2+ → Cd2+ → Hg2+ устойчивость КС растет.
По той же причине растет устойчивость КС в ряду лигандов: F- → Cl- → Br- → I-
(Hg):
2 KI + HgI2 → K2[HgI4]
Слайд 115HgS растворяется в растворах основных сульфидов:
K2S + HgS =
K2[HgS2] (дитиомеркурат(II) калия).
Соединения ртути(I) диспропорционируют:
Hg22+
→ Hg0 + Hg2+
Слайд 116 Химия элементов III A подгруппы
ПОСТПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ
(Ga, In, Tl)
Слайд 117«ПОСТПЕРЕХОДНЫЕ» - следуют непосредственно за декадой переходных 3d, 4d, 5d
- элементов
«ПОСТПЕРЕХОДНЫЕ» - Валентным электронам предшествует полностью сформированная 18-ти электронная
легко деформируемая оболочка
«ТИПИЧЕСКИЕ»(B, Al) - Валентным электронам предшествует жесткая малодеформируемая электронная оболочка благородного газа
НАБЛЮДАЕТСЯ НАРУШЕНИЕ ПРИНЦИПА МОНОТОННОСТИ СВОЙСТВ
ΔG
Al
Ga
In
Tl
B
Sc
Y
La
ЭCl3
Вторичная периодичность
Слайд 118ПОСТПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ
d - ЭЛЕМЕНТЫ
ПОВЫШЕНИЕ УСТОЙЧИВОЙ СТЕПЕНИ ОКИСЛЕНИЯ
Ga(III)
In(III)
Tl(I)
ПРИЧИНА:
Эффект «инертной пары» 6s2
ФОРМАЛЬНО
возможна реализация СО=+2 в комплексных соединениях, где Э имеет СО=
+1 и +3
Э+1[Э+3Cl4]
Ga , In , Tl
Рост металличности
Слайд 119Ga , In ,Tl - мягкие, легкоплавкин, серебристо-белые металлы
На воздухе
Ga и In (подобно Al) покрываются тонкой
оксидной пленкой
Tl медленно
окисляется: Tl + O2= Tl2O
РАСТВОРЕНИЕ МЕТАЛЛОВ:
а)растворение в кислотах
Э + разбавленные минеральные кислоты = соли Ga+3,In+3, Tl+1
Tl + HF = TlF
Tl + HCl, HBr, HI = TlHal ↓ (не растворимые галогениды)
б)растворение в щелочах (Ga – легко (Al), In – с трудом
Tl – не растворим)
2Э + 2 NaOH + 6H2O = 2Na[Ga(OH)4] + 3H2↑
Слайд 120ОКСИДЫ Э2О3
Нелетучи, тугоплавки, не растворимы в воде
Термическая устойчивость уменьшается
в ряду Ga2О3 - In2O3, Tl2O3
Tl2O3 500
Tl2O + O2 (диссоциация)
3. Ga2O3 – амфотерен
Ga2O3 + 2NaOH+5H2O = 2Na[Ga(OH)4(H2O)2]
4. Tl2O3 - проявляет окислительные свойства
Tl2O3 + 6HCl = 2 TlCl↓ + 2Cl2↑ + 3H2O
Слайд 121ГИДРОКСИДЫ Э(ОН)3
Ga (OH)3 In(OH)3
Tl(OH)3
Амфот.
Амф.с преоблад. основных свойств
Основание
Tl(OH)
Сильное
основание
ПОЛУЧЕНИЕ:
Нейтрализация водорастворимых галлатов и индиатов кислотами
[Ga(OH)4]- + H3O+ = Ga(OH)3 + 2H2O
2) Для получения Tl(OH)3 используют реакцию окисления соединений Tl+1 в щелочной среде
Tl2SO4 + 2NaOH + 2H2O2 = 2Tl(OH)3↓ + Na2SO4
Увеличение основных свойств
Рост размера атома Э(III)
Слайд 122РАСТВОРЕНИЕ ГИДРОКСИДОВ
В кислотах образуются аквакомплексы:
Ga(ОН)3 + 3Н3О+ =
[Ga (H2O)6]3+
2. В щелочах растворяются Ga, In с образованием гидроксокомплексов
Э(ОН)3 + 3ОН- = [Э(ОН)6]3-
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
с кислород - содержащими лигандами (OH-, H2O)
2. с галогенидными лигадами ( особенно с F-)
ЭCl3 + MCl = M[ЭCl4] , M3[ЭCl6]
наиболее устойчивы комплексы
Ga с F-, In и Tl c Cl- и Вr-
Слайд 124Химия элементов IV A подгруппы
В ряду Ge – Sn –
Pb уменьшается роль
внешней S-электронной пары в образовании хим.связи (участвуют не
4, а 2 электрона).
С.О.: Ge +4, Sn +4,+2, Pb +2
В ряду Ge - Sn - Pb увеличиваются
металлические свойства.
Ge и α-Sn (серое) - полупроводники
Pb и β-Sn (белое) - металлы
Слайд 125Химические свойства
При нагревании Ge, Sn и Pb взаимодействуют с неметаллами.
Образуются бинарные соединения Ge(IV),
Sn(IV), Pb(II).
В ряду напряжений Ge после Н,
а Sn и Pb непосредственно перед ним.
Слайд 126Растворение металлов
Ge с разб. HCl и H2SO4 не взаимодействует.
Pb устойчив
по отношению к этим реагентам поскольку на поверхности образуются нерастворимые
соли хлорид или сульфат свинца.
В конц. HCl Sn и Pb образуют HЭCl3 или
Н2ЭCl4
Слайд 127Различия в хим.природе простых веществ
п/г Ge проявляются при взаимодействии с
азотной кислотой:
Э (Ge, Sn) + 4HNO3(конц) = Н2ЭО3 + 4NO2
+
H2O
В разб. HNO3 Sn ведет себя как металл:
3Sn + 8HNO3 = 3 Sn(NO3)2 + 2NO + 4H2O
Pb + 2HNO3 = Pb(NO3)2 + H2
Слайд 128При нагревании Sn и Pb взаимодействуют с водными растворами щелочей:
Sn
+ 2KOH + 2H2O = K2[Sn(OH)4] + H2
Pb + 2KOH
+ 2H2O = K2[Pb(OH)4] + H2
Ge растворяется в щелочи в присутствии
окислителей:
Ge + 2KOH + 2H2O2 = K2[Ge(OH)6]
Слайд 129Лучшим реагентом для перевода Ge в раствор являются смеси Ох
с комплексообразователями (ЦВ и смесь HF + HNO3):
Ge + 4HCl
+ 4HNO3 = GeCl4 + 4NO2 + 4H2O
3Ge + 4HNO3 + 18HF = 3H2[GeF6] + 4NO + 8H2O
Хлорид-ион не способен выступать в качестве L в таком комплексе, т.к. обладает меньшей донорной активностью по сравнению с фторид-ионами, поэтому в ЦВ образуется
GeCl4 .
Слайд 130Соединения со с.о. -4
Подобно Si Ge и его аналоги образуют
с
Mg соединения Mg2Э ((германид, станнид, плюмбит).
В ряду Mg2S –
Mg2Ge – Mg2Sn – Mg2Pb
Повышается доля металлической связи и уменьшаются tпл, ΔН и ΔЕ эВ.
Слайд 131Соединения со с.о. +4
В ряду Ge(IV) – Sn(IV) – Pb(IV)
устойчивость бинарных соединений уменьшается (оксиды, хлориды, фториды).
PbCl4 очень неустойчив.
Для Ge(IV)
и Sn(IV) известны:
ЭBr4, ЭI4, ЭS2, нириды Э3N4
Слайд 132Оксиды
GeO2 и SnO2 (белые) подобно диоксиду кремния тугоплавки.
PbO2 (черн.) при
t разлагается.
GeO2 – обладает кисл. свойствами, растворяется в щелочи при
нагревании.
SnO2 - амфотерен, при t реаг. с H2SO4,
SnO2 и PbO2 спл. со щ. и оксидами:
2CaO + PbO2 _= Ca2PbO4
2PbO + PbO2 = Pb2PbO4 (сурик)
Pb2PbO4 + 4HNO3 = 2Pb(NO3)2 + PbO2 + 2H2O
Слайд 133Германиевые, оловянные и свинцовые кислоты (как и кремниевые) в индивидуальном
состоянии выделить трудно. Образуются коллоидные растворы
состава ЭО2×nH2O.
SnCl4+ 4NH3 + 6H2O
= H2[Sn(OH)6] + 4NH4Cl SnO2×nH2O
Слайд 134Дисульфиды
GeS2 (бел.) и SnS2(желт.) не растворяются в воде и разб.
кислотах.
SnCl4 раст. + 2H2S = SnS2 + 4HCl
ЭS2 +
(NH4)2S = (NH4)2ЭS3 (сульфидогерманат IV …)
(NH4)2ЭS3 + 2HCl = H2ЭS3 + 2NH4Cl
H2ЭS3 = ЭS2 + H2S
Гидролиз:
SnCl4 + 4H2O = Sn(OH)4 + 4HCl
Слайд 135Гидриды
Гидриды элементов п/г Ge немногочисленны и малоустойчивы.
В ряду Ge –
Sn – Pb прочность связи Э-Н
уменьшается. Ge и Sn с
Н2 непосредственно не реагируют.
Их получают косвенно:
Mg2Э + 4HCl + H2O = 2MgCl2 + ЭН4
Слайд 136При действии кислот на Mg2Ge, кроме GeH4, одновременно получаются дигерман
Ge2H6
и тригерман Ge3H8. Известен также
дистаннан Sn2H6.
Связь Э-Н в этих
гидридах близка к неполярной. Данные соединения можно рассматривать и как производные Н(-1) и как производные Н(+1).
Слайд 137С формальной точки зрения эти гидриды
можно считать производными Ge, Sn
в с.о.
-4 (сильные восстановители).
Положительную с.о. Ge в германе можно
объяснить
на примере замещения Н на Hal:
GeH4 + HHal = GeH3Hal + H2
Слайд 138Соединения Ge(II),Sn(II),Pb(II)
С.О. +2 характерна для Pb. Для Sn - +2,+4,
а
для Ge(II) – только бинарные соединения.
Окраску имеют GeO и
SnO – черн., PbO –
красн. или желт.
Сульфиды GeS и SnS – бур.цв., PbS – черн.
SnI2 - красн., PbI2 - желт.
Слайд 139Оксиды и гидроксиды амфотерны:
Э(ОН)2 + 2НCl = ЭCl2 +
2Н2О
Э(ОН)2 + КОН = К[Э(ОН)3]
У соед. Pb(II) преобладают
основные свойства
Ge(II) - кислотные.
Соединения Ge(II) и Sn(II) – сильн.восст.,
а Pb(II) нет.
SnS + (NH4)2S2 = SnS2 + (NH4)2S
SnS2 + (NH4)2S = (NH4)2ЭS3 (раствор)
Слайд 140ТИПИЧЕСКИЕ ЭЛЕМЕНТЫ (В)
Аморфный В ( коричневый порошок), кристаллический В (
серо-черный с металлическим блеском);
Дальнейшее ослабление признаков металлического элемента ( по
сравнению с Li и Be);
Диагональное сходство с Si ( а не Al);
Полупроводник, но не типа металлов;
Электронная конфигурация 1s22s22p1;
Размер атома 0.97Å – типичный металл;
Значения потенциала ионизации высокие ( ПИ1=8.296 эВ, ПИ2=25.15 эВ, ПИ3=37.93 эВ)
- поэтому не происходит отдачи электрона с внешнего слоя
Слайд 141– энергетические затраты на образование иона В+3 очень велики,
- электростатическое
взаимодействие В+3 – А3- не компенсирует этих затрат,
решающее значение
имеет образование ковалентных связей;
Степень окисления: -3, 0, +3. Отрицательная СО проявляется редко. Чаще всего проявляется СО=+3 в соединениях с более электроотрицательными элементами (в галогенидах, оксиде, сульфиде, нитриде, гидридах и анионных борат-комплексах с КЧ=4 и 3)
Слайд 1429. Образование химических соединений
Слайд 143ОБРАЗОВАНИЕ ХИМИЧЕСКОЙ СВЯЗИ В МОЛЕКУЛЕ ВF3 (метод валентных связей)
Слайд 14410. Нахождение в природе: содержание в земной коре 10-3 %
бораты Na2B4O7 × 10H2O бура
Na2B4O7 × 4H2O кернит
Невысокое содержание объясняется взаимодействием ядер бора с нейтронами:
замедлитель ядерных процессов
Слайд 145РАСТВОРЕНИЕ
Химически инертен, но реагирует при (t>700 0C) с
4B + 3O2
= 2B2O3
B + N2 = BN
2B + 3Cl2 =
2BCl3
B + Mg = MgB2 (борид магния)
Растворяется:
a) в конц. HNO3
В + 3HNO3 (конц) = H3BO3 + 3NO2↑
б) в щелочах при сплавлении в присутствии окислителя
2В + 2NaOH + NaClO3 = 2NaBO2 + NaCl + H2O
борат натрия
Слайд 1503) Образование боразола
(неорганический бензол)
1 способ:
3В2Н6 + 6NH3 →t,
закр. сосуд 2B3N3H6 + 12H2
В ходе реакции растет число молей в-ва, поэтому взаимодействие реагентов сопровождается повышением давления. Для завершения реакции запаянную ампулу с реакционной смесью охлаждают жидким азотом и осторожно разрезают: из ампулы вырывается сжатый Н2↑ (свист), на охлажденных стенках оседает белый налет - B3N3H6
2 способ:
3 LiBH4 + 3NH4Cl → B3N3H6 + 3 LiCl + 9 H2
4) Окисление:
В2Н6 + О2 → B2O3 + H2O + Q (выделение большого количества тепла,
использование в составе ракетного топлива)
5) Гидролиз:
В2Н6 + 6 Н2О → 2 H3BO3 + 3H2
б/ц, летучая жидкость
Тпл=-850С, Ткип=550С
«ароматический» запах
растворяет жиры, горит
реакц. способность выше, чем у бензола
Слайд 151НИТРИДЫ БОРА
в бинарных соединениях с АЗОТОМ бор проявляет акцепторные свойства:
2B
+ N2 →1000 °C 2BN (α-форма)
гексагональный BN
sp2-гибридизация,
аналог графита
расстояния: BN
в слоях= 1.45Å ( ССграф=1.42Å)
BN между слоями= 3.34Å
угол: 1200
Применение:
сухая смазка для подшипников
огнеупор
термостойкое волокно
Слайд 1522B + N2 →1300 °C, Р↑ (BN)n (β-форма)
кубический BN
sp3-гибридизация
эльбор, боразон
по твердости подобен алмазу,
Тпл = 32000С
α-BN→˃1350 °C, Р↑ β-BN
Применение:
сверхтонкий абразив
термостойкие защитные пленки
Слайд 153ГАЛОГЕНИДЫ БОРА
BI3 > BВr3 > BCl3 > BF3
Соединения ГАЛОГЕНАМИ –
Льюисовские кислоты:
Галогениды бора являются ЭЛЕКТРОНОДЕФИЦИТНЫМИ
Одна из молекулярных орбиталей расположена перпендикулярно
плоскости молекуоы и не участвует в образовании связей с атомом F в молекуле BF3.Эта орбиталь обладает низкой энергией за счет изменения пространственной протяженности (релаксации- сжатия) р-орбитали атома B под действием сильно-ЭО атома F.
Уменьшается акцепторная способность
Поэтому на данной МО выгодно размещение пары электронов донора.
Результат: BHal3 реагируют по д/а механизму и являются Льюисовскими к-ми
Слайд 154ПОЛУЧЕНИЕ BHal3 (где Нal = F, Cl, Br)
галогенирование B2O3 и
др. соед. бора
B2O3 + 3CaF2 +3H2SO4 = 2BF3↑ + 3CaSO4
+ 3H2O
B2O3 + 3C + 3Cl2 = 2BCl3 + 3CO
BF3 + AlBr3 =BBr3 + AlF3
2) получение BI3 (наименее термодинамически устойчив, взрывается при контакте с водой)
3HI + BCl3 = BI3 + 3HCl
3Na[BH4] +8I2 = 2BI3 + 3NaI + 4H2 + 4HI
Слайд 155B-неметалл, поэтому BHal3 обладают свойствами ГАЛОГЕНАНГИДРИДОВ
На влажном воздухе BHal3 дымят
вследствие ГИДРОЛИЗА:
BCl3 + 3 H2O = H3BO3 + 3HCl
две кислоты
Гидролиз BF3 сопровождается параллельной реакцией образования HBF4 (тетрафтороборной кислоты)
BF3 + 3H2O = H3BO3 + 3 HF
3BF3 + 3 HF = 3HBF4
4BF3 + 3H2O = H3BO3 + 3HBF4
Слайд 156КИСЛОТЫ БОРА
Дегидратация ортоборной кислоты
при нагревании (обратимый процесс)
H3BO3
t° HBO2 + H2O (100
0С)
орто- мета-
4HBO2 t° H2B4O7 + H2O (140 0С)
тетра-
H2B4O7 → t° 2B2O3 + H2O (500 0С)
борный ангидрид
Получение H3BO3:
Na2B4O7 + H2SO4 + 5H2O = Na2SO4 + 4H3BO3
H3BO3 – бесцветные пластинчатые кристаллы;
умеренно растворима в воде;
пары окрашивают пламя в зеленый цвет
Слайд 157H3BO3 – слабая кислота К1~10-9, К2~10-13, К3~10-14 (ошиб.)
Менее гидратированные формы
HBO2 и H2B4O7 -
более сильные кислоты
Согласно современным данным H3BO3 – одноосновная кислота
Правильнее описывать ее строение формулой B(OH)3
Слабокислая реакция в растворах B(OH)3 связана не с ее депротонированием, а с ПРИСОЕДИНЕНИЕМ ОН- - иона и образованием комплексной частицы
Т.о. H3BO3 – кислота Льюиса, т.к. ее кислотные свойства связаны не с отщеплением H+, а с присоединением ОН-
Слайд 158ДИССОЦИАЦИЯ H3BO3
B(OH)3 + H2O H+
+ [B(OH)4]- (рК = 9)
Доказательство принадлежности H3BO3 к
кислотам – способность образовывать сложные эфиры при взаимодействии со спиртами ( в присутствии H2SO4 как водоотнимающего реагента)
H3BO3 + 3CH3OH → B(OCH3)3 + H2O
H3BO3 + C2H5OH →B(OC2H5)3 + 3H2O
B(OCH3)3 – борнометиловый эфир (Ткип=68.7 0С)
B(OC2H5)3 – борноэтиловый эфир (Ткип=117.2 0С)
Пары эфиров горючи, пламя окрашено в ярко –зеленый цвет (кач. реакция обнаружения соединений бора)
Слайд 160СИНТЕЗ ТЕТРАБОРАТОВ
1. Синтез в растворе
4H3BO3 +2NaOH=Na2B4O7+7H2O
с последующей кристаллизацией Na2B4O7×10H2O -
бура
2. Твердофазный синтез
4H3BO3 + Na2CO3 =Na2B4O7 (безвод) + 6H2O↑ +
CO2↑
СИНТЕЗ ОРТОБОРАТОВ
Только пирохимический способ (прокаливание)
3Na2CO3 + 2H3BO3 = 2Na3BO3 + 3H2O↑ + 3CO2↑
Слайд 161ПОЛУЧЕНИЕ БОРА
Известны:
B аморфный –
коричневый порошок
В кристаллический – серо-черный
с металлич. блеском,
по твердости близок алмазу
Слайд 162Получение технического или аморфного В
H3BO3 →t B2O3 +3H2O (термолиз)
B2O3
+ 3Mg → 2Bаморф + 3MgO (металлотермия)
(B2O3 нельзя восстановить С)
KBF4
+ 3Na → B + 3NaF + KF
Na2B4O7 + 12Na → 4B + 7Na2O
Na2B4O7 + 3Mg = 2B +2NaBO2 + 3MgO
Побочный продукт MgB2 – борид магния
Слайд 1632. Получение кристаллического В
-Термолиз бороводородов
B2H6 → t 2B чист +
3Н2
-Восстановление BBr3 водородом на танталовой нити
2BBr3 + 3H2 → Tat=1300-1500
2B +6HBr
-Растворение Ваморф в расплаве Al с последующей кристаллизацией В крист.
Слайд 164АЛЮМИНИЙ
Самый распространенный металл (k = 8.8 %) в земной коре.
Немного истории:
1.В V в. до н.э. в Египте добывались квасцы,
которые древние римляне затем обозначили словом «alumen»
2. 1754 г. – нем.химик А.С.Мрггаф выделил из квасцов бесцветную «землю» ( Al2O3)-глинозем (найдена в глине)
3. Лавуазье – предположение о том, что глинозем – оксид не известного металла
4. 1825 г. – датский физик Х.К.Эрстед впервые получил металлический Al ( в 2 cтадии)
1-пропускание хлора через раскаленную смесь глинозема с углем
Al2O3 + 3C + 3Cl2 = 2AlCl3безвод + 3CO
2- обработка безводного AlCl3 амальгамой калия при нагревании
AlCl3безвод + 3K/Hg = Al + 3KCl + 3Hg
Слайд 1655. 1827 г. – нем. химик Ф.Велер предложил более простой
и эффективный способ получения Al
нагревание AlCl3 безвод с металлическим К
AlCl3
+ 3K = Al + 3KCl
Новому металлу было дано название «алюмиум» или «алюминум» от латинского «алюмен».
До конца XIX века Al считался редким металлом и был дороже Au
НАХОЖДЕНИЕ В ПРИРОДЕ
аллюмосиликаты
R1(R2)3 [AlSi3O10](OH, F)2,
где R1 = К, Na; R2 = Al, Mg, Fe, Li:
полевые шпаты K[AlSi3O8]
Слайд 166слюда
нефелин
KNa3[AlSiO4]4
- бокситы Al2O3×nH2O:
- глинозем Al2O3:
Слайд 167каолинит
Al4[Si4O10(OH)8]
криолит
Na3[AlF6]
Слайд 168Получение Аl (промышленный способ)
Электрохимическим методом из Al2O3 (основа боксита Al2O3
• nH2O до 60 %)
1 стадия: технологическая подготовка
сырья
Дегидратация боксита при 2000С, обработка NaOHконц (P, T=160-1700С) → образование Na[Al(OH)4]
Na[Al(OH)4] + Са(ОН)2 → фильтрация примесей малорастворимых соединений железа и кремния
Разбавление водой для гидролиза
Na[Al(OH)4] (+ Н2О) → NaOH + Al(OH)3↓
Прокаливание ( 1100-12000С)
2Al(OH)3 →t Al2O3 + 3H2O
Слайд 1692 cтадия: электролиз
Сложный процесс: Al2O3 не проводит электрический ток
и имеет высокую Тпл = 2050 0С.
Для оптимизации процесса электролиз
Al2O3 проводят в расплавленном криолите Na3AlF6 ( 6 % раствор Al2O3 в криолите, 94 % - эвтектический состав). Это позволяет снизить Тпл до 1000 0С, а расплав криолита обладает высокой электропроводностью, что обеспечивает эффективность электролиза
В электролизере:
Диссоциация Al2O3 → Al3+ + AlO33- (аллюминат-анион)
КАТОД (графитовые пластины на дне ванны):
Al3+ + 3e = Al ( выделение Al на дне электролизера)
АНОД (графитовый): 4 AlO33- - 12е = 2Al2O3 + 3O2↑
(разряжаются аллюминат-анионы)
Слайд 170Поскольку на аноде выделяется О2, то углерод анода выгорает:
О2 +
С → СО ( СО2)
Необходимо постоянное обновление анода – углеродные
стержни наращивают.
Расход углерода: 0.7 т / 1 т Al
Несмотря на большую энергоемкость в настоящее время это единственный способ промышленного получения Al
Слайд 171Сходство и различия В и Al
Радиусы : 0.88 Å (В)
< 1.26 Å (Al)
Al – металл, связь валентных электронов
с ядром ослабевает
2. Al и B – p – элементы ( но Al: 3s23p13d0)
3. Наличие у Al 3d0 – орбитали. Возможна реализация не только sp3 – гибридизации , но и sp3d2 (в большинстве соединений).
Например:
[AlCl4]-, [AlH4]-, Al2F6 – sp3 - гибридизация (тетраэдр)
[Al(H2O)6]3+, [AlF6]3- – sp3d2 - гибридизация (октаэдр)
Слайд 1724. Степень окисления Al и В = +3
5. КЧ: для
В = 3 и 4, для Al = 4 и
6.
6. Al – типичный металл, но с атомами или ионами, способными поляризоваться образует соединения с ковалентным типом связи.
Причина: сочетание большого заряда ядра и большого заряда катиона с малыми размерами иона Al3+ ( 0.53Å) обеспечивает катион Al3+ сильной поляризующей способностью.
7. Al амфотерен в отличии от В
8. Al3+ образует не только анионные, но и катионные комплексные соединения
Слайд 173ФИЗИЧЕСКИЕ СВОЙСТВА Al
Cеребристо-белый металл
Кристаллизуется в гранецентрироованной кубической решетке
Высокая электропроводность (d=2.7
г/см)
Тпл = 660 0С
Слайд 174Химические свойства Al
1.Алюминий химически активен, на воздухе покрывается тонкой оксидной
пленкой, которая обеспечивает значительную коррозионную стойкость. Если пленку удалить, что
можно сделать амальгамированием или механическим путем, то алюминий взаимодействует даже с водой с выделением водорода.
2Al + 6H2O = 2Al(OH)3 + 3H2↑
2. Вследствие образования оксидной пленки алюминий не взаимодействует с очень разбавленной HNO3 оч.разб. и HNO3конц. и H2SO4 конц. на холоду .
!!!!! Поэтому для транспортировки HNO3конц используют алюминиевые емкости ( причина: повышение плотности оксидной пленки под действием HNO3конц ).
Слайд 1753. Al растворяется в разбавленных HCl и H2SO4 (при нагрев.)
2Al
+ 6HCl разб = 2AlCl3 + 3H2↑
4. Алюминий хорошо растворим
в щелочах:
2Al + 6NaOH + 6Н2О = 2Na3[Al(OH)6] + 3H2
или
2Al + 2NaOH + 6Н2О = 2Na[Al(OH)4] + 3H2
Щелочи разрушают оксидный слой.
Слайд 1765. Алюминий взаимодействует с кислородом только при высокой температуре
(мешает пленка Al2O3).
ЕСЛИ:
4Al пудра + 3O2 = 2Al2O3 (белый
дым) + Q (сгорание без остатка)
(выделяется БОЛЬШОЕ количество тепла, поэтому производство аллюминиевой пудры взрывоопасно)
Т.о. алюминий проявляет большое сродство к кислороду. Поэтому Al обладает свойствами сильного ВОССТАНОВИТЕЛЯ и способен вытеснять многие металлы из их оксидов – метод алюмотермии.
Слайд 177АЛЮМОТЕРМИЯ
Получение металлов из их оксидов ( Mn, Cr, V, W,
Fe и др.)
8Al + 3Fe3O4 =4Al2O3 + 9Fe0 ( 1200-3000
0C)
Сварка железных деталей ( предложил В.М. Гольдшмидт):
При поджигании смеси Fe2O3 и порошка Al происходит восстановление железа:
2Al + Fe2O3 = Al2O3 + Fe0
Развивается высокая температура (более 1300 0С), железо плавится, а по окончании реакции застывает в виде слитка, сваривающего две железные детали.
Слайд 178Al2O3 встречается в виде нескольких модификаций:
α – ромбоэдрическая, γ –
модификация.
Наиболее устойчива α – модификация.
В природе встречается в
виде корунда.
Корунд с примесью хрома(III) - рубин,
с примесью титана(III)
и железа(III) - сапфир.
Вследствие прочности связи Al – O корунд твердый, огнеупорный материал.
По твердости к о р у н д уступает алмазу, карборунду и эльбору.
Слайд 179Al2O3 + NaOH + H2O → Na3[Al(OH)6]
В кислотах
не растворяется.
Al(OH)3 - полимерное соединение, получают из солей:
[Al(H2O)6]3+
+ OH- = [Al(H2O)5OH]2+ + H2O
[Al(H2O)5OH]2+ + OH- = [Al(H2O)4(OH)2]+ + H2O
[Al(H2O)4(OH)2]+ + OH- = [Al(H2O)3(OH)3]0 + Н2О
При старении осадок теряет воду и переходит в кристаллический гидроксид алюминия.
t
Слайд 180В кислых растворах существует [Al(H2O)6]3+
В щелочных растворах:
[Al(OH)6]3-
В растворах солей существуют равновесия:
[Al(H2O)6]3+ + H2O =
[Al(H2O)5OH]2+ + H3O+
[Al(H2O)5OH]2+ + H2O = [Al(H2O)4(OH)2]+ + H3O+
Cоли слабых кислот (сульфиды, цианиды, карбонаты) вследствие их гидролиза из водных растворов получить не удается.
Слайд 181Галогениды
AlCl3, AlBr3, AlI3 - гидролизуются.
AlF3 - тугоплавкий,
не растворяется в воде.
AlHal3 (BHal3) - электронодефицитные.
Алюминий - акцептор электронных пар. Галогениды легко присоединяют молекулы-доноры (H2O, NH3, PCl5).
Галогениды алюминия реагируют с галогенидами основного характера, образуя галогеноалюминаты: M3AlHal6, M2AlHal5, MAlHal4 ( Cl, Br, I).
2Al(OH)3 + 12 HF + 3 Na2CO3 = 2 Na3AlF6 + 3CO2 + 9H2O
Слайд 182Непосредственно Al не взаимодействует с водородом. Получают косвенно:
AlCl3
+ LiAlH4 = AlH3
+ 3 LiCl
полимер
(AlH3)n - трехцентровая двухэлектронная связью.
Взаимодействуют с основными гидридами:
n NaH + (AlH3)n = n Na[AlH4]
(гидридоалюминаты – сильные восстановители)
Слайд 183Атом водорода в AlH3 может замещаться или присоединить к молекуле
AlH3 других доноров:
H3N – AlH3 H2N = AlH2
HN ≡ AlH Al3N3H6
алазан алазен алазин алазол
2000 0С
4Al + 3 C = Al4C3 (метанид)
t
Al + N = AlN (нитрид)
Слайд 184Металлический алюминий используют для тонких отражающих покрытий (оптические зеркала, теплоизолирующие
полимерные пленки), в пленочных и электролитических конденсаторах, в качестве важнейшего
компонента твердых ракетных топлив (до 20%), для электрических проводов, как конструкционный материал, прежде всего в авиации. Работающий на околоземной орбите телескоп-рефлектор “Хаббл” массой более 12 т использует главное стеклянное зеркало диаметром 2,4 м, покрытое слоем алюминия толщиной 7*10-6 см (70 нм), с защитным слоем фторида магния толщиной 25 нм


















![Общая характеристика металлов d5d6d4:[(5 × 4) + (0 × 0)] 2B1 =Pобм = – d5d6d4:[(5 × 4) + (0 × 0)] 2B1 =Pобм = – 10 Pсп= 10[(5 × 4) +](/img/thumbs/6e3053cfc82aed576734c0f1a57eda80-800x.jpg)

![Общая характеристика металлов ΔoΔo'egt2g[CoF6]3-[Co(CN)6]3-Высокоспиновый, парамагнитныйΔo < Р СПНизкоспиновый, диамагнитныйΔo' > Р СПΔo < Δ o'Магнитные свойства зависят не ΔoΔo'egt2g[CoF6]3-[Co(CN)6]3-Высокоспиновый, парамагнитныйΔo < Р СПНизкоспиновый, диамагнитныйΔo' > Р СПΔo < Δ o'Магнитные свойства зависят не только от природы металла, но и](/img/thumbs/8a4be54788694e51455a6d8ef006857d-800x.jpg)

![Общая характеристика металлов КС Cu+, Ag+, Zn2+, Cd2+,Hg2+ бесцветны (d10).t2geg[Ti(H2O)6]3+Ti3+ (3d1)Δ=238 кДж/моль400500600пропусканиепоглощениепропусканиеАλ, нм КС Cu+, Ag+, Zn2+, Cd2+,Hg2+ бесцветны (d10).t2geg[Ti(H2O)6]3+Ti3+ (3d1)Δ=238 кДж/моль400500600пропусканиепоглощениепропусканиеАλ, нм](/img/thumbs/d1dfe49f03962dab911a82ab1985944c-800x.jpg)















![Общая характеристика металлов В серной кислоте могут также присутствовать Ti(OH)3HSO4 и [Ti(OH)2HSO4]+. При увеличении В серной кислоте могут также присутствовать Ti(OH)3HSO4 и [Ti(OH)2HSO4]+. При увеличении рН происходит полимеризация, гидролиз, образование](/img/thumbs/973e3b5a11ecfb5230e60ba17dea44d8-800x.jpg)




![Общая характеристика металлов 2 V + 12 HF = 2 H[VF6] 2 V + 12 HF = 2 H[VF6]](/img/tmb/3/271180/9291e18aa8ed8eabe5d6b604f094ef63-800x.jpg)













![Общая характеристика металлов Гетерополикислоты (ГПК) - остатки разных кислот Н3[P(Mo3O10)4] (Mo, W)Основные формы изополимолибдатов:рН Гетерополикислоты (ГПК) - остатки разных кислот Н3[P(Mo3O10)4] (Mo, W)Основные формы изополимолибдатов:рН > 7](/img/tmb/3/271180/d71672a20c6a9a35db0068102db885b5-800x.jpg)










![Общая характеристика металлов Энергетическая диаграмма [Fe(CN)6]4- Энергетическая диаграмма [Fe(CN)6]4-](/img/thumbs/55b9e97913ff414945a29e46fb422400-800x.jpg)
![Общая характеристика металлов Соединения Fe(III). [Fe(H2O)6]3+ в Н2ОFe(OH)3 имеет переменный состав: Fe2O3nH2O3.Галогениды: FeCl3, FeF3, Соединения Fe(III). [Fe(H2O)6]3+ в Н2ОFe(OH)3 имеет переменный состав: Fe2O3nH2O3.Галогениды: FeCl3, FeF3, FeBr3 (Fe3+ + 2I-](/img/tmb/3/271180/3eec8e66e7459742ec7ce5a90bde7cc9-800x.jpg)
![Общая характеристика металлов Координационные соединения Fe(III)Катионные КС малоустойчивы, например, [Fe(NH3)6]Cl3.Анионные КС более устойчивы, чем Координационные соединения Fe(III)Катионные КС малоустойчивы, например, [Fe(NH3)6]Cl3.Анионные КС более устойчивы, чем у Fe(II): K3[Fe(OH)6], K3[Fe(CN)6], K3[FeF6]Na2[Fe(NO)(CN)5]2H2O -](/img/thumbs/d5ea27a6fa5d18a7e72925f2f0f59eea-800x.jpg)

![Общая характеристика металлов Октаэдрическая (t2g5eg2) и тетраэдрическая (eg4t2g3) конфигурации практически равновероятны. Например, розовый раствор Октаэдрическая (t2g5eg2) и тетраэдрическая (eg4t2g3) конфигурации практически равновероятны. Например, розовый раствор [Co(H2O)6]2+ изменяет окраску при](/img/tmb/3/271180/cf5b8ef1d6177d733c546bed2ae52924-800x.jpg)







![Общая характеристика металлов Э(IV) : реализуется в соединениях всех соединений МПГ. Но особенно характерно Э(IV) : реализуется в соединениях всех соединений МПГ. Но особенно характерно для соединений платины. H2[PtCl6] -](/img/tmb/3/271180/49d4666717f0d7fb4d5ed80697f66ca7-800x.jpg)




![Общая характеристика металлов PtClClClClK2+NH3PtClClClNH3K+KClPtClClClNH3K+NH3PtClNH3ClNH3+KClВзаимодействие аминов и комплексных ионов типа [PtX4]2-, где Х = Cl-, PtClClClClK2+NH3PtClClClNH3K+KClPtClClClNH3K+NH3PtClNH3ClNH3+KClВзаимодействие аминов и комплексных ионов типа [PtX4]2-, где Х = Cl-, Br-, I-, SCN-, CN-, NO2-, приводит](/img/thumbs/9f0f7bd584962dacce4ec07505dc7d6b-800x.jpg)
![Общая характеристика металлов PtH3NNH3H3NNH3Cl2NH3PtClNH3Cl+H3NH3NNH3PtClNH3+H3NClPtClNH3ClH3NH3NВзаимодействие галоидоводородной кислоты и комплексных ионов типа [PtA4]2-, где А – PtH3NNH3H3NNH3Cl2NH3PtClNH3Cl+H3NH3NNH3PtClNH3+H3NClPtClNH3ClH3NH3NВзаимодействие галоидоводородной кислоты и комплексных ионов типа [PtA4]2-, где А – амины, приводит к образованию диаминов [PtA2X2]](/img/tmb/3/271180/ddca51dbbb3581ac173c638f8ab44a19-800x.jpg)
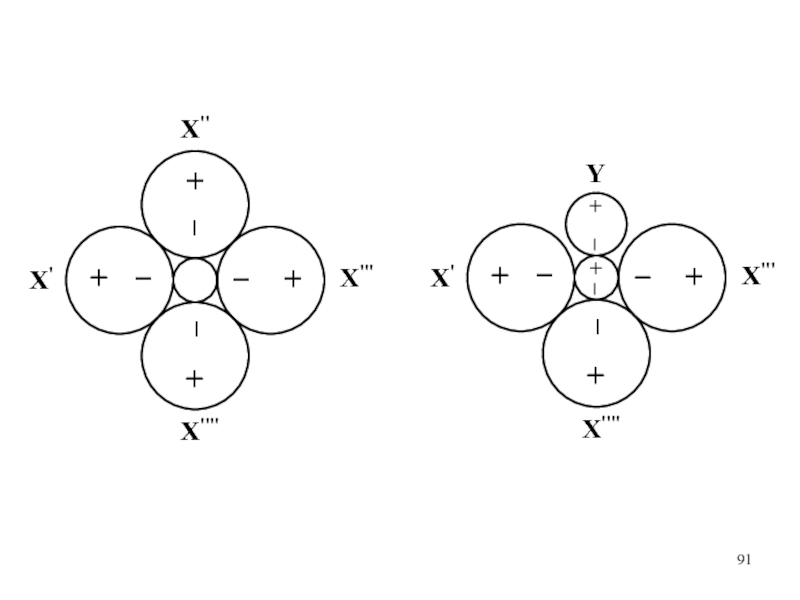
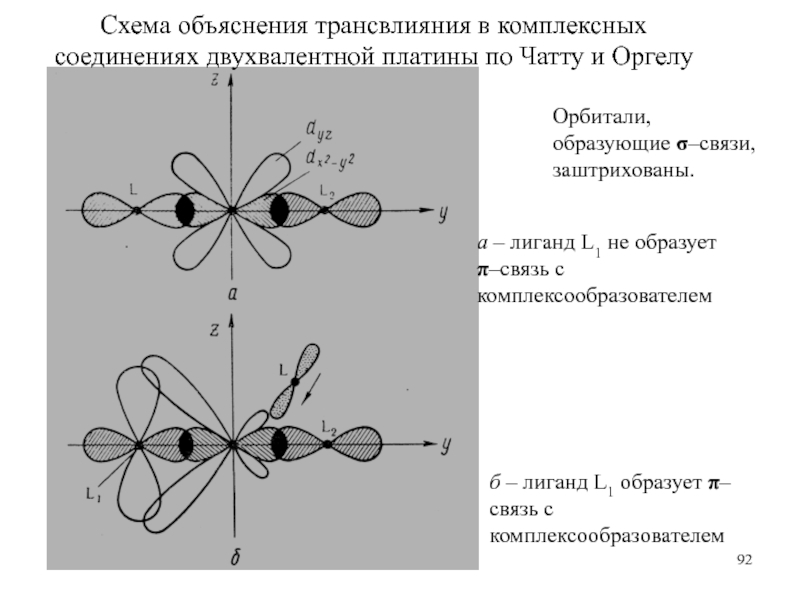

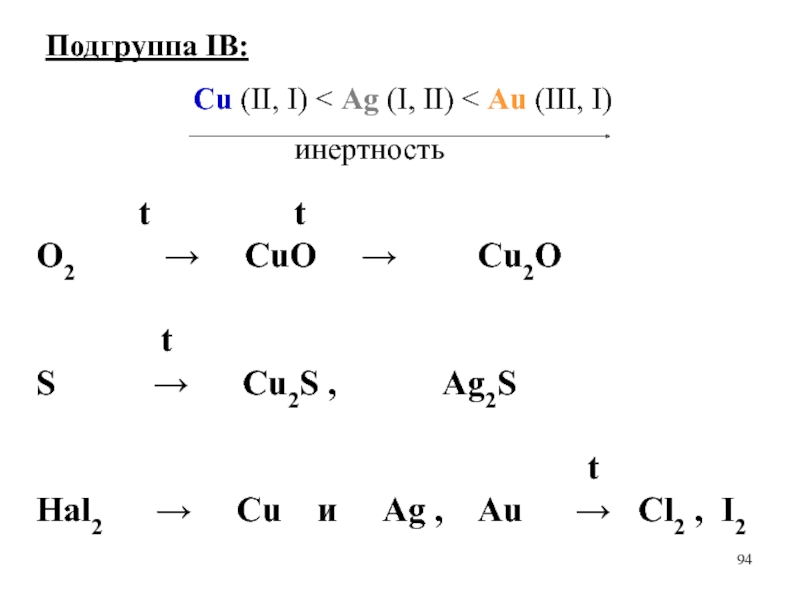


![Общая характеристика металлов Гидроксиды ЭОН тоже неустойчивы: 2AgOH → Ag2O + H2OУстойчивее [Cu(NH3)2]OH в Гидроксиды ЭОН тоже неустойчивы: 2AgOH → Ag2O + H2OУстойчивее [Cu(NH3)2]OH в результате снижения поляризующего действия Э+ на](/img/thumbs/c28fb9c32dd46508a422af984cd627eb-800x.jpg)
![Общая характеристика металлов Галогениды растворяются в избытке реактива: CuCl + HCl = Галогениды растворяются в избытке реактива: CuCl + HCl = H[CuCl2]AgCl](/img/tmb/3/271180/ee3fe299fd3ac4e83d15f9993d811321-800x.jpg)
![Общая характеристика металлов КС Э(I) наиболее устойчивы с цианид-ионами:[Cu(CN)2]- → [Ag(CN)2]- → [Au(CN)2]- (усиление КС Э(I) наиболее устойчивы с цианид-ионами:[Cu(CN)2]- → [Ag(CN)2]- → [Au(CN)2]- (усиление π-дативного взаимодействия).Соединения](/img/thumbs/372597a34c0ecac7c2f4df9f3cf95f7c-800x.jpg)


![Общая характеристика металлов Катионные КС меди(II): [Cu(H2O)6]2+ - светло-синий (800 нм)[Cu(NH3)4(H2O)2]2+ Катионные КС меди(II): [Cu(H2O)6]2+ - светло-синий (800 нм)[Cu(NH3)4(H2O)2]2+](/img/thumbs/4c41545635255a43b428057b8caa884b-800x.jpg)

![Общая характеристика металлов Анионные КС меди(II):[Cu(CN)4]2- , [CuCl4]2- , [Cu(OH)4]2-, [Cu(CO3)]2- - купратыСоединения меди(III), Анионные КС меди(II):[Cu(CN)4]2- , [CuCl4]2- , [Cu(OH)4]2-, [Cu(CO3)]2- - купратыСоединения меди(III), серебра(III) и](/img/thumbs/95fa442313e3683e20a7f0fc2fb019f5-800x.jpg)

![Общая характеристика металлов Cu(III) и Ag(III) - известны фторпроизводные:K3[CuF6] и K[AgF4]При окислении Cu(III) и Ag(III) - известны фторпроизводные:K3[CuF6] и K[AgF4]При окислении Cu(OH)2 в щелочной](/img/tmb/3/271180/58d6dd7df3cae06bd543083f72e5d0f3-800x.jpg)



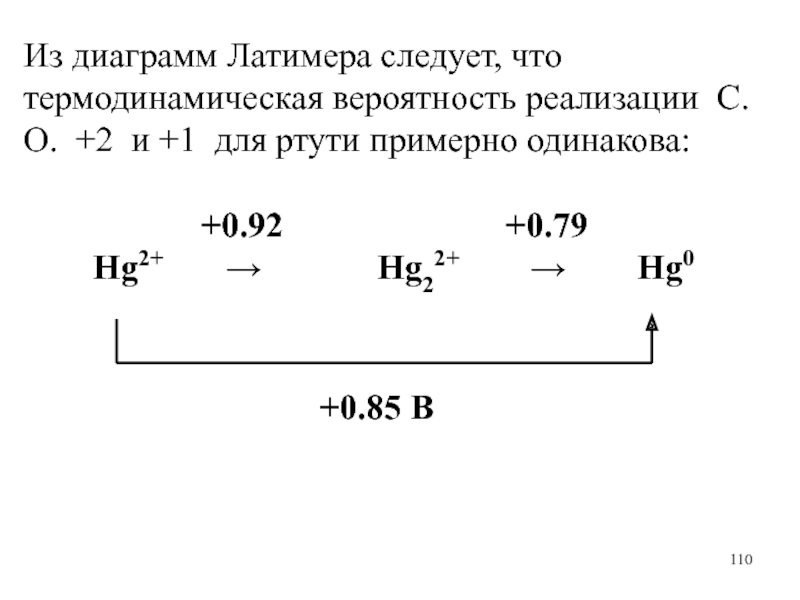


2 + Цинк растворяется в аммиаке: Zn + 4 NH3H2O = [Zn(NH3)4](OH)2 + H2 + 2 H2OЦинк -](/img/tmb/3/271180/90ae3249b3d1638ee3388ee59ada0bf7-800x.jpg)

![Общая характеристика металлов HgS растворяется в растворах основных сульфидов:K2S + HgS = K2[HgS2] (дитиомеркурат(II) HgS растворяется в растворах основных сульфидов:K2S + HgS = K2[HgS2] (дитиомеркурат(II) калия).Соединения ртути(I) диспропорционируют: Hg22+](/img/tmb/3/271180/e547eca08da52faa5ca2a37c3c36e544-800x.jpg)

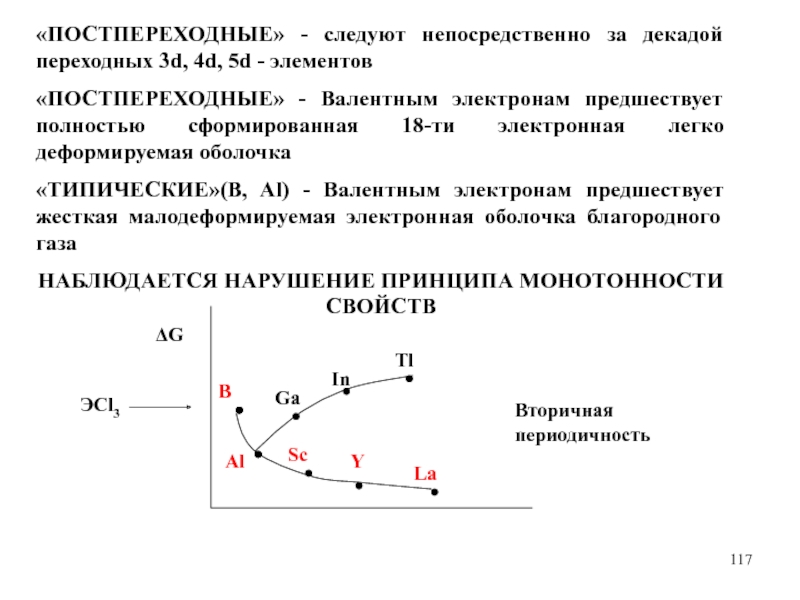
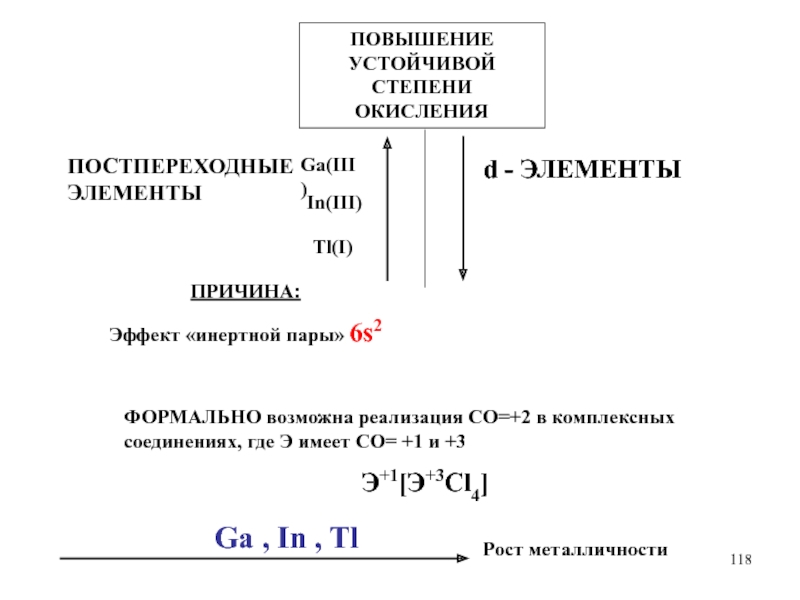



![Общая характеристика металлов РАСТВОРЕНИЕ ГИДРОКСИДОВВ кислотах образуются аквакомплексы: Ga(ОН)3 + 3Н3О+ = [Ga (H2O)6]3+2. РАСТВОРЕНИЕ ГИДРОКСИДОВВ кислотах образуются аквакомплексы: Ga(ОН)3 + 3Н3О+ = [Ga (H2O)6]3+2. В щелочах растворяются Ga, In](/img/thumbs/782c78129825d4ea4f483fb526596fb8-800x.jpg)





![Общая характеристика металлов При нагревании Sn и Pb взаимодействуют с водными растворами щелочей:Sn + При нагревании Sn и Pb взаимодействуют с водными растворами щелочей:Sn + 2KOH + 2H2O = K2[Sn(OH)4] +](/img/tmb/3/271180/204ec4017eac23ead1ce84b359e188e6-800x.jpg)










![Общая характеристика металлов Оксиды и гидроксиды амфотерны:Э(ОН)2 + 2НCl = ЭCl2 + 2Н2ОЭ(ОН)2 + Оксиды и гидроксиды амфотерны:Э(ОН)2 + 2НCl = ЭCl2 + 2Н2ОЭ(ОН)2 + КОН = К[Э(ОН)3]У](/img/thumbs/d8ac5f08c8d12de8c26e2a6f296d11e3-800x.jpg)


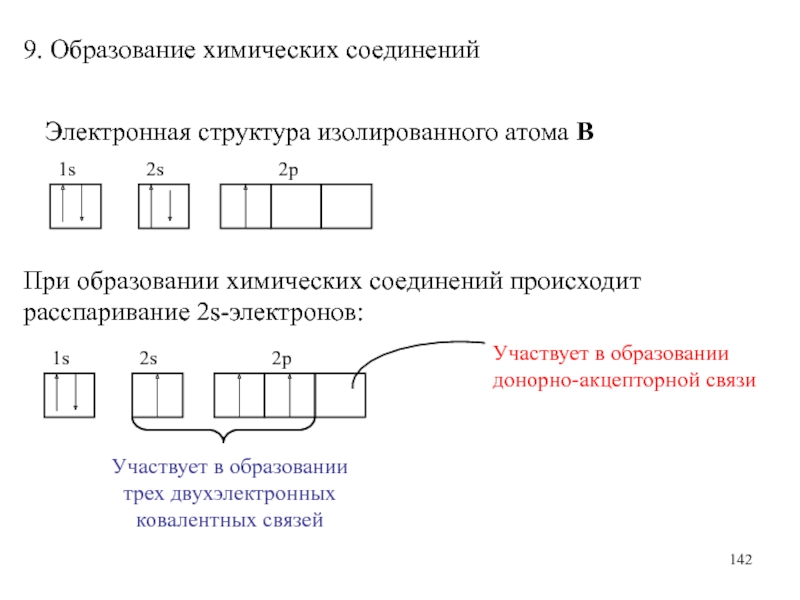
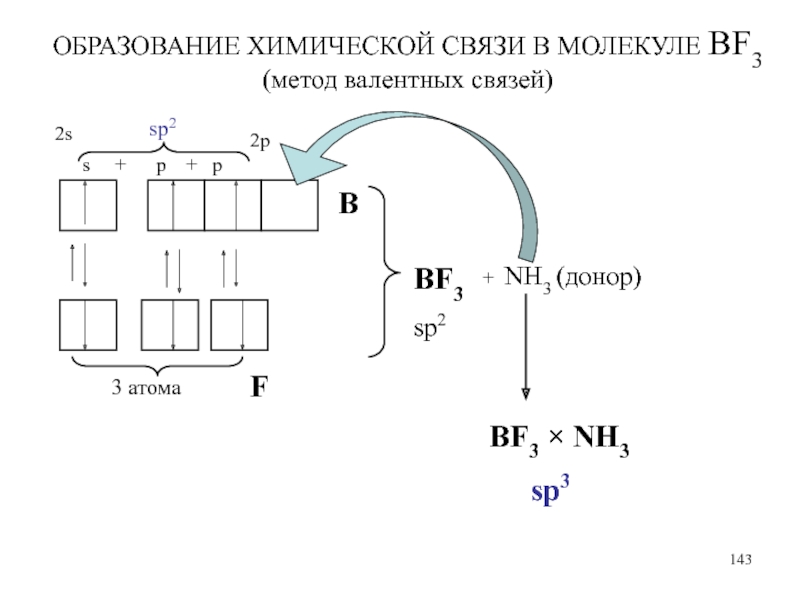



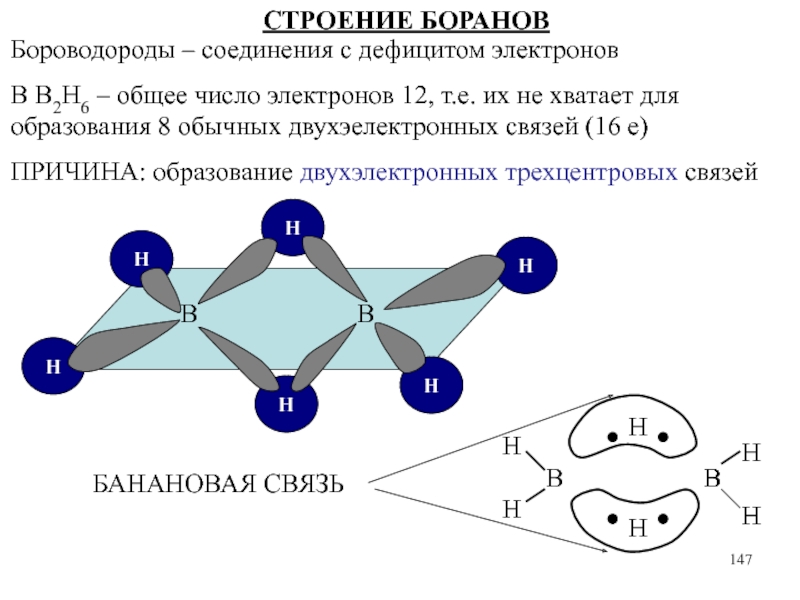
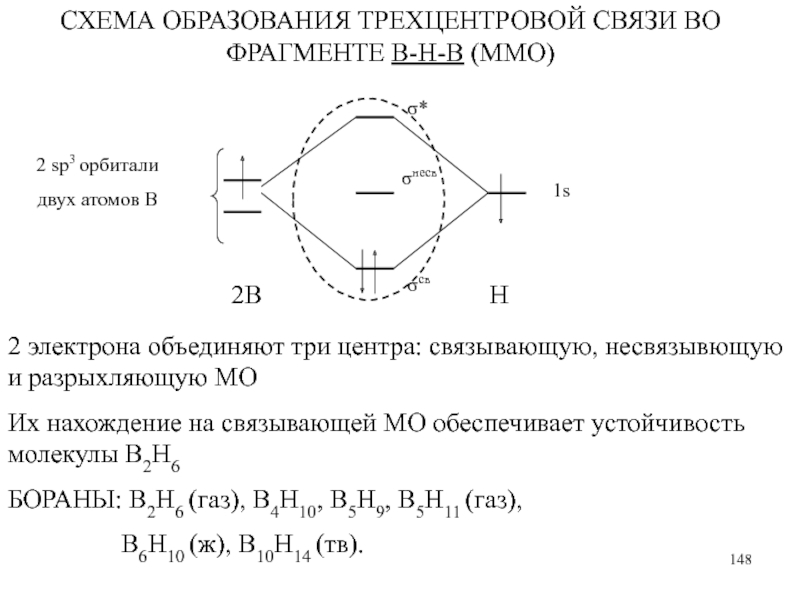



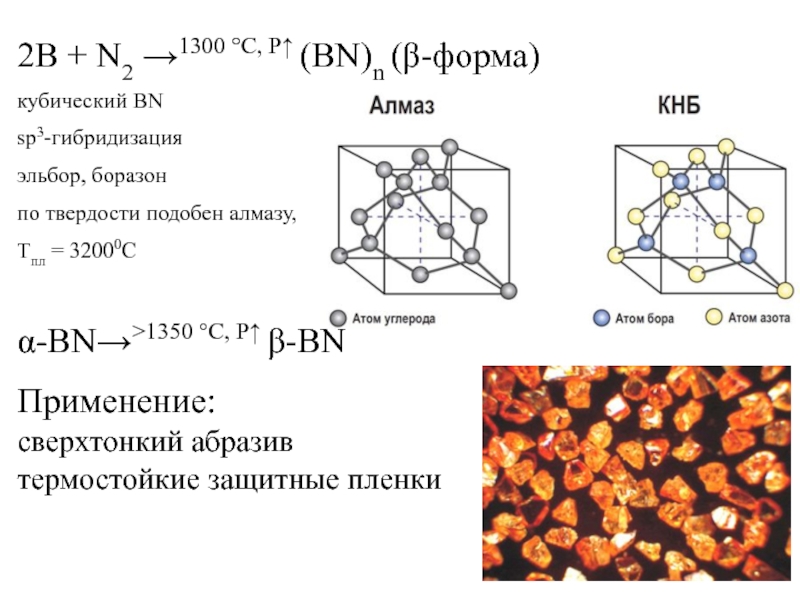
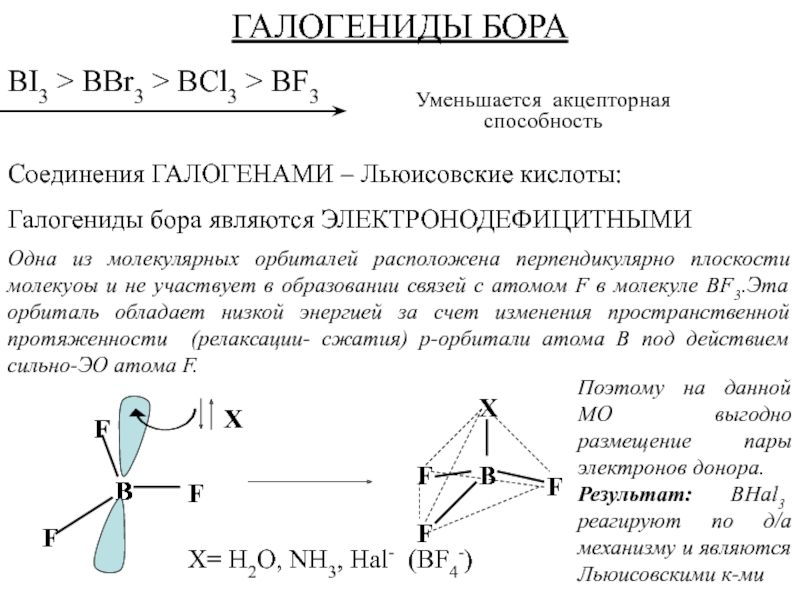



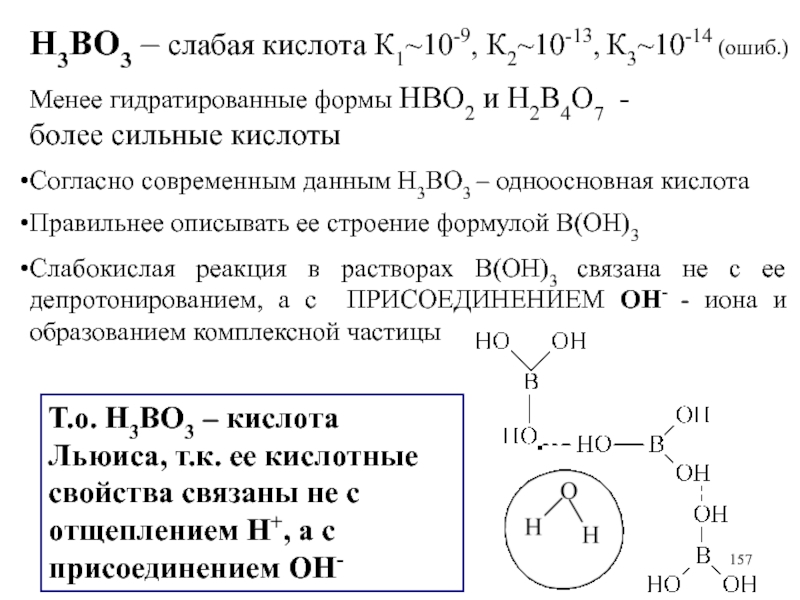
![Общая характеристика металлов ДИССОЦИАЦИЯ H3BO3B(OH)3 + H2O H+ + [B(OH)4]- (рК ДИССОЦИАЦИЯ H3BO3B(OH)3 + H2O H+ + [B(OH)4]- (рК = 9)Доказательство](/img/thumbs/697e5f606f37ed2370acb2a93d4a6eb1-800x.jpg)







![Общая характеристика металлов слюданефелинKNa3[AlSiO4]4- бокситы Al2O3×nH2O:- глинозем Al2O3: слюданефелинKNa3[AlSiO4]4- бокситы Al2O3×nH2O:- глинозем Al2O3:](/img/tmb/3/271180/04fe9cd4fe4aa8ecb6c1cd5a57787bc2-800x.jpg)
![Общая характеристика металлов каолинит Al4[Si4O10(OH)8]криолит Na3[AlF6] каолинит Al4[Si4O10(OH)8]криолит Na3[AlF6]](/img/tmb/3/271180/3a8419c7c0d6a938706841329ca40942-800x.jpg)


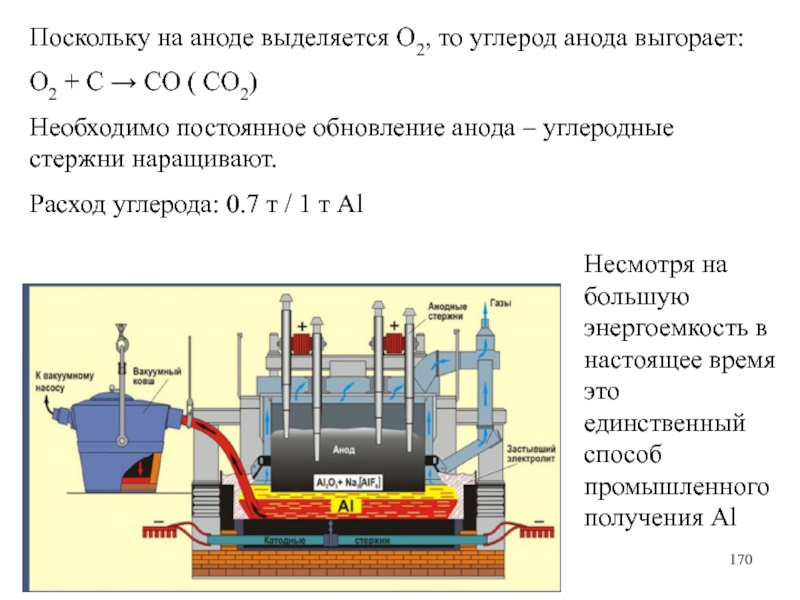








![Общая характеристика металлов Al2O3 + NaOH + H2O → Na3[Al(OH)6]В кислотах не растворяется.Al(OH)3 - Al2O3 + NaOH + H2O → Na3[Al(OH)6]В кислотах не растворяется.Al(OH)3 - полимерное соединение,](/img/tmb/3/271180/18a1c1a3be08a3fcdb6942df64c618de-800x.jpg)
![Общая характеристика металлов В кислых растворах существует [Al(H2O)6]3+ В щелочных растворах: [Al(OH)6]3- В В кислых растворах существует [Al(H2O)6]3+ В щелочных растворах: [Al(OH)6]3- В растворах солей существуют равновесия:[Al(H2O)6]3+ +](/img/tmb/3/271180/b89387d3a3573fb2533c84cbf1d67f91-800x.jpg)























