Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Общие химические свойства металлов
Содержание
- 1. Общие химические свойства металлов
- 2. Цели урокаСформировать представления о металлах как восстановителяхВыяснить причину разной активности металловВыделить основные свойства металлов
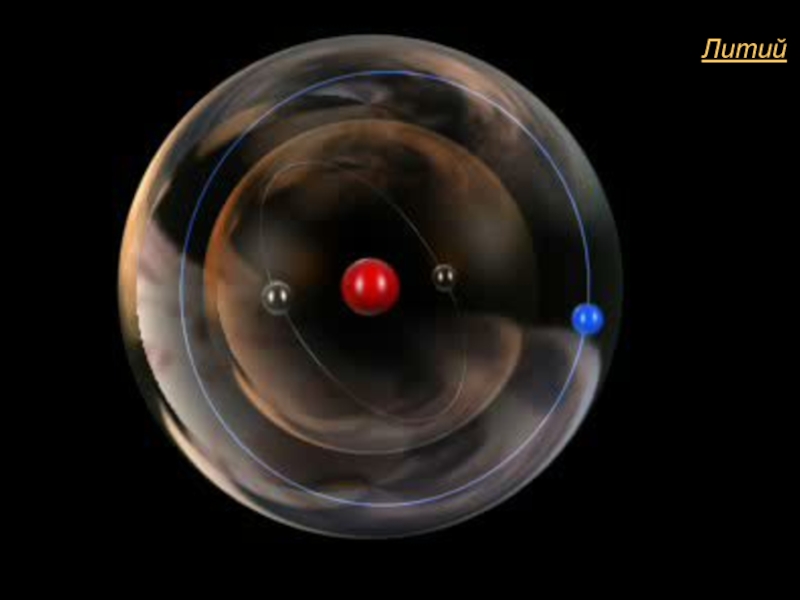
- 3. Литий
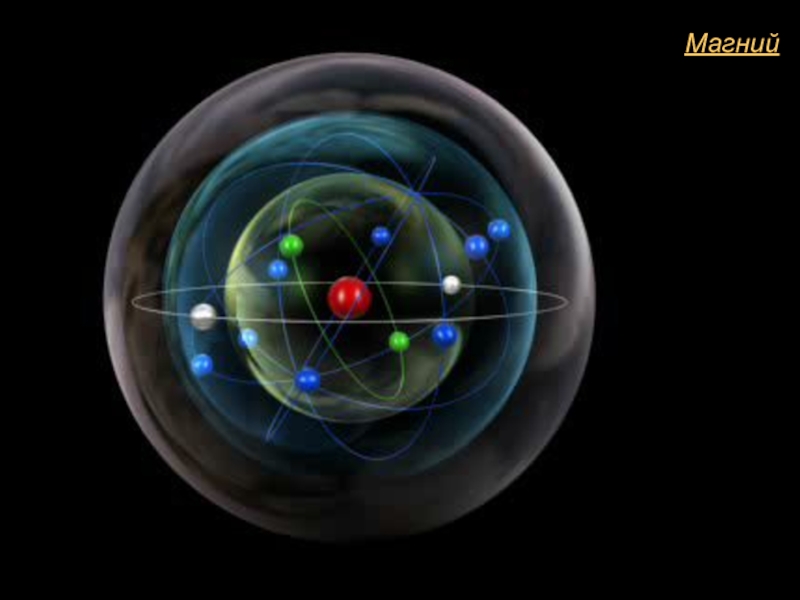
- 4. Магний
- 5. Калий
- 6. Рубидий
- 7. Ме - восстановителиАтомы Ме имеют сравнительно большие
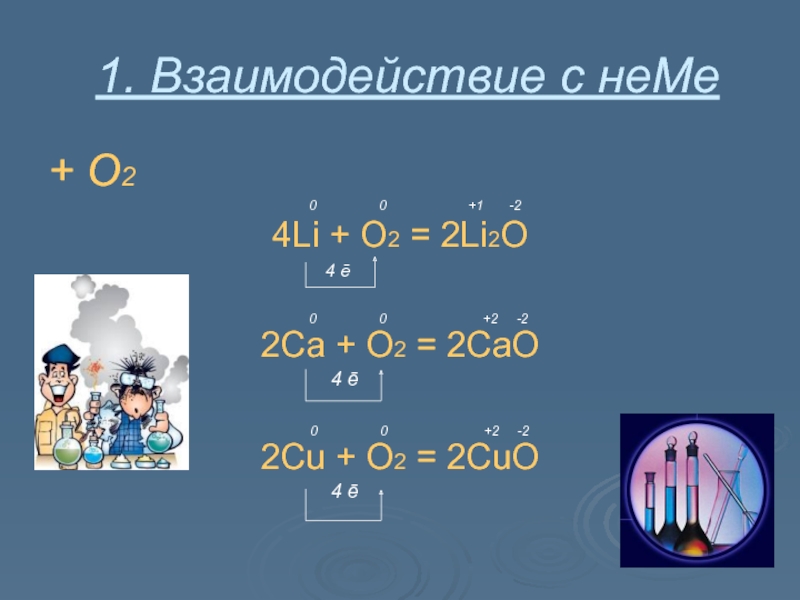
- 8. 1. Взаимодействие с неМе+ О2
- 9. 1. Взаимодействие с неМе+ Cl2
- 10. 2. Взаимодействие с водойЩелочные и щелочноземельные Ме
- 11. БекетовНиколай Николаевич
- 12. 3. Взаимодействие с кислотами
- 13. ИсключенияH2SO4 (конц.) и HNO3 (любой конц-ии) реагируют с металлами по-особому, при этом Н2 не образуется
- 14. 4. Взаимодействие с солями
- 15. Упражнение 1Расставьте коэффициенты методом электронного баланса, укажите
- 16. Ответы
- 17. Упражнение 2Допишите практически осуществимые реакции:а) Fe +
- 18. Ответыа) 2Fe + 6HCl → 2FeCl3 +
- 19. Домашнее заданиеВыучить общие химические свойства металлов.Задача. Смесь
- 20. Источники материалаГабриелян О.С. Химия. 9 класс. —
- 21. Скачать презентанцию
Цели урокаСформировать представления о металлах как восстановителяхВыяснить причину разной активности металловВыделить основные свойства металлов
Слайды и текст этой презентации
Слайд 2Цели урока
Сформировать представления о металлах как восстановителях
Выяснить причину разной активности
металлов
Слайд 7Ме - восстановители
Атомы Ме имеют сравнительно большие радиусы.
ē значительно удалены от ядра и слабо с ним связаны
У
наиболее активных Ме на внешнем энергетическом уровне находятся 1-3 ē.
Ме легко отдают внешние ē и являются
восстановителями
Слайд 81. Взаимодействие с неМе
+ О2
0 0 +1 -2
4Li + O2 = 2Li2O
4 ē
0 0 +2 -2
2Ca + O2 = 2CaO
4 ē
0 0 +2 -2
2Cu + O2 = 2CuO
4 ē
Слайд 91. Взаимодействие с неМе
+ Cl2
0 0 +2 -1
Cu + Cl2 = CuCl2
2 ē
0 0 +3 -1
2Fe + 3Cl2 = 2FeCl3
6 ē
+ S
0 0 +2 -2
Cu + S = CuS
2 ē
0 0 +2 -2
Hg + S = HgS
2 ē
Слайд 102. Взаимодействие с водой
Щелочные и щелочноземельные Ме
Щелочи
0 +1 +1 0
2Na + 2H2O = 2NaOH + H2↑
2 ē
Менее активные Ме (раскаленные) оксид
3Fe + 4H2O = Fe3O4 + 4H2↑
Ag, Au, Pt, Hg, Cu с водой не взаимодействуют
Слайд 123. Взаимодействие с кислотами
0 +1 +2 0
Mg + H2SO4 = MgSO4 + H2↑
2 ē
0 +1 +2 0
Zn + H2SO4 = ZnSO4 + H2↑
2 ē
Cu + H2SO4 =
Вывод: Ме, стоящие в ряду напряжений левее водорода, вытесняют его из растворов кислот, а стоящие правее – не вытесняют водород из растворов кислот
Слайд 13Исключения
H2SO4 (конц.) и HNO3 (любой конц-ии) реагируют с металлами по-особому,
при этом Н2 не образуется
Слайд 144. Взаимодействие с солями
0 +2 +2 0
Zn + CuSO4 = ZnSO4 + Cu
2 ē
Cu + ZnSO4 =
Вывод: Каждый металл вытесняет из растворов солей другие металлы, находящиеся правее него в ряду напряжений, и сам может быть вытеснен металлами, расположенными левее
Слайд 15Упражнение 1
Расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель:
а)
Al + O2 = Al2O3
б) Zn + S =ZnS
Слайд 16Ответы
0
0 +3 -2а) 4Al + 3O2 = 2Al2O3
в-ль о-ль
Al0 - 3ē → Al+3 4 окисление
O20 + 4ē → 2O-2 3 восстановление
0 0 +2 -2
б) Zn + S =ZnS
в-ль о-ль
Zn0 - 2ē → Zn+2 2 1 окисление
S0 + 2ē → S-2 2 1 восстановление
Слайд 17Упражнение 2
Допишите практически осуществимые реакции:
а) Fe + HCl →
б) Ag
+ H3PO4 →
в) Al + HCl →
г) Zn + Pb(NO3)2
→д) Fe + MgCl2 →
Слайд 18Ответы
а) 2Fe + 6HCl → 2FeCl3 + 3H2↑
б) Ag +
H3PO4 →
в) 2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
г)
Zn + Pb(NO3)2 → Zn(NO3)2 + Pbд) Fe + MgCl2 →
Слайд 19Домашнее задание
Выучить общие химические свойства металлов.
Задача. Смесь медных и магниевых
опилок массой 1,5 г обработали избытком соляной кислоты. В результате
выделился газ объемом 560 мл (н.у.). Определите массовую долю меди в смеси.Слайд 20Источники материала
Габриелян О.С. Химия. 9 класс. — М.: Дрофа, 2014.
Кузьменко
Н.Е., Еремин В.В., Попков В.А. Начала химии. — М.: Экзамен,
2001.Диск «Электронные уроки и тесты. Химия в школе. Соли».
http://images.yandex.ru/yandsearch?p=3&text=%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9+%D1%80%D1%8F%D0%B4+%D0%BD%D0%B0%D0%BF%D1%80%D1%8F%D0%B6%D0%B5%D0%BD%D0%B8%D0%B9+%D0%BC%D0%B5%D1%82%D0%B0%D0%BB%D0%BB%D0%BE%D0%B2&stype=image
http://images.yandex.ru/yandsearch?text=%D0%BA%D0%BD%D0%B8%D0%B3%D0%B8&stype=image
http://images.yandex.ru/yandsearch?p=1&text=%D1%88%D0%BA%D0%BE%D0%BB%D0%B0&stype=image&ed=1
http://images.yandex.ru/yandsearch?ed=1&rpt=simage&text=%D0%B2%D0%BE%D0%BF%D1%80%D0%BE%D1%81&img_url=www.avonru.ru%2F_bl%2F2%2F13624920.gif&spsite=fake-017-7701509.ru&p=8
http://images.yandex.ru/yandsearch?nl=1&ed=1&rpt=simage&text=%D0%B2%D0%BE%D0%BF%D1%80%D0%BE%D1%81%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D1%8B%D0%B9%20%D0%B7%D0%BD%D0%B0%D0%BA&img_url=www.soyanews.ru%2Fupload%2Fiblock%2F3a1%2Fquestion7.jpg&spsite=fake-053-3034273.ru&p=371