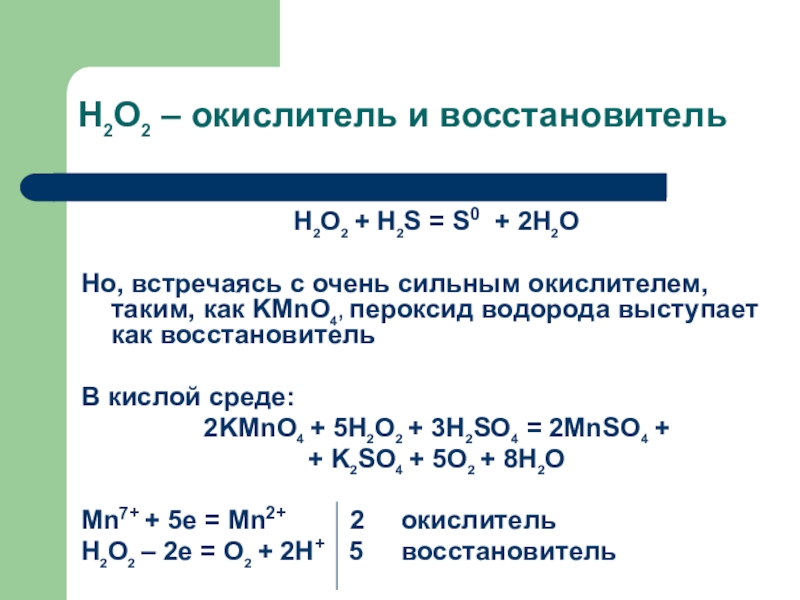
находят окислитель, восстановитель и среду
2. Записывают формулы окислителя и
восстановителя и соответствующие продукты реакции в ионном виде
3. Составляют ионные уравнения полуреакций восстановления и окисления, соблюдая для каждой из них законы сохранения числа атомов и заряда
4. Находят наименьшее общее кратное (н.о.к.) числа переданных в каждой полуреакции электронов и подбирают дополнительные множители для уравнений полуреакций так, чтобы число принятых электронов стало равным числу отданных электронов
5. Составляют ионное уравнение реакции
6. Уравнивают числа остальных атомов, участвующих в реакции, и получают уравнение реакции с подобранными коэффициентами
K2Cr2O7 + H2SO4 + H2S S + ...
Ок Среда Вс
Cr2O72– + H+ + H2S S + Cr3+ + H2O
Cr2O72– (Оф) → Cr3+ (Вф)
H2S (Вф) → S (Оф)
Cr2O72– + 14H+ + 6e– = 2Cr3+ + 7H2O
H2S – 2e– = S + 2H+
н.о.к. 6
Cr2O72– + 14H+ + 6e– = 2Cr3+ + 7H2O | 1
H2S – 2e– = S + 2H+ | 3
Cr2O72– + 8H+ + 3H2S = 3S + 2Cr3+ + 7H2O
K2Cr2O7 + 4H2SO4 + 3H2S = 3S + Cr2(SO4)3 + 7H2O + K2SO4