Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Оксосоединения, получение, свойства, таутомерия
Содержание
- 1. Оксосоединения, получение, свойства, таутомерия
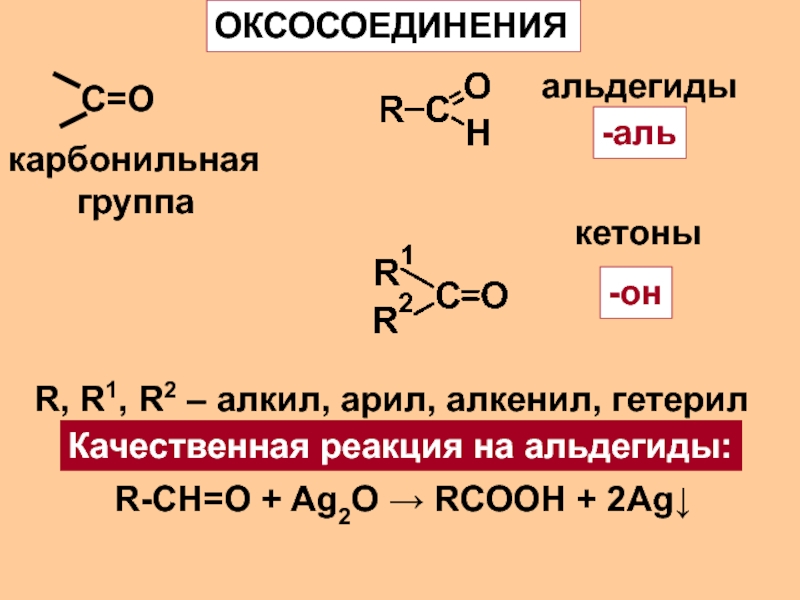
- 2. С=ООКСОСОЕДИНЕНИЯкарбонильная группаальдегиды-алькетоны-онR, R1, R2
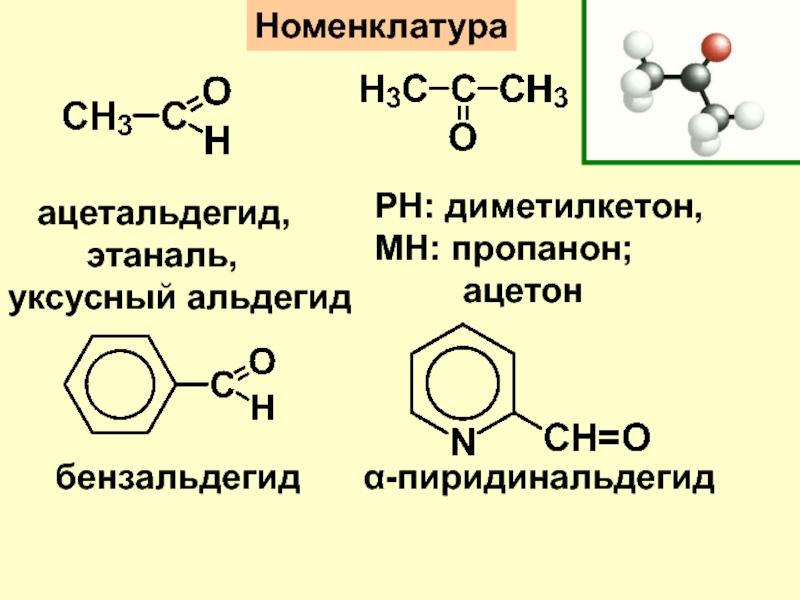
- 3. НоменклатураРН: диметилкетон,МН: пропанон; ацетон ацетальдегид, этаналь,уксусный альдегидбензальдегидα-пиридинальдегид
- 4. Природные оксосоединения 4-гидрокси-3-метокси-бензальдегид (ванилин)камфора
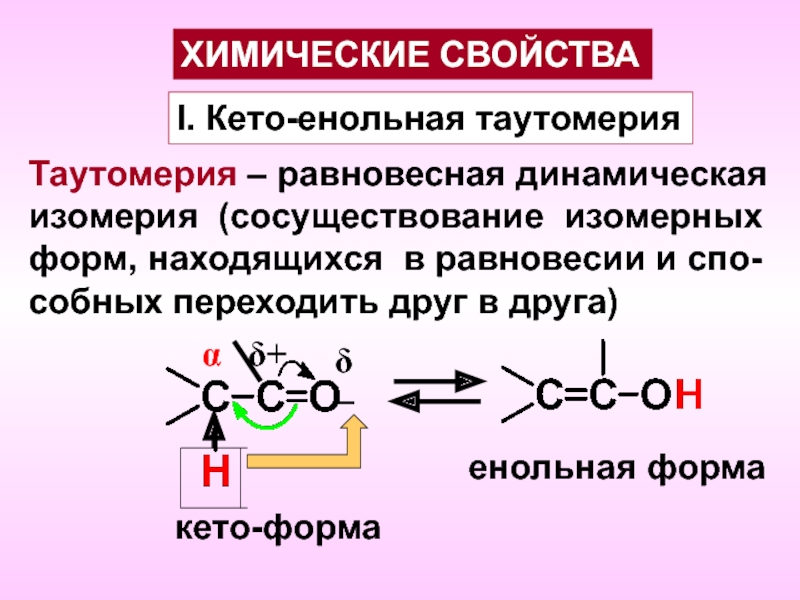
- 5. I. Кето-енольная таутомерияТаутомерия – равновесная динамическаяизомерия (сосуществование
- 6. Примеры:1. Уксусный альдегидкето-формаенольная формаα10-4 – 10-5 %
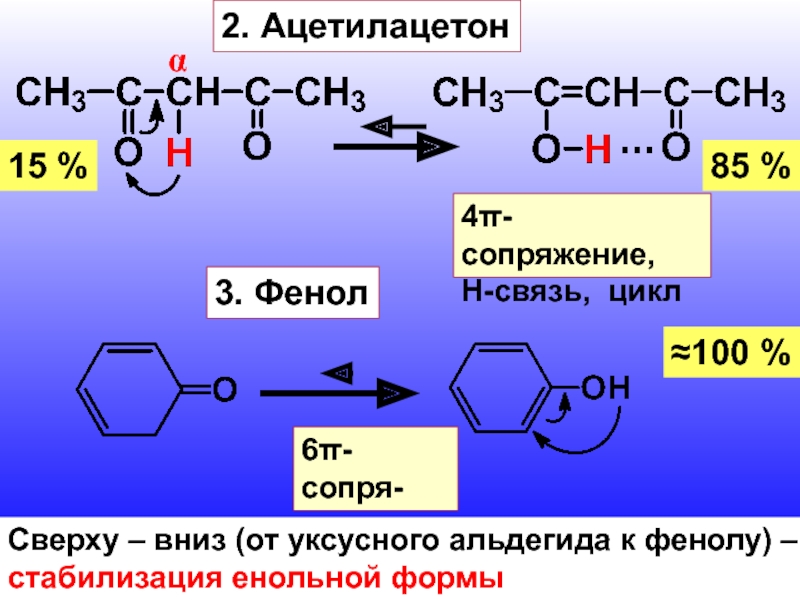
- 7. 2. Ацетилацетонα15 %85 %4π-сопряжение,Н-связь, цикл3. Фенол≈100 %6π-сопря-
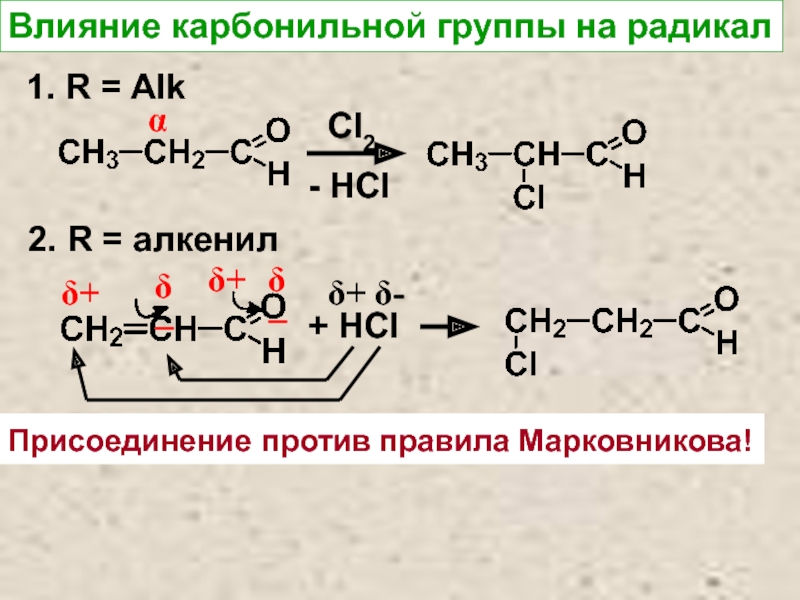
- 8. Влияние карбонильной группы на радикал1. R = AlkαCl2- HCl2. R = алкенилδ−δ+δ−δ++ HClδ+δ-Присоединение против правила Марковникова!
- 9. 3. R = арилЗаместитель II рода,акцептор электроновHONO2(к.)H2SO4(к.)- Н2Оδ−δ−
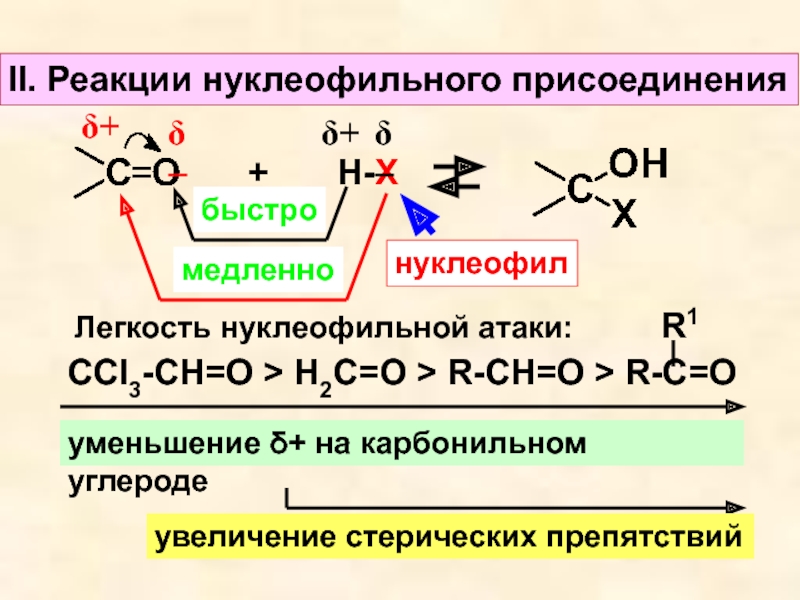
- 10. II. Реакции нуклеофильного присоединенияδ−δ++
- 11. 1. Гидрирование (присоединение гидридов Me)CH3CH=O альдегид[Н]
- 12. + Н-ОНХлоральгидрат (снотворное)
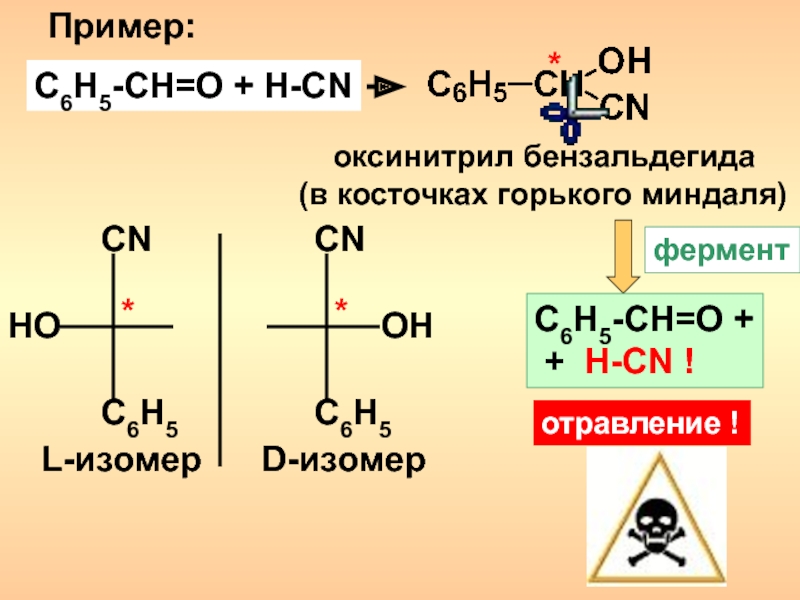
- 13. Пример:C6H5-CH=O + H-CN* оксинитрил бензальдегида(в косточках горького миндаля)C6H5C6H5CNCNOHHO**D-изомерL-изомерферментC6H5-CH=O + + H-CN !отравление !
- 14. 4. Присоединение NaHSO3(используется для качественной и количествен-
- 15. 5. Присоединение спиртов – образование полуацеталей
- 16. Кольчато-цепная таутомерияHO-(CH2)3-CH=O4-гидрокси- бутанальDDβ-формаα-формаHO-(CH2)4-CH=O5-гидрокси- пентанальDDβ-формаα-форма
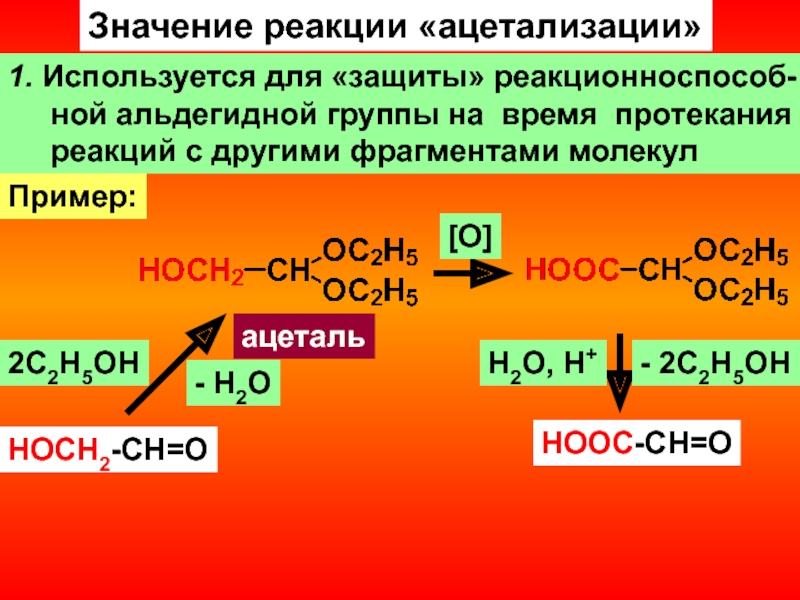
- 17. Значение реакции «ацетализации»1. Используется для «защиты» реакционноспособ-
- 18. 2. Выведение из организма чужеродных соедине-
- 19. 6. Присоединение меркаптанов+ H-S-RполумеркаптальRSH, H+- H2O полныймеркапталь сульфонал(снотворное)
- 20. III. Реакции замещения карбонильногокислорода
- 21. 1. Образование иминов(взаимодействие с NH3, аминами, аминокислотами)В организме – трансаминирование+- H2Oкетокислотааминокислотаoснование Шиффа Ioснование Шиффа IIH2O+аминокислотакетокислота
- 22. 2. Образование оксимов(взаимодействие с гидроксиламином)СH3-C=OСH3-C=O+2 H2N-OH- 2H2OСH3-C=N-OHСH3-C=N-OHбутандион-2,3,диметилглиоксальдиметилглиоксим(реактив
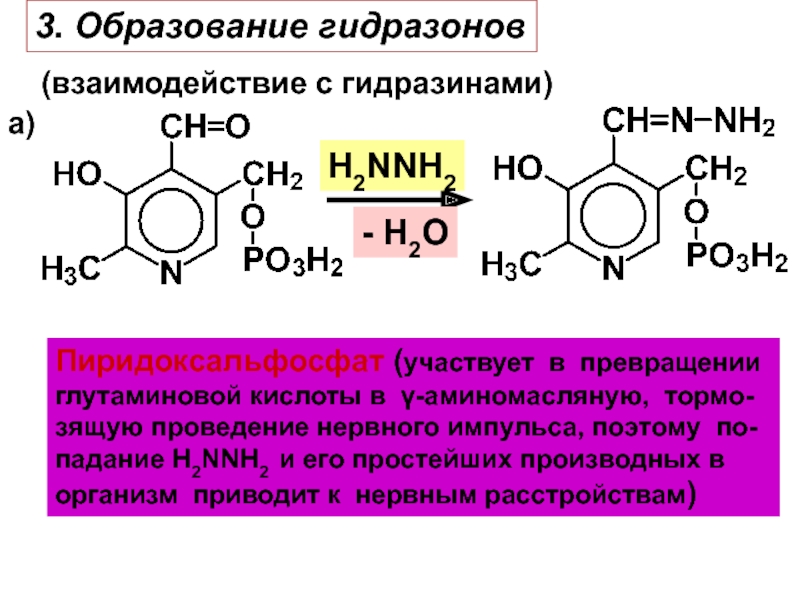
- 23. 3. Образование гидразонов(взаимодействие с гидразинами)а)Пиридоксальфосфат (участвует в
- 24. б)H2NNHС6Н5- H2Oозазон глицериновогоальдегидаИдентификация карбонильных соединений
- 25. IV. Реакции конденсации оксосоединенийАльдольная (а) и кротоновая
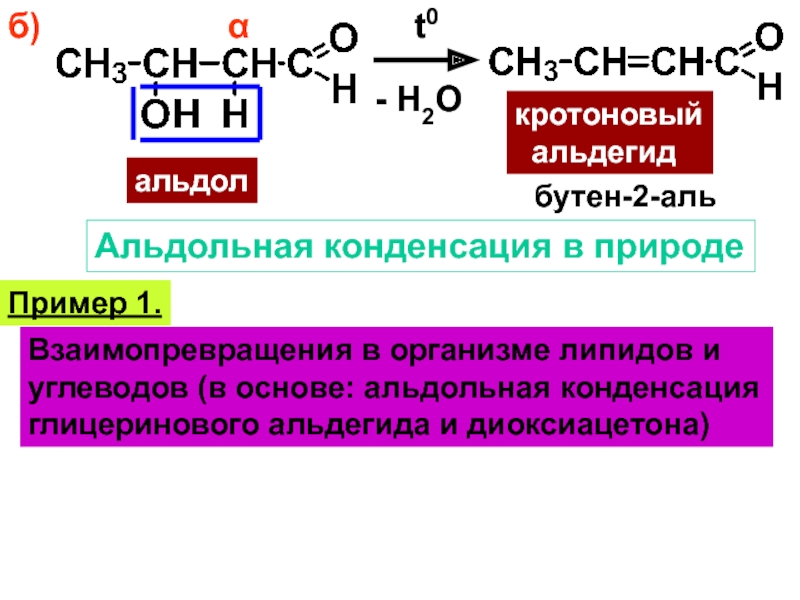
- 26. б)αt0альдол- H2Oкротоновый альдегидбутен-2-альАльдольная конденсация в природеПример 1.Взаимопревращения
- 27. +[O][H]αлипиды глицерино-вый альдегиддиокси-ацетонфруктозауглеводыкарбонильная компонентаметиленовая компонента11- альдольная конденсация22ретроальдолизация(ретроальдольный распад)
- 28. Пример 2.щавелево-уксуснаякислота+αацетилко-фермент АОбразование лимонной кислоты вцикле трикарбоновых кислотН2О- HSKoAлимонная кислота
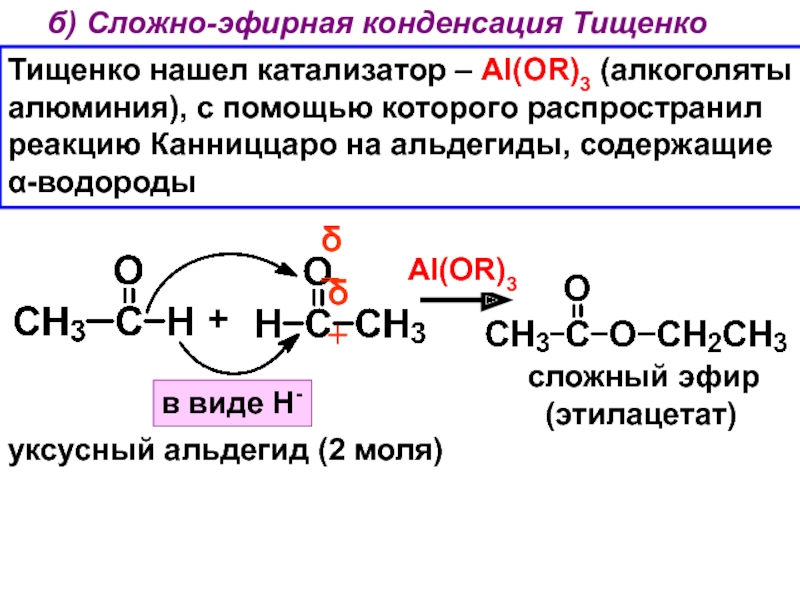
- 29. 2. Реакция Канниццаро (1853 г.) - Тищенко
- 30. б) Сложно-эфирная конденсация Тищенко Тищенко нашел катализатор
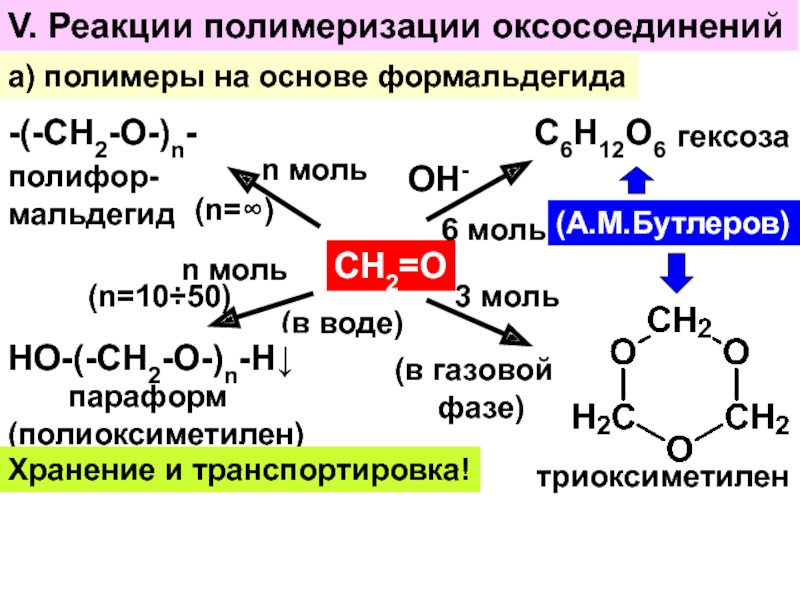
- 31. V. Реакции полимеризации оксосоединенийа) полимеры на основе
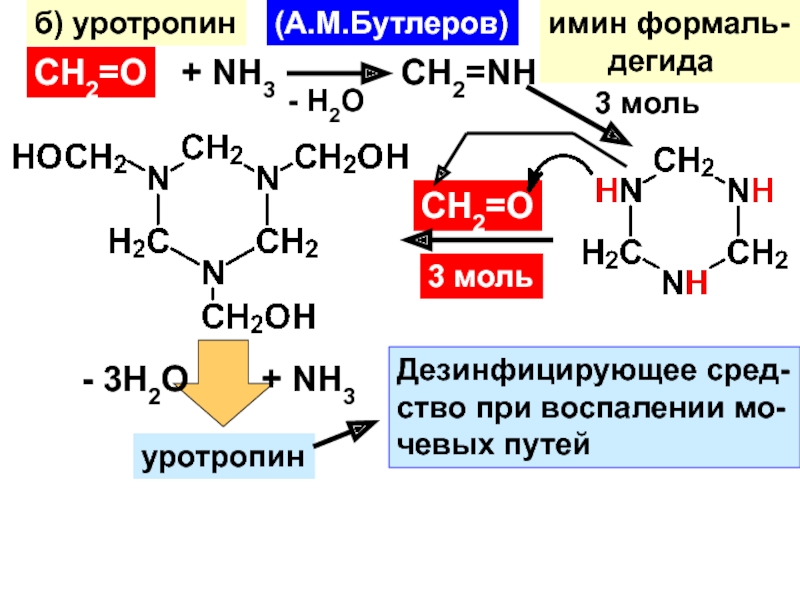
- 32. б) уротропин(А.М.Бутлеров)СН2=О+ NH3- H2OCH2=NHимин формаль-
- 33. уротропин(гексаметилентетрамин)тетраазаадамантанСуммарно:
- 34. в) полимеры на основе ацетальдегидаCH3-СН=О3 моль4 мольпаральдегид(снотворное)Н+ метальдегид(«сухой спирт»)Н+, < 00C
- 35. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Кафедра химии
Тема лекции:
Оксосоединения, получение, свойства, таутомерия. Химические свойства
Слайд 2С=О
ОКСОСОЕДИНЕНИЯ
карбонильная
группа
альдегиды
-аль
кетоны
-он
R, R1, R2 – алкил, арил,
алкенил, гетерил
+ 2Ag↓Слайд 3Номенклатура
РН: диметилкетон,
МН: пропанон;
ацетон
ацетальдегид,
этаналь,
уксусный альдегид
бензальдегид
α-пиридинальдегид
Слайд 5I. Кето-енольная таутомерия
Таутомерия – равновесная динамическая
изомерия (сосуществование изомерных
форм, находящихся в
равновесии и спо-
собных переходить друг в друга)
δ−
δ+
α
кето-форма
енольная форма
ХИМИЧЕСКИЕ СВОЙСТВА
Слайд 72. Ацетилацетон
α
15 %
85 %
4π-сопряжение,
Н-связь, цикл
3. Фенол
≈100 %
6π-сопря-
жение
Сверху
– вниз (от уксусного альдегида к фенолу) –
стабилизация енольной формы
Слайд 8Влияние карбонильной группы на радикал
1. R = Alk
α
Cl2
- HCl
2. R
= алкенил
δ−
δ+
δ−
δ+
+ HCl
δ+
δ-
Присоединение против правила Марковникова!
Слайд 10II. Реакции нуклеофильного присоединения
δ−
δ+
+ Н-Х
δ+
δ−
быстро
медленно
нуклеофил
Легкость нуклеофильной атаки:
СCl3-CH=O
> H2C=O > R-CH=O > R-C=O
R1
уменьшение δ+ на карбонильном углероде
увеличение
стерических препятствийСлайд 111. Гидрирование (присоединение гидридов Me)
CH3CH=O
альдегид
[Н]
СН3СН2ОН
первичный спирт
кетон
[Н]
LiAlH4
LiAlH4
вторичный
спирт
2. Гидратация
+ Н-ОН
неустойчиво
Но!
Слайд 12+ Н-ОН
Хлоральгидрат (снотворное)
устойчив!
3. Присоединение HCN
+ Н-CN
α-оксинитрил
(циангидрин)
(удлинение цепи!)
Оксинитрилы оптически активны, если R1 =
R2 *
Слайд 13Пример:
C6H5-CH=O + H-CN
*
оксинитрил бензальдегида
(в косточках горького миндаля)
C6H5
C6H5
CN
CN
OH
HO
*
*
D-изомер
L-изомер
фермент
C6H5-CH=O +
+ H-CN !
отравление !
Слайд 144. Присоединение NaHSO3
(используется для качественной и количествен-
ной идентификации оксосоединений,
для их
очистки и выделения из смесей)
+
бисульфитное
производное
Слайд 155. Присоединение спиртов – образование
полуацеталей и ацеталей
+ H-O-R
ROH,
H+
- H2O
полуацеталь
aцеталь (R1=H)
[кеталь (R1,R2=H)]
полуацетальный
гидроксил
Внутримоле-
кулярная
реакция:
4-гидрокси-
бутаналь
*
кольчатый
полуацеталь
Слайд 16Кольчато-цепная таутомерия
HO-(CH2)3-CH=O
4-гидрокси-
бутаналь
D
D
β-форма
α-форма
HO-(CH2)4-CH=O
5-гидрокси-
пентаналь
D
D
β-форма
α-форма
Слайд 17Значение реакции «ацетализации»
1. Используется для «защиты» реакционноспособ-
ной
альдегидной группы на время протекания
реакций с другими
фрагментами молекулHOCH2-CH=О
Пример:
2С2Н5ОН
- H2О
ацеталь
[О]
HOOC-CH=О
- 2С2Н5ОН
H2О, H+
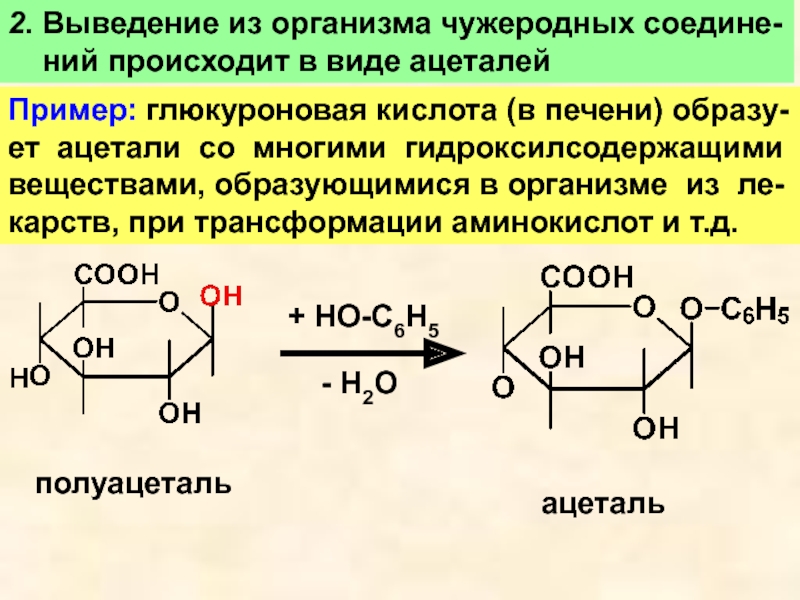
Слайд 182. Выведение из организма чужеродных соедине-
ний происходит в
виде ацеталей
Пример: глюкуроновая кислота (в печени) образу-
ет ацетали со многими
гидроксилсодержащими веществами, образующимися в организме из ле-
карств, при трансформации аминокислот и т.д.
полуацеталь
+ HO-C6H5
- H2О
ацеталь
Слайд 196. Присоединение меркаптанов
+ H-S-R
полумеркапталь
RSH, H+
- H2O
полный
меркапталь
сульфонал
(снотворное)
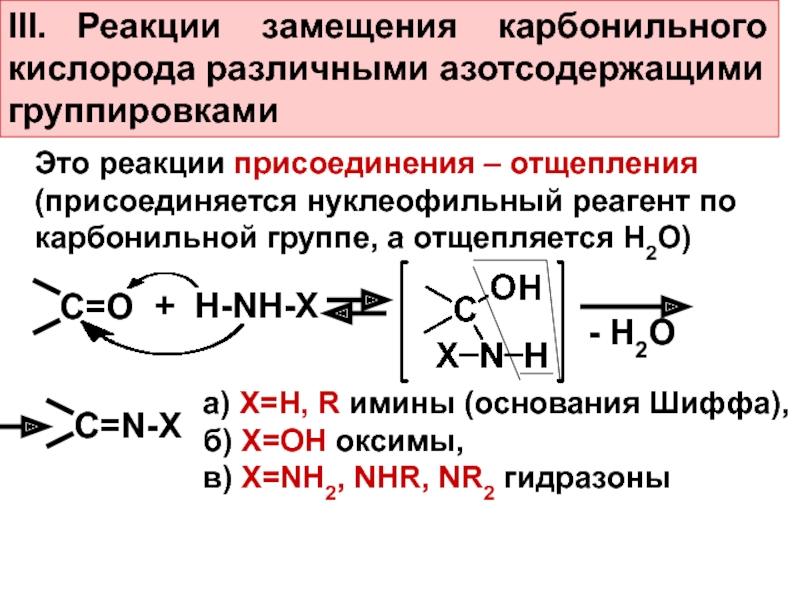
Слайд 20III. Реакции замещения карбонильного
кислорода различными азотсодержащими
группировками
Это реакции
присоединения – отщепления
(присоединяется нуклеофильный реагент по
карбонильной группе, а
отщепляется Н2О)С=О
+ H-NH-X
- H2O
C=N-X
а) Х=Н, R имины (основания Шиффа),
б) Х=ОН оксимы,
в) Х=NH2, NHR, NR2 гидразоны
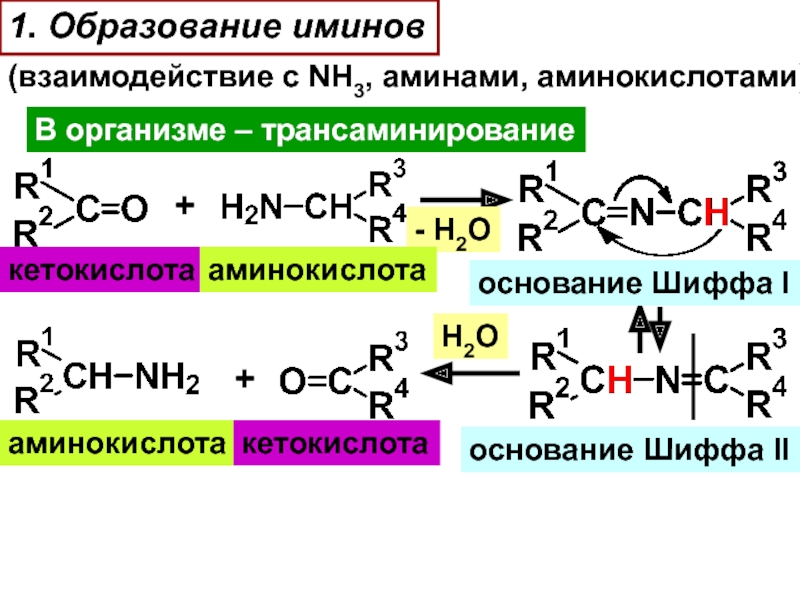
Слайд 211. Образование иминов
(взаимодействие с NH3, аминами, аминокислотами)
В организме – трансаминирование
+
-
H2O
кетокислота
аминокислота
oснование Шиффа I
oснование Шиффа II
H2O
+
аминокислота
кетокислота
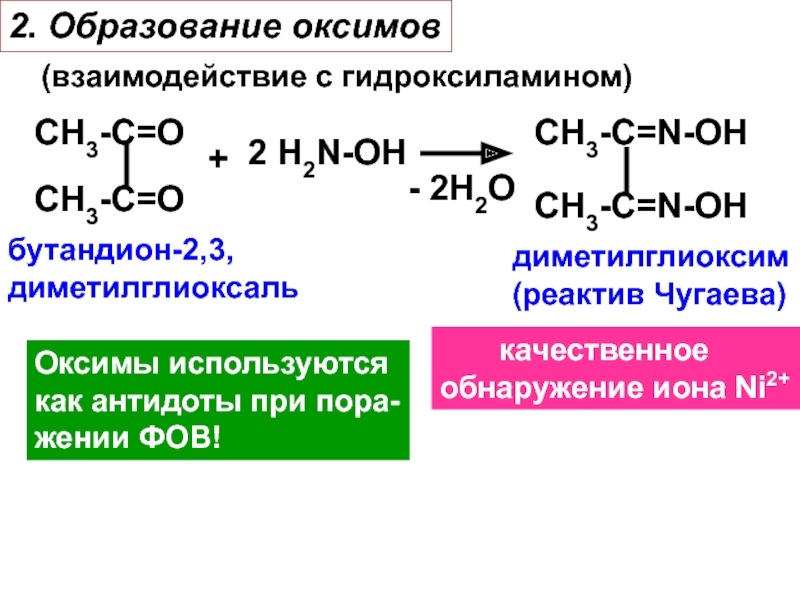
Слайд 222. Образование оксимов
(взаимодействие с гидроксиламином)
СH3-C=O
СH3-C=O
+
2 H2N-OH
- 2H2O
СH3-C=N-OH
СH3-C=N-OH
бутандион-2,3,
диметилглиоксаль
диметилглиоксим
(реактив Чугаева)
качественное
oбнаружение иона Ni2+
Оксимы используются
как антидоты при пора-
жении ФОВ!
Слайд 233. Образование гидразонов
(взаимодействие с гидразинами)
а)
Пиридоксальфосфат (участвует в превращении
глутаминовой кислоты
в γ-аминомасляную, тормо-
зящую проведение нервного импульса, поэтому по-
падание H2NNH2 и
его простейших производных в организм приводит к нервным расстройствам)
H2NNH2
- H2O
Слайд 25IV. Реакции конденсации оксосоединений
Альдольная (а) и кротоновая (б) конден-
сации
[образование новых С-С связей]
А.П. Бородин и А. Вюрц
а)
δ−
δ+
+
α
ОН−
на холоде
карбонильная
компонента
метиленовая
компонентаальдол
3-гидроксибутаналь
Оксосоединения, не содержащие α-водородов,
не вступают в реакцию альдольной конденсации!
Слайд 26б)
α
t0
альдол
- H2O
кротоновый
альдегид
бутен-2-аль
Альдольная конденсация в природе
Пример 1.
Взаимопревращения в организме липидов
и
углеводов (в основе: альдольная конденсация
глицеринового альдегида и диоксиацетона)
Слайд 27+
[O]
[H]
α
липиды
глицерино-
вый альдегид
диокси-
ацетон
фруктоза
углеводы
карбонильная
компонента
метиленовая
компонента
1
1
- альдольная конденсация
2
2
ретроальдолизация
(ретроальдольный распад)
Слайд 28Пример 2.
щавелево-
уксусная
кислота
+
α
ацетилко-
фермент А
Образование лимонной кислоты в
цикле трикарбоновых кислот
Н2О
- HSKoA
лимонная
кислота
Слайд 292. Реакция Канниццаро (1853 г.) - Тищенко
(1906
г.) [реакция диспропорционирования]
R-CH=O
R-CH2ОН
альдегид
спирт
R-CООН
карбоновая
кислота
[O]
[O]
[Н]
[Н]
а) Реакция Канниццаро
(вступают альдегиды,+
КОН
+
не содержащие α-водородов)
бензальдегид (2 моля)
бензоат
калия
ох
red
бензиловый
спирт
Слайд 30б) Сложно-эфирная конденсация Тищенко
Тищенко нашел катализатор – Al(OR)3 (алкоголяты
алюминия),
с помощью которого распространил
реакцию Канниццаро на альдегиды, содержащие
α-водороды
+
уксусный альдегид (2
моля)в виде Н-
δ+
δ−
Al(OR)3
сложный эфир
(этилацетат)
Слайд 31V. Реакции полимеризации оксосоединений
а) полимеры на основе формальдегида
СН2=О
ОН-
6 моль
С6Н12О6
гексоза
(А.М.Бутлеров)
3 моль
(в
газовой
фазе)
триоксиметилен
n моль
(в воде)
(n=10÷50)
НО-(-СН2-О-)n-Н↓
параформ
(полиоксиметилен)
-(-СН2-О-)n-
n
моль(n=∞)
полифор-
мальдегид
Хранение и транспортировка!




![Оксосоединения, получение, свойства, таутомерия 1. Гидрирование (присоединение гидридов Me)CH3CH=O альдегид[Н] СН3СН2ОН первичный спирткетон[Н]LiAlH4LiAlH4вторичный спирт2. Гидратация+ Н-ОНнеустойчивоНо! 1. Гидрирование (присоединение гидридов Me)CH3CH=O альдегид[Н] СН3СН2ОН первичный спирткетон[Н]LiAlH4LiAlH4вторичный спирт2. Гидратация+ Н-ОНнеустойчивоНо!](/img/thumbs/9b6b8093d2bd48ca9ad4ef3b75e1ad42-800x.jpg)


![Оксосоединения, получение, свойства, таутомерия 5. Присоединение спиртов – образование полуацеталей и ацеталей+ H-O-RROH, H+- H2Oполуацетальaцеталь (R1=H)[кеталь (R1,R2=H)]полуацетальный гидроксилВнутримоле-кулярнаяреакция:4-гидрокси-бутаналь*кольчатыйполуацеталь 5. Присоединение спиртов – образование полуацеталей и ацеталей+ H-O-RROH, H+- H2Oполуацетальaцеталь (R1=H)[кеталь (R1,R2=H)]полуацетальный гидроксилВнутримоле-кулярнаяреакция:4-гидрокси-бутаналь*кольчатыйполуацеталь](/img/thumbs/edabd3f2028277452680fd3078bcfac4-800x.jpg)



![Оксосоединения, получение, свойства, таутомерия IV. Реакции конденсации оксосоединенийАльдольная (а) и кротоновая (б) конден- сации [образование IV. Реакции конденсации оксосоединенийАльдольная (а) и кротоновая (б) конден- сации [образование новых С-С связей]А.П. Бородин и А.](/img/thumbs/c0d160cd16da8c13f791c293a9a1dda0-800x.jpg)
![Оксосоединения, получение, свойства, таутомерия +[O][H]αлипиды глицерино-вый альдегиддиокси-ацетонфруктозауглеводыкарбонильная компонентаметиленовая компонента11- альдольная конденсация22ретроальдолизация(ретроальдольный распад) +[O][H]αлипиды глицерино-вый альдегиддиокси-ацетонфруктозауглеводыкарбонильная компонентаметиленовая компонента11- альдольная конденсация22ретроальдолизация(ретроальдольный распад)](/img/thumbs/e83c718c4f3e22eca869745bfae3fe89-800x.jpg)

![Оксосоединения, получение, свойства, таутомерия 2. Реакция Канниццаро (1853 г.) - Тищенко (1906 г.) [реакция 2. Реакция Канниццаро (1853 г.) - Тищенко (1906 г.) [реакция диспропорционирования]R-CH=OR-CH2ОНальдегидспиртR-CООНкарбоновая кислота[O][O][Н][Н]а) Реакция Канниццаро](/img/thumbs/c731b590653c6cb671b93458452a0c23-800x.jpg)