Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ОРГАНИЧЕСКАЯ ХИМИЯ Реакционная способность аренов. Классификация. Изомерия
Содержание
- 1. ОРГАНИЧЕСКАЯ ХИМИЯ Реакционная способность аренов. Классификация. Изомерия
- 2. Классификация. Изомерия. Номенклатура 1. Арены. Классификация Арены –
- 3. Классификация. Изомерия. НоменклатураПо числу бензольных колец в
- 4. Классификация. Изомерия. Номенклатура
- 5. Классификация. Изомерия. НоменклатураОтдельную группу составляют небензоидные ароматические
- 6. Классификация. Изомерия. Номенклатура Номенклатура и изомерия аренов Первым
- 7. Классификация. Изомерия. НоменклатураПоложения заместителей указывают наименьшими цифрами
- 8. Классификация. Изомерия. НоменклатураИз более чем 30 родоначальных
- 9. Классификация. Изомерия. НоменклатураИзомерия монозамещенных аренов обусловлена строением
- 10. Физические свойства2. Физические свойства моноциклических аренов. Отдельные
- 11. Физические свойстваБензол С6Н6 — бесцветная жидкость с
- 12. Физические свойстваТолуол С6Н5СН3 — бесцветная жидкость, нерастворимая
- 13. Физические свойстваКумол С6Н5СН(СН3)2 — важный промежуточный продукт
- 14. Физические свойстваКсилолы (диметилбензолы) получают из продуктов сухой
- 15. Способы получения3. Способы получения аренов Известны
- 16. Способы получения2) Каталитическое дегидрирование циклогексана и его
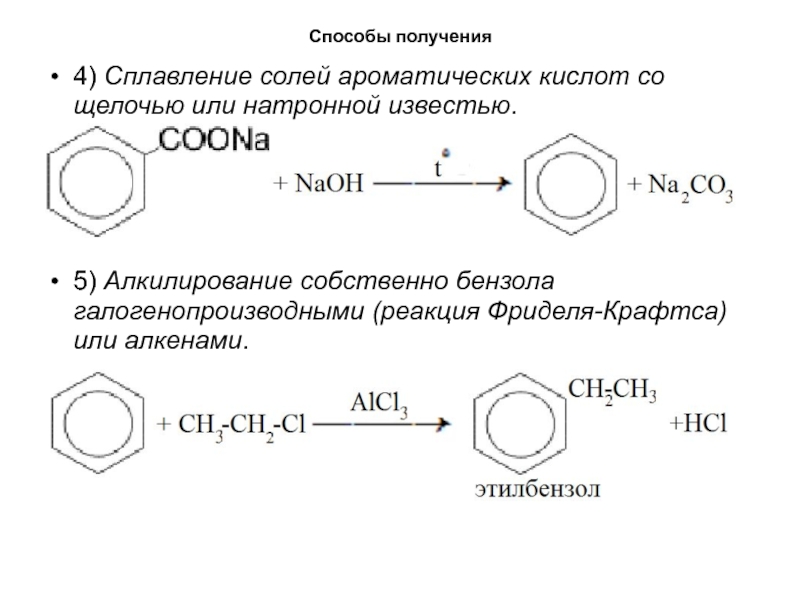
- 17. Способы получения4) Сплавление солей ароматических кислот со
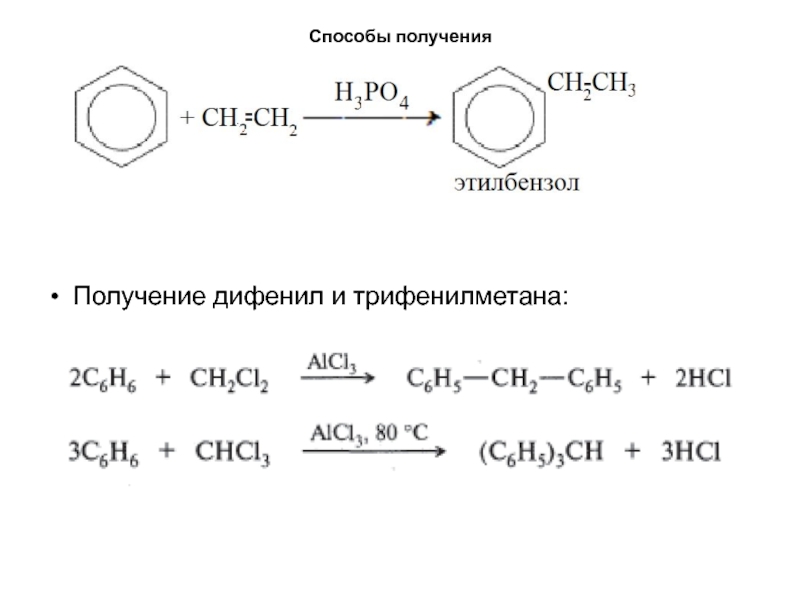
- 18. Способы полученияПолучение дифенил и трифенилметана:
- 19. Химические свойства. Реакции электрофильного замещения4. Ароматические
- 20. Химические свойства. Реакции электрофильного замещения
- 21. Химические свойства. Реакции электрофильного замещенияМеханизм реакции электрофильного замещения в ряду бензола:
- 22. Химические свойства. Реакции электрофильного замещенияПервичной стадией является
- 23. Химические свойства. Реакции электрофильного замещенияИными словами, π
- 24. Химические свойства. Реакции электрофильного замещенияσ - комплекс
- 25. Химические свойства. Реакции электрофильного замещенияНа заключительной стадии
- 26. Правила ориентации в бензольном ядре5. Правила ориентации
- 27. Правила ориентации в бензольном ядреЗаместители первого рода
- 28. Правила ориентации в бензольном ядре
- 29. Правила ориентации в бензольном ядреВ отсутствии катализаторов
- 30. Правила ориентации в бензольном ядреЗаместители второго рода
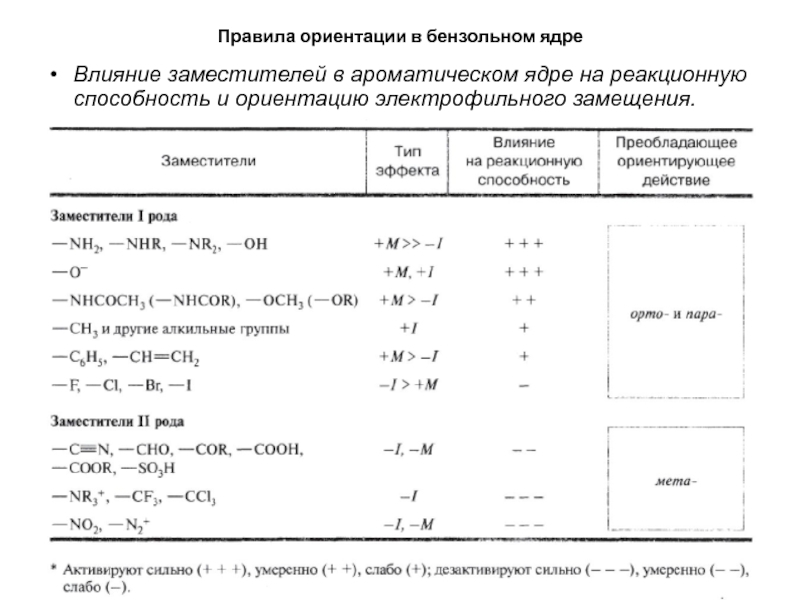
- 31. Правила ориентации в бензольном ядреВлияние заместителей в
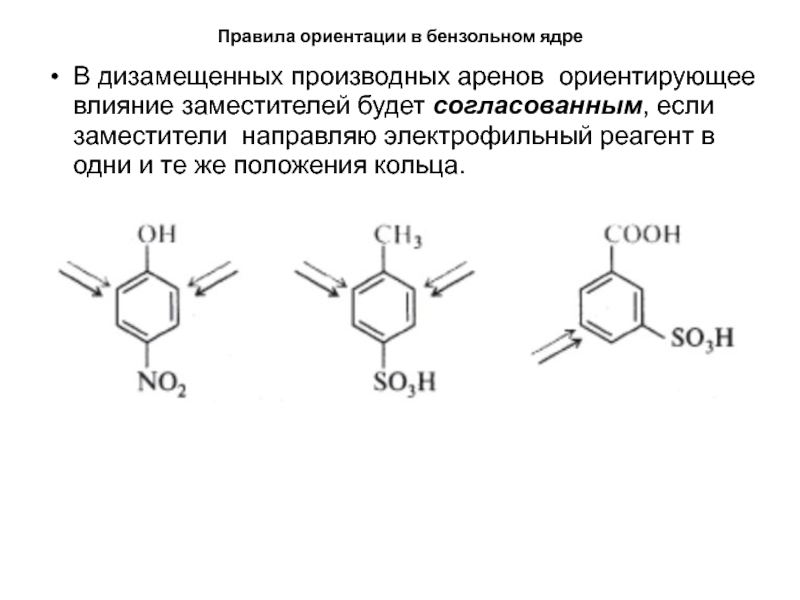
- 32. Правила ориентации в бензольном ядреВ дизамещенных производных
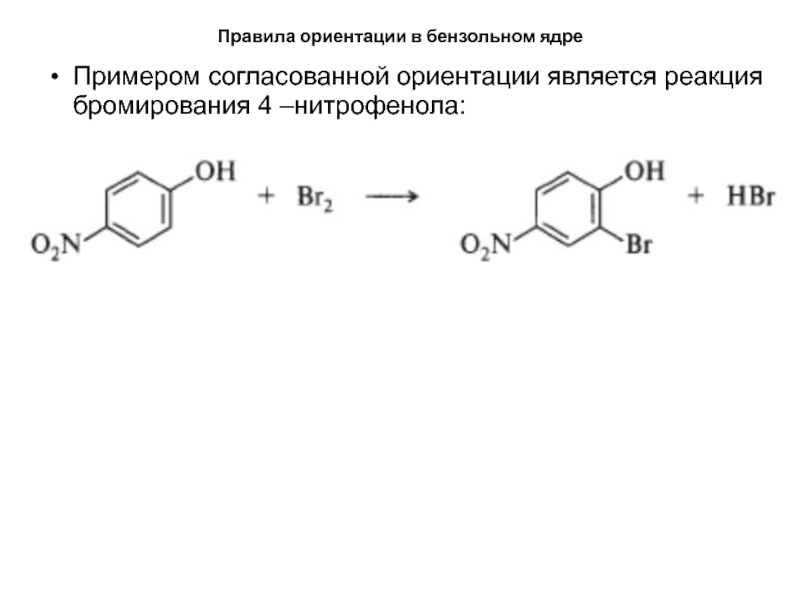
- 33. Правила ориентации в бензольном ядреПримером согласованной ориентации является реакция бромирования 4 –нитрофенола:
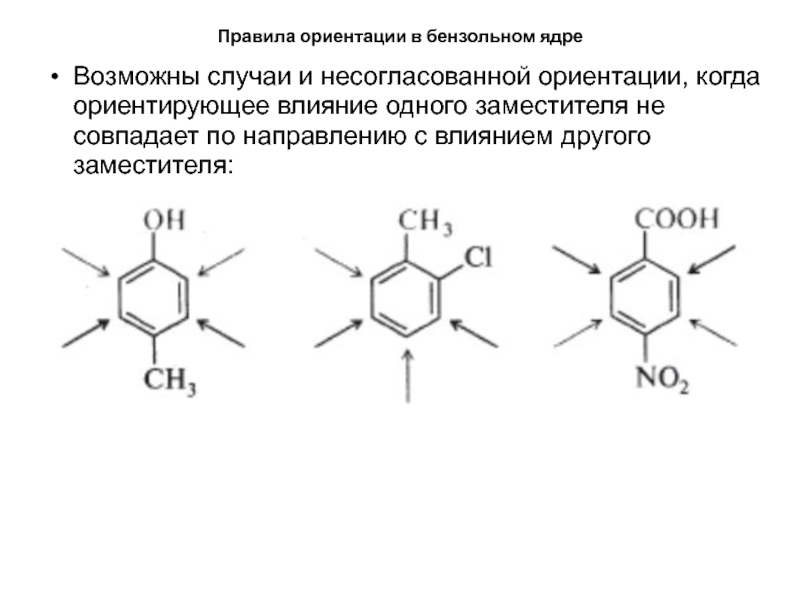
- 34. Правила ориентации в бензольном ядреВозможны случаи и
- 35. Правила ориентации в бензольном ядреПри несогласованной ориентации
- 36. Реакции присоединения. Реакции окисления6. Реакции протекающие
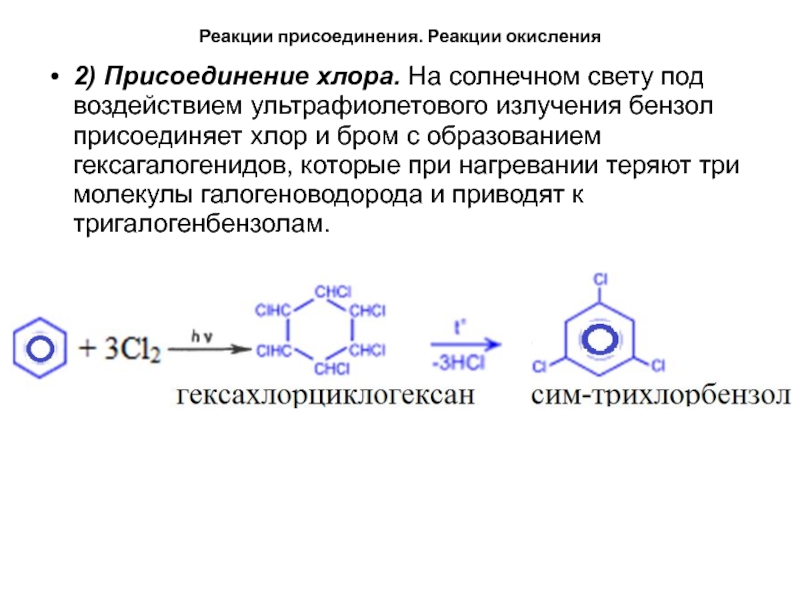
- 37. Реакции присоединения. Реакции окисления2) Присоединение хлора. На
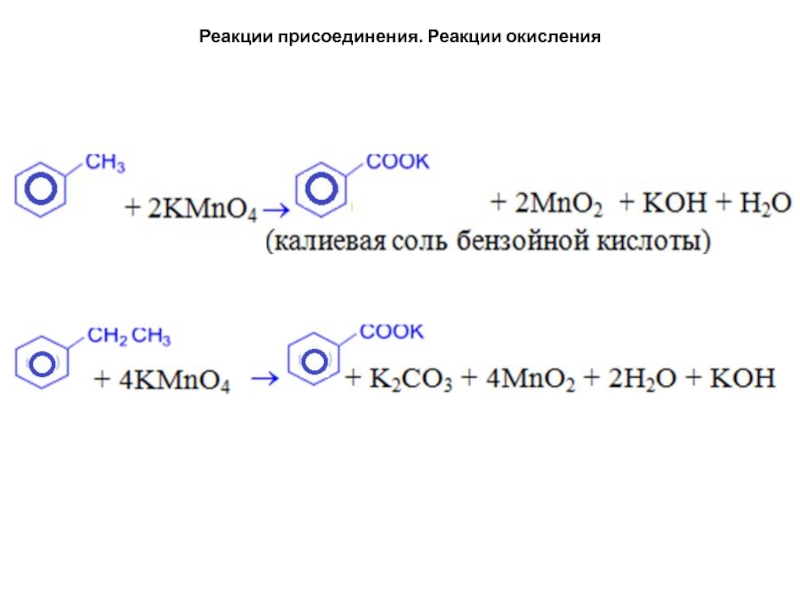
- 38. Реакции присоединения. Реакции окисленияРеакции боковых цепей в
- 39. Реакции присоединения. Реакции окисления
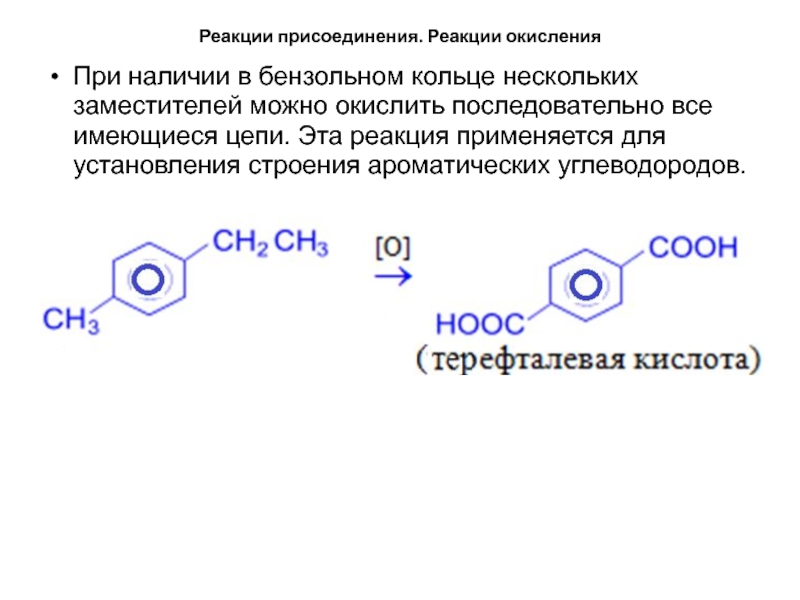
- 40. Реакции присоединения. Реакции окисленияПри наличии в бензольном
- 41. Реакционная способность многоядерных аренов7. Реакционная способность многоядерных
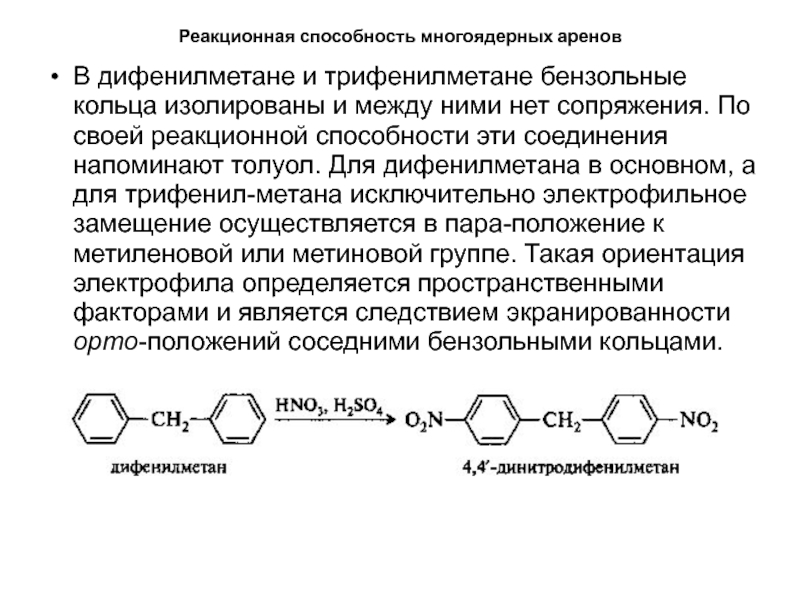
- 42. Реакционная способность многоядерных ареновВ дифенилметане и трифенилметане
- 43. Реакционная способность многоядерных ареновМетиленовая группа в дифенилметане
- 44. Реакционная способность многоядерных ареновТрифенилметан обладает значительной реакционной
- 45. Реакционная способность многоядерных ареновII. Важнейшие реакции конденсированных
- 46. Реакционная способность многоядерных аренов
- 47. Реакционная способность многоядерных ареновРеакции присоединения. Примером является
- 48. Реакционная способность многоядерных ареновОкисление. Нафталин окисляется легче,
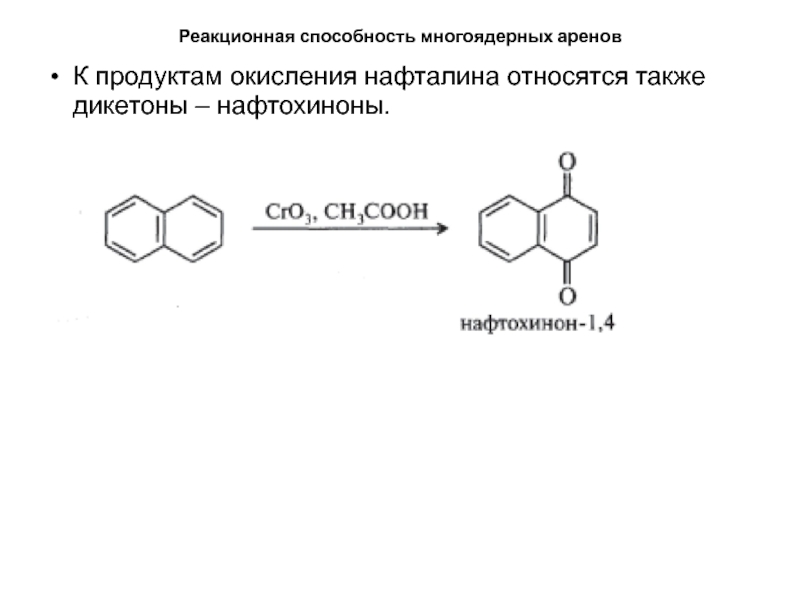
- 49. Реакционная способность многоядерных ареновК продуктам окисления нафталина относятся также дикетоны – нафтохиноны.
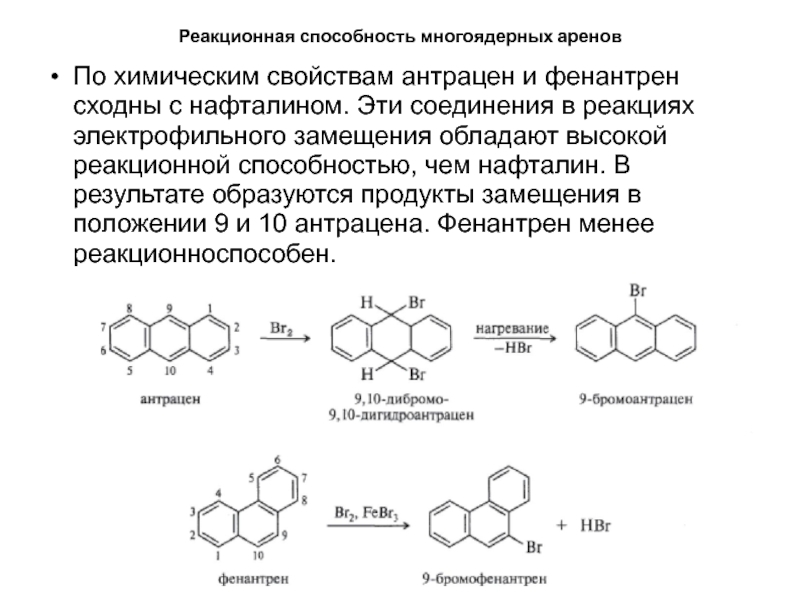
- 50. Реакционная способность многоядерных ареновПо химическим свойствам антрацен
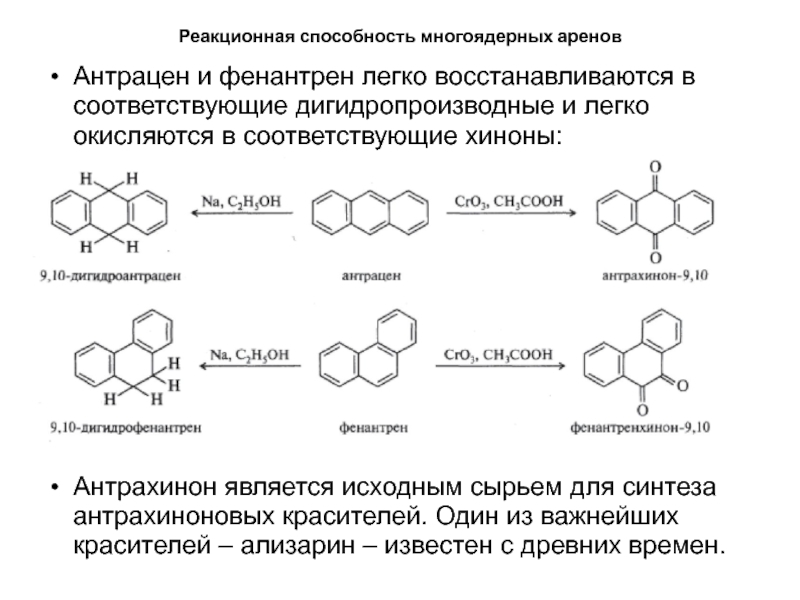
- 51. Реакционная способность многоядерных ареновАнтрацен и фенантрен легко
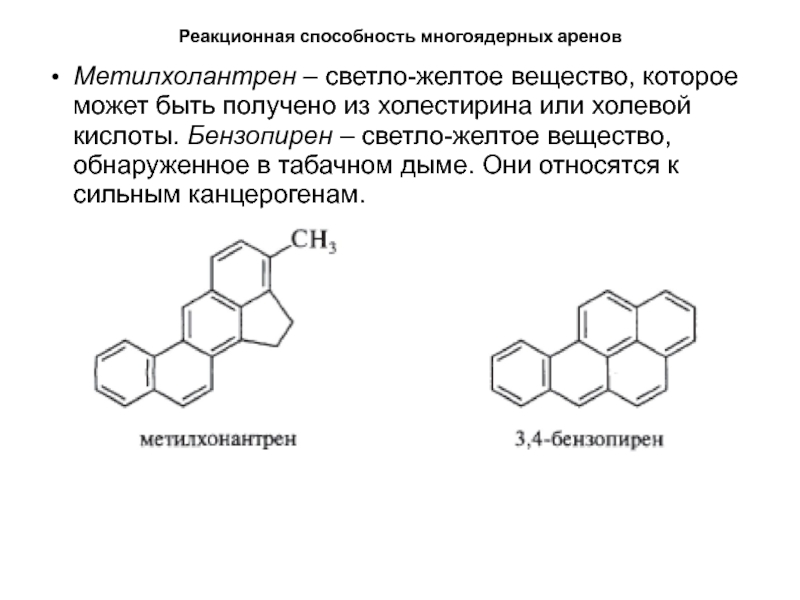
- 52. Реакционная способность многоядерных ареновМетилхолантрен – светло-желтое вещество,
- 53. Спасибо за внимание!
- 54. Скачать презентанцию
Классификация. Изомерия. Номенклатура 1. Арены. Классификация Арены – это карбоциклические углеводороды, в молекулах которых имеется особая циклическая группировка из шести атомов углерода, называемая бензольным или ароматическим ядром
Слайды и текст этой презентации
Слайд 1ОРГАНИЧЕСКАЯ ХИМИЯ
Реакционная способность аренов.
Классификация. Изомерия. Номенклатура.
Физические свойства.
Способы получения.
Химические свойства. Реакции
SE
ареновСлайд 2Классификация. Изомерия. Номенклатура
1. Арены. Классификация
Арены – это карбоциклические углеводороды,
в молекулах которых имеется особая циклическая группировка из шести атомов
углерода, называемая бензольным или ароматическим ядромСлайд 3Классификация. Изомерия. Номенклатура
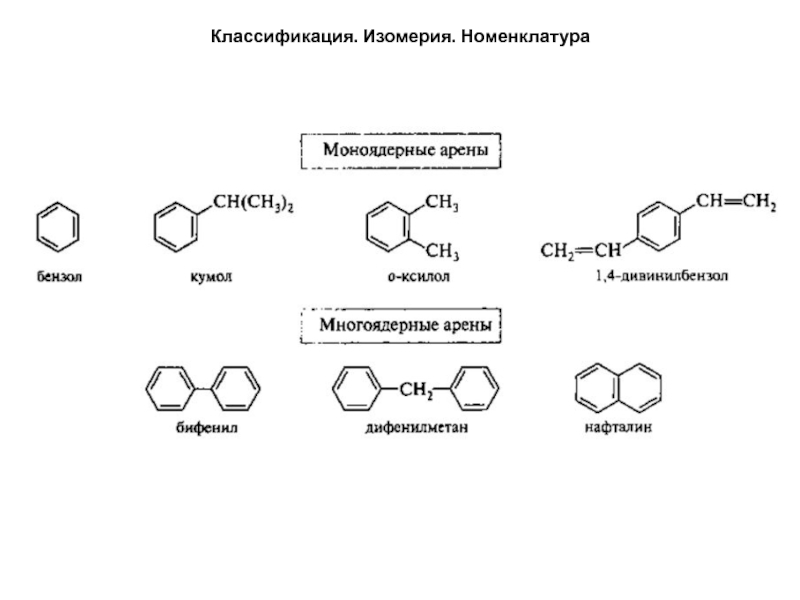
По числу бензольных колец в молекуле арены подразделяются
на моноядерные и многоядерные. К моноядерным относятся соединения с одним
бензольным кольцом в молекуле. У многоядерных аренов бензольные кольца могут быть конденсированными (как, например, в нафталине) или изолированными. Изолированные кольца могут быть непосредственно связаны друг с другом (бифенил) или разделены атомами углерода (дифенилметан):Слайд 5Классификация. Изомерия. Номенклатура
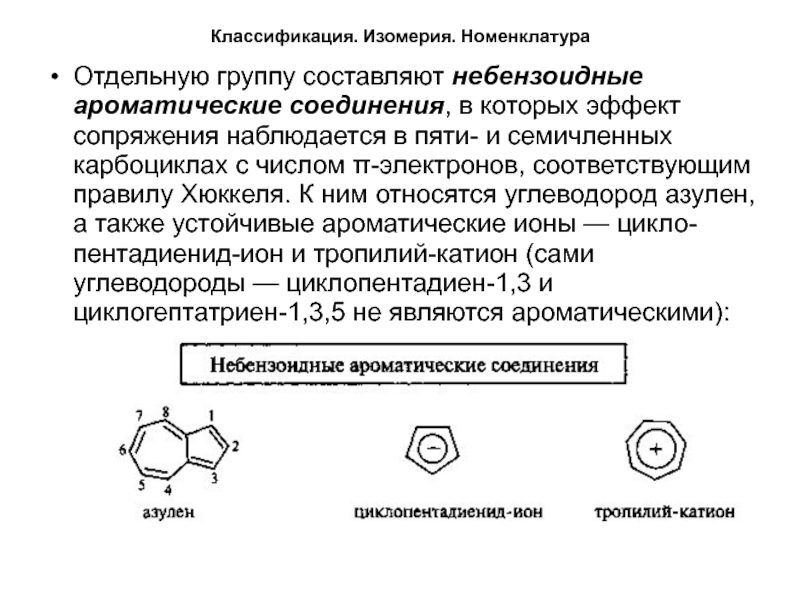
Отдельную группу составляют небензоидные ароматические соединения, в которых
эффект сопряжения наблюдается в пяти- и семичленных карбоциклах с числом
π-электронов, соответствующим правилу Хюккеля. К ним относятся углеводород азулен, а также устойчивые ароматические ионы — цикло-пентадиенид-ион и тропилий-катион (сами углеводороды — циклопентадиен-1,3 и циклогептатриен-1,3,5 не являются ароматическими):Слайд 6Классификация. Изомерия. Номенклатура
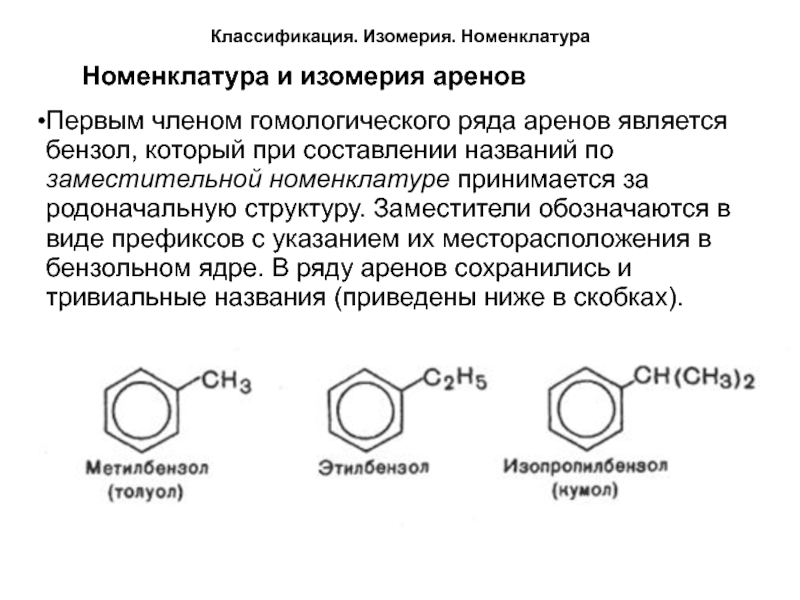
Номенклатура и изомерия аренов
Первым членом гомологического ряда
аренов является бензол, который при составлении названий по заместительной номенклатуре
принимается за родоначальную структуру. Заместители обозначаются в виде префиксов с указанием их месторасположения в бензольном ядре. В ряду аренов сохранились и тривиальные названия (приведены ниже в скобках).Слайд 7Классификация. Изомерия. Номенклатура
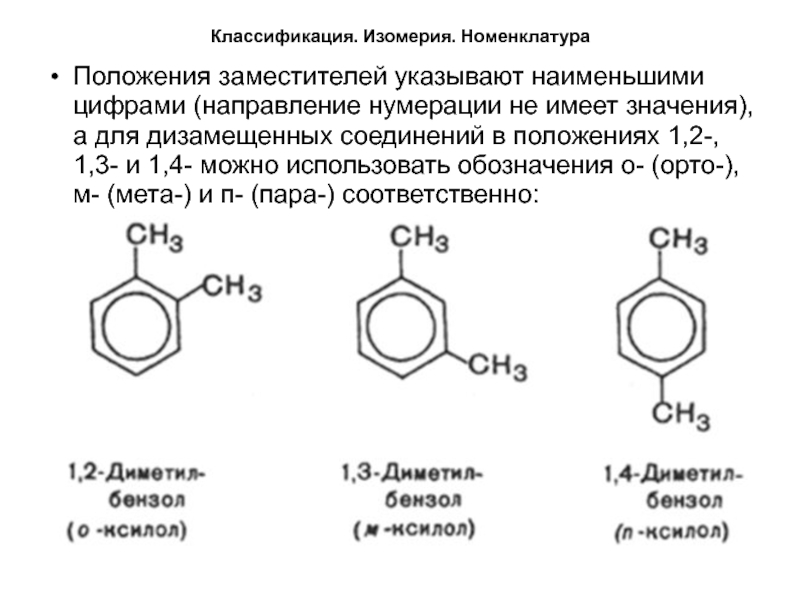
Положения заместителей указывают наименьшими цифрами (направление нумерации не
имеет значения), а для дизамещенных соединений в положениях 1,2-, 1,3-
и 1,4- можно использовать обозначения о- (орто-), м- (мета-) и п- (пара-) соответственно:Слайд 8Классификация. Изомерия. Номенклатура
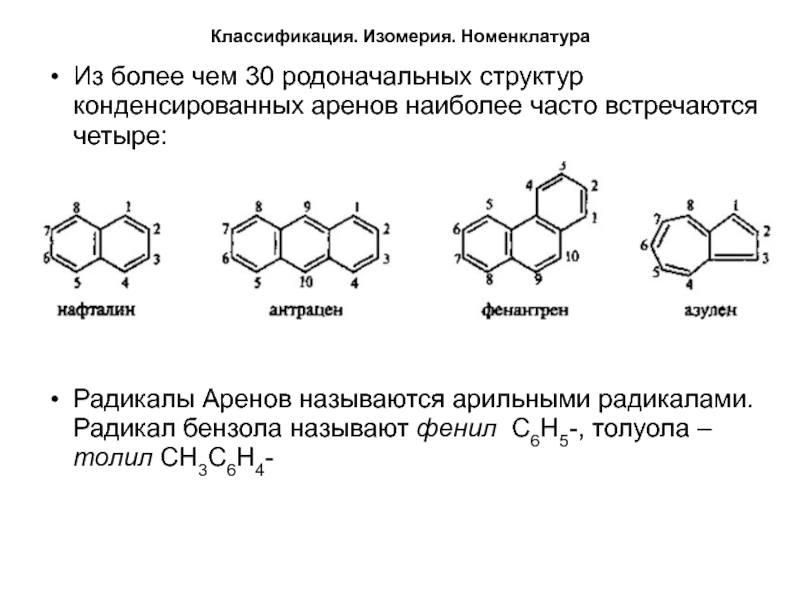
Из более чем 30 родоначальных структур конденсированных аренов
наиболее часто встречаются четыре:
Радикалы Аренов называются арильными радикалами. Радикал бензола
называют фенил С6Н5-, толуола – толил СН3С6Н4-Слайд 9Классификация. Изомерия. Номенклатура
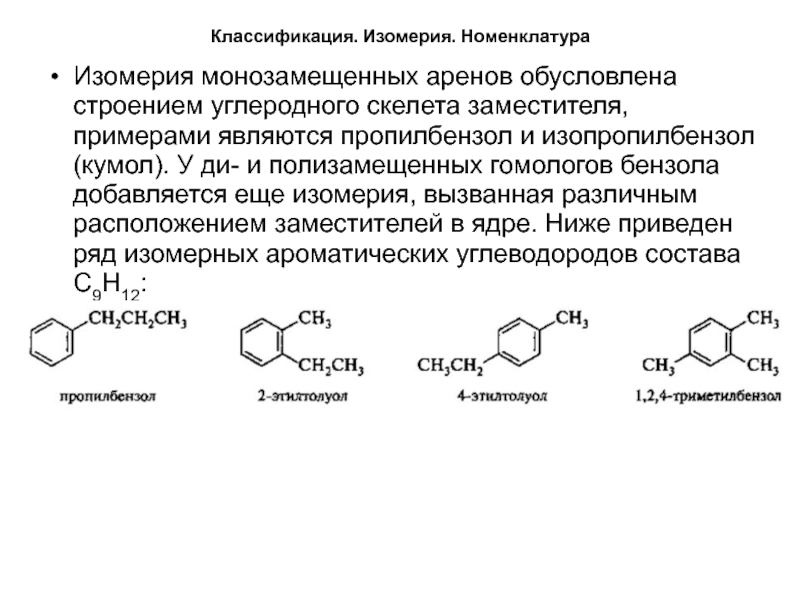
Изомерия монозамещенных аренов обусловлена строением углеродного скелета заместителя,
примерами являются пропилбензол и изопропилбензол (кумол). У ди- и полизамещенных
гомологов бензола добавляется еще изомерия, вызванная различным расположением заместителей в ядре. Ниже приведен ряд изомерных ароматических углеводородов состава С9Н12:Слайд 10Физические свойства
2. Физические свойства моноциклических аренов. Отдельные представители и их
применение
Бензол и его ближайшие гомологи – бесцветные жидкости со специфическим
запахом. Ароматические углеводороды легче воды и в ней не растворяются, однако легко растворяются в органических растворителях – спирте, эфире, ацетоне. Такие константы, как плотность и показатель преломления, у аренов выше, чем у алканов и алкенов. Температуры кипения Аренов закономерно возрастают с увеличением молярной массы. Температуры плавления в значительной степени зависят от симметричности строения арена. Симметричные арены компактнее упакованы в кристаллической решетке и имеют более высокие температуры плавления.Слайд 11Физические свойства
Бензол С6Н6 — бесцветная жидкость с характерным запахом, легче
воды. Бензол широко используется в промышленной органической химии в качестве
растворителя и сырья для синтеза красителей, полимеров, взрывчатых веществ, поверхностно-активных веществ, лекарственных препаратов. Бензол растворяет жиры, полимеры, нефтепродукты, масла, лаки. Бензол токсичен, вдыхание его паров вызывает острое отравление, приступы головокружения, судороги. При хроническом отравлении бензол поражает почки, печень, костный мозг, приводит к уменьшению в крови эритроцитов.Слайд 12Физические свойства
Толуол С6Н5СН3 — бесцветная жидкость, нерастворимая в воде. Применяется
в производстве взрывчатых веществ (тринитротолуол), красителей, лекарственных веществ, бензойной кислоты,
сахарина, лаков, типографских красок. Толуол употребляется в качестве добавки к моторному топливу как компонент высокооктановых бензинов. Толуол примерно на два порядка менее токсичен, чем бензол, вследствие того что окисляется в организме в бензойную кислоту и экскретируется из организма. Во всех случаях, где это возможно, следует производить замену бензола на толуол.Слайд 13Физические свойства
Кумол С6Н5СН(СН3)2 — важный промежуточный продукт в процессе получения
фенола и ацетона из бензола кумольным способом.
Стирол С6Н5СН=СН2 — жидкость
с приятным запахом. Стирол легко по-лимеризуется с образованием полистирола, применяющегося в качестве электроизоляционного материала. При сополимеризации с бутадиеном получают некоторые виды синтетических каучуков. Полистирольные полимеры, в бензольные кольца которых введены различные функциональные группы (—SO3H, —N(CH3)3+), используются в качестве ионообменных смол.Слайд 14Физические свойства
Ксилолы (диметилбензолы) получают из продуктов сухой перегонки каменного угля
в виде смеси орто-, мета- и пара-ксилолов. Смесь ксилолов используют
в качестве компонента высокооктановых бензинов и растворителей в лакокрасочной промышленности. Для многих целей смесь ксилолов разделяют и используют отдельные изомеры. Так, пара-ксилол окислением превращают в терефталевую кислоту, применяемую для получения полиэфиров.Слайд 15Способы получения
3. Способы получения аренов
Известны следующие способы получения
ароматических углеводородов.
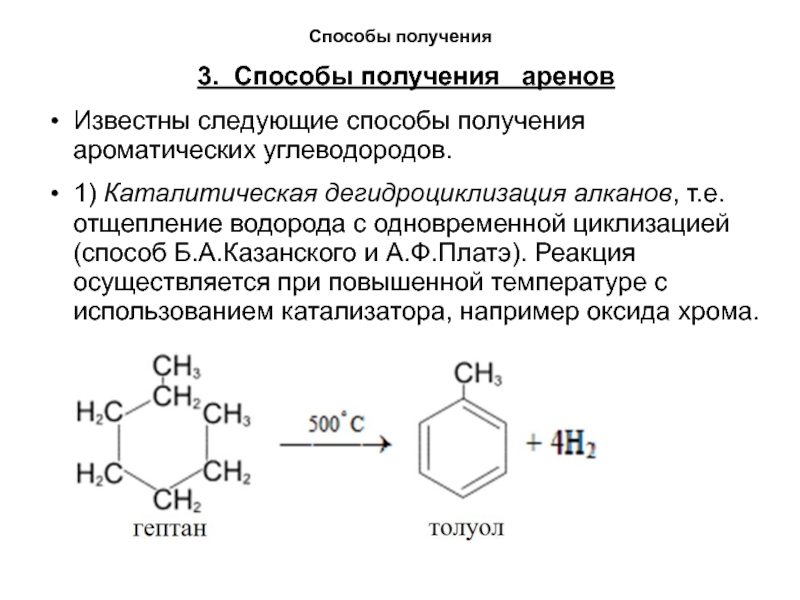
1) Каталитическая дегидроциклизация алканов, т.е. отщепление водорода с одновременной
циклизацией (способ Б.А.Казанского и А.Ф.Платэ). Реакция осуществляется при повышенной температуре с использованием катализатора, например оксида хрома.Слайд 16Способы получения
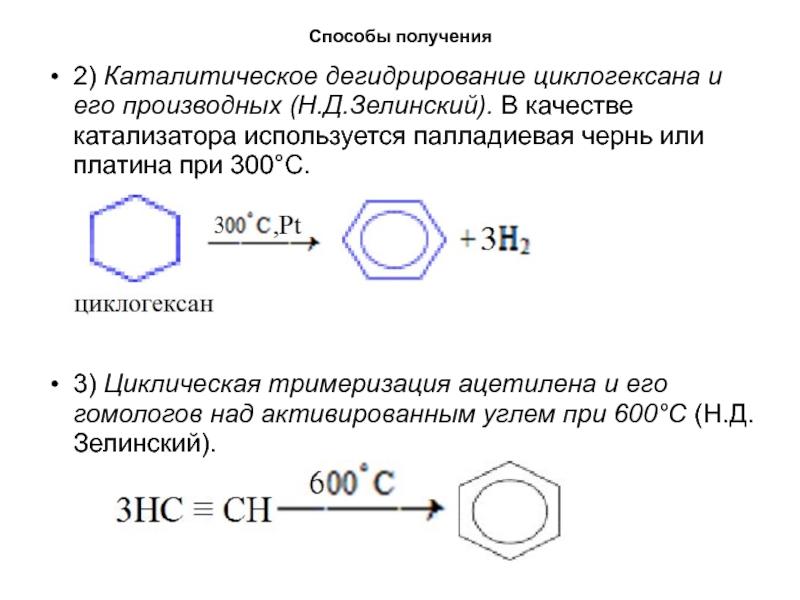
2) Каталитическое дегидрирование циклогексана и его производных (Н.Д.Зелинский). В
качестве катализатора используется палладиевая чернь или платина при 300°C.
3) Циклическая
тримеризация ацетилена и его гомологов над активированным углем при 600°C (Н.Д.Зелинский).Слайд 17Способы получения
4) Сплавление солей ароматических кислот со щелочью или натронной
известью.
5) Алкилирование собственно бензола галогенопроизводными (реакция Фриделя-Крафтса) или алкенами.
Слайд 19Химические свойства. Реакции электрофильного замещения
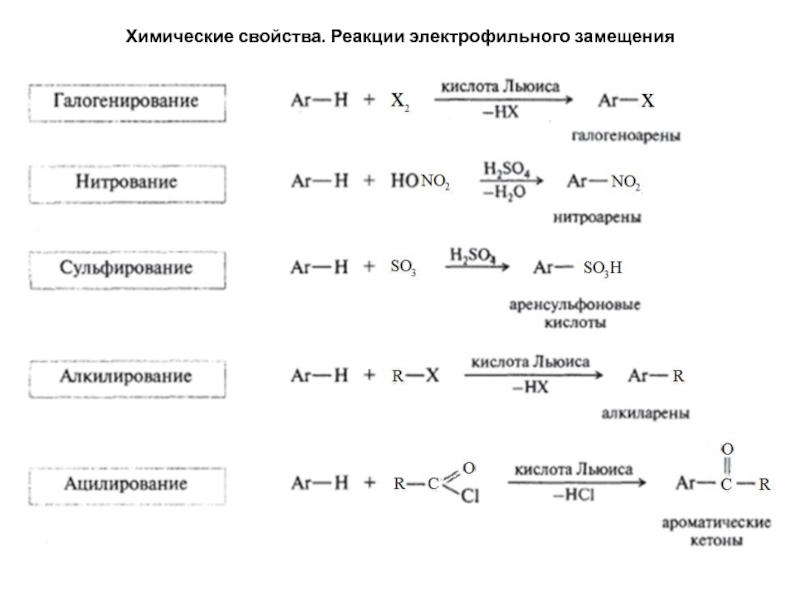
4. Ароматические свойства. Реакции электрофильного
замещения в моноядерных аренах
Бензольное ядро обладает высокой прочностью, чем
и объясняется склонность ароматических углеводородов к реакциям замещения(SЕ). В отличие от алканов, которые также склонны к реакциям замещения, ароматические углеводороды характеризуются большой подвижностью атомов водорода в ядре, поэтому реакции галогенирования, нитрования, сульфирования и др. протекают в значительно более мягких условиях, чем у алканов.Слайд 21Химические свойства. Реакции электрофильного замещения
Механизм реакции электрофильного замещения в ряду
бензола:
Слайд 22Химические свойства. Реакции электрофильного замещения
Первичной стадией является генерирование электрофильной частицы.
Она образуется в результате гетеролитического расщепления ковалентной связи в молекуле
галогена под действием катализатора и представляет собой хлорид-катион.Образующаяся электрофильная частица атакует бензольное ядро, приводя к быстрому образованию нестойкого p- комплекса, в котором электрофильная частица притягивается к электронному облаку бензольного кольца.
Слайд 23Химические свойства. Реакции электрофильного замещения
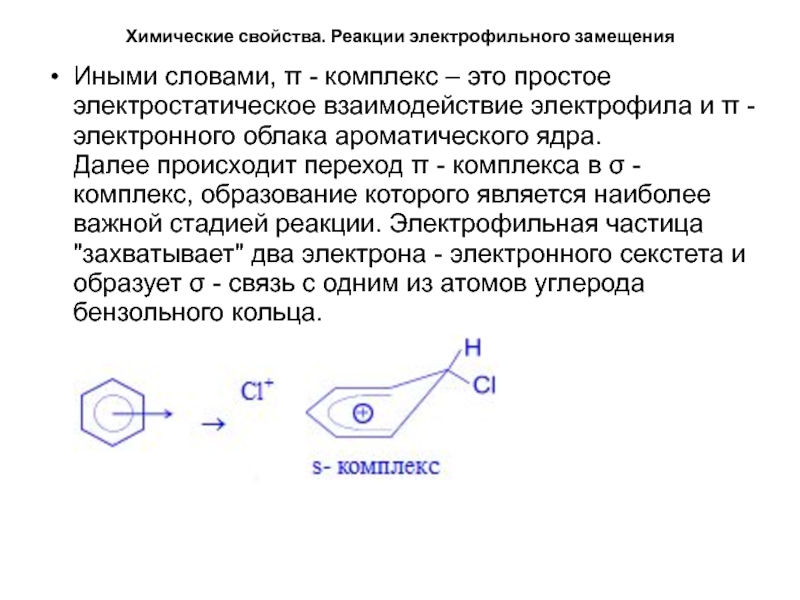
Иными словами, π - комплекс –
это простое электростатическое взаимодействие электрофила и π - электронного облака
ароматического ядра. Далее происходит переход π - комплекса в σ - комплекс, образование которого является наиболее важной стадией реакции. Электрофильная частица "захватывает" два электрона - электронного секстета и образует σ - связь с одним из атомов углерода бензольного кольца.Слайд 24Химические свойства. Реакции электрофильного замещения
σ - комплекс – это катион,
лишенный ароматической структуры, с четырьмя p- электронами, делокализованными ( распределенными)
в сфере воздействия ядер пяти углеродных атомов. Шестой атом углерода меняет гибридное состояние своей электронной оболочки от sp2- до sp3-, выходит из плоскости кольца и приобретает тетраэдрическую симметрию. Оба заместителя – атомы водорода и хлора располагаются в плоскости, перпендикулярной к плоскости кольца.Слайд 25Химические свойства. Реакции электрофильного замещения
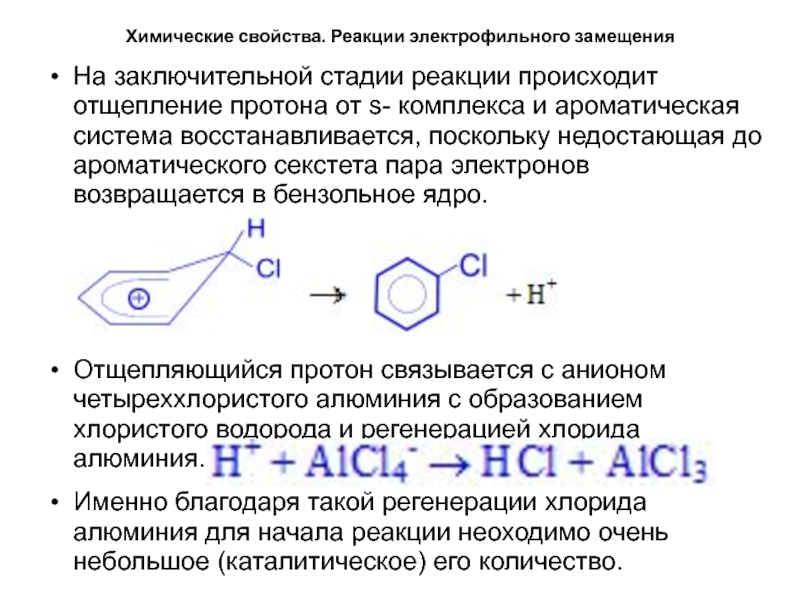
На заключительной стадии реакции происходит отщепление
протона от s- комплекса и ароматическая система восстанавливается, поскольку недостающая
до ароматического секстета пара электронов возвращается в бензольное ядро.Отщепляющийся протон связывается с анионом четыреххлористого алюминия с образованием хлористого водорода и регенерацией хлорида алюминия.
Именно благодаря такой регенерации хлорида алюминия для начала реакции неоходимо очень небольшое (каталитическое) его количество.
Слайд 26Правила ориентации в бензольном ядре
5. Правила ориентации в бензольном ядре
Гомологи бензола также вступают в реакцию электрофильного замещения. Однако, существенной
особенностью этих реакций является то, что новые заместители вступают в бензольное кольцо в определенные положения по отношению к уже имеющимся заместителям. Закономерности, определяющие направление реакций замещения в бензольном ядре, называются правилами ориентации.Все заместители по характеру своего ориентирующего действия делятся на две группы.
Слайд 27Правила ориентации в бензольном ядре
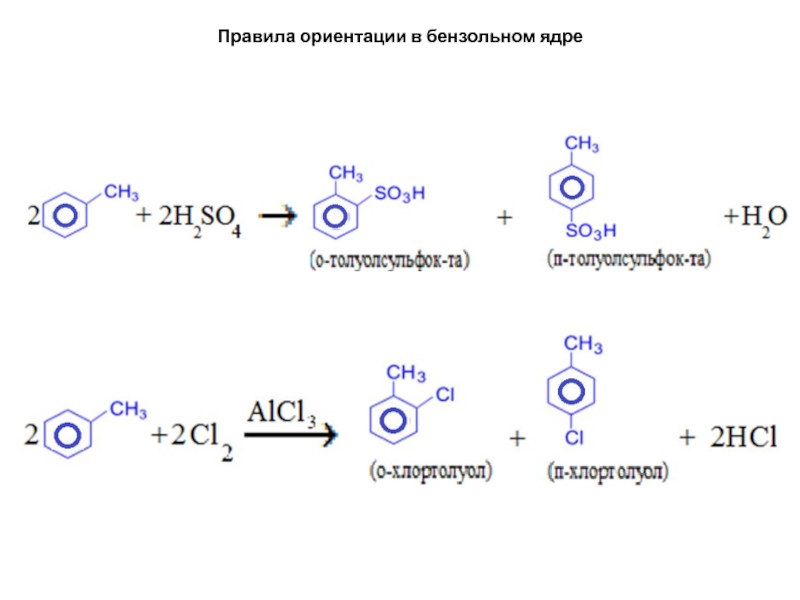
Заместители первого рода (или орто-пара-ориентанты) –
это атомы или группы атомов, способные отдавать электроны (электронодонорные). К
ним относятся углеводородные радикалы, группы –OH и –NH2, а также галогены. Перечисленные заместители (кроме галогенов) увеличивают активность бензольного ядра. Заместители первого рода ориентируют новый заместитель преимущественно в орто- и пара-положение.Слайд 29Правила ориентации в бензольном ядре
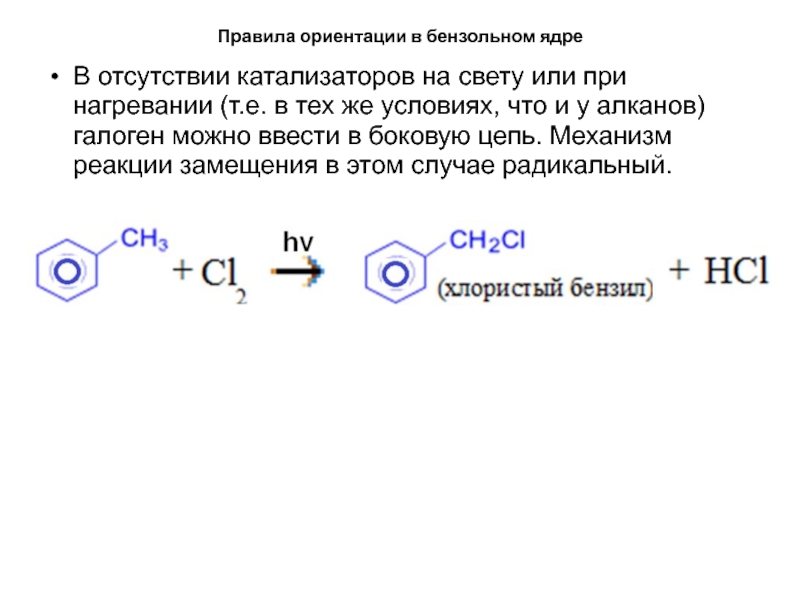
В отсутствии катализаторов на свету или
при нагревании (т.е. в тех же условиях, что и у
алканов) галоген можно ввести в боковую цепь. Механизм реакции замещения в этом случае радикальный.Слайд 30Правила ориентации в бензольном ядре
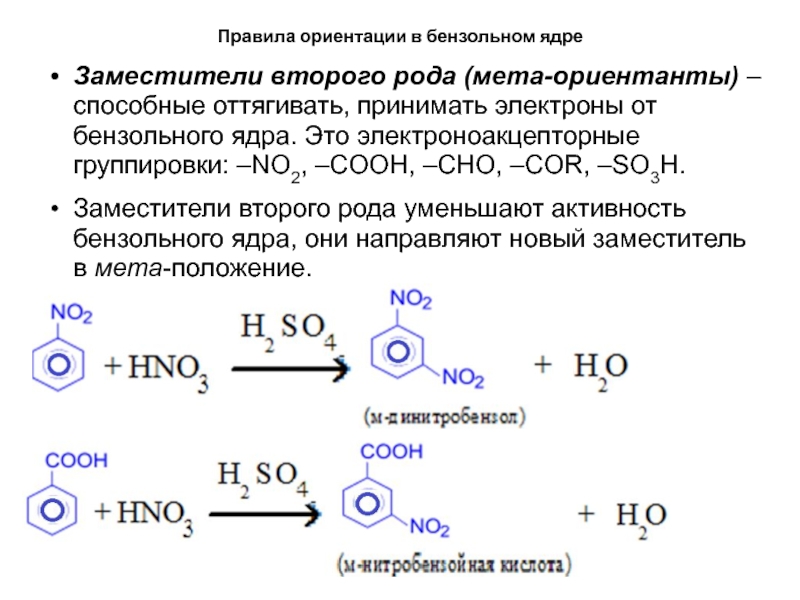
Заместители второго рода (мета-ориентанты) – способные
оттягивать, принимать электроны от бензольного ядра. Это электроноакцепторные группировки: –NO2,
–COOH, –CHO, –COR, –SO3H.Заместители второго рода уменьшают активность бензольного ядра, они направляют новый заместитель в мета-положение.
Слайд 31Правила ориентации в бензольном ядре
Влияние заместителей в ароматическом ядре на
реакционную способность и ориентацию электрофильного замещения.
Слайд 32Правила ориентации в бензольном ядре
В дизамещенных производных аренов ориентирующее влияние
заместителей будет согласованным, если заместители направляю электрофильный реагент в одни
и те же положения кольца.Слайд 33Правила ориентации в бензольном ядре
Примером согласованной ориентации является реакция бромирования
4 –нитрофенола:
Слайд 34Правила ориентации в бензольном ядре
Возможны случаи и несогласованной ориентации, когда
ориентирующее влияние одного заместителя не совпадает по направлению с влиянием
другого заместителя:Слайд 35Правила ориентации в бензольном ядре
При несогласованной ориентации заместители конкурируют между
собой, что приводит к образованию смеси продуктов. Но в этих
случаях можно предсказать основное направление реакции пользуясь следующими обобщениями:Если в бензольном кольце имеются сильная и слабая активирующие группы, то ориентация в основном определяется сильной группой.
Если в бензольном кольце имеются активирующая и дезактивирующая группы, то ориентация электрофильного реагента определяется главным образом активирующей группой.
Слайд 36Реакции присоединения. Реакции окисления
6. Реакции протекающие с потерей ароматичности
Несмотря на склонность бензола к реакциям замещения, он в жестких
условиях вступает и в реакции присоединения.1) Гидрирование. Присоединение водорода осуществляется только в присутствии катализаторов и при повышенной температуре. Бензол гидрируется с образованием циклогексана, а производные бензола дают производные циклогексана.
Слайд 37Реакции присоединения. Реакции окисления
2) Присоединение хлора. На солнечном свету под
воздействием ультрафиолетового излучения бензол присоединяет хлор и бром с образованием
гексагалогенидов, которые при нагревании теряют три молекулы галогеноводорода и приводят к тригалогенбензолам.Слайд 38Реакции присоединения. Реакции окисления
Реакции боковых цепей в алкилбензолах. Окисление.
Бензольное
ядро более устойчиво к окислению, чем алканы. Даже перманганат калия,
азотная кислота, пероксид водорода в обычных условиях на бензол не действуют. При действии же окислителей на гомологи бензола ближайший к ядру атом углерода боковой цепи окисляется до карбоксильной группы и дает ароматическую кислоту.Слайд 40Реакции присоединения. Реакции окисления
При наличии в бензольном кольце нескольких заместителей
можно окислить последовательно все имеющиеся цепи. Эта реакция применяется для
установления строения ароматических углеводородов.Слайд 41Реакционная способность многоядерных аренов
7. Реакционная способность многоядерных аренов
I. Важнейшие реакции
многоядерных аренов с изолированными кольцами .
Простейший представитель соединений с
изолированными бензольными ядрами является бифенил. Бифенил содержит сопряженную систему, включающую два бензольных кольца, и у него ярко выражена склонность к реакциям электрофильного замещения. Электрофил атакует бензольные кольца предпочтительно в пара-положения, где меньше сказываются пространственные препятствия. Например, при нитровании бифенила одна нитрогруппа вступает в пара-положение одного кольца, а вторая — в пара-положение другого кольцаСлайд 42Реакционная способность многоядерных аренов
В дифенилметане и трифенилметане бензольные кольца изолированы
и между ними нет сопряжения. По своей реакционной способности эти
соединения напоминают толуол. Для дифенилметана в основном, а для трифенил-метана исключительно электрофильное замещение осуществляется в пара-положение к метиленовой или метиновой группе. Такая ориентация электрофила определяется пространственными факторами и является следствием экранированности орто-положений соседними бензольными кольцами.Слайд 43Реакционная способность многоядерных аренов
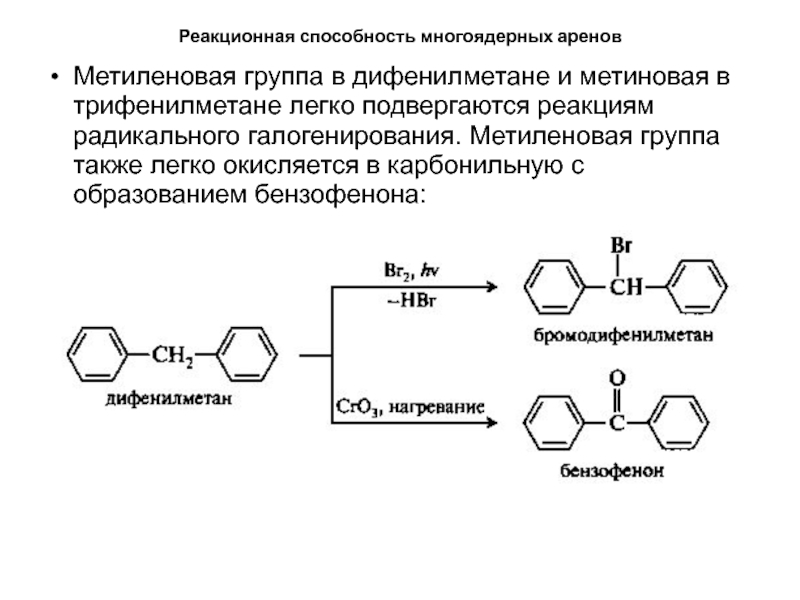
Метиленовая группа в дифенилметане и метиновая в
трифенилметане легко подвергаются реакциям радикального галогенирования. Метиленовая группа также легко
окисляется в карбонильную с образованием бензофенона:Слайд 44Реакционная способность многоядерных аренов
Трифенилметан обладает значительной реакционной способностью благодаря особой
подвижности атома водорода при третичном атоме углерода:
Амино- и гидроксипроизводные трифенилметана
являются красителями.Слайд 45Реакционная способность многоядерных аренов
II. Важнейшие реакции конденсированных аренов.
Наиболее важным
представителем многоядерных аренов с конденсированными бензольными ядрами является нафталин. Это
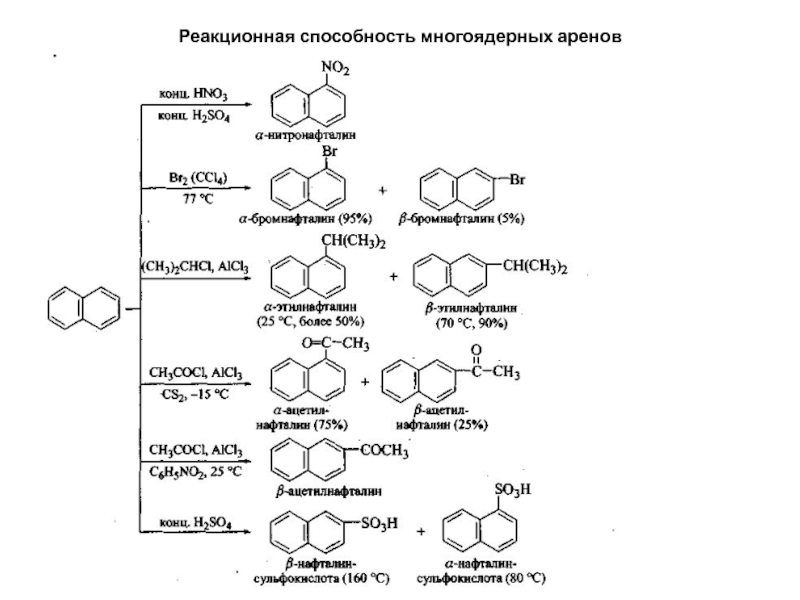
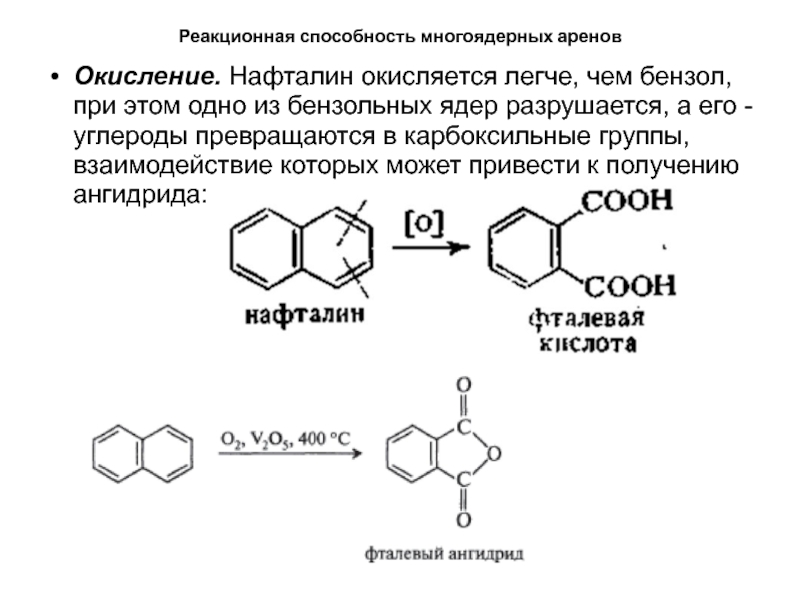
бесцветное кристаллическое вещество с характерным запахом, легко возгоняется. В отличии от бензола у нафталина нет полного выравнивания электронной плотности, они менее ароматичны. Как и для бензола для них характерны реакции электрофильного замещения. Потеря ароматичности одного из колец на стадии образования σ-комплекса, требует меньших затрат энергии, чем для бензола. Кроме того, нафталин легко вступает в реакции окисления и присоединения. Реакции замещения идут легче в -положениях, чем в -положениях. В некоторых случаях тип ориентации может быть измнен условиями реакции.Слайд 47Реакционная способность многоядерных аренов
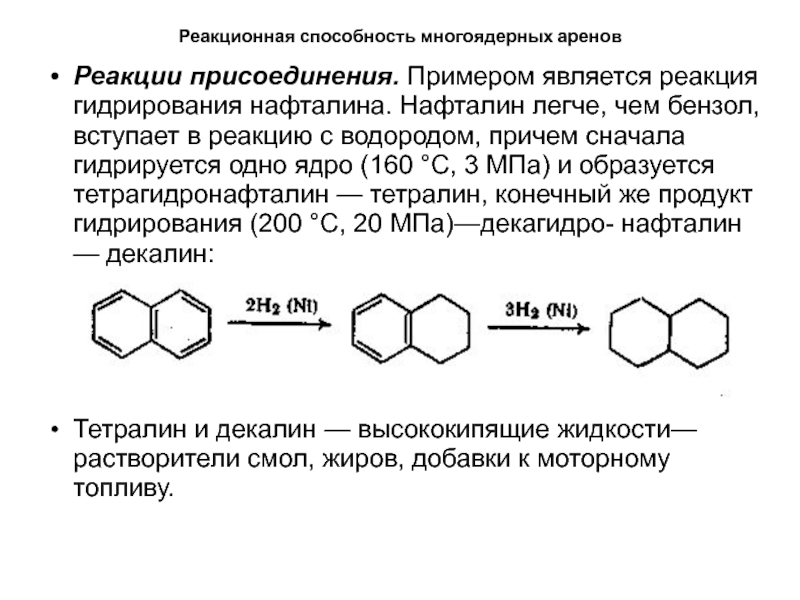
Реакции присоединения. Примером является реакция гидрирования нафталина.
Нафталин легче, чем бензол, вступает в реакцию с водородом, причем
сначала гидрируется одно ядро (160 °С, 3 МПа) и образуется тетрагидронафталин — тетралин, конечный же продукт гидрирования (200 °С, 20 МПа)—декагидро- нафталин — декалин:Тетралин и декалин — высококипящие жидкости— растворители смол, жиров, добавки к моторному топливу.