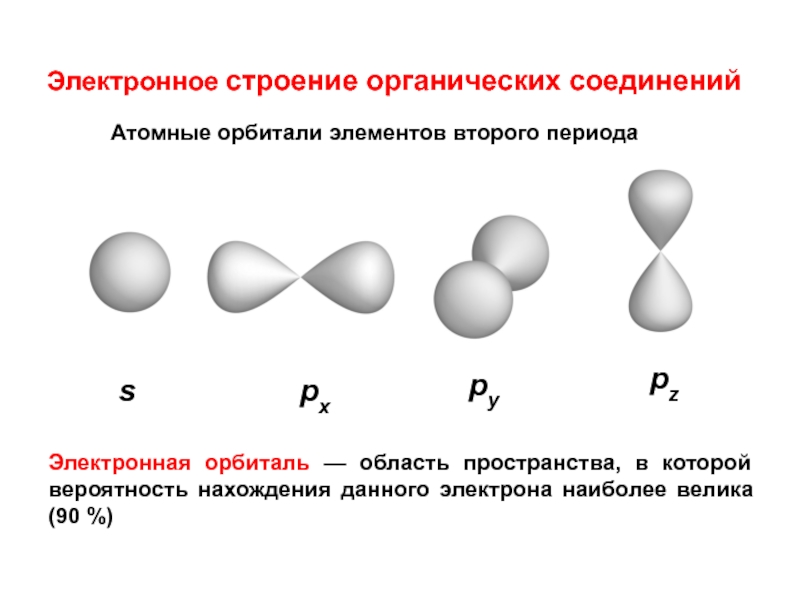
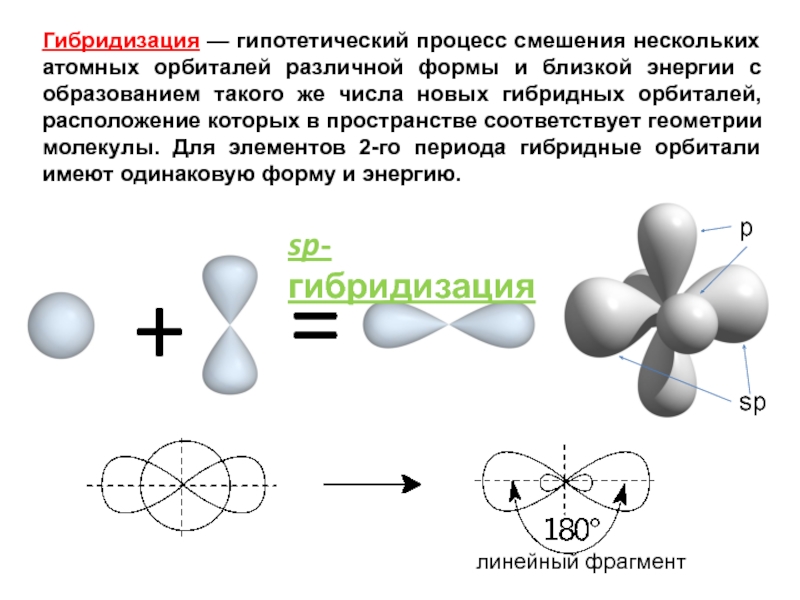
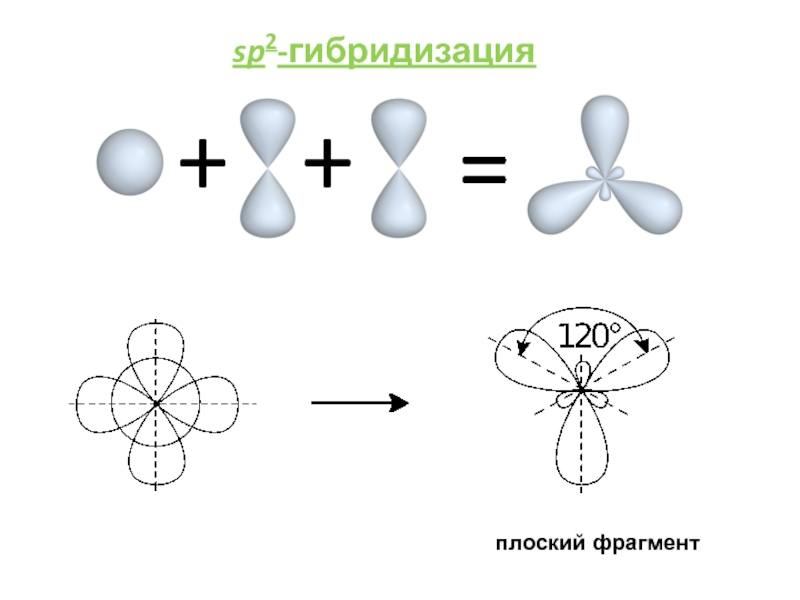
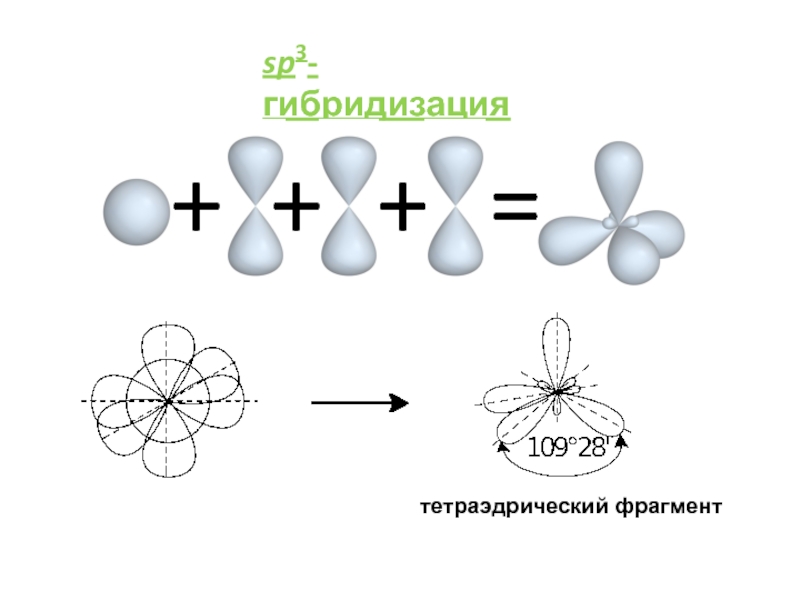
им. Н.И.ПИРОГОВА
Лекция 1
Строение органических соединений
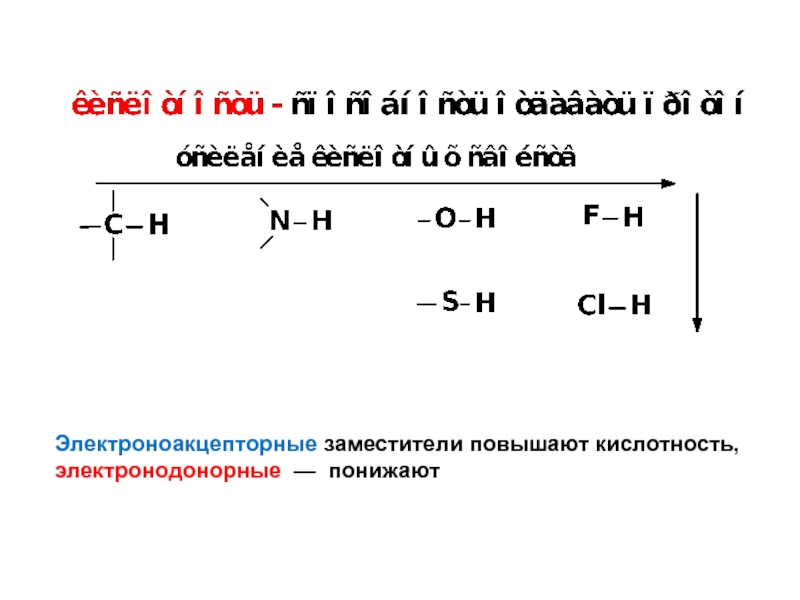
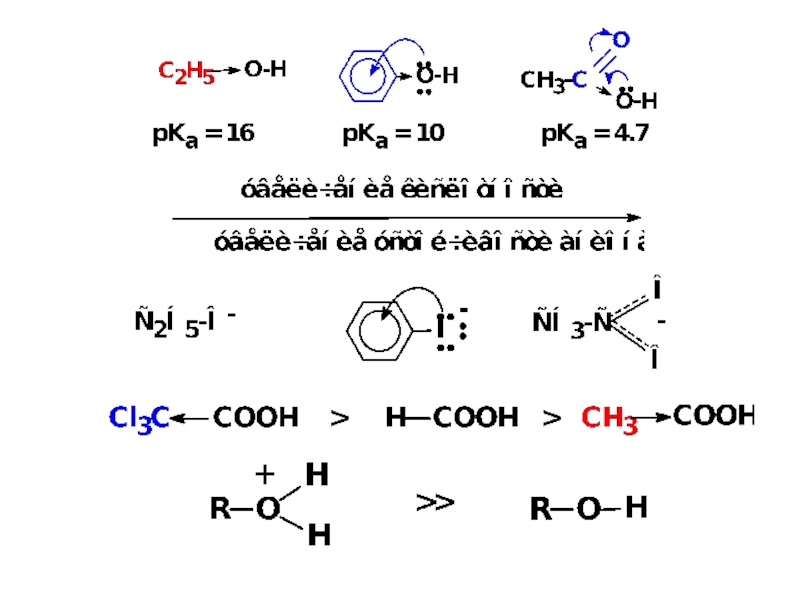
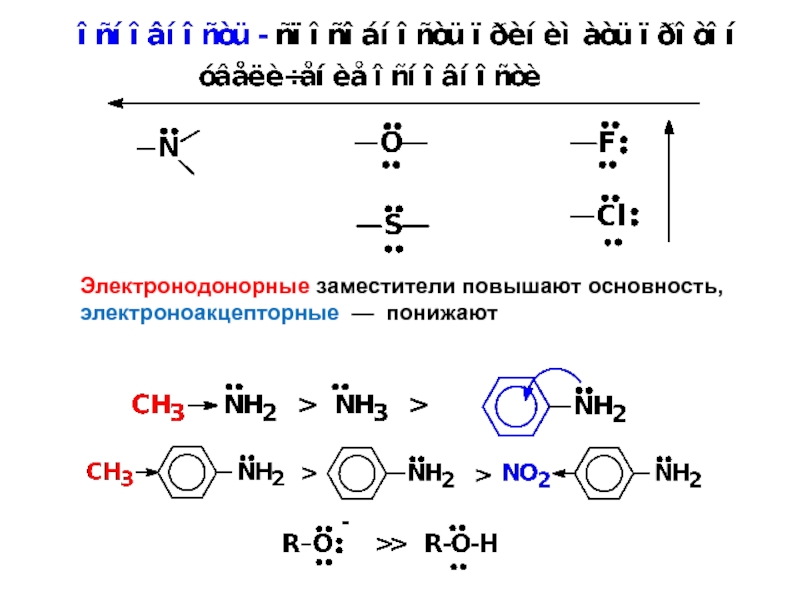
Кислотно-основные свойства органических соединений
Курс
лекций для студентов медико-биологического факультета, направление «Биофизика»Лекции читает ст.преподаватель Гузеева Татьяна Владимировна