Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основания. Получение и химические свойства
Содержание
- 1. Основания. Получение и химические свойства
- 2. Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними ионов гидроксильных групп.
- 3. Валентность гидроксогруппы – Количество гидроксогрупп определяется степенью
- 4. Название основанийГидроксид +Название металла в родительном падеже+Степень окисления римскими цифрами
- 5. Дайте названия гидроксидамNaOHCa(OH)2Fe(OH)2Fe(OH)3Al(OH)3Гидроксид натрияГидроксид железа (II)Гидроксид кальция Гидроксид алюминия Гидроксид железа (III)
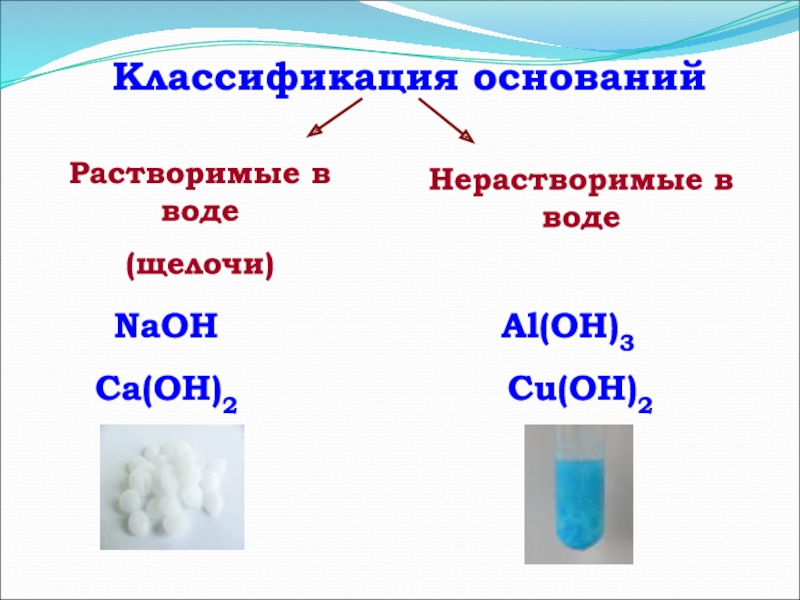
- 6. Классификация основанийРастворимые в воде(щелочи)Нерастворимые в водеNaOHCa(OH)2Al(OH)3Сu(OH)2
- 7. Получение оснований и их свойства
- 8. Активные метаталлы- Металлы 1 группы главной подгруппы
- 9. Щелочи получают взаимодействием активных металлов с водой.2Na + 2H2O = 2NaOH + H2
- 10. Помни! Нерастворимые основания не меняют окраску индикаторов.
- 11. Проверь себя!В щелочахЛакмус окрашивается в … цветМетиловый
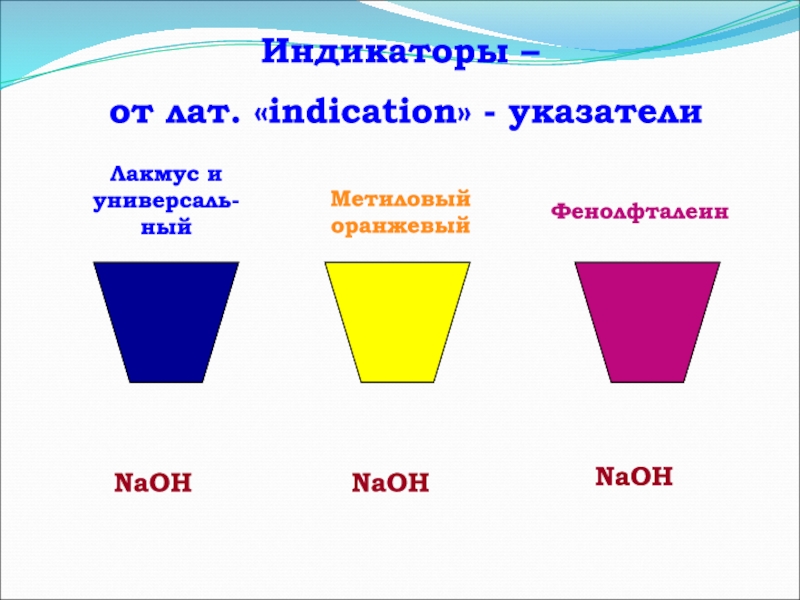
- 12. Индикаторы – от лат. «indication» - указателиNaOHNaOHNaOHЛакмус и универсаль-ный Метиловый оранжевыйФенолфталеин
- 13. Щёлочь + оксид неметалла → соль +
- 14. Щелочь + соль → новое основание
- 15. Получение и свойства нерастворимых оснований
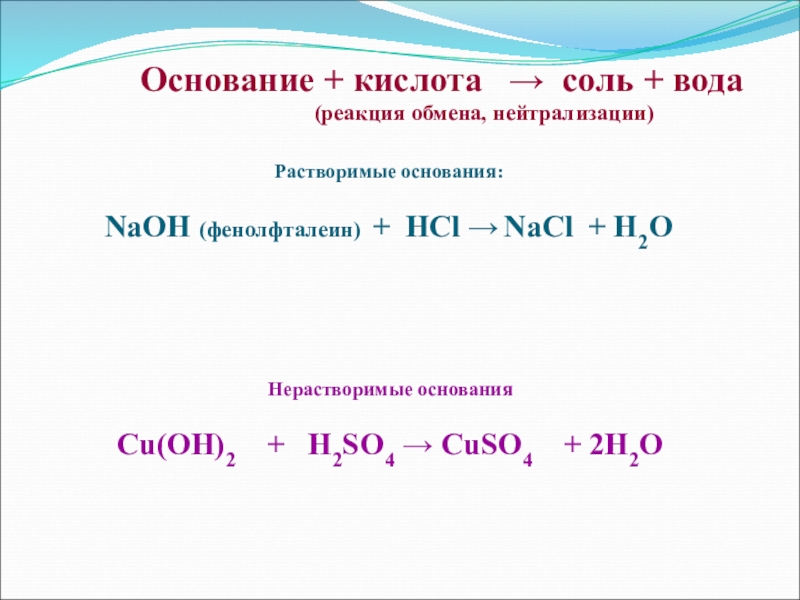
- 16. Основание + кислота → соль +
- 17. Лабораторная работа«Получение и химические свойства оснований»Цель: изучить
- 18. Нерастворимое основание →оксид металла +
- 19. Выполните задания1 вариантНапишите уравнения реакции в трех видах:Na2CO3+Вa(OH)2=2 вариантНапишите уравнения реакции в трех видах:Mg(OH)2+H2SO4=
- 20. Домашнее задание § 24 и 31 (Габриэлян) § 41, 42 (Рудзитис)
- 21. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Основания
– это сложные вещества, состоящие из ионов металлов и
связанных с ними ионов гидроксильных групп.
Слайд 3Валентность гидроксогруппы –
Количество гидроксогрупп определяется степенью окисления металла, образующего
основание.
Например:
Слайд 4Название оснований
Гидроксид
+
Название металла в родительном падеже
+
Степень окисления римскими цифрами
Слайд 5Дайте названия гидроксидам
NaOH
Ca(OH)2
Fe(OH)2
Fe(OH)3
Al(OH)3
Гидроксид натрия
Гидроксид железа (II)
Гидроксид кальция
Гидроксид алюминия
Гидроксид
железа (III)
Слайд 6Классификация оснований
Растворимые в воде
(щелочи)
Нерастворимые в воде
NaOH
Ca(OH)2
Al(OH)3
Сu(OH)2
Слайд 8Активные метаталлы
- Металлы 1 группы главной подгруппы (щелочные),
- Металлы 2
группы главной подгруппы (щелочно-земельные), кроме Берилия и Магния
Литий
- Натрий -
Калий Кальций
Рубидий Стронций
Цезий Барий
Франций Радий
Слайд 11Проверь себя!
В щелочах
Лакмус окрашивается в … цвет
Метиловый оранжевый в …
цвет
Фенолфталеин в … цвет
Универсальный в … цвет
Слайд 12Индикаторы –
от лат. «indication» - указатели
NaOH
NaOH
NaOH
Лакмус и универсаль-ный
Метиловый
оранжевый
Фенолфталеин
Слайд 13Щёлочь + оксид неметалла → соль + вода
(
реакция обмена)
УСЛОВИЕ:
оксиду неметалла должна соответствовать определенная кислота например: N2+5O5 → H N+5O3
S+6O3 → H2 S+6O4
2KOH + N2O5 → 2KNO3 + H2O
2LiOH + SO3 → Li2SO4 + H2O
Слайд 14 Щелочь + соль → новое основание + новая соль
( реакция обмена)
3NaOH+FeCl3→Fe(OH)3↓+ 3NaCl
Условия протекания реакции до конца:
образование осадка.
Слайд 16Основание + кислота → соль + вода
(реакция обмена, нейтрализации)
Растворимые основания:
NaOH
(фенолфталеин) + HCl → NaCl + H2OНерастворимые основания
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
Слайд 17Лабораторная работа
«Получение и химические свойства оснований»
Цель: изучить химические свойства оснований.
Оборудование
и реактивы: штатив с пробирками, растворы :гидроксида натрия, соляной ,серной
кислот, солей: сульфата меди(||),хлорида железа(|||), фенолфталеин, универсальная индикаторная бумага.ОПЫТ № 1 «Получение и свойства нерастворимых оснований»
В две пробирки налить по 1мл гидроксида натрия и в обе добавить по 1 мл сульфата меди (||).Что наблюдаете?В одну добавить несколько капель фенолфталеина, а во вторую - немного серной кислоты. Написать уравнения реакций в молекулярной и ионных формах. ПОМНИТЕ! Формулы нерастворимых веществ на ионы не расписываются!
Опыт № 2 «Действие индикаторов на растворы щелочей».
В пробирку налить 1 мл гидроксида натрия и добавить несколько капель фенолфталеина.Что наблюдаете?На полоску универсальной индикаторной бумаги капнуть раствора щелочи. Что наблюдаете?Сделайте вывод.
Опыт №3 «Взаимодействие с растворами кислот».
В пробирку с щелочью из предыдущего опыта добавить по каплям раствор серной кислоты.Написать уравнения реакции в молекулярной и ионных формах . ПОМНИТЕ! Вода является слабым электролитом и записывается в виде молекулы!
Опыт № 4 «Взаимодействие щелочей с растворами солей».
В пробирку налейте 1 мл раствора гидроксида натрия и несколько капель раствора хлорида железа (||| )до образования осадка. Написать уравнения реакции в молекулярной и ионных формах.
Слайд 18 Нерастворимое основание →оксид металла + вода
Mg(OH)2 → MgO + H2O
2Fe(OH)3 → Fe2O3 + 3H2O
Данный тип реакции нехарактерен для растворимых оснований