Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основные группы органических соединений, их химические свойства, особенности
Содержание
- 1. Основные группы органических соединений, их химические свойства, особенности
- 2. Ненасыщенные (непредельные) углеводороды (алкены) Ненасыщенными, или непредельными,
- 3. Согласно теории химического строения в ненасыщенных углеводородах
- 4. Все другие органические соединения, в молекулах которых
- 5. Ненасыщенные углеводороды ряда этилена (олефины, алкены) Углеводородами
- 6. Гомология, изомерия и номенклатураЭтиленовые углеводороды образуют гомологический
- 7. Оба углерода и все водородные атомы в
- 8. Замещая в этилене каждый из водородных атомов
- 9. Однако этиленовые углеводороды имеют больше изомеров, чем
- 10. усложнение изомерии непредельных углеводородов обусловлено тем, что
- 11. Цис –транс изомерия В ряду этиленовых углеводородов
- 12. В молекулах с двойной связью между вторым
- 13. Слайд 13
- 14. Слайд 14
- 15. Двойная связь препятствует вращению соединенных ею атомов
- 16. Изомерия, которая основана на различном пространственном расположении
- 17. Номенклатура Названия отдельных гомологов этиленовых углеводородов производят
- 18. Физические свойстваУглеводороды ряда этилен – бесцветные тела.
- 19. Химические свойства В отличие от насыщенных углеводородов
- 20. Электроны второй пары находятся в особом состоянии
- 21. Присоединение водорода (реакция гидрирования) При действии на
- 22. В результате гидрирования образуются предельные углеводороды. Гидрирование
- 23. Присоединение галогенов (галогенирование) При действии на этиленовые
- 24. Присоединение галогеноводородов (гидрогалогенирование)При действии на этиленовые углеводороды
- 25. Присоединение воды (реакция гидратации) В обычных условиях
- 26. Способы получения алкенов В природе этиленовые углеводороды
- 27. Диеновые углеводороды (алкадиены) Диеновыми углеводородами или алкадиенами,
- 28. Номенклатура и классификация Индивидуальные углеводороды с двумя
- 29. Задание 1Напишите формулы углеводородов диенового ряда от
- 30. Диеновые углеводороды, в которых две двойные связи
- 31. Диеновые углеводороды, в молекулах которых две двойные
- 32. Особое значение имеют этиленовые углеводороды, в молекулах
- 33. Ненасыщенные углеводороды ряда ацетилена (алкины) Углеводородами ряда
- 34. Гомология, изомерия и номенклатура Состав каждого члена
- 35. Изомерия.Возможны два типа ацетиленовых соединений R—C C—Н
- 36. Номенклатура Международная заместительная номенклатура. Ацетиленовые углеводороды называют
- 37. Напишите формулы углеводородов алкинового ряда от С=3
- 38. Свойства ацетиленовых углеводородов (алкинов) Физические свойства.Зависимости изменения
- 39. Химические свойства. Ацетиленовым углеводородам, так же как
- 40. Присоединение водорода (реакция гидрирования) В присутствии катализаторов
- 41. Слайд 41
- 42. Присоединение галогенов При взаимодействии ацетиленовых углеводородов с
- 43. Присоединение галогеноводородов Присоединение галогеноводородов протекает ступенчато. Вначале
- 44. Присоединение воды (реакция гидратации) Эта реакция была
- 45. Образующееся соединение – виниловый спирт – относится
- 46. Слайд 46
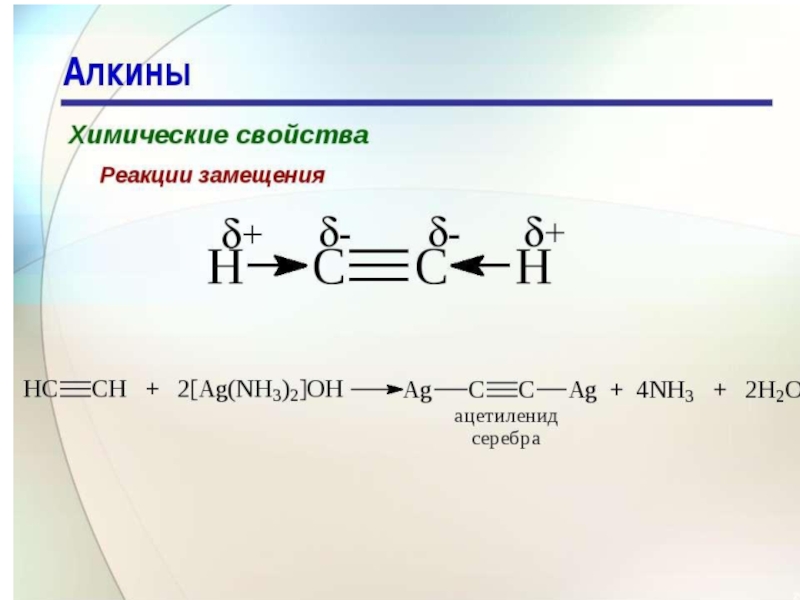
- 47. Замещение водорода при атомах углерода с
- 48. Слайд 48
- 49. Присоединение СОПрисоединение СО (реакция В. Реппе). Идет в присутствии никелевых катализаторов (Х=ОН, ОС2Н5, NH2)
- 50. Слайд 50
- 51. Слайд 51
- 52. Практическая частьПолучение ацетилена и его горение
- 53. ЦельПолучить ацетилен и рассмотреть его химические свойства
- 54. Реактивы и оборудование :карбид кальция СаС2 (в кусочках). пробирки, газоотводная трубка с оттянутым концом.
- 55. Работу с ацетиленом необходимо проводить в вытяжном
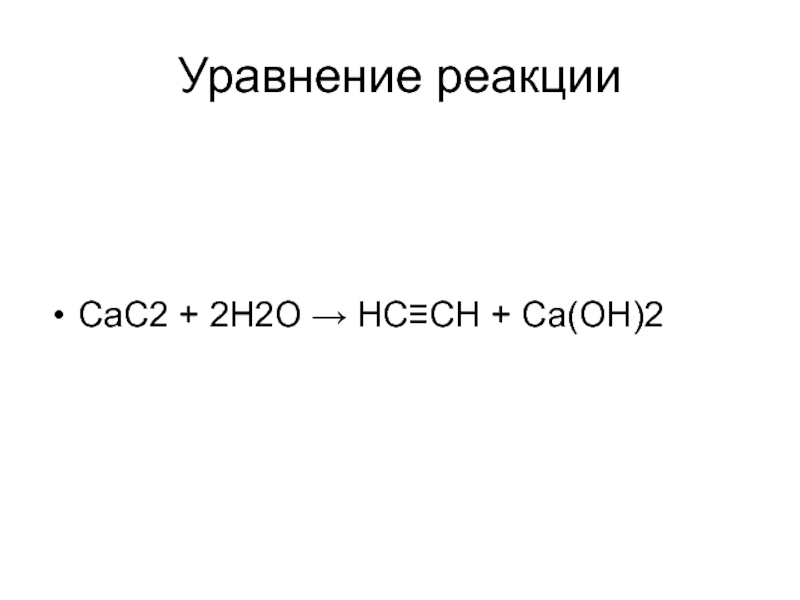
- 56. Уравнение реакцииСаС2 + 2Н2О → НС≡СН + Са(ОН)2
- 57. Поджигают ацетилен у конца газоотводной трубки. Он
- 58. Вывод:Реакция взаимодействия карбида кальция с водой экзотермична. Ацетилен легко окисляется
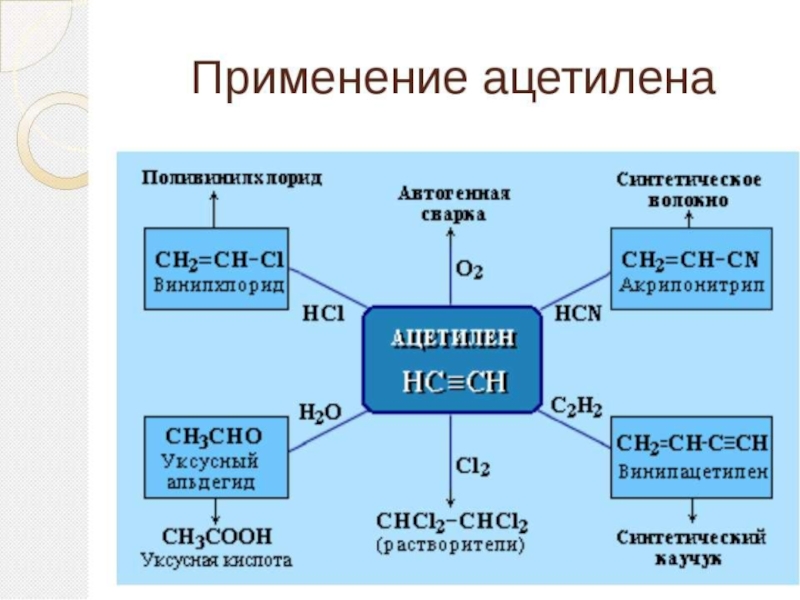
- 59. Темы для сообщенийПромышленное использование алкиновАцетилен, его открытие,
- 60. Скачать презентанцию
Ненасыщенные (непредельные) углеводороды (алкены) Ненасыщенными, или непредельными, углеводородами называют такие углеводороды, элементарный состав которых характеризуется меньшим содержанием водорода по сравнению с соответствующими по числу углеродных атомов предельными углеводородами.
Слайды и текст этой презентации
Слайд 1Основные группы органических соединений, их химические свойства, особенности молекулярной структуры
и классификации Лабораторная № 3 (4 часа)
и алкиновСлайд 2Ненасыщенные (непредельные) углеводороды (алкены)
Ненасыщенными, или непредельными, углеводородами называют такие
углеводороды, элементарный состав которых характеризуется меньшим содержанием водорода по сравнению
с соответствующими по числу углеродных атомов предельными углеводородами.Слайд 3Согласно теории химического строения в ненасыщенных углеводородах углерод также имеет
валентность равную четырем, но строение этих соединений отличается тем, что
в их молекулах имеются пары углеродных атомов, соединенные так называемыми кратными – двойными или тройными – связями. Благодаря наличию кратных связей атомы углерода в непредельных углеводородах не до предела насыщены водородом; отсюда и возникло название - непредельные или ненасыщенные.Слайд 4Все другие органические соединения, в молекулах которых имеются кратные связи
между углеродными атомами, являются производными ненасыщенных углеводородов; их также называют
непредельными органическими веществами.В противоположность насыщенным, ненасыщенные углеводороды проявляют высокую активность в химических реакциях и особенно склонны к реакциям присоединения.
Слайд 5Ненасыщенные углеводороды ряда этилена (олефины, алкены)
Углеводородами ряда этилена, или
этиленовыми углеводородами (олефинами) называют ненасыщенные углеводороды, строение которых отличается наличием
в их молекулах одной двойной связи между углеродными атомами, т.е. – группировки >C=C<.Слайд 6Гомология, изомерия и номенклатура
Этиленовые углеводороды образуют гомологический ряд, состав каждого
члена которого выражается общей эмпирической формулой CnH2n. Родоначальником этого ряда
является углеводород этилен состава С2Н4,Слайд 7Оба углерода и все водородные атомы в этилене равноценны. Поэтому
этилену соответствует один одновалентный радикал СН2=СН—, называемый винилом.
Слайд 8Замещая в этилене каждый из водородных атомов на радикал метил,
мы можем вывести следующий гомолог этого ряда – пропилен состава
С3Н6, имеющий строение СН2=СН—СН3. (Его радикал СН2=СН—СН2— , называют аллил). Точно также, в результате замещения на метил водородных атомов пропилена можно вывести формулу следующего непредельного углеводорода С4Н8. Как и в предыдущем ряду, у непредельных углеводородов, начиная с гомологов, содержащих четыре углеродных атома, проявляется изомерия.Слайд 9Однако этиленовые углеводороды имеют больше изомеров, чем предельные с тем
же числом углеродных атомов. Так, мы видели, что существует только
два изомерных предельных углеводорода состава С4Н10. Непредельных же углеводородов состава С4Н8 существует три. Строение их может быть выведено исходя их пропилена путем последовательной замены в его молекуле атомов водорода при различных углеродных атомах на метил.Слайд 10усложнение изомерии непредельных углеводородов обусловлено тем, что наряду с изомерией
углеродной цепи для них характерна изомерия положения двойной связи.
Для
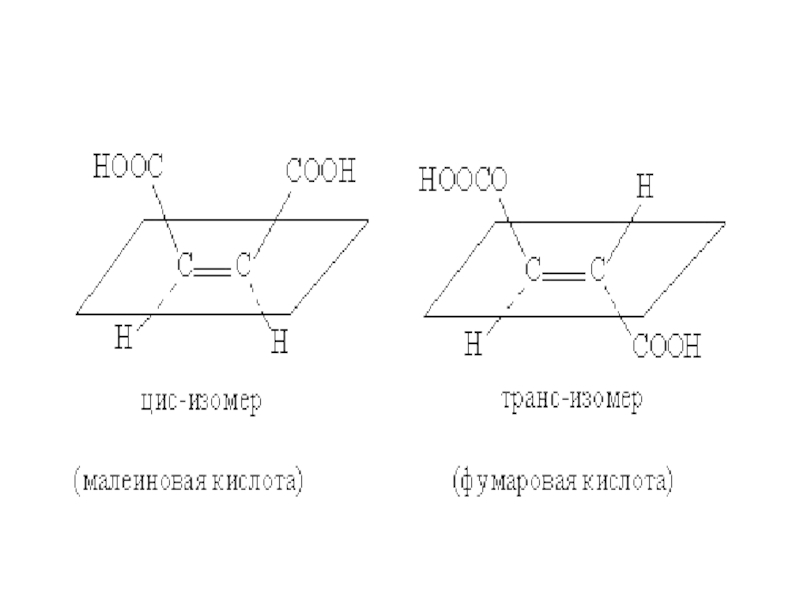
высших гомологов этиленовых углеводородов различие в числе изомеров по сравнению с предельными углеводородами с тем же числом углеродных атомов еще больше. Слайд 11Цис –транс изомерия
В ряду этиленовых углеводородов встречается еще один вид
изомерии, который связан с различием в пространственном строении некоторых молекул,
имеющих двойную связь.Слайд 12В молекулах с двойной связью между вторым и третьим углеродными
атомами обе метильные группы могут располагаться в пространстве двояким способом:
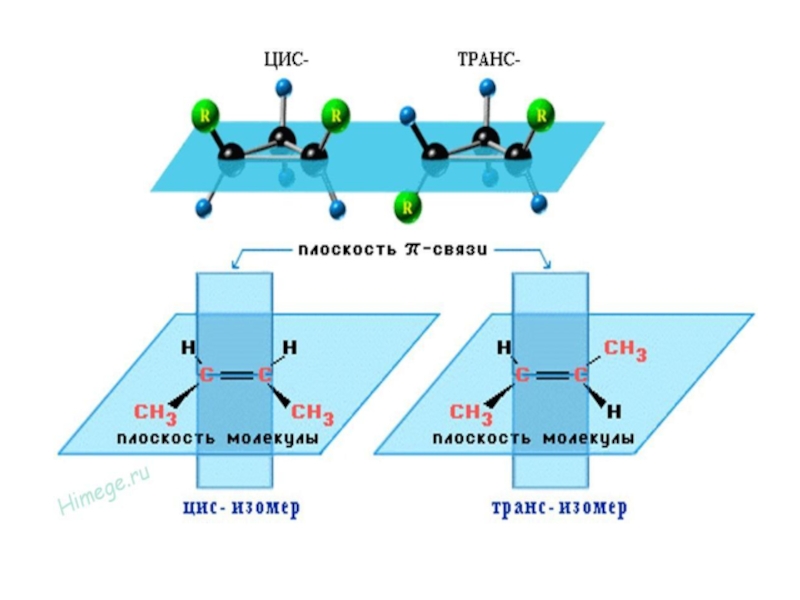
по одну сторону плоскости двойной связи и по обе стороны от нее.Слайд 15Двойная связь препятствует вращению соединенных ею атомов вокруг линии связи.
Поэтому строение молекул изомеров в пространстве зафиксировано
расстояние между метильными группами
в каждой из них различно, и, следовательно, размеры этих молекул неодинаковы. Такое различие в пространственном строении приводит к различию в свойствах
Слайд 16Изомерия, которая основана на различном пространственном расположении атомов или групп
атомов, соединенных двойной связью, называется цис–транс изомерией, а соответствующие изомеры
- цис–транс изомерами.Те из них, в которых различные группы атомов расположены по одну сторону плоскости двойной связи, называются цис-изомерами, а те, в которых группы атомов направлены в разные стороны, - транс-изомерами.
Слайд 17Номенклатура
Названия отдельных гомологов этиленовых углеводородов производят от названий предельных углеводородов
с тем же числом углеродных атомов путем замены родового окончания
– ан на окончание – илен. Например, этан – этилен, пропан – пропилен, изобутан – изобутилен, и т.д. Только углеводороды С5Н10, как исключение, называют амиленами.Слайд 18Физические свойства
Углеводороды ряда этилен – бесцветные тела. Температуры кипения и
температуры плавления гомологов этилена нормального строения возрастают по мере увеличения
в их составе числа углеродных атомов. Первые три члена ряда (С2-С4)- газы, начиная с амиленов и кончая углеводородами С16Н32 – жидкости, высшие этиленовые углеводороды – твердые тела.Слайд 19Химические свойства
В отличие от насыщенных углеводородов для углеводородов ряда
этилена характерны разнообразные реакции присоединения по месту двойной связи; при
этом они значительно легче вступают во взаимодействие с различными реагентами.Все специфические особенности этиленовых углеводородов определяются характером двойной связи. Казалось бы, что двойная связь должна быть прочнее простой; на самом же деле она легко разрывается и превращается в простую (чем и обусловлены реакции присоединения). При определенных условиях молекулы непредельных соединений распадаются с разрывом углеродной цепи именно по месту двойной связи.
Слайд 20Электроны второй пары находятся в особом состоянии (-связь). Эта пара
электронов весьма лабильна и осуществляемая ею связь в значительно большей
мере, чем простая связь, подвергается поляризации.Поэтому именно атомы, соединенные двойной связью, наиболее реакционноспособны и проявляют ненасыщенность, т.е. присоединяют к себе атомы или атомные группы реагента.
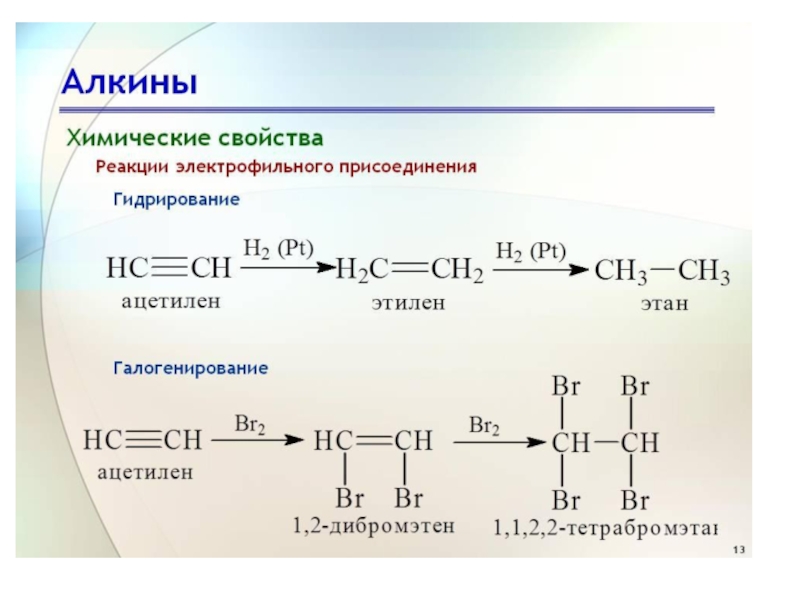
Слайд 21Присоединение водорода (реакция гидрирования)
При действии на этиленовые углеводороды водорода в
присутствии катализаторов (Ni, Pt) атомы водорода легко присоединяются к углеродным
атомам, соединенным двойной связью, которая при этом разрывается и на ее месте сохраняется простая связьСлайд 22В результате гидрирования образуются предельные углеводороды. Гидрирование непредельных углеводородов –
важный способ получения углеводородов ряда метана.
Присоединение водорода по месту
кратных связей вообще имеет большое практическое значение для превращения непредельных соединений различных классов в предельные. Так, гидрирование применяют в промышленности при получении твердых жиров из жидких растительных масел. Слайд 23Присоединение галогенов (галогенирование)
При действии на этиленовые углеводороды галогенов в результате
присоединения их по месту двойной связи образуются дигалогенпроизводные предельных углеводородов
с атомами галогена при соседних углеродных атомах.Слайд 24Присоединение галогеноводородов (гидрогалогенирование)
При действии на этиленовые углеводороды галогеноводородов также идет
реакция присоединения, но образуются моногалогенпроизводные предельных углеводородов
Слайд 25Присоединение воды (реакция гидратации)
В обычных условиях этиленовые углеводороды не реагируют
с водой, но при нагревании в присутствии катализаторов (хлористый цинк,
серная кислота) элементы воды (водород и гидроксил) присоединяются к углеродным атомам по месту двойной связи с образованием спиртовСлайд 26Способы получения алкенов
В природе этиленовые углеводороды (олефины; алкены) встречаются довольно
редко. Иногда низшие олефины в небольших количествах растворены в нефти
и входят в состав попутного нефтяного газа. Лишь в некоторых месторождениях нефть содержит значительные количества высших олефинов (например, канадская нефть). Довольно много этиленовых углеводородов получается при крекинге и пиролизе углеводородов нефти и содержатся в крекинг-бензинах. Важным источником этилена, пропилена и бутиленов служат получающиеся при этом газы (газы крекинга); в таблице приведены данные о содержании в них непредельных углеводородов в зависимости от вида переработки нефтепродуктов.Слайд 27Диеновые углеводороды (алкадиены)
Диеновыми углеводородами или алкадиенами, называются ненасыщенные углеводороды с
открытой цепью углеродных атомов, в молекулах которых имеются две двойные
связи. Состав этих углеводородов может быть выражен формулой СnH2n-2.Слайд 28Номенклатура и классификация
Индивидуальные углеводороды с двумя двойными связями называют,
пользуясь принципами международной заместительной номенклатуры для алкенов, с той лишь
разницей, что в наименовании перед окончанием – ен, обозначающим двойную связь, ставят греческое числительное –ди, так образуется родовое для этих углеводородов окончание – диен (отсюда и название диеновые). Перед названием основы (т.е. главной цепи, включающей обе двойные связи) ставят цифры, обозначающие номера углеродных атомов, за которыми следуют двойные связи. Отдельные представители имеют также и тривиальные названия.Слайд 29Задание 1
Напишите формулы углеводородов диенового ряда от С=3 до С=10.
К каждому углеводороду С5 и больше напишите по 2 изомера
Слайд 30Диеновые углеводороды, в которых две двойные связи находятся рядом и
не разделены простыми связями, называют углеводородами с кумулированными двойными связями.
Например:1 2 3
СН2=С=СН2 1,2-пропадиен (аллен)
Слайд 31Диеновые углеводороды, в молекулах которых две двойные связи разделены двумя
или более простыми связями, называются углеводородами с изолированными двойными связями.
Слайд 32Особое значение имеют этиленовые углеводороды, в молекулах которых двойные связи
разделены одной простой связью. Такие углеводороды называют углеводородами с сопряженными
двойными связями. Простейшим представителем является 1,3-бутадиенСлайд 33Ненасыщенные углеводороды ряда ацетилена (алкины)
Углеводородами ряда ацетилена или ацетиленовыми
углеводородами называют ненасыщенные углеводороды, в молекулах которых имеется тройная связь,
т.е. группировка —СС—.Слайд 34Гомология, изомерия и номенклатура
Состав каждого члена гомологического ряда ацетиленовых углеводородов
может быть выражен общей эмпирической формулой СnH2n-2. Простейшим членом этого
ряда является углеводород ацетилен состава С2Н2, строение которого выражают структурная и упрощенная структурная формулы:Н—СС—Н и СНСН
Гомологи ацетилена можно рассматривать как его производные, образовавшиеся в результате замещения одного или обоих атомов водорода в молекуле ацетилена на углеводородные радикалы.
Слайд 35Изомерия.
Возможны два типа ацетиленовых соединений R—C C—Н и R—CC—R'. (Линейная
геометрия тройной связи делает невозможной цис- и транс-изомерию алкинов.)
В
соединениях первого типа при углероде с тройной связью имеется водород, в соединения второго типа при атомах углерода с тройной связью водорода нет. Изомерия ацетиленовых углеводородов, так же как и этиленовых, обусловлена изомерией углеродного скелета и изомерией положения кратной связи. Интересно отметить, что общая формула состава ацетиленовых углеводородов СnH2n-2 аналогична общей формуле состава диеновых углеводородов. Иначе говоря, непредельные углеводороды с двумя двойными связями изомерны непредельным углеводородам с одной тройной связью. Слайд 36Номенклатура
Международная заместительная номенклатура. Ацетиленовые углеводороды называют по заместительной номенклатуре так
же, как предельные, с той лишь разницей, что наличие тройной
связи обозначают путем замены в заместительном названии предельного углеводорода окончания –ан на –ин. Поэтому углеводороды с тройной связью по международной номенклатуре объединяют общим названием – алкины. Перед основой названия ставят цифру, соответствующую номеру углеродного атома главной цепи молекулы, за которым следует тройная связь. Принцип выбора главной цепи и нумерации атомов такой же, как в случае этиленовых углеводородов. Таким образом, ацетиленовые углеводороды, формулы которых написаны выше, называют так: (1)- 1-бутин и (2) – 2-бутин.Слайд 37Напишите формулы углеводородов алкинового ряда от С=3 до С=10. К
каждому углеводороду С5 и больше напишите по 2 изомера
Слайд 38Свойства ацетиленовых углеводородов (алкинов)
Физические свойства.
Зависимости изменения физических свойств в
гомологических рядах ацетиленовых углеводородов по мере возрастания числа атомов углерода
в их молекулах аналогичны тем зависимостям, которые наблюдаются в рядах предельных и этиленовых углеводородов. Простейшие гомологи нормального строения до С5Н8 – газы, от С5Н8 до С16Н30 – жидкости, высшие ацетиленовые углеводороды – твердые тела. Все эти соединения бесцветны.Слайд 39Химические свойства.
Ацетиленовым углеводородам, так же как этиленовым, свойственны реакции присоединения
по месту кратной связи, в данном случае тройной.
Тройная связь, так
же как и двойная, по характеру отличается от простой связи. Она осуществляется тремя парами обобщенных электронов. Из них, как и в случае двойной связи, одна пара осуществляет простую связь (-связь), а две другие электронные пары находятся в особом состоянии (-связи); осуществляемые ими связи проявляют повышенную склонность к поляризации. Этим обуславливаются реакции присоединения по месту тройной связи. Последние идут ступенчато: вначале тройная связь разрывается в двойную, и образуются производные этиленовых углеводородов. Затем разрывается и двойная связь, превращаясь в простую с образованием производных предельных углеводородов. При энергичном химическом воздействии возможен распад молекул с разрывом углеродной цепи по месту тройной связи. Слайд 40Присоединение водорода (реакция гидрирования)
В присутствии катализаторов (например, Pt или Pd)
водород присоединяется по месту тройной связи. При этом вначале образуется
этиленовый, а затем предельный углеводородСлайд 42Присоединение галогенов
При взаимодействии ацетиленовых углеводородов с галогенами последние присоединяются по
месту тройной связи; вначале присоединяется одна молекула, а затем может
присоединиться и вторая. Наиболее удобна реакция с бромом; как и в случае этиленовых углеводородов, она может быть использована как качественная реакция на тройную связь; в результате реакции бурая окраска брома или его растворов исчезаеСлайд 43Присоединение галогеноводородов
Присоединение галогеноводородов протекает ступенчато. Вначале образуется моногалогенпроизводное этиленового ряда
К
последнему может присоединиться еще одна молекула галогеноводорода, причем реакция в
этом случае протекает по правилу Марковникова: водород может присоединяется к углероду с большим числом водородных атомов, и в результате образуется дигалогенпроизводное предельного углеводорода, в котором оба атома галогена стоят при одном том же углеродом атомеСлайд 44Присоединение воды (реакция гидратации)
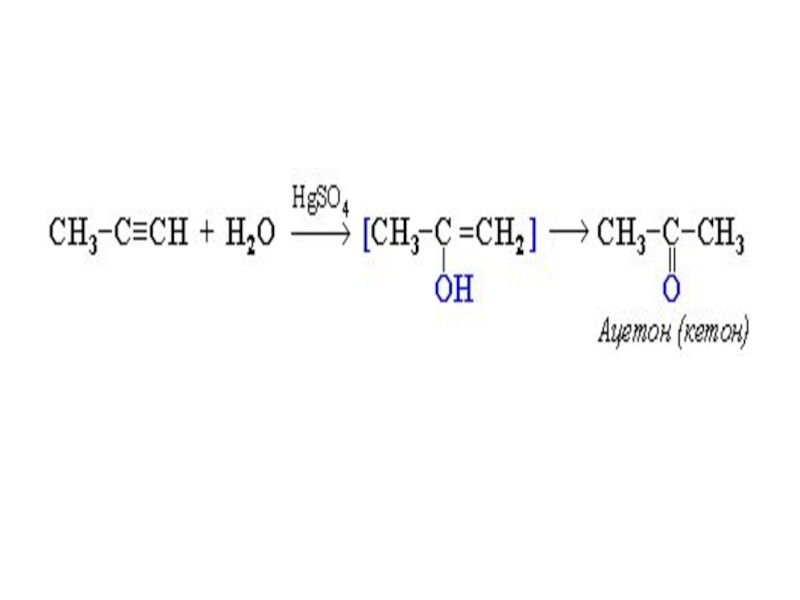
Эта реакция была открыта в 1881г. М.Г.
Кучеровым. Под действием солей окисной ртути в сернокислом растворе по
месту тройной связи присоединяется одна молекула водыСлайд 45Образующееся соединение – виниловый спирт – относится к непредельным спиртам,
в которых гидроксильная группа расположена при углероде с двойной связью.
Такие соединения неустойчивы и в свободном виде не существуют, т.к. в момент образования в их молекулах происходит перегруппировка: водород гидроксильной группы перемещается к соседнему углеродному атому, этиленовая связь разрывается и возникает двойная связь между углеродом и кислородом (правило Эльтекова)Слайд 47 Замещение водорода при атомах углерода с тройной связью на
металл
Все рассмотренные до сих пор реакции ацетиленовых углеводородов аналогичны
реакциям углеводородов ряда этилена. Отличительной особенностью ацетиленовых углеводородов является подвижность атомов водорода, соединенных с углеродными атомами при тройной связи. Под влиянием последней атомы водорода в присутствии сильного основания (амида натрия NaNH2,металлоорганического соединения, иногда концентрированных растворов щелочей) проявляют способность замещаться на металл. При этом образуется металлические производные – ацетилениды Слайд 49Присоединение СО
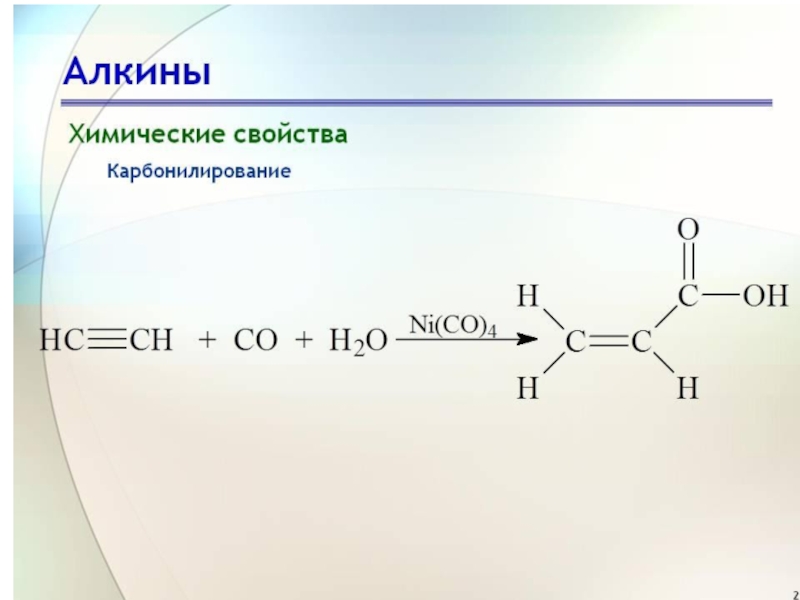
Присоединение СО (реакция В. Реппе). Идет в присутствии никелевых
катализаторов (Х=ОН, ОС2Н5, NH2)
Слайд 54Реактивы и оборудование :
карбид кальция СаС2 (в кусочках).
пробирки, газоотводная трубка
с оттянутым концом.
Слайд 55Работу с ацетиленом необходимо проводить в вытяжном шкафу, так как
неочищенный ацетилен, полученный из карбида кальция, содержит вредные, неприятно пахнущие
примеси.В пробирку помещают маленький кусочек карбида кальция СаС2, добавляют 2 капли воды и закрывают пробирку пробкой с газоотводной трубкой, имеющей оттянутый конец. В пробирке бурно выделяется газообразный ацетилен.