Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основные классы органических соединений: циклические соединения
Содержание
- 1. Основные классы органических соединений: циклические соединения
- 2. все органические соединения подразделяются на :соединения с
- 3. Слайд 3
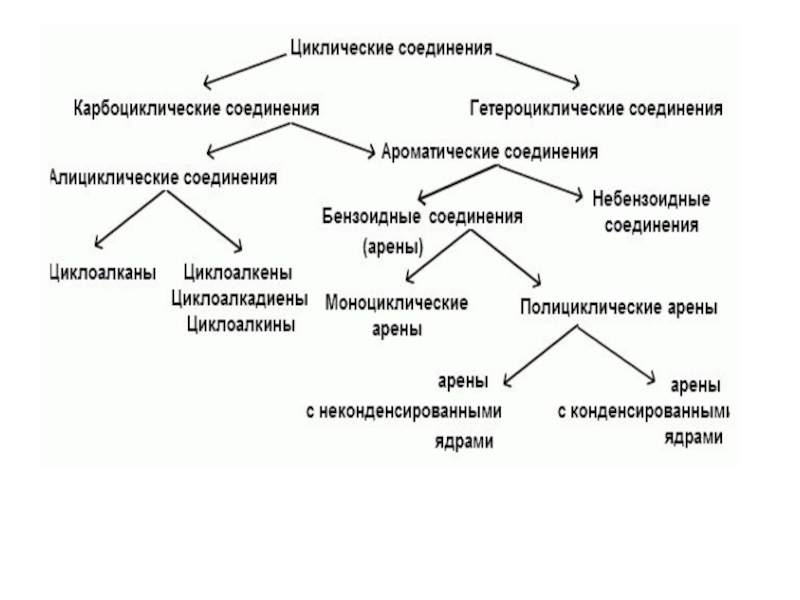
- 4. Циклические соединенияподразделяются на:Карбоциклические соединенияалициклические соединенияароматические соединения.Гетероциклические соединения.
- 5. Слайд 5
- 6. Слайд 6
- 7. Карбоциклические соединения – это соединения, в молекулах
- 8. Гетероциклические соединения - это циклические соединения, в
- 9. Карбоциклические соединения разделяют на алициклические ароматические.Алициклические соединения
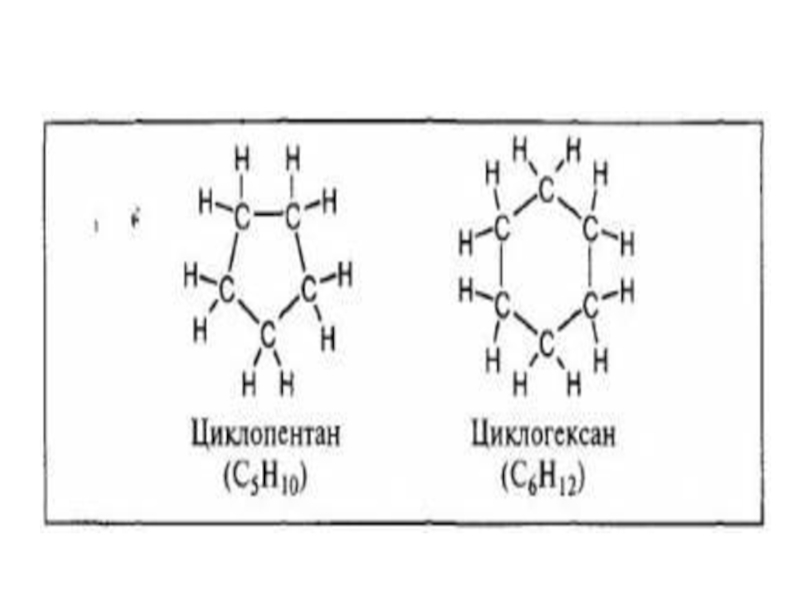
- 10. Они различаются по числу атомов углерода в
- 11. Названия циклических соединений строятся подобно наименованиям соединений жирного (алифатического) ряда с добавлением приставки «цикло».
- 12. Ароматическими соединениями обычно называют карбоциклические соединения, в
- 13. Слайд 13
- 14. Благодаря наличию в ароматических соединениях бензольного ядра
- 15. Ароматические углеводороды ряда бензолаПервый представитель ароматических углеводородов
- 16. Строение бензолаДолгое время оставался неясным вопрос о
- 17. Выяснилось все же, что в определенных условиях
- 18. было установлено, что однозамещенные производные бензола C6H5X
- 19. Впервые формулу строения бензола предложил в 1865г.
- 20. Формула Кекулеполучила широкое распространение. Она согласуется с
- 21. Однако формула Кекуле имеет существенные недостатки. Допуская,
- 22. Особенности бензольной связиОдна из электронных пар двойной
- 23. Слайд 23
- 24. Плотность облаков π-электронов в бензоле равномерно распределена
- 25. Гомологи бензола.Гомологический ряд бензола имеет общую формулу
- 26. Слайд 26
- 27. Слайд 27
- 28. Гетероциклическиминазывают соединения с замкнутой цепью, включающие не только атомы углерода, но и атомы других элементов.
- 29. Одно и многоатомные спирты. Простые эфиры. Лекция 5
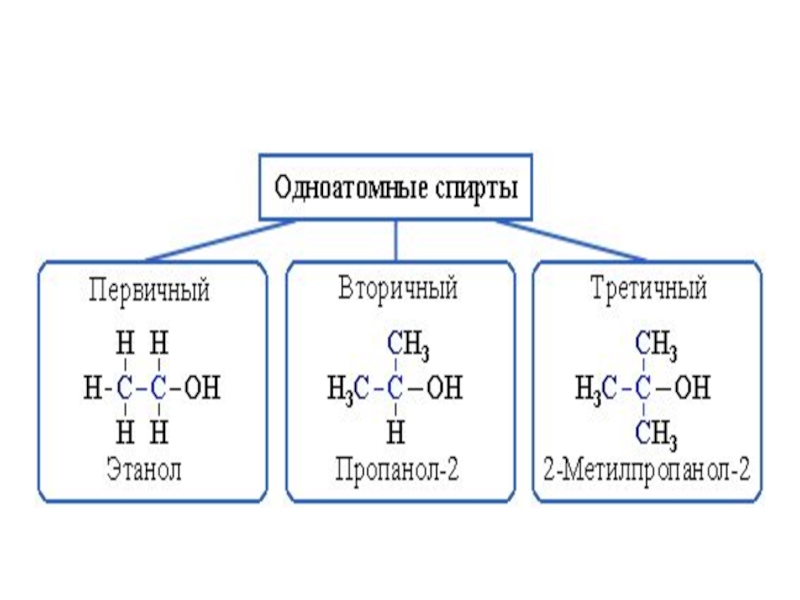
- 30. Одноатомные спирты.
- 31. Слайд 31
- 32. Слайд 32
- 33. Слайд 33
- 34. Изомерия предельных одноатомных спиртовобусловлена изомерией углеродного скелета
- 35. В спиртах имеет место ассоциация молекул друг с другом за счет образования водородной связи.
- 36. Физические свойстваСпирты легче воды: их плотности меньше
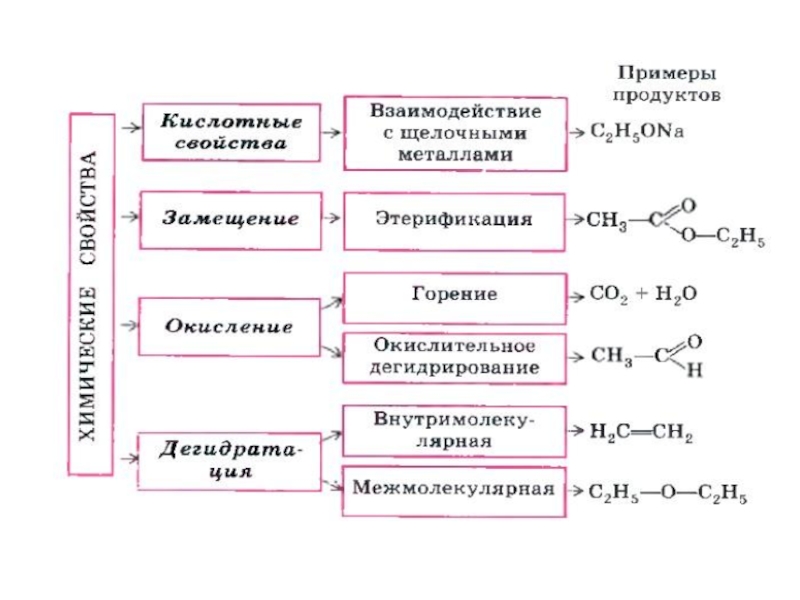
- 37. Химические свойстваСпирты реагируют со щелочными металлами (Na, K и т.д.) с образованием алкоголятов
- 38. Слайд 38
- 39. Слайд 39
- 40. Многоатомные спирты.Двухатомные спирты называются гликолями, трехатомные –
- 41. Слайд 41
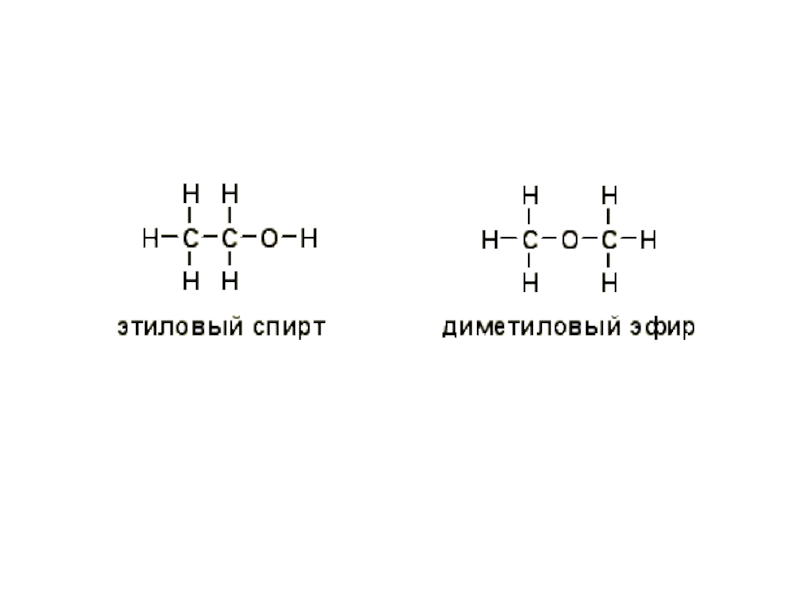
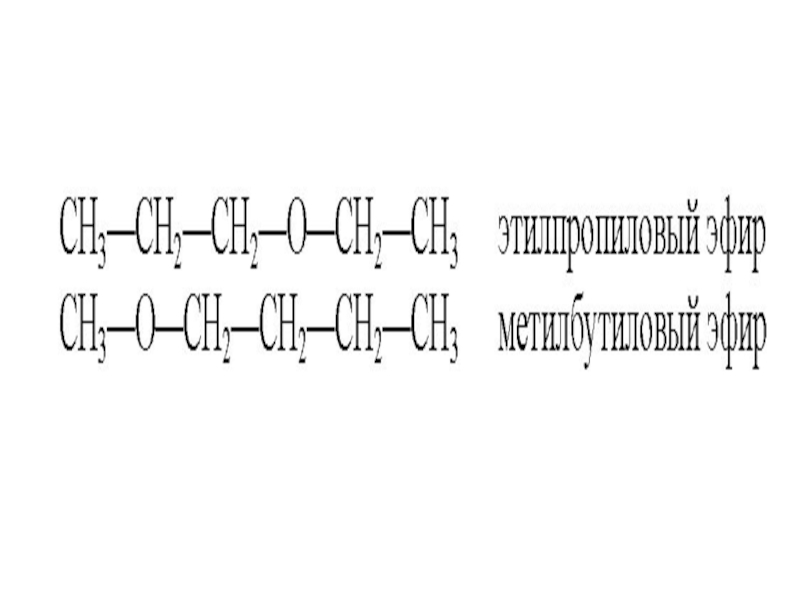
- 42. Простые эфиры Простыми эфирами называют производные спиртов,
- 43. Слайд 43
- 44. Слайд 44
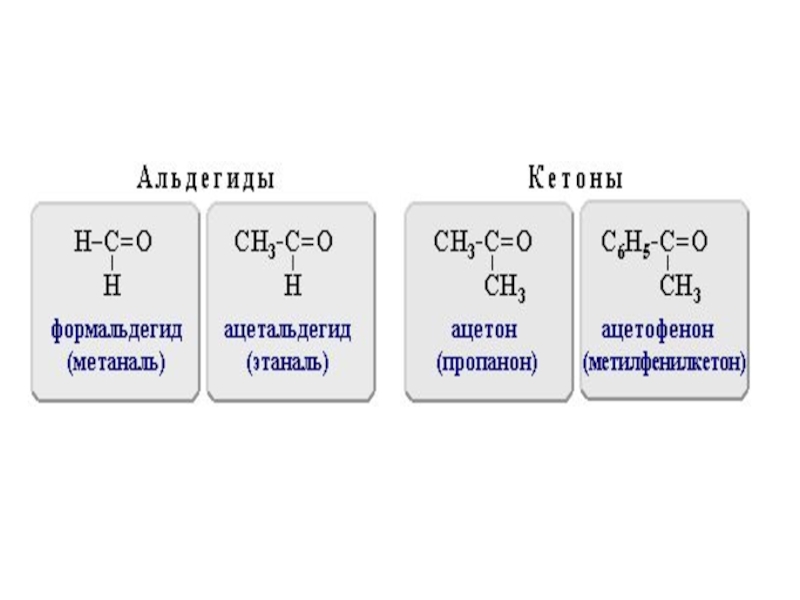
- 45. АЛЬДЕГИДЫ И КЕТОНЫпредставляют собой производные углеводородов, в
- 46. Альдегидами называют соединения с карбонильной группой, в
- 47. Характерное для альдегидов сочетание карбонильной группы с
- 48. Слайд 48
- 49. По международной заместительной номенклатуре названия альдегидов производят
- 50. В соответствии с этим по заместительной номенклатуре
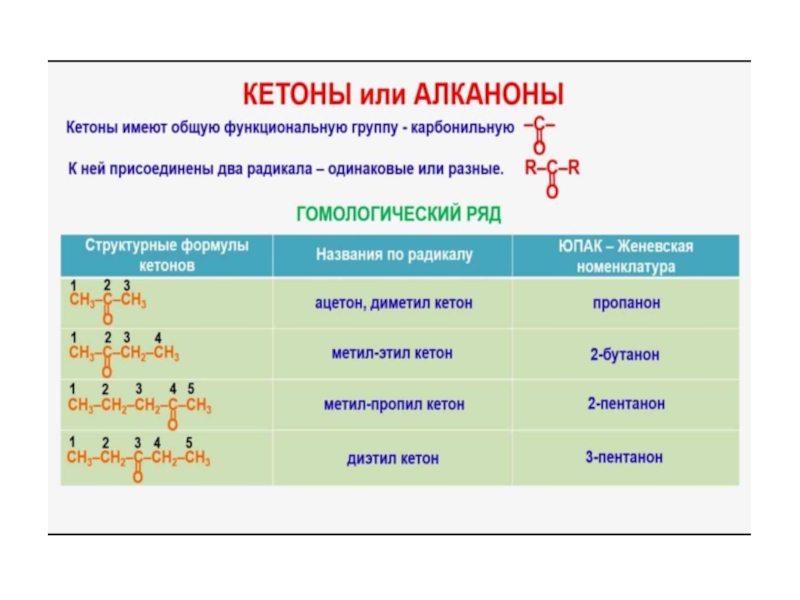
- 51. Номенклатура и изомерия кетонов По международной радикально-функциональной
- 52. Слайд 52
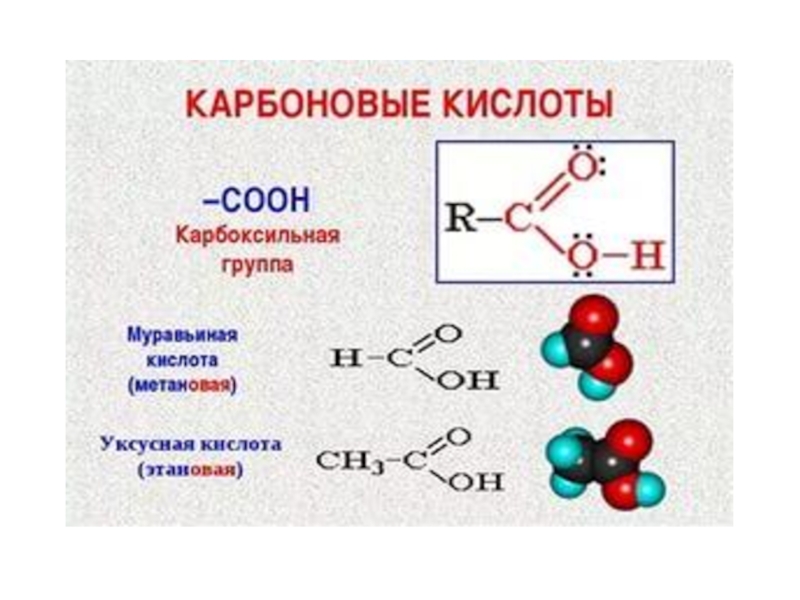
- 53. Карбоновые кислотыВ этой сложной функциональной группе соединены
- 54. Водород гидроксильной группы, входящей в карбоксильную группу,
- 55. Насыщенные одноосновные кислоты Насыщенные кислоты являются производными
- 56. Строение, изомерия, номенклатура В строении и изомерии
- 57. Для простейших кислот широко используются тривиальные названия,
- 58. Слайд 58
- 59. Слайд 59
- 60. Скачать презентанцию
все органические соединения подразделяются на :соединения с открытой цепью атомов (алифатические) ициклические соединения.Циклические соединения характерны наличием в их молекулах циклов.Цикл – это замкнутая цепь, т. е. такая цепь, которая, начавшись в
Слайды и текст этой презентации
Слайд 2все органические соединения
подразделяются на :
соединения с открытой цепью атомов
(алифатические) и
– это замкнутая цепь, т. е. такая цепь, которая, начавшись в некоторой вершине, завершается в ней жеСлайд 4Циклические соединения
подразделяются на:
Карбоциклические соединения
алициклические соединения
ароматические соединения.
Гетероциклические соединения.
Слайд 7Карбоциклические соединения – это соединения, в молекулах которых присутствуют циклы,
состоящие только из атомов углерода.
Помимо связи друг с другом, атомы
углерода также связаны и с другими атомами (водородом, кислородом и т.д), но сам цикл составлен именно из атомов углерода.Слайд 8Гетероциклические соединения - это циклические соединения, в циклах которых помимо
атомов углерода, присутствуют атомы других элементов (кислорода, азота, серы и
др.). И это тоже отражено в их названии (от греч. ετερος — «иной», «различный»).Слайд 9Карбоциклические соединения
разделяют на
алициклические
ароматические.
Алициклические соединения называют так потому, что
по химическим свойствам они наиболее близки к алифатическим соединениям, хотя
по структуре они и являются кольцеобразными.Слайд 10Они различаются по числу атомов углерода в цикле и, в
зависимости от характера связи между этими атомами, могут быть предельными
и непредельными.В молекулах предельных циклические углеводородов атомы угерода соединены простыми связями, как и в молекулах предельных углеводородов с открытой цепью, что делает их сходными по свойствам с последними.
Слайд 11Названия циклических соединений строятся подобно наименованиям соединений жирного (алифатического) ряда
с добавлением приставки «цикло».
Слайд 12Ароматическими соединениями обычно называют карбоциклические соединения, в молекулах которых имеется
особая циклическая группировка из шести углеродных атомов – бензольное ядро.
Простейшим веществом, содержащим такую группировку, является углеводород бензол; все остальные ароматические соединения этого типа рассматривают как производные бензола.Слайд 14Благодаря наличию в ароматических соединениях бензольного ядра они по некоторым
свойствам значительно отличаются от предельных и непредельных алициклических соединений, а
также и от соединений с открытой цепью. Отличительные свойства ароматических веществ, обусловленные наличием в них бензольного ядра, обычно называют ароматическими свойствами, а бензольное ядро – соответственно ароматическим ядром.Слайд 15Ароматические углеводороды ряда бензола
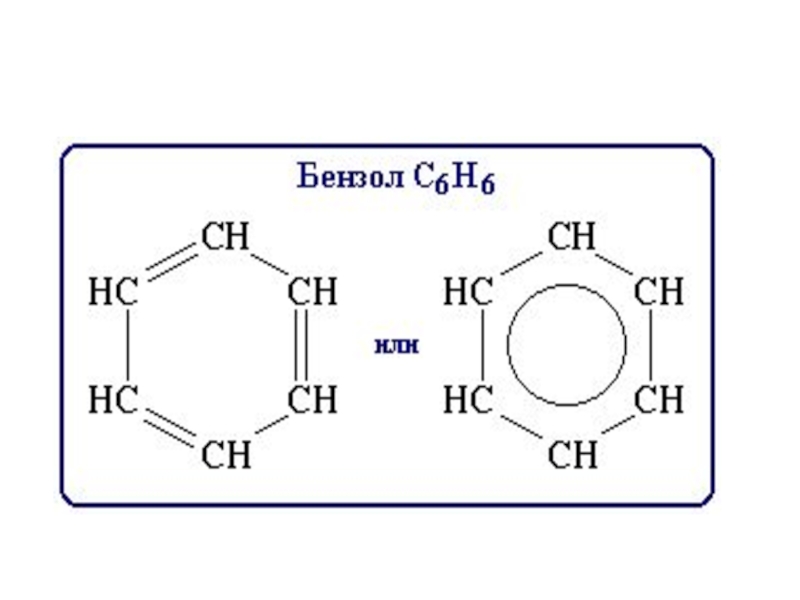
Первый представитель ароматических углеводородов – бензол –
имеет состав C6H6 .
Это вещество было открыто М.Фарадеем в
1825 г. в жидкости, образующейся при сжатии или охлаждении т.н. светильного газа, который получается при сухой перегонке каменного угля. Впоследствии бензол обнаружили (А.Гофман, 1845г.) в другом продукте сухой перегонки каменного угля – в каменноугольной смоле. Он оказался весьма ценным веществом и нашел широкое применение. Затем было установлено, что очень многие органические соединения являются производными бензола.Слайд 16Строение бензола
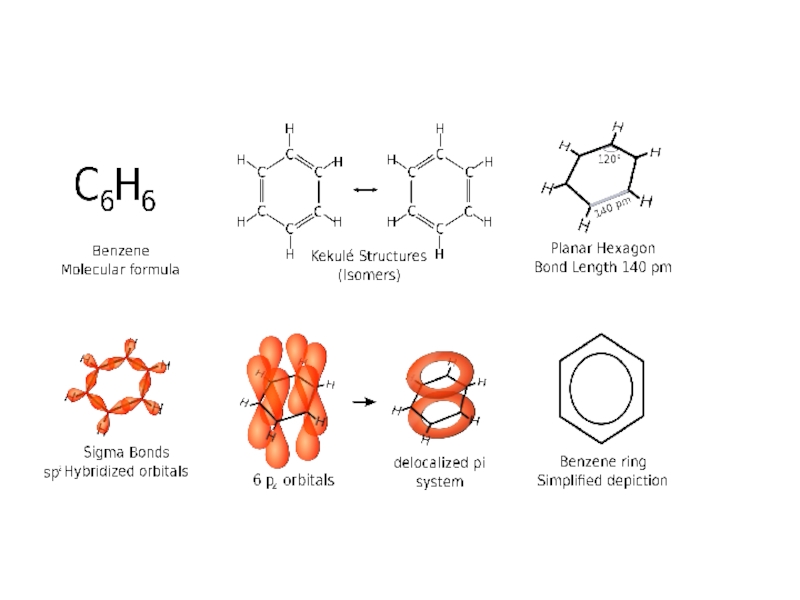
Долгое время оставался неясным вопрос о химической природе и
о строении бензола. Казалось бы, что он представляет собой сильно
непредельное соединение. Ведь его состав C6H6 по соотношению атомов углерода и водорода отвечает формуле CnH2n-6, тогда как соответствующий по числу углеродных атомов предельный углеводород гексан имеет состав C6H14 и отвечает формуле CnH2n+2.Однако бензол не дает характерных для непредельных соединений реакций; он, например, не обеспечивает бромной воды и раствора KMnO4, т.е. в обычных условиях не склонен к реакциям присоединения, не окисляется. Напротив, бензол в присутствии катализаторов вступает в характерные для предельных углеводородов реакции замещения, например, с галогенами:
Слайд 17Выяснилось все же, что в определенных условиях бензол может вступать
и в реакции присоединения. Там, в присутствии катализаторов он гидрируется,
присоединяя 6 атомов водородаСлайд 18было установлено, что однозамещенные производные бензола C6H5X не имеют изомеров.
Это показало, что все водородные и все углеродные атомы в
его молекуле по своему положению равноценны, что также долго не находило объясненияСлайд 19Впервые формулу строения бензола предложил в 1865г. немецкий химик Август
Кекуле. Он высказал предложение, что
6 углеродных атомов в бензоле
образуют цикл, соединяясь друг с другом чередующимися простыми и двойными связями, и, кроме того, каждый из них соединен с одним атомом водорода Слайд 20Формула Кекуле
получила широкое распространение. Она согласуется с представлениями о четырехвалентности
углерода, объясняет равноценность водородных атомов в бензоле.
Наличие в последнем
шестичленного цикла доказано; в частности, оно подтверждено тем, что при гидрировании бензол образует циклогексан, в свою очередь циклогексан путем дегидрирования превращается в бензол.Слайд 21Однако формула Кекуле имеет существенные недостатки. Допуская, что в бензоле
имеются три двойных связи, она не может объяснить, почему бензол
в таком случае с трудом вступает в реакции присоединения, устойчив к действию окислителей, т.е. не проявляет свойств непредельных соединений.Исследование бензола с применением новейших методов указывает на то, что в его молекуле между углеродными атомами нет ни обычных простых, ни обычных двойных связей.
6 атомов углерода в бензоле, образующие цикл, лежат в одной плоскости в вершинах правильного шестиугольника и центры их находятся на равных расстояниях друг от друга
Слайд 22Особенности бензольной связи
Одна из электронных пар двойной связи находится в
таком же состоянии, как пара электронов, осуществляющая простую связь (-связь).
Вторая же электронная пара осуществляет связь особого характера (π-связь).В соответствии с формулой Кекуле в бензоле должны быть три π-связи. На самом же деле в бензоле нет обычных пар π-электронов фиксированных между двумя определенными С-атомами
В шестичленном цикле бензола все простые связи С-С и С-Н (-связи) лежат в одной плоскости. Облака π-электронов всех С-атомов, имеющие форму объемных восьмерок, направлены перпендикулярно плоскости бензольного кольца. Каждое из таких облаков перекрывается облаками двух соседних углеродных атомов.
Слайд 24Плотность облаков π-электронов в бензоле равномерно распределена между всеми С-С-связями.
Следовательно, π-электроны обобщены всеми углеродными атомами кольца, образуя единое кольцевое
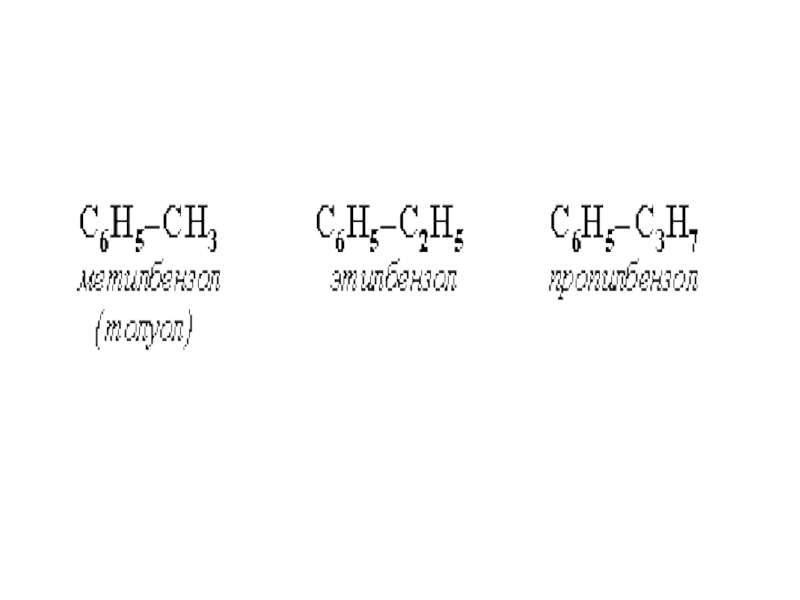
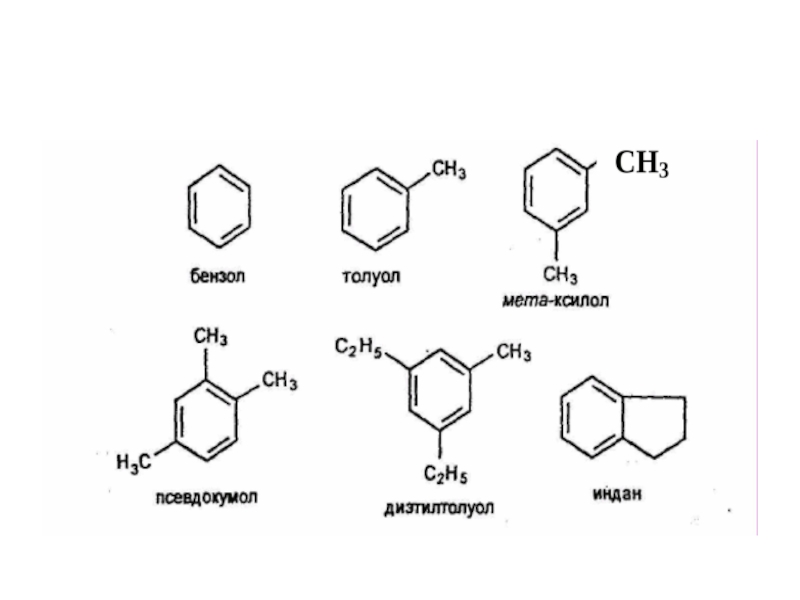
облако шести электронов (ароматический электронный секстет). Таким образом объясняется равноценность (выравненность) ароматических связей, придающих бензольному ядру характерные (ароматические) свойства.Слайд 25Гомологи бензола.
Гомологический ряд бензола имеет общую формулу СnН2n-6.
Гомологи можно
рассматривать как производные бензола, в котором один или несколько атомов
водорода замещены различными углеводородными радикалами. Например, С6Н5-СН3 - метилбензол или толуол, С6Н4(СН3)2 - диметилбензол или ксилол, С6Н5—С2Н5 - этилбензол.Слайд 28Гетероциклическими
называют соединения с замкнутой цепью, включающие не только атомы углерода,
но и атомы других элементов.
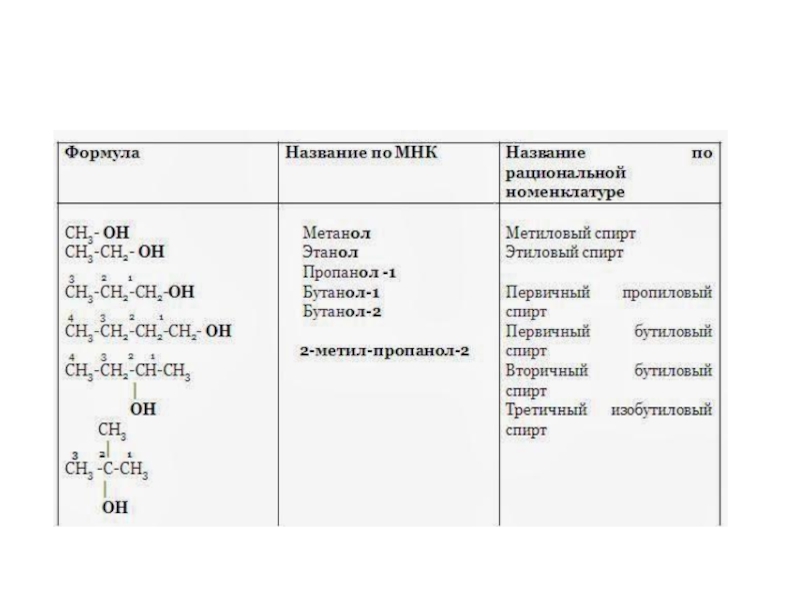
Слайд 30Одноатомные спирты.
Спиртами называются производные углеводородов, представляющие собой продукты замещения атома (атомов) водорода в углеводородной молекуле гидроксильной группой –ОН.
В зависимости от того, какое количество атомов водорода замещено, спирты бывают одноатомными и многоатомными. Т.е. число групп –ОН в молекуле спирта характеризует атомность последнего.
Наибольшее значение имеют предельные одноатомные спирты. Состав членов ряда предельных одноатомных спиртов может быть выражен общей формулой — СnH2n+1ОН или R-OH.
Слайд 34Изомерия предельных одноатомных спиртов
обусловлена изомерией углеродного скелета и изомерией положения
ОН- группы. Метиловый и этиловый спирты не имеют изомеров. В
зависимости от положения гидроксильной группы при первичном, вторичном или третичном углеродном атоме спирты могут быть первичными, вторичными, третичнымиСлайд 35В спиртах имеет место ассоциация молекул друг с другом за
счет образования водородной связи.
Слайд 36Физические свойства
Спирты легче воды: их плотности меньше 1. Метиловый, этиловый
и пропиловый спирты смешиваются с водой во всех соотношениях. По
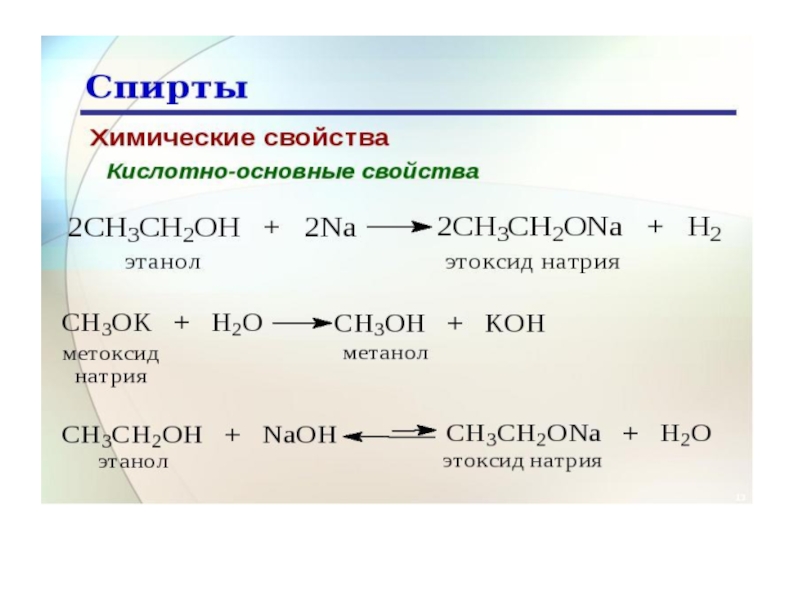
мере усложнения углеводородных радикалов растворимость спиртов резко падает. Бутиловый спирт растворяется частично. Высшие спирты в воде не растворяются, т.е. выталкиваются из воды.Слайд 37Химические свойства
Спирты реагируют со щелочными металлами (Na, K и т.д.)
с образованием алкоголятов
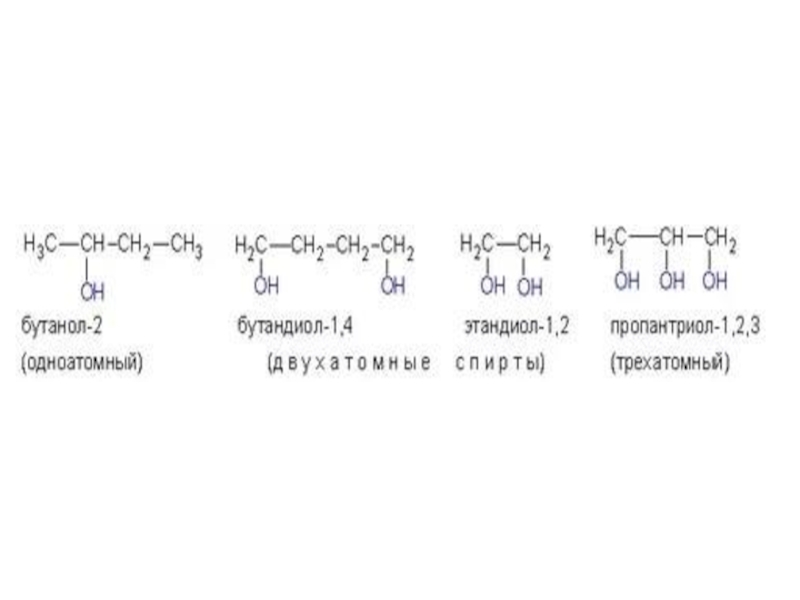
Слайд 40Многоатомные спирты.
Двухатомные спирты называются гликолями, трехатомные – глицеринами.
По международной
заместительной номенклатуре двухатомные спирты называются алкандиолами, трехатомные – алкантриолами.
Спирты
с двумя гидроксилами при одном углеродном атоме обычно в свободном виде не существуют; при попытках получить их они разлагаются, выделяя воду и превращаясь в соединение с карбонильной группой – альдегиды или кетоныСлайд 42Простые эфиры
Простыми эфирами называют производные спиртов, образованные в результате замещения
водорода гидроксильной группы спирта на углеводородный остаток.
Слайд 45АЛЬДЕГИДЫ И КЕТОНЫ
представляют собой производные углеводородов, в молекулах которых имеется
карбонильная группа, называемая также карбонилом, >С=О.
Слайд 46Альдегидами называют соединения с карбонильной группой, в которых атом углерода
этой группы связан, по крайней мере, с одним атомом водорода.
Кетонами называют карбонилсоединения, в которых углерод карбонильной группы связан с двумя углеводородными остатками.
Слайд 47Характерное для альдегидов сочетание карбонильной группы с водородом, называют
альдегидной группой
карбонильную группу кетонов – кетогруппой.
По международной
номенклатуре карбонильная группа называется также оксогруппой, а альдегиды и кетоны – соответственно оксосоединениями. Общая формула СnH2nO.Слайд 49По международной заместительной номенклатуре
названия альдегидов производят от заместительных названий
соответствующих по углеродному скелету углеводородов, добавляя окончание – аль. Выбирая
в формуле наиболее длинную (главную) углеродную цепь, в нее включают альдегидный углерод. Нумерацию цепи начинают с альдегидного углерода; при этом, поскольку альдегидная группа всегда находится при первичном углеродеи, следовательно, в начале цепи, цифру 1, относящуюся к альдегидной группе, перед названием основы можно и не ставить.
Слайд 50В соответствии с этим по заместительной номенклатуре название муравьиного альдегида
– метаналь, уксусного – этаналь, н-валерианового (I) – пентаналь, изовалерианового
(II) – 3-метил-1-бутаналь, или просто 3-метилбутаналь, а его изомера (III) – 2-метилбутаналь.Слайд 51Номенклатура и изомерия кетонов
По международной радикально-функциональной номенклатуре названия кетонов, производят
из названий радикалов, соединенных с карбонильной группой, и от окончания
– кетон.Диметилкетон, или, как его обычно называют (тривиальное название), ацетон, является простейшим кетоном.
Слайд 53Карбоновые кислоты
В этой сложной функциональной группе соединены друг с другом
две простые кислородсодержащие группы: карбонильная СО и гидроксильная (или окси
группа) –ОН; отсюда и происходит название – карбоксильная группа.Слайд 54Водород гидроксильной группы, входящей в карбоксильную группу, обуславливает кислотные свойства
карбоновых кислот; поэтому число карбоксильных групп характеризует основность кислоты. В
молекулах одноосновных (монокарбоновых) кислот – одна карбоксильная группа, двухосновных (дикарбоновых) кислот – две карбоксильные группы.Слайд 55Насыщенные одноосновные кислоты
Насыщенные кислоты являются производными насыщенных углеводородов. Высшие гомологи
этих кислот впервые были выделены из природных жиров, поэтому их,
а затем и все другие кислоты с открытой целью углеродных атомов назвали жирными кислотами.Слайд 56Строение, изомерия, номенклатура
В строении и изомерии предельных одноосновных кислот наблюдается
определенная аналогия со строением и изомерией альдегидов. Карбоксильная группа, как
и альдегидная, может быть образована лишь первичным углеродным атомом.Слайд 57Для простейших кислот широко используются тривиальные названия, происходящие от названий
природных продуктов, из которых та или иная кислота была впервые
получена.Простейший представитель гомологического ряда насыщенных одноосновных кислот – муравьиная кислота, она была впервые обнаружена в выделениях муравьев, откуда и происходит ее название.