Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основные понятия химии
Содержание
- 1. Основные понятия химии
- 2. Химия – это наука о составе, строении,
- 3. Молекула – это отдельная электронейтральная частица, образующаяся
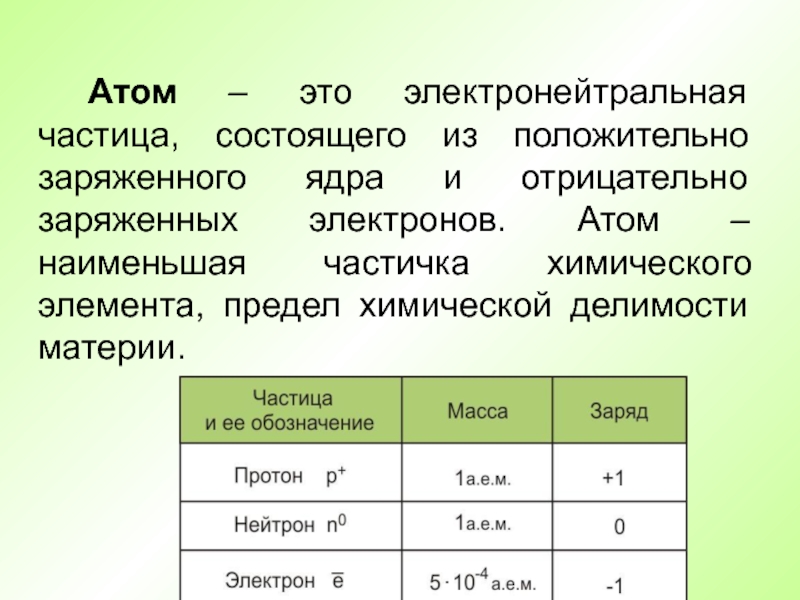
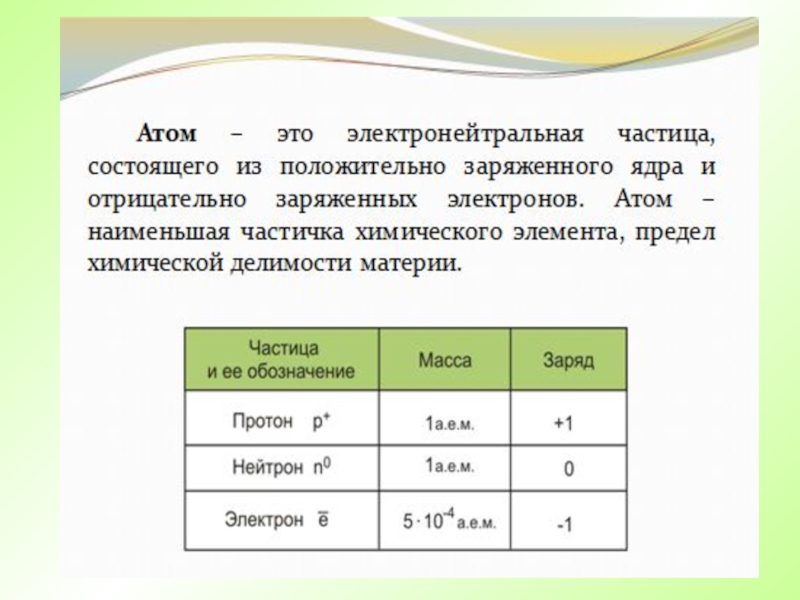
- 4. Атом – это электронейтральная частица, состоящего из
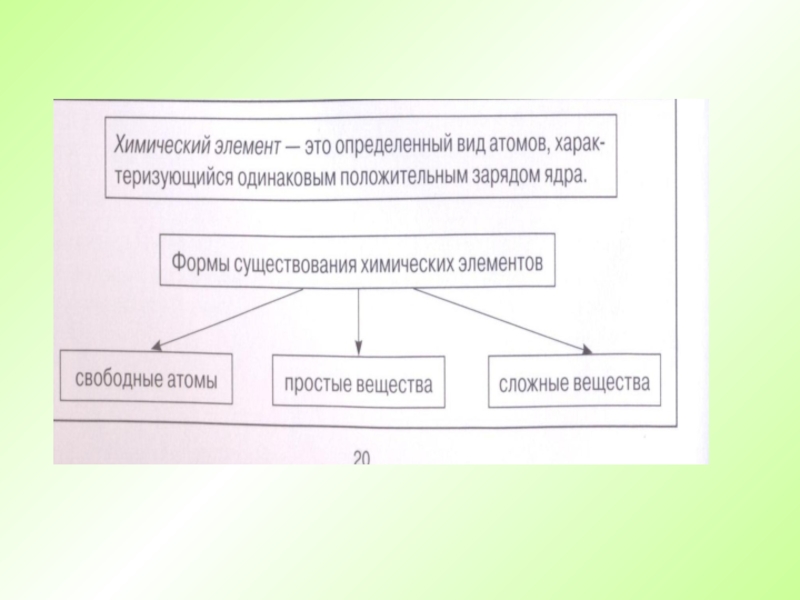
- 5. Химический элемент – это совокупность атомов с
- 6. Состав веществ. Изменение веществ.
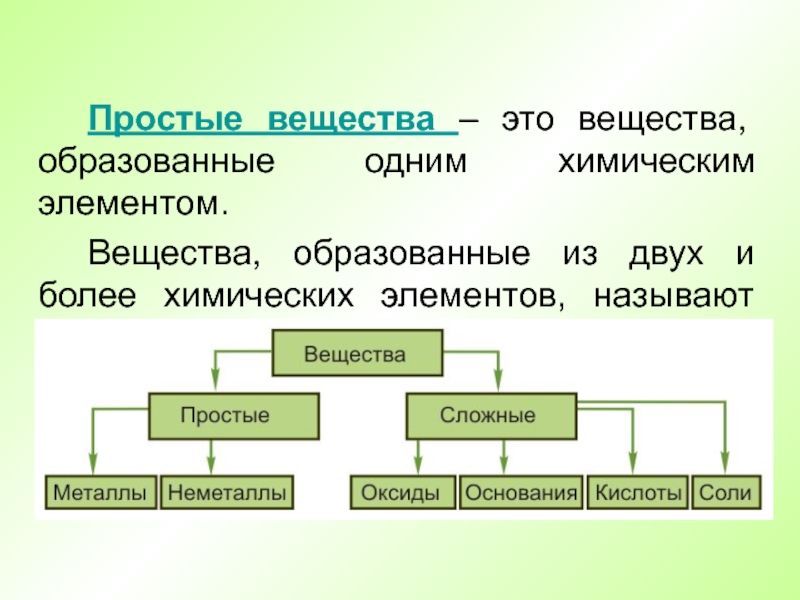
- 7. Простые вещества – это вещества, образованные одним
- 8. Различают в качественный и количественный состав веществ. Качественный
- 9. Состав веществ отображают посредством химической символики. По предложению
- 10. Химический знак (символ) – несет значительную информацию.
- 11. Химическая формула – это способ отображения химического
- 12. Строениеатома
- 13. Маленькая точка, сделанная карандашом, состоит из огромного количества атомов, большего, чем количество жителей на Земле !
- 14. ДемокритВ основе философии Демокрита лежит учение об
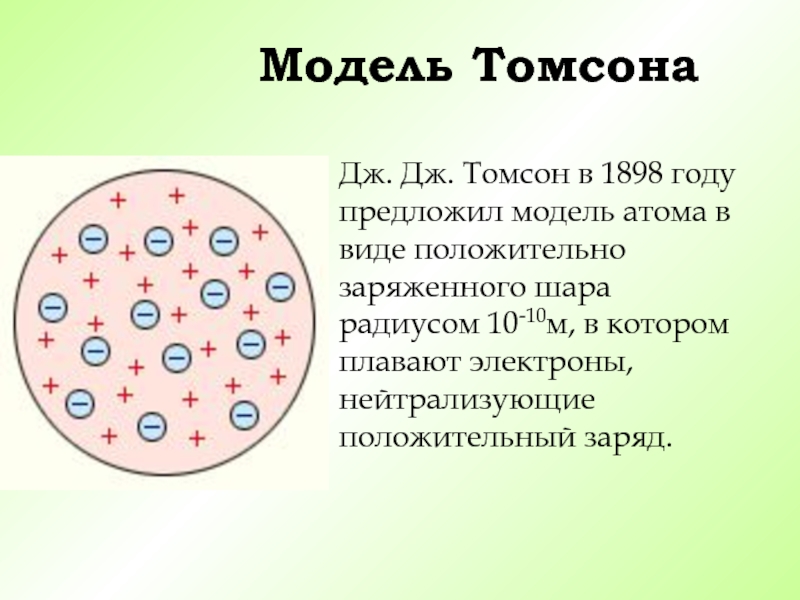
- 15. Модель ТомсонаДж. Дж. Томсон в 1898 году
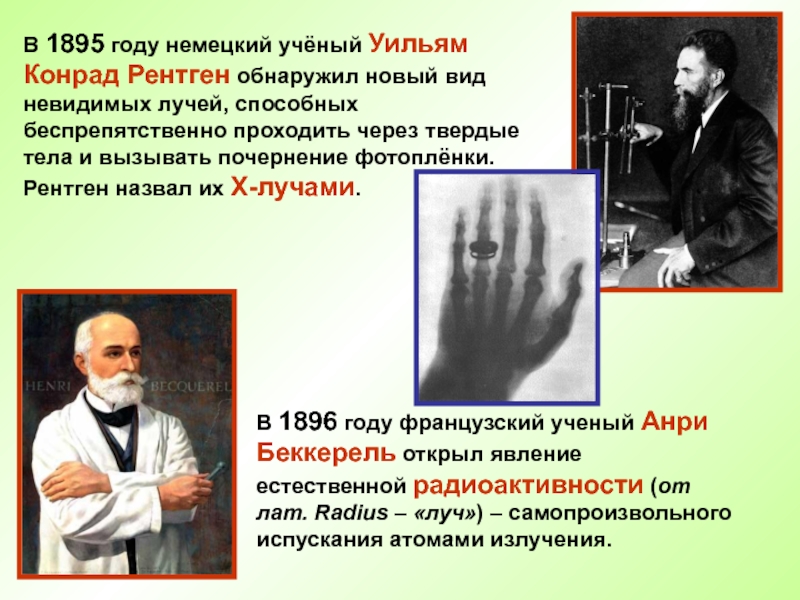
- 16. В 1895 году немецкий учёный Уильям Конрад
- 17. В 1898 году Пьер Кюри и Мария
- 18. Английский физик Эрнест Резерфорд в 1909 г.
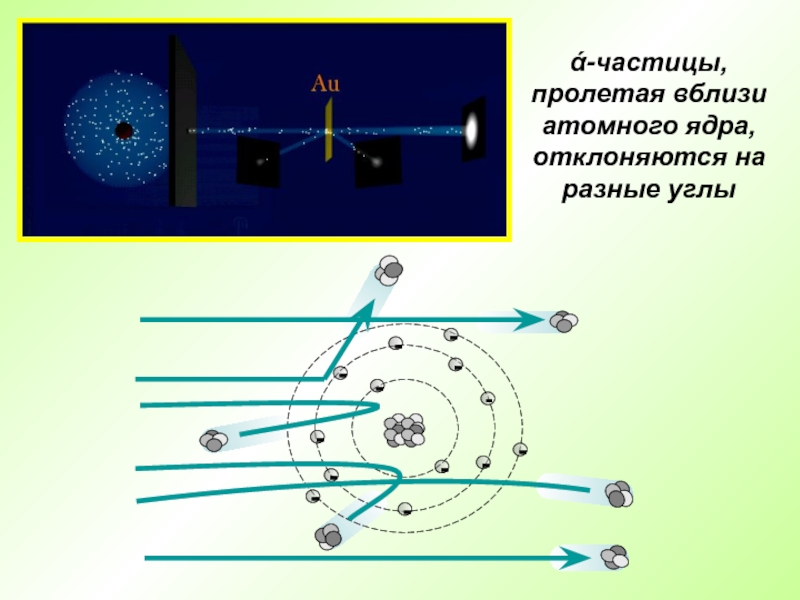
- 19. ά-частицы, пролетая вблизи атомного ядра, отклоняются на разные углы
- 20. Э. Резерфорд предложил планетарную модель атома: в
- 21. Родители атома.Демокрит(460 до н. э. — 370
- 22. М.В. Ломоносов (1711-1765 гг.)Материя состоит из мельчайших
- 23. Слайд 23
- 24. Слайд 24
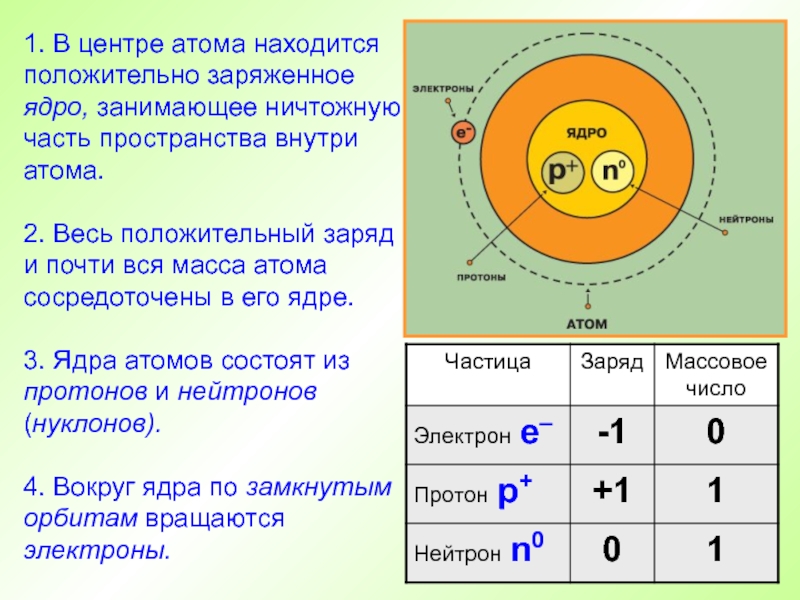
- 25. 1. В центре атома находится положительно заряженное
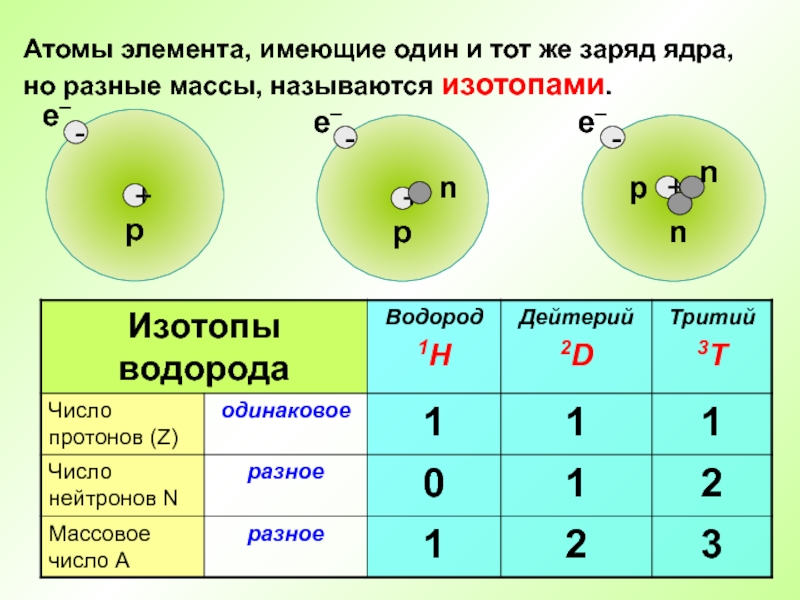
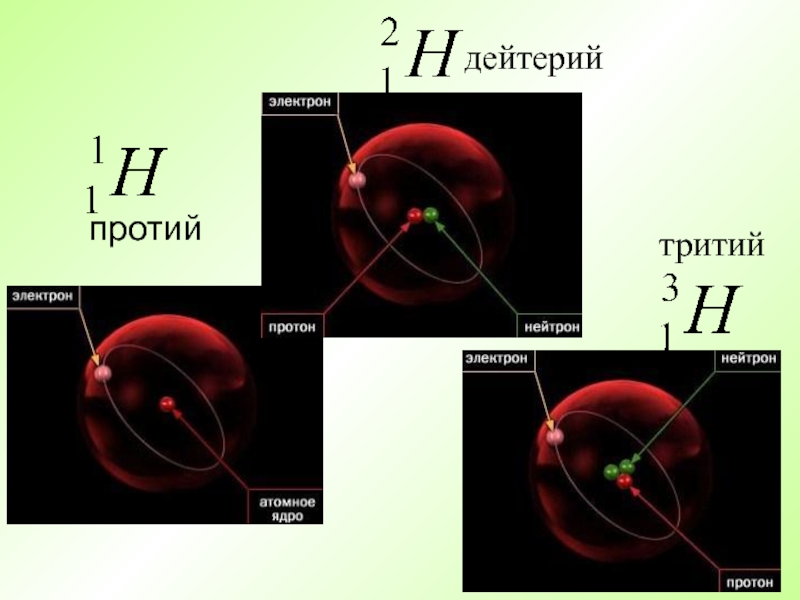
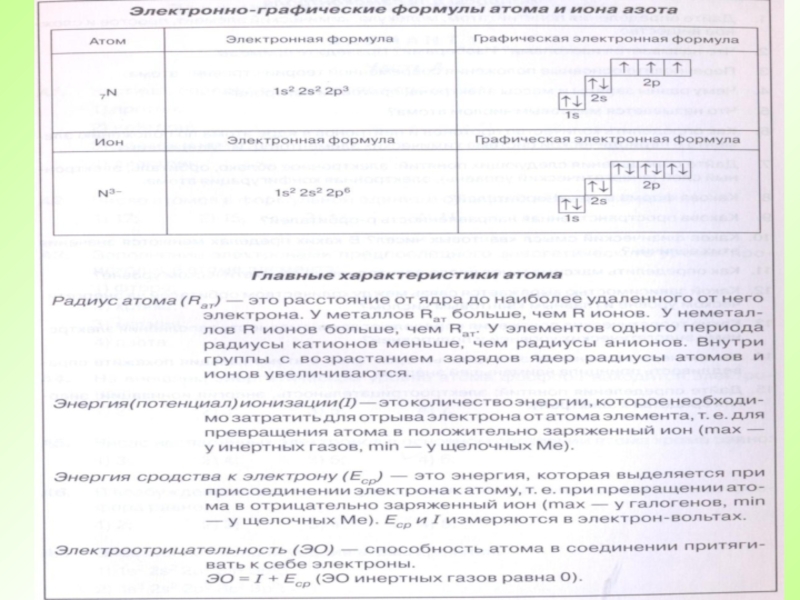
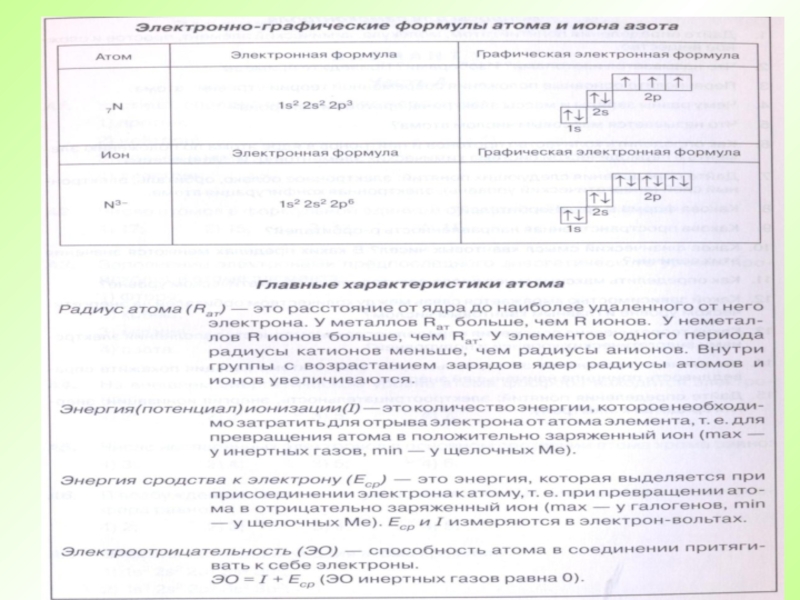
- 26. Атомы элемента, имеющие один и тот же заряд ядра, но разные массы, называются изотопами.
- 27. протий дейтерийтритий
- 28. Во атомах одного химического элемента число протонов
- 29. Атом – электронейтральная частицаЧисло протонов (заряд ядра)Атомный номер (Z)Число электронов=Число нейтронов Число протонов+Массовое число (А)
- 30. Слайд 30
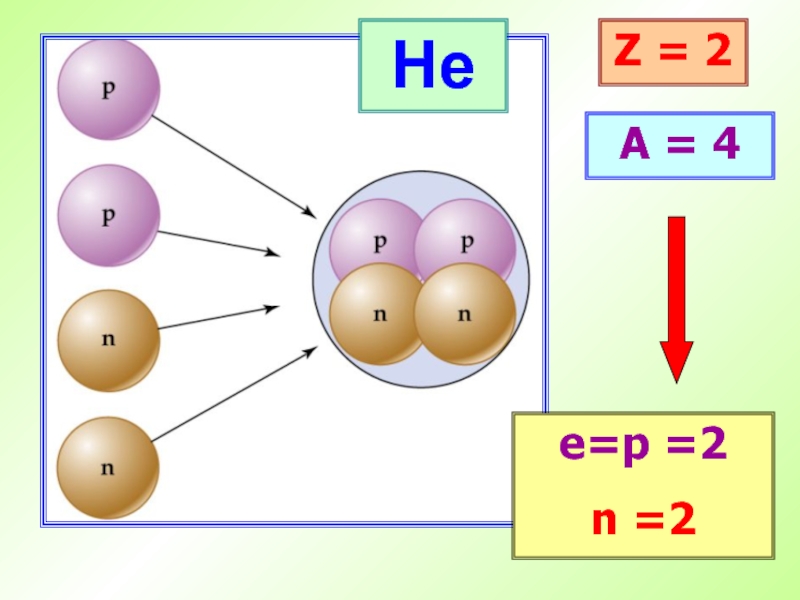
- 31. HeZ = 2A = 4е=p =2n =2
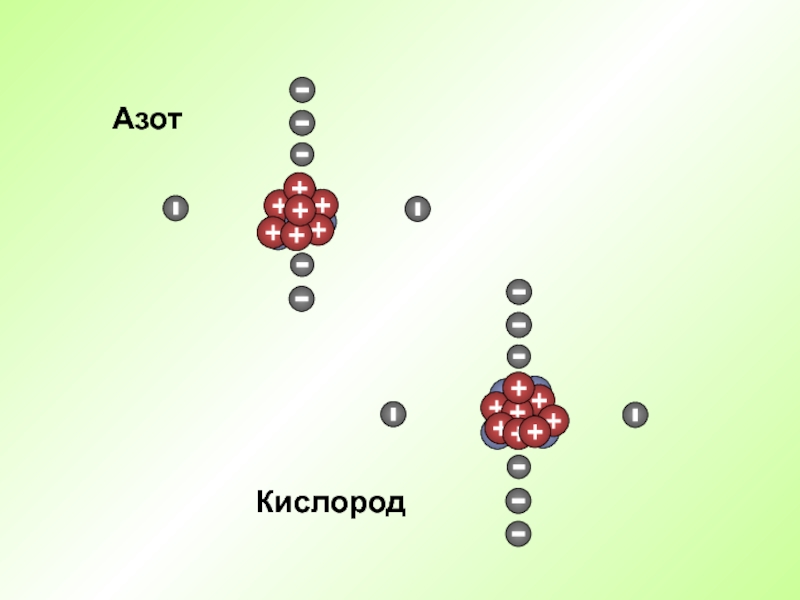
- 32. КислородАзот
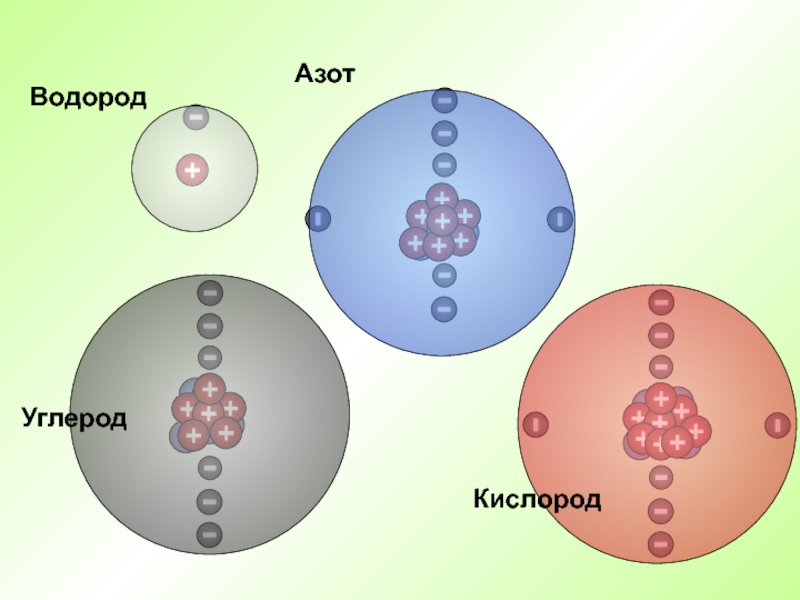
- 33. ВодородАзотКислородУглерод
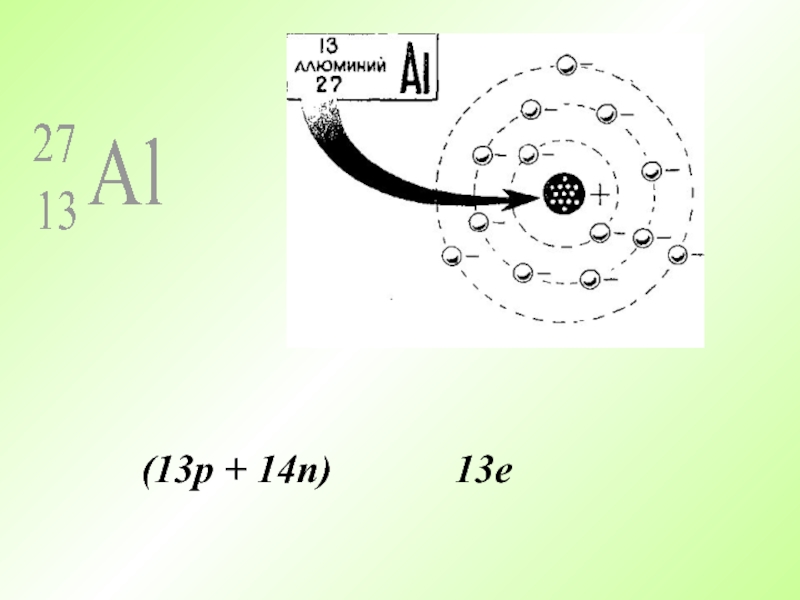
- 34. (13p + 14n) 13e
- 35. Слайд 35
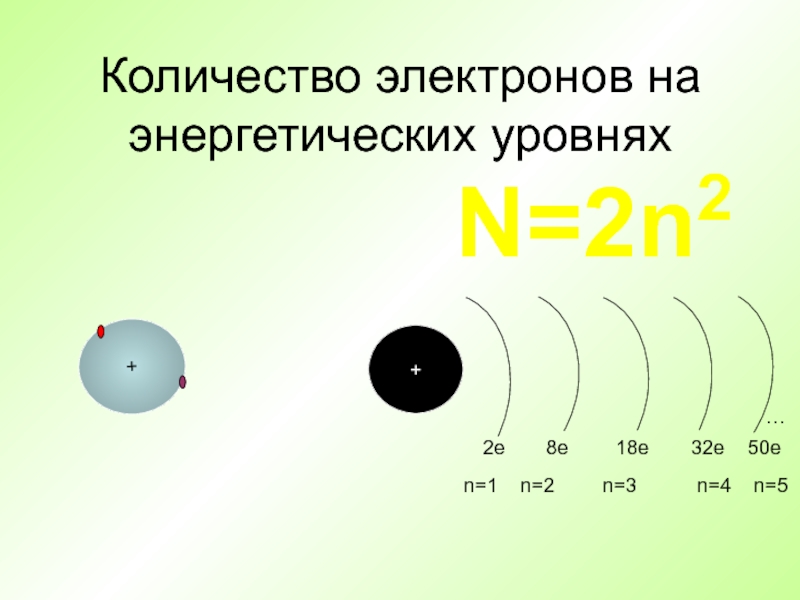
- 36. Количество электронов на энергетических уровнях++…2e8e18е32е50еn=1n=2n=3n=4n=5N=2n2
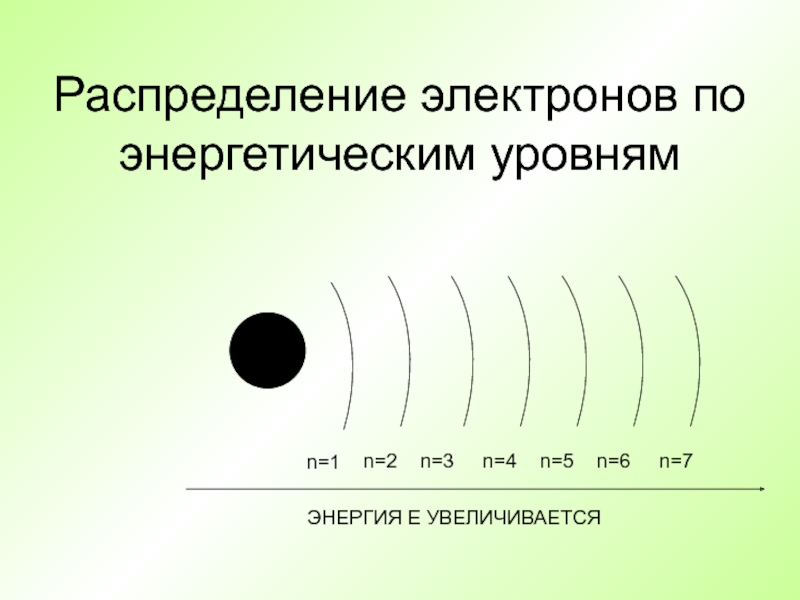
- 37. Распределение электронов по энергетическим уровням+n=1n=2n=3n=4n=5n=6n=7ЭНЕРГИЯ Е УВЕЛИЧИВАЕТСЯ
- 38. Слайд 38
- 39. Слайд 39
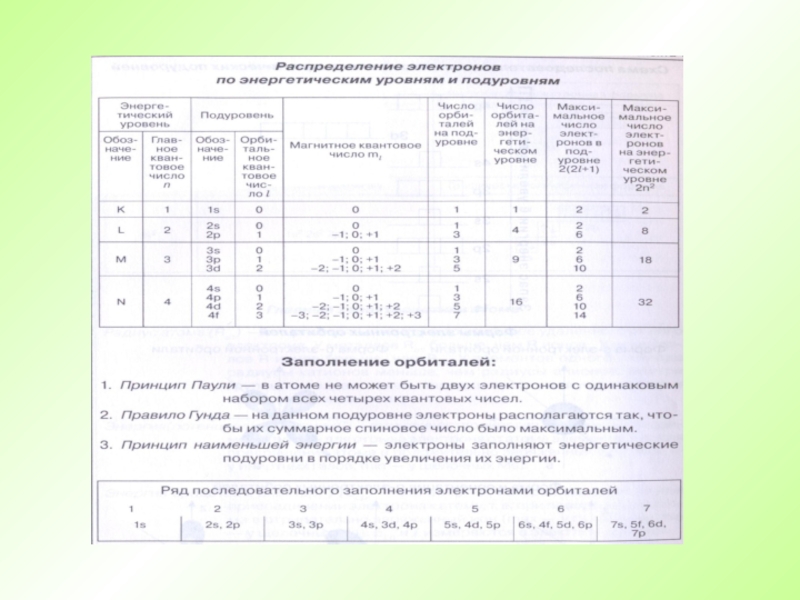
- 40. Правила для составления электронно-графической схемыКаждый уровень (новая
- 41. Слайд 41
- 42. Слайд 42
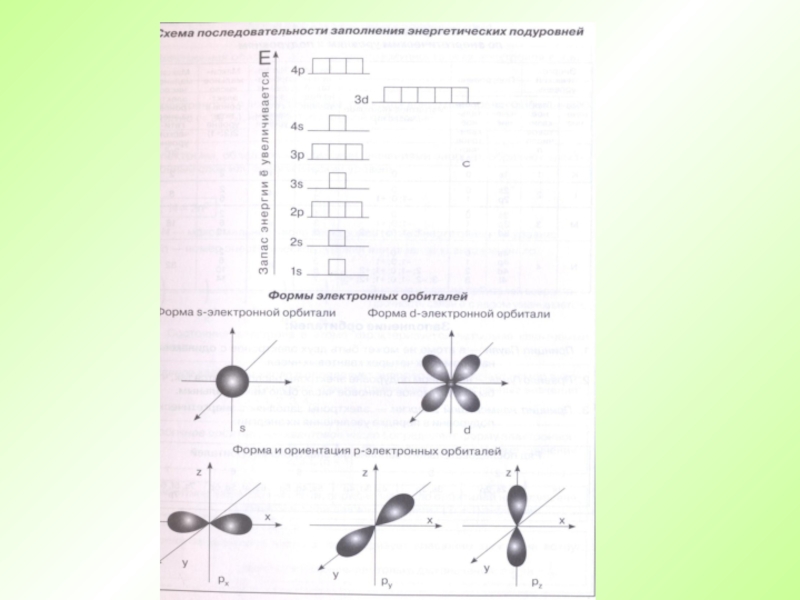
- 43. Порядок заполнения орбиталей электронамиVII – 7s5f6d7p
- 44. p+ =1 ē = 1 n0 = 0 11s1Е1sЭнергетическая диаграммаОрбитальЭлектронЭлектронная формулаЭнергетические уровни
- 45. p+ =2 ē = 2 n0 = 2 21s2Е1sЭлектроны с разными спинами
- 46. p+ =3 ē = 3 n0 = 4 21s2Е1s12s2s1
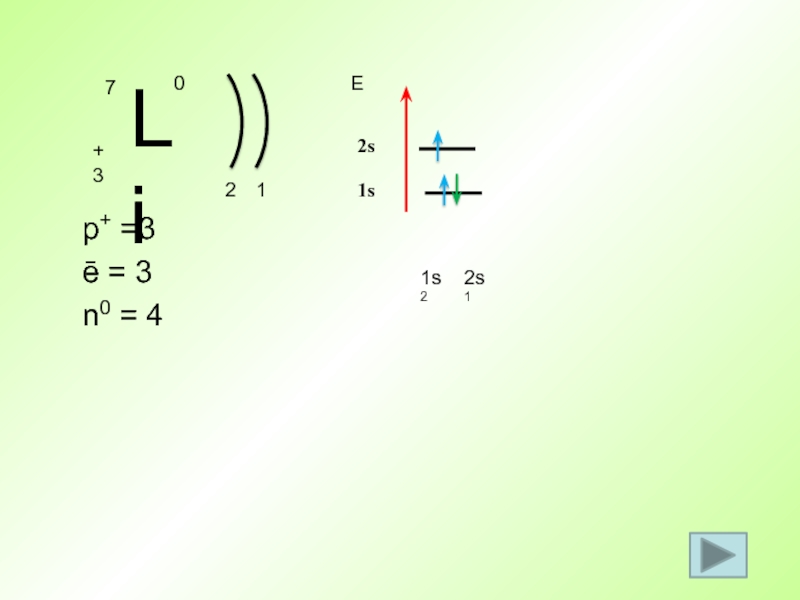
- 47. p+ =7 ē =7 n0 = 7 21s2Е1s52s2s22p2p3
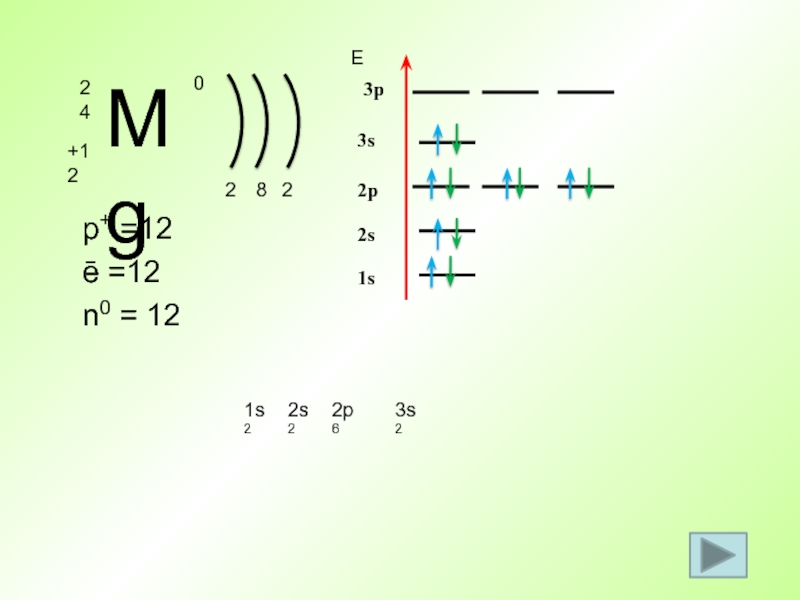
- 48. p+ =12 ē =12 n0 = 12 21s2Е1s82s2s22p2p623s3p3s2
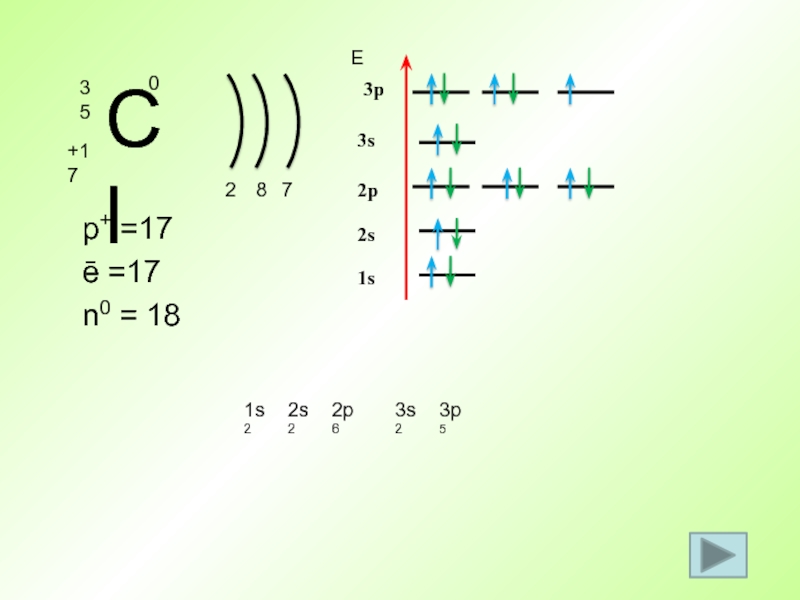
- 49. p+ =17 ē =17 n0 = 18 21s2Е1s82s2s22p2p673s3p3s23p5
- 50. Проверка знанийУстноПисьменноДалее:Электронная оболочка атома.
- 51. I. Строение электронной оболочкиЭлектронная оболочка атома.- Энергетический уровень состоит из подуровней.- Подуровень состоит из орбиталей.1s2s3s2р3р3d
- 52. I. Строение электронной оболочки- Подуровень состоит из
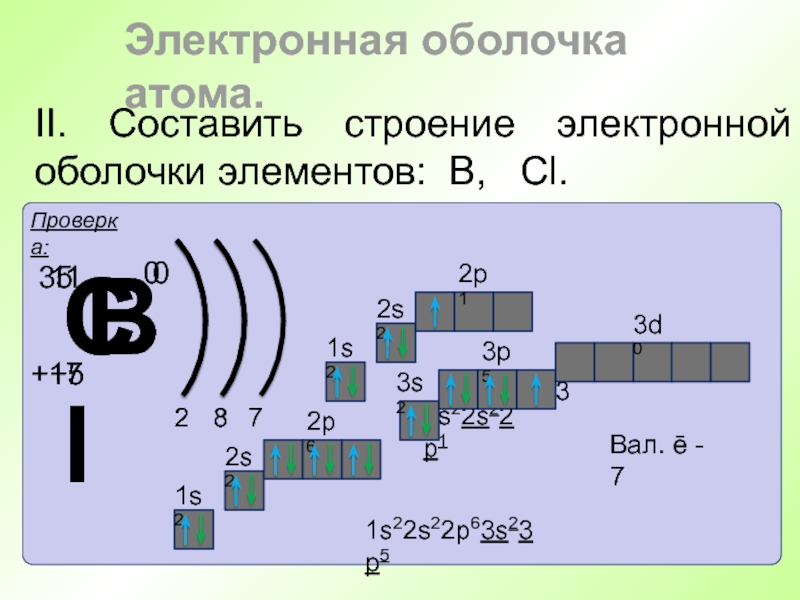
- 53. II. Составить строение электронной оболочки элементов: В, Cl. Электронная оболочка атома.
- 54. МОЛОДЦЫ !!!Вы справились. Желаю дальнейших успехов в изучении химии!
- 55. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2
Химия – это наука о составе, строении, свойствах и превращениях
веществ.
Это совокупность атомов, ионов или молекул, состоящих из одного или нескольких химических элементов.Слайд 3 Молекула – это отдельная электронейтральная частица, образующаяся при возникновении ковалентных
связей между атомами одного или нескольких элементов, которая определяет химические
свойства вещества.Слайд 4
Атом – это электронейтральная частица, состоящего из положительно заряженного ядра
и отрицательно заряженных электронов. Атом – наименьшая частичка химического элемента,
предел химической делимости материи.Слайд 5
Химический элемент – это совокупность атомов с одинаковым зарядом ядра.
Вещества,
образованные одним химическим элементом, называют простыми. Один и тот же
химический элемент может образовывать несколько простых веществ. Это явление называют аллотропией, а различные простые вещества, образованные одним элементом, - аллотропными видоизменениями, или аллотропными модификациями.Слайд 7 Простые вещества – это вещества, образованные одним химическим элементом.
Вещества, образованные
из двух и более химических элементов, называют сложными. Сложных веществ
гораздо больше, чем простых.Слайд 8
Различают в качественный и количественный состав веществ.
Качественный состав – это
совокупность химических элементов и (или) атомных группировок, составляющих данное химическое
вещество.Количественный состав – это показатели, характеризующие количество или число атомов того или иного химического элемента и (или) атомных группировок, образующих данное химическое вещество.
Слайд 9 Состав веществ отображают посредством химической символики.
По предложению Й. Я. Берцелиуса
элементы принято обозначать первой или первой и одной из последующих
букв латинских названий элементов.Слайд 10 Химический знак (символ) – несет значительную информацию. Он обозначает название
элемента, один его атом, один моль атомов этого элемента. По
символу химического элемента можно определить его атомный номер и относительную атомную массу.Слайд 11 Химическая формула – это способ отображения химического состава вещества. Она
обозначает название вещества, одну молекулу его, один моль этого вещества.
По химической формуле можно определить качественный состав вещества, число атомов и количество вещества каждого элемента в одном моле вещества, его относительную молекулярную и молярную массу.Слайд 13Маленькая точка, сделанная карандашом, состоит из огромного количества атомов, большего,
чем количество жителей на Земле !
Слайд 14Демокрит
В основе философии Демокрита лежит учение об атомах и пустоте
как двух принципах, порождающих многообразие космоса. Атом есть мельчайшее «неделимое»
тело, не подверженное никаким изменениям. Неделимость атома аналогична неделимости «бытия».Слайд 15Модель Томсона
Дж. Дж. Томсон в 1898 году предложил модель атома
в виде положительно заряженного шара радиусом 10-10м, в котором плавают
электроны, нейтрализующие положительный заряд.Слайд 16В 1895 году немецкий учёный Уильям Конрад Рентген обнаружил новый
вид невидимых лучей, способных беспрепятственно проходить через твердые тела и
вызывать почернение фотоплёнки. Рентген назвал их Х-лучами.В 1896 году французский ученый Анри Беккерель открыл явление естественной радиоактивности (от лат. Radius – «луч») – самопроизвольного испускания атомами излучения.
Слайд 17В 1898 году Пьер Кюри и Мария Склодовская – Кюри,
изучавшие явление радиоактивности, открыли новые элементы – полоний и радий.
Слайд 18Английский физик Эрнест Резерфорд в 1909 г. открыл ядро атома
Опыт
Резерфорда: поток ά-частиц, излучаемый радиоактивным источником, через узкую щель направлялся
на тонкую золотую фольгу; при помощи флюоресцирующего экрана проводилась регистрация ά-частиц, которые в отсутствии фольги двигались узким пучком, вызывая на экране яркую вспышкуСлайд 20Э. Резерфорд предложил планетарную модель атома: в центре находится положительно
заряженное ядро, которое имеет достаточно малые размеры, но в нём
заключена почти вся масса атома; вокруг ядра по круговым орбитам движутся отрицательно заряженные электроны, подобно движению планет вокруг солнца.Слайд 21Родители атома.
Демокрит
(460 до н. э. —
370 до н. э.)
Джозеф
Джон
Томсон
(1856–1940 г)
Эрнест
Резерфорд
(1871–1937г)
Джеймс
Чедвик
(1891–1974г)
Атом
Пудинг Планетарная Сложное с изюмом модель строение ядра
Слайд 22М.В. Ломоносов
(1711-1765 гг.)
Материя состоит из мельчайших первичных частиц, или
атомов.
Атомы неделимы и не могут создаваться и разрушаться.
Атомы характеризуются определенным
размером и массой.Молекулы состоят из атомов, как из одинаковых, так и различных.
При физических явлениях молекулы сохраняются, при химических – разрушаются.
Химические реакции заключаются в образовании новых молекул из тех же самых атомов, из которых состояли исходные вещества.
атомно-
молекулярная
теория
Джон Дальтон
(1766-1844 гг.)
Слайд 251. В центре атома находится положительно заряженное ядро, занимающее ничтожную
часть пространства внутри атома.
2. Весь положительный заряд и почти вся
масса атома сосредоточены в его ядре.3. Ядра атомов состоят из протонов и нейтронов (нуклонов).
4. Вокруг ядра по замкнутым орбитам вращаются электроны.
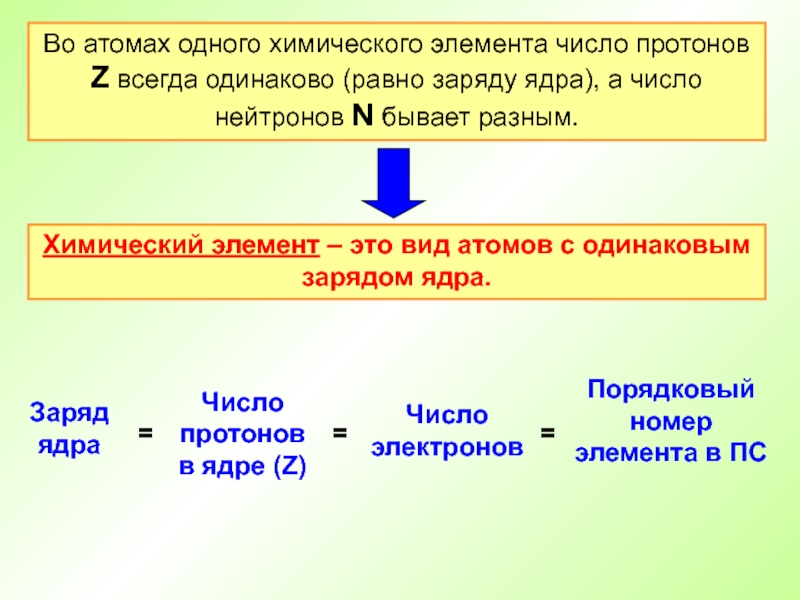
Слайд 28Во атомах одного химического элемента число протонов Z всегда одинаково
(равно заряду ядра), а число нейтронов N бывает разным.
Химический элемент
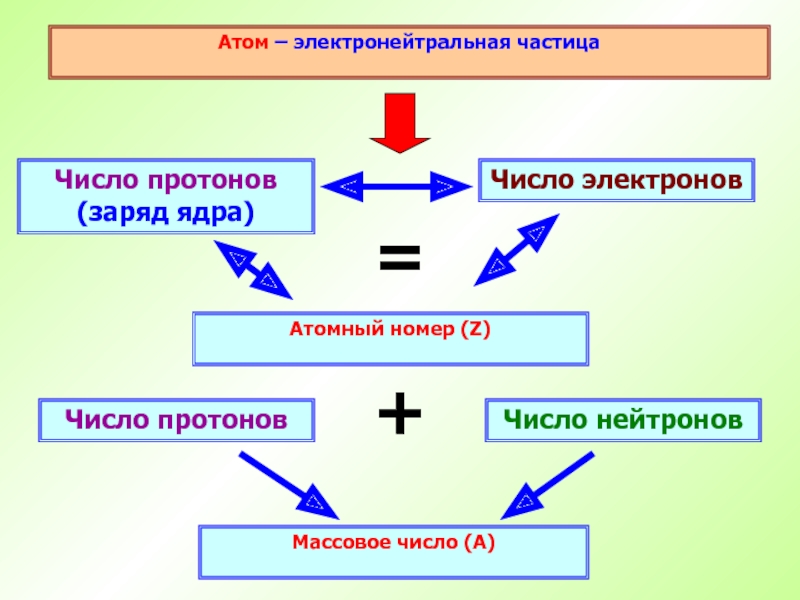
– это вид атомов с одинаковым зарядом ядра.Слайд 29Атом – электронейтральная частица
Число протонов (заряд ядра)
Атомный номер (Z)
Число электронов
=
Число
нейтронов
Число протонов
+
Массовое число (А)
Слайд 37Распределение электронов по энергетическим уровням
+
n=1
n=2
n=3
n=4
n=5
n=6
n=7
ЭНЕРГИЯ Е УВЕЛИЧИВАЕТСЯ
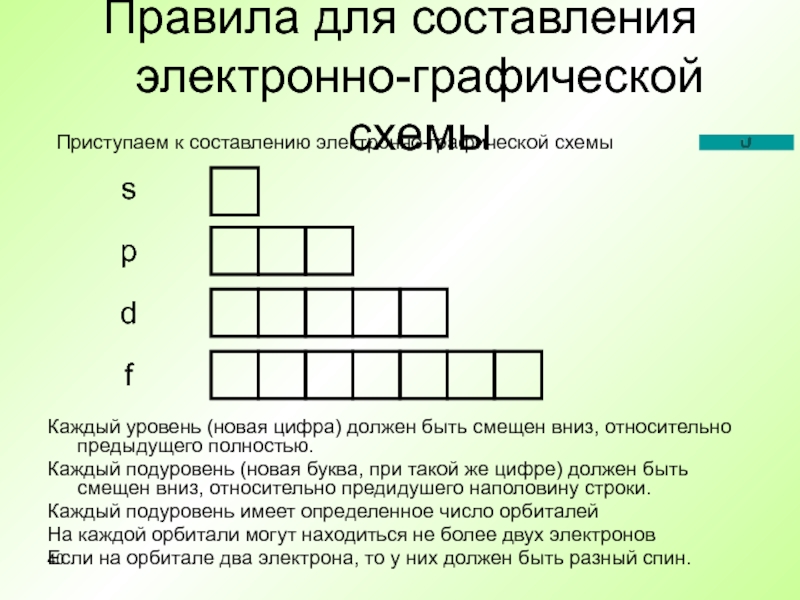
Слайд 40Правила для составления электронно-графической схемы
Каждый уровень (новая цифра) должен быть
смещен вниз, относительно предыдущего полностью.
Каждый подуровень (новая буква, при такой
же цифре) должен быть смещен вниз, относительно предидушего наполовину строки.Каждый подуровень имеет определенное число орбиталей
На каждой орбитали могут находиться не более двух электронов
Если на орбитале два электрона, то у них должен быть разный спин.
s
p
d
f
Приступаем к составлению электронно-графической схемы
Слайд 43Порядок заполнения орбиталей электронами
VII – 7s5f6d7p 32
VI –
6s4f5d6p 32
V – 5s4d5p 18
IV –
4s3d4p 18III – 3s3p 8
II – 2s2p 8
I – 1s 2
Е
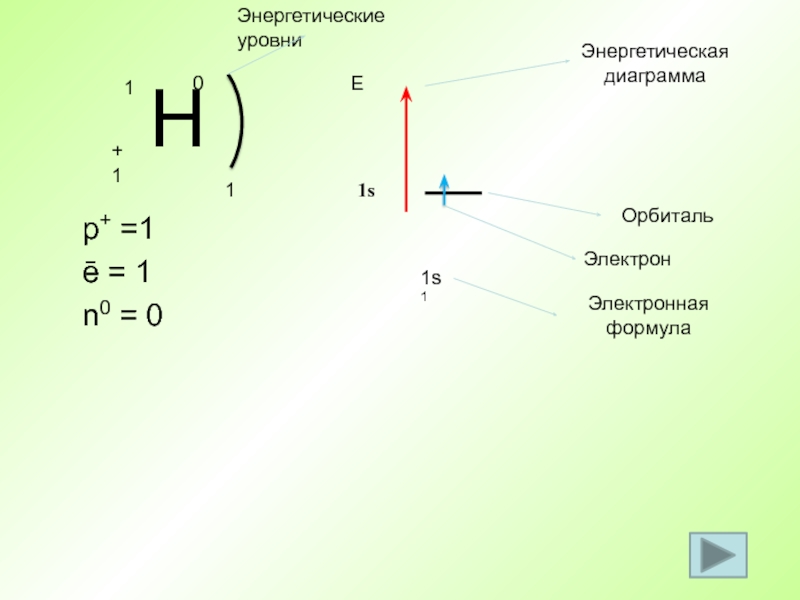
Слайд 44 p+ =1
ē = 1
n0 = 0
1
1s1
Е
1s
Энергетическая диаграмма
Орбиталь
Электрон
Электронная формула
Энергетические уровни
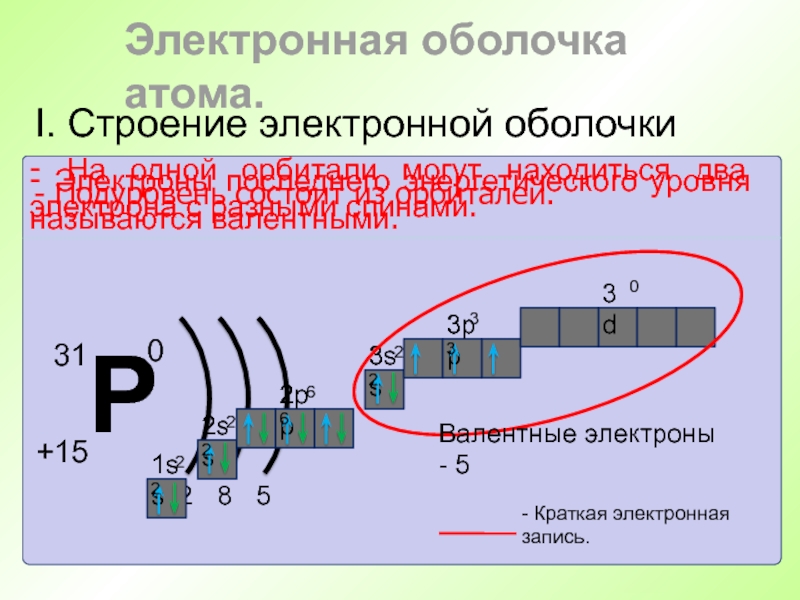
Слайд 51I. Строение электронной оболочки
Электронная оболочка атома.
- Энергетический уровень состоит из
подуровней.
- Подуровень состоит из орбиталей.
1s
2s
3s
2р
3р
3d
Слайд 52I. Строение электронной оболочки
- Подуровень состоит из орбиталей.
- На одной
орбитали могут находиться два электрона с разными спинами.
2
2
6
2
3
0
1s2
2s2
2р6
3s2
3р3
- Краткая электронная
запись.- Электроны последнего энергетического уровня называются валентными.
Валентные электроны - 5
Электронная оболочка атома.