Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ОСНОВЫ ЭЛЕКТРОХИМИИ
Содержание
- 1. ОСНОВЫ ЭЛЕКТРОХИМИИ
- 2. Окислительно-восстановительные процессы.Окислительно-восстановительными (ОВР) называются процессы, в результате
- 3. Окисление – процесс отдачи электронов, при этом
- 4. Восстановление – процесс присоединения электронов, сопровождающийся понижением
- 5. Нередко в ОВР взаимодействуют непосредственно окислители и
- 6. Любую ОВР можно условно разделить на две
- 7. Суммируем эти две полуреакции, уравняв число отданных
- 8. Таким образом, в основе метода полуреакций составления
- 9. В процессах окисления восстановления могут принимать участие
- 10. Электродные процессы При погружении металла в воду
- 11. Если металл погрузить в раствор его
- 12. Двойной электрический слой (ДЭС) – это упорядоченное
- 13. - Электродный –потенциал, возникающий на границе
- 14. - Диффузионный – потенциал, возникающий на границе
- 15. Величина электродного потенциала зависит от природы металла,
- 16. Нормальный водородный электрод (нвэ):Водородный электрод
- 17. Стандартный электродный потенциал (φ0)- это ЭДС гальванического элемента, составленного из данного электрода и нормального водородного электрода.
- 18. .Измеренные по отношению к водородному электроду при
- 19. Ряд стандартных электродных потенциалов металлов
- 20. Уравнение
- 21. Гальванические элементы. Электродвижущая сила (Э.Д.С.). Устройство,
- 22. Анод – электрод, на котором протекает процесс
- 23. Простейшим гальваническим элементом является элемент Даниеля –
- 24. Гальванический элементАнод: Zn - 2e =
- 25. Схема гальванического элемента (-) Zn
- 26. Концентрационный гальванический элемент Анод: ZnZn2+(0,1н)
- 27. Окислительно-восстановительные (редокс) потенциалыСхема ОВ-электрода: Pt ǀ Ох,
- 28. ОВ потенциал зависит от: температуры
- 29. Стандартный ОВ потенциал ЭДС гальванического
- 30. Если составить ГЭ
- 31. В реальных условиях расчет ОВ потенциала системы
- 32. Слайд 32
- 33. Sn+2 - 2ē = Sn+4 ;
- 34. Чем больше стандартный ОВ потенциал системы, тем
- 35. КРИТЕРИИ САМОПРОИЗВОЛЬНОГО ПРОТЕКАНИЯ ОВ РЕАКЦИЙ Вопрос о
- 36. Таким образом, условием самопроизвольного протекания ОВР будет
- 37. Окислительно-восстановительные Гальванические элементы
- 38. 2KI + 2FeCl3 I2 + 2FeCl2+2КCl
- 39. Электрическая проводимость растворов электролитов Способность вещества проводить
- 40. Мерой электрической проводимости раствора является количество электричества,
- 41. Электрическая проводимость одного и того же электролита
- 42. На основании экспериментальных данных Кольрауш пришел к
- 43. Закон Кольрауша: Предельная молярная электрическая проводимость при
- 44. Живой организм с точки зрения электрохимии можно
- 45. Изменение электрической проводимости тканей и клеток широко
- 46. диффузный потенциал
- 47. Диффузный потенциалОбычно диффузный потенциал является побочным и
- 48. Мембранный потенциалМембранный потенциал, возникающий по обе стороны
- 49. Мембранный потенциалДля живых клеток и особенно для
- 50. Потенциал покоя – мембранный потенциал между наружной
- 51. В течение короткого интервала времени мембранный потенциал
- 52. Потенциал действияПотенциал действия - амплитуда колебания (деполяризация
- 53. Физико-химические методы анализа, основанные на электрохимических процессахКондуктометрия
- 54. Различают прямую кондуктометрию и кондуктометрическое титрование. Прямая
- 55. Кондуктометрическое титрование – титриметрический метод анализа, в
- 56. Потенциометрия. Потенциометрией называют совокупность физико-химических
- 57. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Окислительно-восстановительные процессы.
Окислительно-восстановительными (ОВР) называются процессы, в результате которых происходит изменение
степеней окисления атомов или ионов, входящих в состав реагирующих веществ.
Степень
окисления (с.о.) - это условный заряд атома в соединении, вычисленный, исходя из предположения, что все связи в соединении имеют ионный характер. Атомам наиболее электроотрицательных элементов в соединении приписывают отрицательную с.о., а атомам с меньшей Э.О. – положительную.Изменение с.о. происходит в результате перераспределения электронов между атомами.
Слайд 3Окисление – процесс отдачи электронов, при этом с.о. увеличивается.
Восстановитель
– вещество, в состав которого входят атомы, отдающие электроны. Типичные
восстановители: металлы в свободном состоянии, водород (Н2), углерод (С), оксид углерода (СО); соединения, в состав которых входят атомы элементов в низших с.о.Слайд 4Восстановление – процесс присоединения электронов, сопровождающийся понижением с.о.
Окислитель –
вещество, в состав которого входят атомы, присоединяющие электроны. Типичные окислители:
галогены, кислород, озон; соединения, в состав которых входят атомы элементов в высших степенях окисления.Слайд 5Нередко в ОВР взаимодействуют непосредственно окислители и восстановители. Но в
водных растворах принимают участие и молекулы воды, ионы водорода (Н+),
а также гидроксид-ионы (ОН-).Слайд 6Любую ОВР можно условно разделить на две полуреакции (например: 2KMnO4
+ 5NaNO2 + 3H2SO4 = 2MnSO4 +5NaNO3 + К2SO4 +
3H2O):- полуреакцию восстановления, включающую окислитель (ион, атом или молекулу) вместе с его восстановленной формой
MnO4- + 8H+ + 5е- = Mn 2+ + 4H2O
- полуреакцию окисления, включающую восстановитель (ион, атом или молекулу) вместе с его окисленной формой
NO2- + H2O - 2е- = NO3- + 2H+
Слайд 7Суммируем эти две полуреакции, уравняв число отданных и принятых электронов
с помощью множителей:
MnO4- + 8H+ + 5е- = Mn
2+ + 4H2O 2NO2- + H2O - 2е- = NO3- + 2H+ 5
2MnO4- + 16H+ + 5NO2- + 5H2O = 2Mn 2+ + 5NO3- + 10H+ + 8H2O
Сокращаем одинаковые молекулы и ионы в левой и правой частях уравнения:
2MnO4- + 6H+ + 5NO2- = 2Mn 2+ + 5NO3- + 3H2O
И переносим полученные коэффициенты в уравнение в молекулярной форме
Слайд 8Таким образом, в основе метода полуреакций составления ОВР лежат следующие
правила:
ОВР – совокупность двух полуреакций – окисления и восстановления.
Окислитель, восстановитель
и продукты их превращения записываются в виде частиц реально существующих в водном растворе с учетом характера среды.Слайд 9В процессах окисления восстановления могут принимать участие молекулы Н2О, ионы
Н+ или ОН-, в зависимости от характера среды. При этом
нужно учитывать: а) в кислой среде используем Н+ и Н2О; б) в щелочной среде - ОН- и Н2О.Слайд 10Электродные процессы При погружении металла в воду небольшая часть атомов металла
с поверхности пластинки переходит в раствор в виде
положительно заряженных ионов. Поверхность жидкости заряжается положительно. Возникает двойной электрический слой (ДЭС).Ме + m Н2О Меn+(Н2О)m+n e
Меn+(Н2О)m+ne Ме + m Н2О
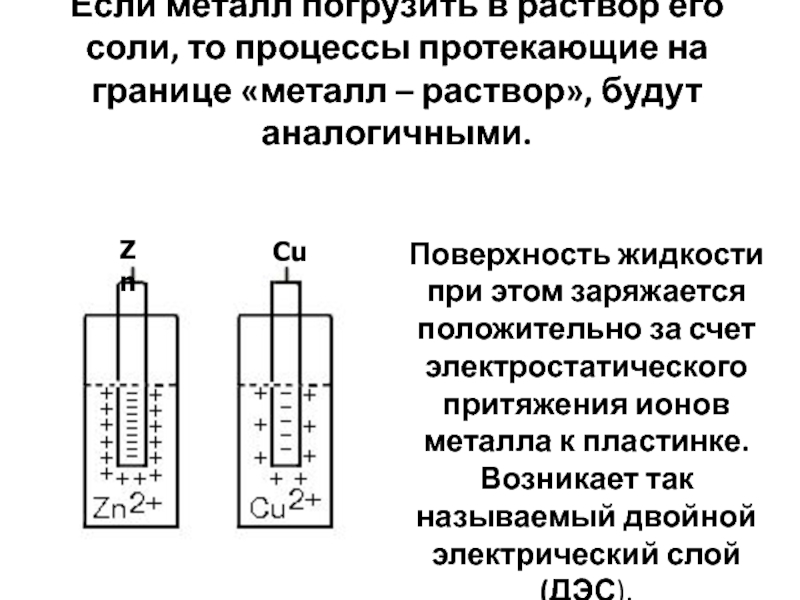
Слайд 11 Если металл погрузить в раствор его соли, то процессы протекающие
на границе «металл – раствор», будут аналогичными.
Поверхность жидкости при этом заряжается положительно за счет электростатического притяжения ионов металла к пластинке. Возникает так называемый двойной электрический слой (ДЭС).
Слайд 12Двойной электрический слой (ДЭС) – это упорядоченное распределение противоположно заряженных
частиц на границе раздела двух фаз.
ДЭС характеризуется разностью потенциалов.
В
зависимости от природы соприкасающихся фаз различают следующие виды потенциалов:Слайд 13 - Электродный –потенциал, возникающий на границе металл-раствор; - Окислительно-восстановительный (редокс) –
потенциал, возникающий на границе инертный металл – раствор, содержащий сопряженную
окислительно - восстановительную пару;Слайд 14- Диффузионный – потенциал, возникающий на границе двух растворов, содержащих
разные концентрации одних и тех же ионов или двух растворов
разных электролитов, вследствие различия в подвижности их катионов и анионов; - Мембранный – потенциал, возникающий по обе стороны мембраны с избирательной проницаемостью, разделяющей растворы разной концентрации.Слайд 15Величина электродного потенциала зависит от природы металла, концентрации (активности) ионов
металла в растворе и температуры.
Абсолютные значения электродных потенциалов невозможно
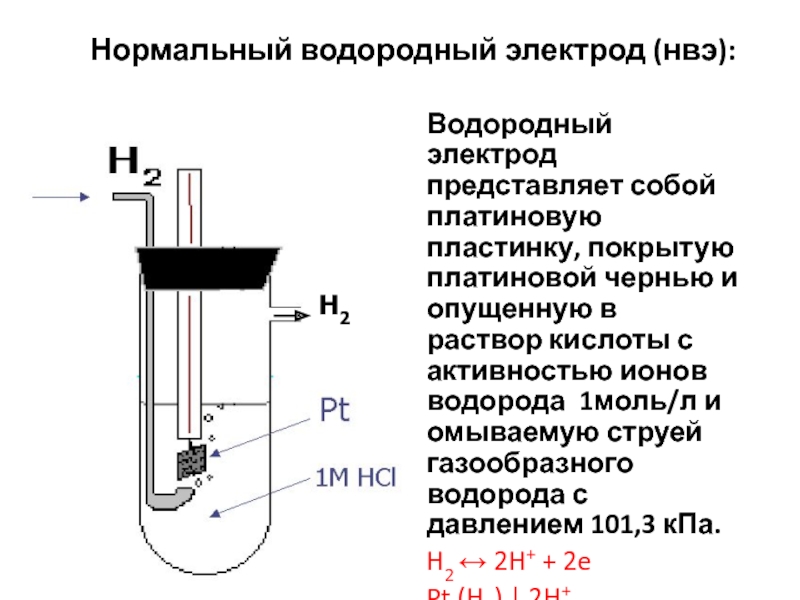
измерить, поэтому их относительную величину определяют путем сравнения с потенциалом стандартного водородного электрода, значение которого условно принято равным нулю. Слайд 16 Нормальный водородный электрод (нвэ):
Водородный электрод представляет собой платиновую
пластинку, покрытую платиновой чернью и опущенную в раствор кислоты с
активностью ионов водорода 1моль/л и омываемую струей газообразного водорода с давлением 101,3 кПа.H2 2H+ + 2e
Pt (H2) | 2H+
Слайд 17Стандартный электродный потенциал (φ0)- это ЭДС гальванического элемента, составленного из
данного электрода и нормального водородного электрода.
Слайд 18.
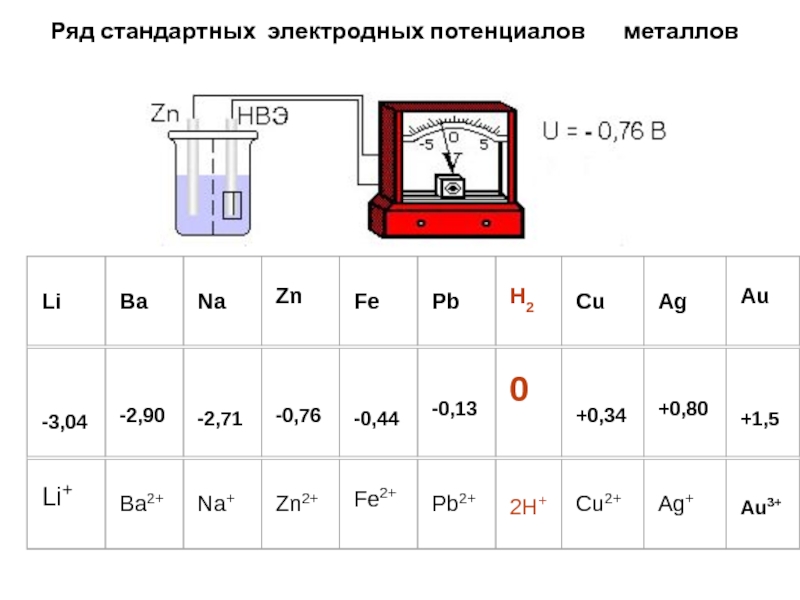
Измеренные по отношению к водородному электроду при стандартных условиях разности
потенциалов различных металлов, и расположенные в порядке возрастания, образуют электрохимический
ряд напряжений металлов (ряд стандартных электродных потенциалов) в водных растворах.Если потенциал какого-нибудь металла больше водородного, его принято считать положительным, если меньше –отрицательным.
Слайд 21Гальванические элементы. Электродвижущая сила (Э.Д.С.).
Устройство, в котором энергия
химической реакции непосредственно превращается в электрическую энергию, называется гальваническим элементом.
Гальванический элемент состоит из двух соприкасающихся друг с другом растворов электролитов, в которые погружены металлические пластинки – электроды, соединенные между собой внешним проводником. В гальваническом элементе различают анод и катод.
Слайд 22Анод – электрод, на котором протекает процесс окисления. Катионы металла
переходят в раствор, масса анода уменьшается. Анод заряжается отрицательно.
Катод
– электрод, на котором протекает процесс восстановления, катод заряжается положительно.Разность между электродными потенциалами двух полуэлементов называется электродвижущей силой гальванического элемента (ЭДС).
Э.Д.С. = φ 1 – φ 2, причем φ 1 > φ 2.
Слайд 23Простейшим гальваническим элементом является элемент Даниеля – Якоби. Он состоит
из медного и цинкового электродов, погруженных соответственно в растворы CuSO4
и ZnSO4. Схематически этот элемент изображается: (-) Zn | ZnSO4 ║ CuSO4| Cu (+).Анодный процесс - Zn – 2е = Zn2+
Катодный процесс - Cu2+ + 2е = Cu
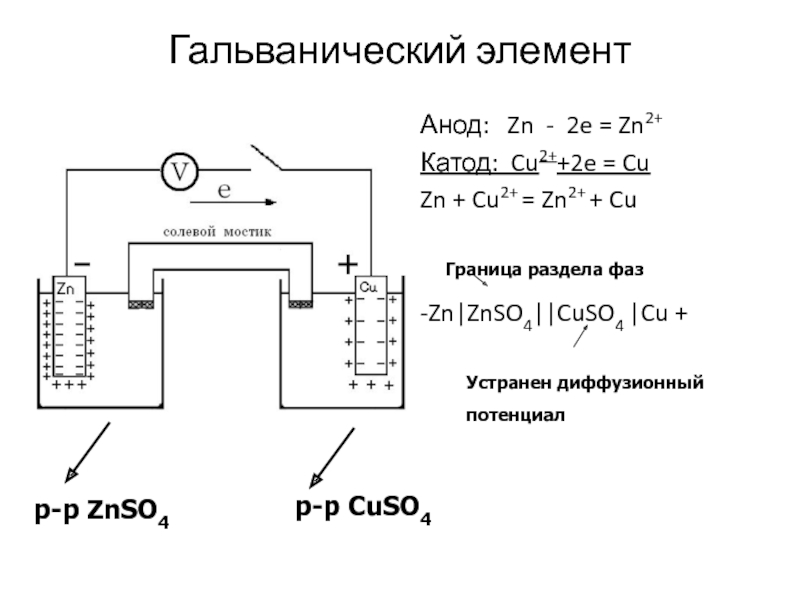
Слайд 24Гальванический элемент
Анод: Zn - 2e = Zn2+
Катод: Cu2++2e =
Cu
Zn + Cu2+ = Zn2+ + Cu
-Zn|ZnSO4||CuSO4 |Cu +
р-р
ZnSO4р-р CuSO4
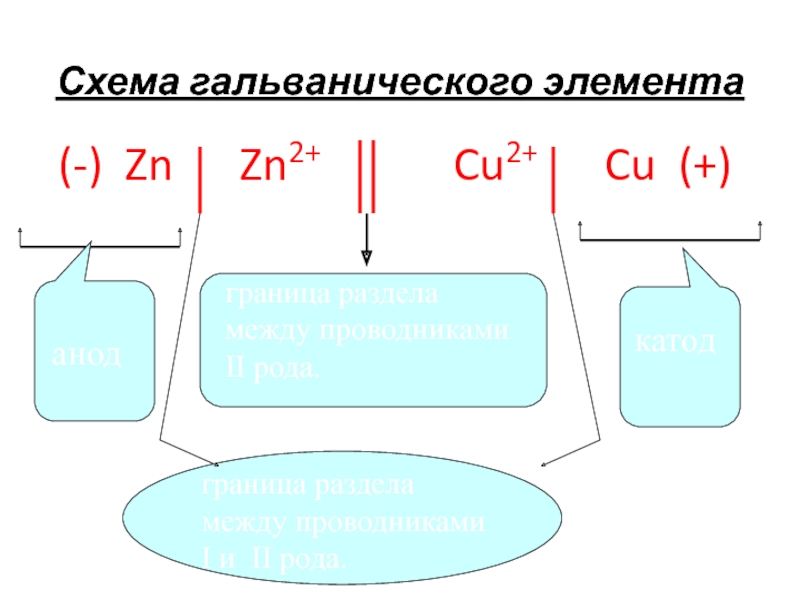
Слайд 25Схема гальванического элемента
(-) Zn Zn2+
Cu2+ Cu (+)
граница раздела
между проводниками II рода. анод
катод
граница раздела между проводниками I и II рода.
Слайд 26
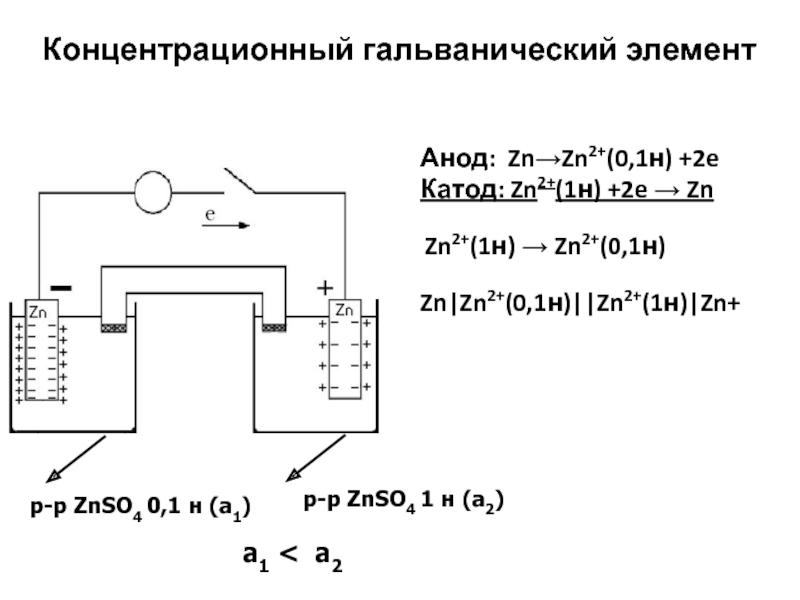
Концентрационный гальванический элемент
Анод: ZnZn2+(0,1н) +2e
Катод: Zn2+(1н) +2e Zn
Zn2+(1н) Zn2+(0,1н)
Zn|Zn2+(0,1н)||Zn2+(1н)|Zn+
p-p ZnSO4 0,1 н (a1)
p-p ZnSO4 1 н
(a2)a1 < a2
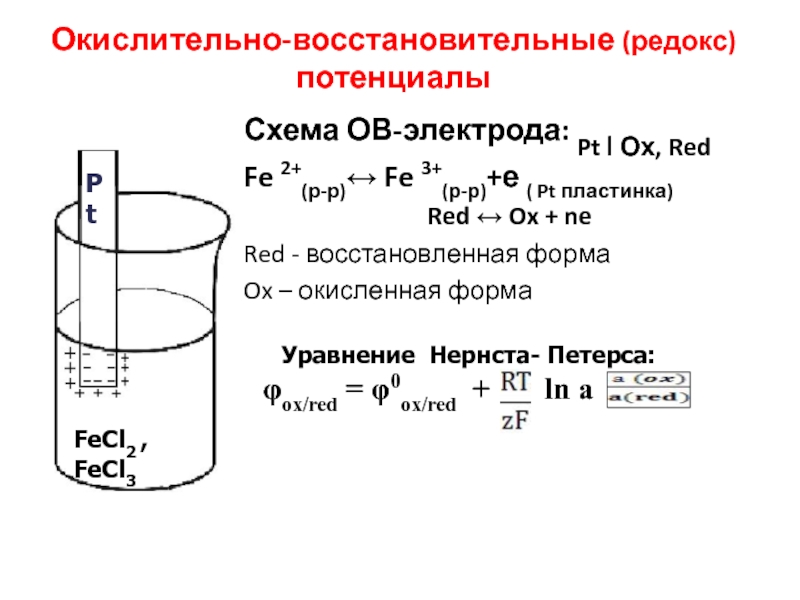
Слайд 27Окислительно-восстановительные (редокс) потенциалы
Схема ОВ-электрода: Pt ǀ Ох, Red
Fe 2+(р-р)
Fe 3+(р-р)+е ( Pt пластинка)
Red Ox + ne
Red -
восстановленная формаOx – окисленная форма
Уравнение Нернста- Петерса:
φox/red = φ0ox/red + ln a
Слайд 28
ОВ потенциал зависит от:
температуры
природы окислителя и восстановителя
концентрации
окисленной и восстановленной форм
рН среды
Слайд 29Стандартный ОВ потенциал
ЭДС гальванического элемента, составленного из
окислительно-восстановительной системы, содержащей окисленную и восстановленную формы в концентрациях 1
моль/л и стандартным водородным электродом называется стандартным ОВ потенциалом данной окислительно-восстановительной системы.Инертный элемент (Pt) не участвует в электродной реакции, а является только носителем электронов от восстановленной к окисленной формам
Слайд 30
Если составить ГЭ из MnO4-/Mn2+ и
(Pt),H2|2H+, то стандартный ОВ потенциал = +1,51 В.
MnO4-
+ 8H+ +5e Mn2+ + 4H2Oa(MnO4-)= a(Mn2+)=1 моль/л
а(H+)= 1 моль/л
Слайд 31В реальных условиях расчет ОВ потенциала системы MnO4-/Mn2+ производится по
уравнению Нернста-Петерса: φox/red = φ0ox/red +
ln aox/ared где φ0ox/red – стандартный ОВ-потенциал
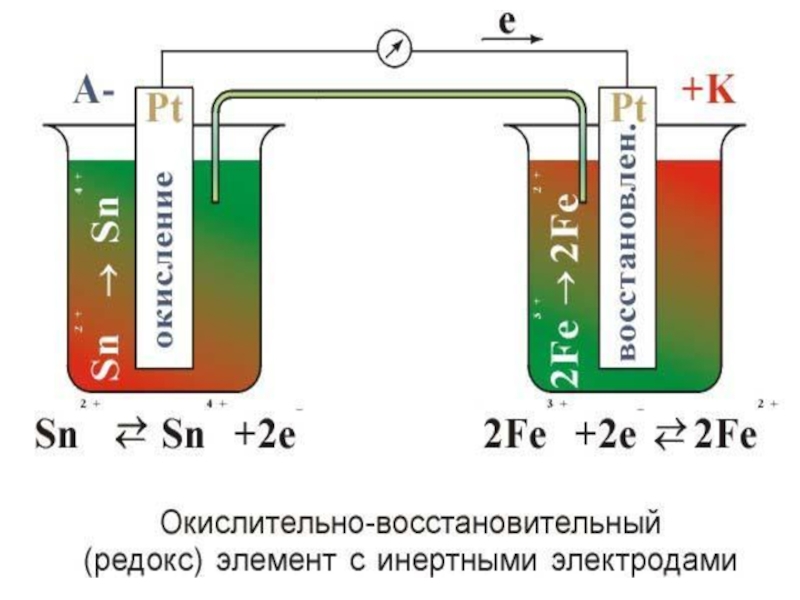
Слайд 33Sn+2 - 2ē = Sn+4 ; φо
=+ 0.15 B
Fe3+ + ē =
Fe2+ ; φо =+ 0.77 BSn2+ + 2Fe3+ = Sn4+ + 2Fe2+
ε o = φo – φo = 0.77-0.15 = 0.62 B
(-) Pt Sn2+ , Sn4+ Fe3+ , Fe2+ Pt (+)
Sn+4/Sn+2
Fe3+/Fe2+
Токообразующая реакция
2ē
Fe3+/Fe2+
Sn+4/Sn+2
Слайд 34Чем больше стандартный ОВ потенциал системы, тем в большей степени
выражены ее окислительные свойства в стандартных условиях.
Например,
MnO4-/Mn2+
E0= 1,51 BFe3+/Fe2+ E0= 0,77 B
Sn4+/Sn2+ E0= 0,15 B
Слайд 35КРИТЕРИИ САМОПРОИЗВОЛЬНОГО ПРОТЕКАНИЯ ОВ РЕАКЦИЙ
Вопрос о возможности самопроизвольного протекания
редокс-процесса можно решить сравниванием редокс-потенциалов редокс-систем, принимающих участие в процессе,
т.е. рассчитав ЭДС мысленно составляемого гальванического элемента.При взаимодействии двух сопряженных окислительно-восстановительных пар окислителем всегда будет окисленная форма той пары, потенциал которой имеет более положительное значение, а восстановителем будет восстановленная форма той пары, потенциал которой имеет меньшее значение.
Слайд 36Таким образом, условием самопроизвольного протекания ОВР будет положительное значение ее
Э.Д.С. :
Е0 = φ(окислителя) - φ(восстановителя) > 0. Таким образом,
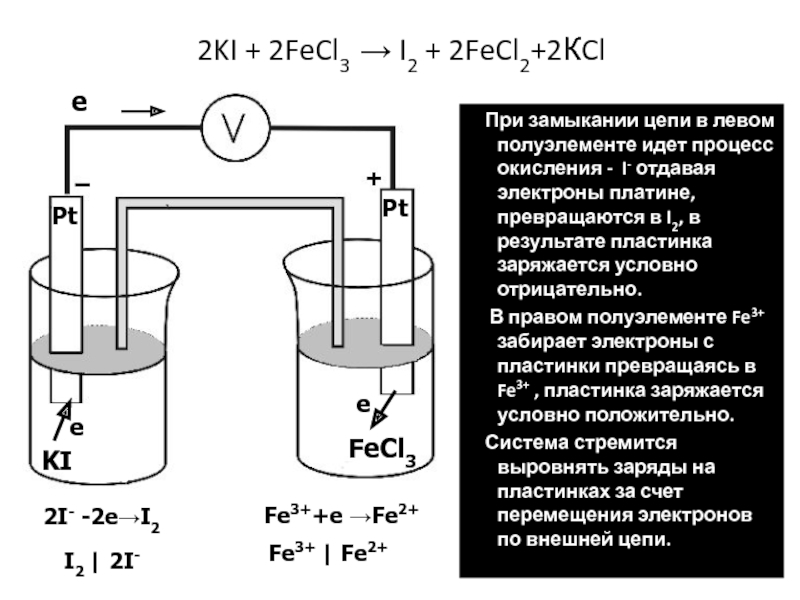
окислителем будет система, у которой редокс-потенциал, вычисленный по уравнению Нернста-Петерса будет иметь большее алгебраическое значение. Слайд 382KI + 2FeCl3 I2 + 2FeCl2+2КCl
При замыкании
цепи в левом полуэлементе идет процесс окисления - I- отдавая
электроны платине, превращаются в I2, в результате пластинка заряжается условно отрицательно.В правом полуэлементе Fe3+ забирает электроны с пластинки превращаясь в Fe3+ , пластинка заряжается условно положительно.
Система стремится выровнять заряды на пластинках за счет перемещения электронов по внешней цепи.
Слайд 39Электрическая проводимость растворов электролитов
Способность вещества проводить электрический ток называется электропроводностью.
Проводники электрического тока делятся на 2 типа: первого и второго
рода. В проводниках первого рода носителями электрического тока являются свободные электроны металлов, второго рода - положительно и отрицательно заряженные ионы растворов и расплавов электролитов.Слайд 40Мерой электрической проводимости раствора является количество электричества, выраженное в кулонах,
которое за единицу времени проходит через электролит.
Электрическая проводимость растворов
электролита зависит от концентрации раствора, от свойств ионов, температуры и увеличивается с возрастанием числа ионов и скорости их движения. Слайд 41Электрическая проводимость одного и того же электролита зависит от концентрации,
поэтому в основном пользуются молярной (эквивалентной) проводимостью (λС).
Численно молярная электрическая
проводимость равна(Ом-1 ∙м2∙моль-1): λС = где χ – удельная электрическая проводимость, Ом-1 ∙м-1; С - концентрация эквивалента вещества, моль/л.
Из этой формулы следует, что молярная электрическая проводимость у сильных и слабых электролитов возрастает с увеличением разбавления и достигает некоторого предельного значения, которая называется электрической проводимостью при бесконечном разбавлении - λ∞
Слайд 42На основании экспериментальных данных Кольрауш пришел к выводу, что в
разбавленных растворах каждый из ионов имеет свою долю молярной проводимости.
Таким образом, молярная проводимость является аддитивным свойством электролита, т.е. суммой двух независимых величин:λ∞ = lK +lA , где lK и lA – проводимости катиона К+ и аниона А- .
Слайд 43Закон Кольрауша: Предельная молярная электрическая проводимость при бесконечном разбавлении (λ∞)
равна сумме подвижностей катиона и аниона.
Численные значения подвижности
всех катионов сейчас определены экспериментально и сведены в соответствующие таблицы.Молярная проводимость прямо пропорциональна разбавлению раствора. Аррениус объяснил это постепенным увеличением числа ионов в растворе т.к. по мере уменьшения концентрации все большее число молекул электролита распадается на ионы:
λV = ( lK +lA)
Слайд 44Живой организм с точки зрения электрохимии можно рассматривать как систему,
состоящую из клеток и межклеточного пространства, заполненного растворами электролитов.
По электрической
проводимости биологические ткани и жидкости можно расположить в такой последовательности: кровь, лимфа, ликвор, желчь>мышечная ткань, серое вещество мозга> ткань легких, сердечная мышца, ткань печени>жировая ткань, костная ткань> роговой слой эпидермиса кожи.Слайд 45Изменение электрической проводимости тканей и клеток широко используют для диагностических
целей. Патологические процессы, а также отмирание тканей приводят к изменению
проницаемости клеточных мембран, что приводит к уменьшению зависимости электрической проводимости от частоты тока, вплоть до исчезновения зависимости при гибели клеток. Такая зависимость существует только у живых клеток, а у растворов электролитов – нет.Слайд 46диффузный потенциал
.
Скачок потенциала возникает не только на границе раздела электрод
– раствор, но и на границе раздела пористой перегородкой двух
растворов с различной концентрацией ионов. Например, при контакте концентрированного и разбавленного растворов соляной кислоты ионы водорода и хлора начинают диффузию из более концентрированного раствора в разбавленный. Но ионы водорода движутся быстрее, и поэтому разбавленный раствор заряжается положительно, а концентрированный – отрицательно. Возникающая при этом разность потенциалов не велика – десятки милливольт.Слайд 47Диффузный потенциал
Обычно диффузный потенциал является побочным и не совсем желательным
явлением, и поэтому, от него стремятся избавиться путем применения солевых
мостиков (трубки, заполненной концентрированными растворами KCl или NH4Cl).В биологических системах диффузионный потенциал возникает при механическом повреждении клеток, поэтому его также называют потенциалом повреждения.
Слайд 48Мембранный потенциал
Мембранный потенциал, возникающий по обе стороны избирательно проницаемой мембраны,
разделяющей два раствора с различными ионами, является частным случаем диффузионного
потенциала.Например, если между растворами НCl с различной концентрацией поместить мембрану, пропускающую только катионы, то через мембрану будут переходить из концентрированного раствора только катионы водорода Н+ и на мембране возникнет разность потенциалов, который называется мембранным.
Слайд 49Мембранный потенциал
Для живых клеток и особенно для клеток нервной системы
потенциалопределяющими являются ионы Nа + и К+. Концентрация ионов
калия внутри клетки в 20 раз превышает их содержание во внеклеточной жидкости, а концентрация ионов натрия в 9 раз выше в межклеточной жидкости, чем внутри клетки. Возникающий из-за различной концентрации ионов калия и натрия по обе стороны мембраны мембранный потенциал подразделяется на потенциалы покоя и потенциалы действия.Слайд 50Потенциал покоя – мембранный потенциал между наружной и внутренней стороной
мембраны, находящейся в невозбужденном состоянии.
Мембраны нервных клеток в состоянии
покоя примерно в 100 раз более проницаемы для ионов К+, чем для ионов Nа +. Если нервную клетку возбуждать , то клеточная мембрана становится более проницаемой для ионов Nа +, чем для К+.Слайд 51В течение короткого интервала времени мембранный потенциал меняется от отрицатель-
ного до положительного.
Обращение знака заряда мембранного потенциала при движении
ионов Nа + внутрь клетки деполяризует мембрану. После этого изменения мембрана вновь становится проницаемой для К+ и непроницаемой для Nа +. После того как избыток ионов Nа + будет откачан из клетки наружу в результате активного транспорта, мембранный потенциал возвращается к своему исходному состоянию.Слайд 52Потенциал действия
Потенциал действия - амплитуда колебания (деполяризация и реполяризация) мембранного
потенциала, возникающая при возбуждении клеточной мембраны. Потенциал действия, генерируемый нервной
клеткой, может быть передан в мышечную клетку. Например, каждому биению сердца предшествует генерация большого по величине потенциала действия. Этот потенциал действия создает ток, который удается регистрировать с помощью электродов, размещенных на грудной клетке (ЭКГ).Слайд 53Физико-химические методы анализа, основанные на электрохимических процессах
Кондуктометрия
Кондуктометрией называется физико-химический метод
исследования, основанный на измерении электрической проводимости различных систем.
Слайд 54Различают прямую кондуктометрию и кондуктометрическое титрование. Прямая кондуктометрия основана на том,
что в области разбавленных и умеренно концентрированных растворов электрическая проводимость
растет с увеличением концентрации электролита.
Слайд 55Кондуктометрическое титрование
– титриметрический метод анализа, в котором точка эквивалентности
определяется по изменению электрической проводимости раствора электролита в процессе титрования.
Для определения точки эквивалентности при кондуктометрическом титровании используется различная проводимость сильных кислот и оснований по сравнению с проводимостью их солей – при равных концентрациях их электрическая проводимость больше проводимости их солей. Электрическая проводимость слабых кислот и оснований меньше проводимости их солей.Слайд 56Потенциометрия.
Потенциометрией называют совокупность физико-химических методов исследования, в основе которых лежит
измерение Э.Д.С. систем, состоящих из индикаторного электрода и электрода сравнения.
Электрод,
потенциал которого зависит от активности (концентрации) определяемых ионов в растворе, называется индикаторным или электродом определения.В качестве индикаторного электрода чаще всего используют стеклянный водородный электрод.
Для измерения потенциала индикаторного электрода в раствор погружают второй электрод, потенциал которого не зависит от концентрации определяемых ионов. Такой электрод называется электродом сравнения.