Слайд 1Основы химической термодинамики
Слайд 2Химическая термодинамика – это наука, которая
изучает условия устойчивости химических
систем и
законы, по которым системы переходят из одного
состояния
в другое.
Система – это тело или группа тел, мысленно или
при помощи реальных границ обособленных от
окружающей среды.
Системы бывают:
открытые, в которых существует обмен
энергией и веществом
с окружающей средой;
закрытые, в которых существует обмен энергией с окружением,
но нет обмена веществом;
изолированные, в которых нет обмена с окружением ни
энергией, ни веществом.
Слайд 4Состояние системы описывают с помощью макроскопических параметров.
Параметры бывают:
внутренние,
которые определяются только координатами тел системы,
например: плотность ρ или
внутренняя энергия U;
внешние, которые определяются координатами тел в окружающей среде,
например, объем V (при фиксированном положении стенок сосуда) или
напряженность электрического поля E;
экстенсивные, которые прямо пропорциональны массе системы или числу
частиц, например, объем V, энергия U, энтропия S, теплоемкость C;
интенсивные, которые не зависят от массы системы или числа частиц,
например, температура T, плотность ρ , давление p.
Слайд 5Состояние системы описывается также с помощью термодинамических
функций, которые зависят
от параметров. Различают:
функции состояния, которые зависят только от состояния
системы и
не зависят от пути, по которому это состояние получено;
функции перехода, значение которых зависит от пути, по которому
происходит изменение системы.
Примеры функций состояния: энергия U, энтальпия H, энергия Гельмгольца F,
энергия Гиббса G, энтропия S. Термодинамические параметры объем V,
давление p, температуру T также можно считать функциями состояния,
т.к. они однозначно характеризуют состояние системы.
Примеры функций перехода: теплота Q и работа A.
Слайд 6Если хотя бы один из параметров системы меняется со временем,
то говорят, что в системе происходит процесс. Процессы бывают:
обратимые,
когда переход системы из одного состояния в другое
и обратно может происходить по одному и тому же пути,
и после возвращения в исходное состояние в окружающей среде
не остается макроскопических изменений;
квазистатические, или равновесные, термодинамические
параметры которых одинаковы во всех точках системы и не
изменяются самопроизвольно (без затраты работы) во времени;
необратимые, или неравновесные, когда параметры меняются
с конечной скоростью.
Слайд 7Первое исходное положение,
или основной постулат термодинамики:
Любая изолированная система
с течением времени
приходит в равновесное состояние и самопроизвольно
не
может из него выйти.
Второе исходное положение, или нулевой закон термодинамики
описывает свойства систем, находящихся в состоянии
теплового равновесия:
Если система А находится в тепловом равновесии с системой В
(например, если происходит равновесный обмен теплом между
системами), а та, в свою очередь, находится в равновесии с
системой С, то системы А и С также находятся в
тепловом равновесии.
Слайд 8Любая система характеризуется запасом
внутренней энергии (U)
внутренней энергия зависит
от количества вещества,
строения и состояния (t°, p, V) вещества
и складывается
из колебательного и вращательного движения молекул,
атомов, протонов, электронов,…
внутренней энергия не учитывает кинетическую и
потенциальную энергию системы во внешней среде
внутреннюю энергию нельзя подсчитать, важно знать
изменение внутренней энергии
Слайд 9колебания
вращение
Примеры колебательного и вращательного движения молекул воды.
Колебательные движения происходят
в результате периодического смещения атомов
относительно друг друга. Вращательные движения
происходят в результате веретенообразного
вращения молекулы воды вокруг некоторой оси.
Слайд 10Поскольку система может обмениваться с окружающей
средой энергией в форме
теплоты (Q) и работы (А),
то изменение внутренней энергии можно
измерить с
помощью работы и теплоты
Zn(тв) + Н2SO4(р-р) → ZnSO4(p-p) + H2(г)↑ + Q
При p=const выделяется 163,2 кДж теплоты;
При V=const выделяется 165,7 кДж теплоты;
QV = 165,7 кДж/моль
QP = 163,2 кДж/моль
(часть теплоты расходуется на работу по расширению системы)
Количественное соотношение между изменением внутренней энергии,
теплотой и работой устанавливает Первый закон термодинамики
Слайд 11Первый закон (первое начало) термодинамики:
Энергия изолированной системы постоянна.
В
неизолированной системе энергия может изменяться за счет:
а) совершения работы
над окружающей средой;
б) теплообмена с окружающей средой.
Для описания этих изменений вводят функцию состояния –
внутреннюю энергию U и две функции перехода - теплоту Q
и работу A.
Математическая формулировка первого закона:
U = Q - A (интегральная форма)
Слайд 12Если система совершает только работу расширения:
A = F·h;
F=p·S; A=p·S·h=p·ΔV,
где А – работа, совершаемая системой, Дж;F – сила, с которой система давит на поршень, Н;
h – высота поднятия поршня, м; р – давление системы, Па; S – площадь поршня, м².
h
U + pV = H – энтальпия системы [кДж/моль]
В случае изобарного процесса теплота, подведенная к системе равна
изменению энтальпии системы.
Слайд 13таким образом,
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
может быть сформулирован так:
Энергия не
может ни создаваться, ни исчезать, но может превращаться из одной
формы в другую.
т.е. изменение энергии в химическом процессе (изменение химической энергии) можно зафиксировать через эквивалентное изменение теплоты системы.
Слайд 14Изменение энергии системы при протекании в ней химической
реакции при условии,
что система не совершает никакой
другой работы, кроме работы расширения,
называется
тепловым эффектом химической реакции.
стандартная энтальпия реакции (при протекании
реакции в стандартных условиях).
стандартные условия: Р = 1 атм., Т = 298 К.
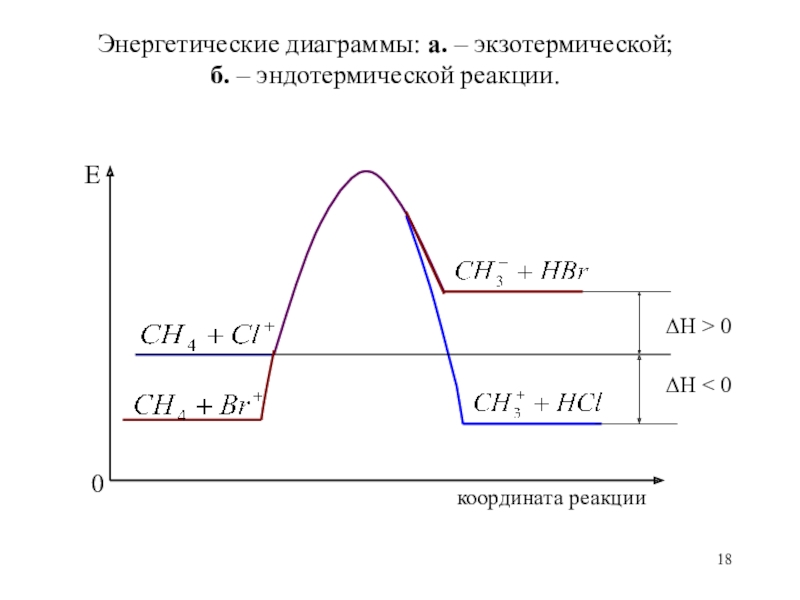
Слайд 17Если в результате реакции теплота выделяется, т.е.
энтальпия системы понижается (ΔН
то реакция
называется экзотермической
Если в результате реакции теплота поглощается, т.е.
энтальпия системы
повышается (ΔН>0), то реакция
называется эндотермической
Самопроизвольно протекающие химические
реакции должны сопровождаться выделением
энергии
Слайд 18Энергетические диаграммы: а. – экзотермической;
б. – эндотермической реакции.
Е
координата реакции
0
ΔН
> 0
ΔН < 0
Тепловой эффект реакции зависит от природы и
состояния исходных веществ и конечных продуктов,
но не зависит от пути реакции, т.е. от числа и
характера промежуточных стадий.
Слайд 21Следствия из закона Гесса:
Тепловой эффект химической реакции по замкнутому контуру
равен нулю;
Если из одинаковых начальных состояний системы
переходят в различные конечные состояния, то разность между тепловыми эффектами этих реакций есть теплота перехода из одного конечного состояния в другое;
Слайд 223. Если из различных начальных состояний системы переходят к одинаковым
конечным состояниям, то разность между тепловыми эффектами этих реакций есть
теплота перехода из одного начального состояния в другое.
Слайд 23Не
Ne
Схема опыта, иллюстрирующего самопроизвольно протекающий процесс
смешивания инертных газов, сила
взаимодействия между молекулами которых
мала. Чтобы снова разделить газы, надо
затратить энергию. Температура
системы газов при смешивании практически не изменилась, в тоже время
процесс протекал самопроизвольно. Почему???
ВОЗРОСЛА МЕРА БЕСПОРЯДКА В СИСТЕМЕ
Беспорядок вычислить невозможно, но вероятность (W) расположения молекул
в том или ином месте пространства легко поддается вычислению. Для этого
было введено понятие функции энтропии (S), [Дж/моль· К]
S = k· lnW, где k – постоянная Больцмана.
Слайд 24Второй закон термодинамики:
В изолированной системе самопроизвольно
совершаются только те процессы,
которые
приводят к увеличению энтропии.
Т.о., системы эволюционируют в направлении
большей
вероятности.
Третий закон термодинамики:
Энтропия идеально сформированного кристалла
при абсолютном нуле равна нулю.
Слайд 26где ΔS – изменение энтропии системы, Дж/моль·К;
Q – тепловой эффект
реакции, кДж/моль, Т – температура системы.
Слайд 29Для того, чтобы предсказать будет протекать
реакция или нет, было
введено понятие изобарно-
изотермического потенциала (энергии Гиббса),
который связывает две движущие
силы процесса –
энтропию и энтальпию.
[кДж/моль]
Если ΔG<0, то реакция протекает самопроизвольно в
прямом направлении;
Если ΔG=0, то реакция находится в состоянии равновесия,
т.е не обладает движущей силой, заставляющей ее
протекать в каком-либо направлении;
Если ΔG>0, то реакция в прямом направлении не может
протекать самопроизвольно.
Слайд 30кривая АDC – характеризует протекание прямой реакции; кривая ВЕС –
обратной реакции; точка D – характеризует состав системы в определенный
момент протекания прямой реакции, точка Е – обратной.
а.
б.
Слайд 32При условии постоянства объема состояние
системы может быть описано с
помощью
изохорно-изотермического потенциала (энергии
Гельмгольца)
Соотношение между ΔG и ΔF
такое же как между
ΔH и ΔU, т.е. они различаются на величину работы
расширения:
ΔG – ΔF = p·ΔV