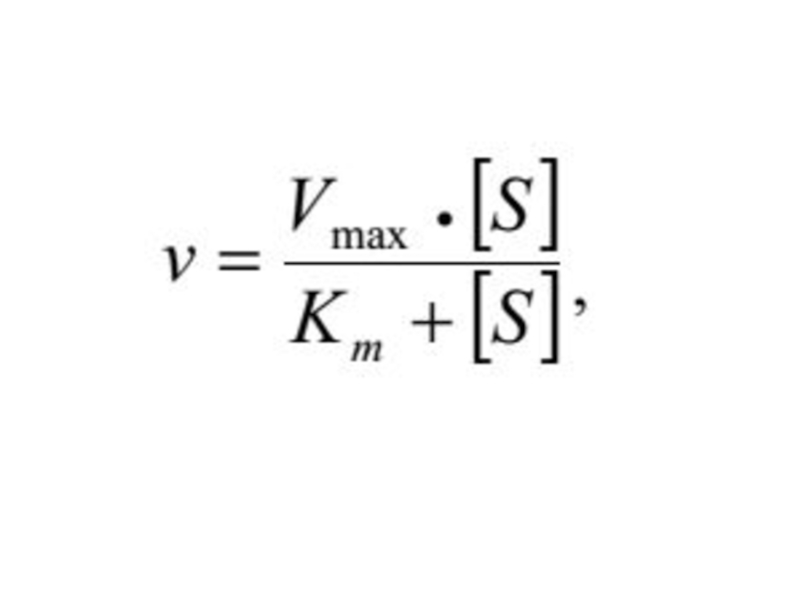Слайд 1ОСНОВЫ КИНЕТИКИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
Слайд 2Кинетика ферментативных реакций - раздел энзимологии, изучающий зависимость скорости химических
реакций, катализируемых ферментами, от химической природы реагирующих веществ, а также
от факторов окружающей среды.
Для измерения каталитической активности ферментов используют
скорость реакции или активность фермента.
Скорость ферментативной реакции - изменение количества молекул субстрата или продукта за единицу времени.
Скорость ферментативной реакции - мера каталитической активности фермента, её обозначают как активность фермента.
Слайд 3Математически скорость ферментативной реакции выражается в изменении концентрации субстрата (уменьшение)
или продукта (увеличение) за единицу времени:
V= D[S]/t = D[P]/t.
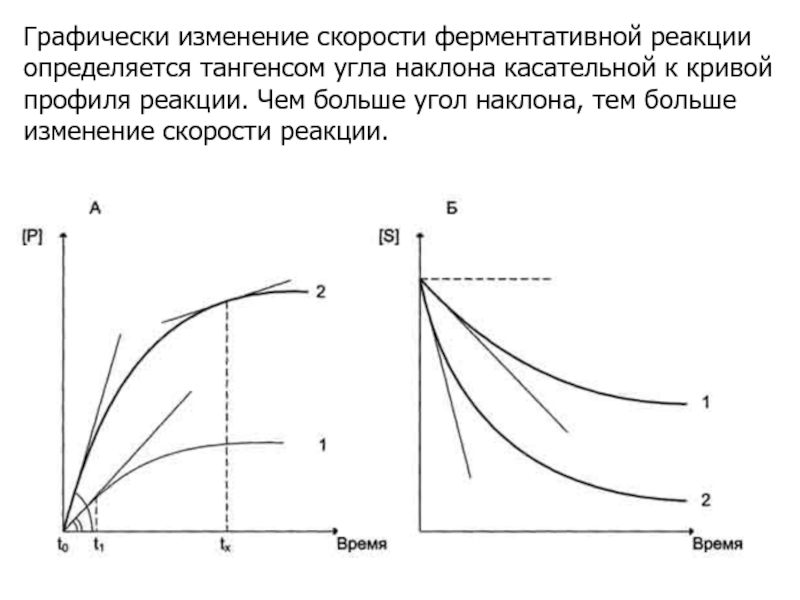
На начальном
этапе [0 - t0] скорость реакции прямо пропорциональна времени и имеет линейную зависимость.
С течением времени изменение скорости ферментативной реакции в экспериментальных условиях уменьшается.
Слайд 4Графически изменение скорости ферментативной реакции определяется тангенсом угла наклона касательной
к кривой профиля реакции. Чем больше угол наклона, тем больше
изменение скорости реакции.
Слайд 5Скорость ферментативной реакции зависит от ряда факторов, таких как
количество
и активность ферментов,
концентрация субстрата,
температура среды,
рН раствора,
присутствие
регуляторных молекул (активаторов и ингибиторов).
Слайд 6Зависимость скорости ферментативной реакции от количества ферментов
При проведении ферментативной реакции
в условиях избытка субстрата скорость реакции будет зависеть от концентрации
фермента.
Количество фермента часто невозможно определить в абсолютных величинах, поэтому на практике пользуются условными величинами, характеризующими активность фермента: одна международная единица активности (ME) соответствует такому количеству фермента, которое катализирует превращение 1 мкмоль субстрата за 1 мин при оптимальных условиях проведения ферментативной реакции. Оптимальные условия индивидуальны для каждого фермента и зависят от температуры среды, рН раствора, при отсутствии активаторов и ингибиторов.
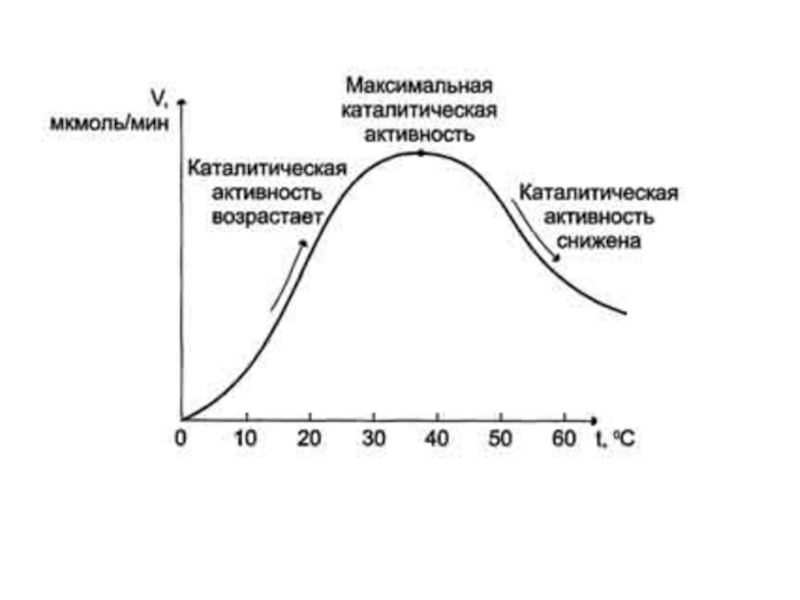
Слайд 7Зависимость скорости ферментативной реакции от температуры среды
Повышение температуры до определённых
пределов оказывает влияние на скорость ферментативной реакции, подобно влиянию температуры
на любую химическую реакцию.
1. С повышением температуры ускоряется движение молекул, что приводит к повышению вероятности взаимодействия реагирующих веществ.
2. Температура может повышать энергию реагирующих молекул, что также приводит к ускорению реакции.
Однако скорость химической реакции, катализируемая ферментами, имеет свой температурный оптимум, превышение которого сопровождается понижением ферментативной активности, возникающим из-за термической денатурации белковой молекулы
Слайд 8Правило Вант-Гоффа
Уравнение Аррениуса:
k = Ae-Ea/RT,
где k – константа
скорости реакции; Ea – энергия активации реакции; R – газовая
постоянная; Т– абсолютная температура; А– коэффициент пропорциональности (характеризует частоту столкновений реагирующих молекул)
где V1 –скорость реакции при температуре T1; V2 – скорость реакции при температуре T2; γ– коэффициент Вант-Гоффа;
Слайд 10Для большинства ферментов человека оптимальна температура 37-38 °С.
Однако в
природе существуют и термостабильные ферменты.
Например, Taq-полимераза, выделенная из микроорганизмов,
живущих в горячих источниках, не инактивируется при повышении температуры до 95 °С. Этот фермент используют в научно-практической медицине для молекулярной диагностики заболеваний с использованием метода полимеразной цепной реакции (ПЦР).
Фермент мышечной ткани– миокиназа, которая выдерживает нагревание до 100°С.
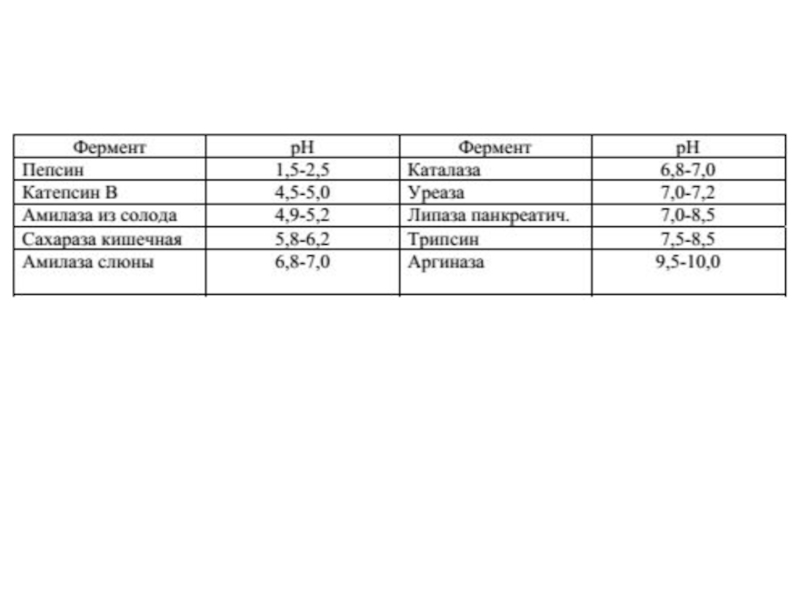
Слайд 11Зависимость скорости ферментативной реакции от рН среды
Активность ферментов зависит от
рН раствора, в котором протекает ферментативная реакция.
Для каждого фермента
существует значение рН, при котором наблюдается его максимальная активность.
Отклонение от оптимального значения рН приводит к понижению ферментативной активности.
Слайд 12Влияние рН на активность ферментов связано с ионизацией функциональных групп
аминокислотных остатков данного белка, обеспечивающих оптимальную конформацию активного центра фермента.
Например, при закислении среды происходит протонирование свободных аминогрупп (NH3+), а при защелачивании происходит отщепление протона от карбоксильных групп (СОО-).
Это приводит к изменению конформации молекулы фермента и конформации активного центра; следовательно, нарушается присоединение субстрата, кофакторов и коферментов к активному центру.
Слайд 13Кроме того, рН среды может влиять на степень ионизации или
пространственную организацию субстрата, что также влияет на сродство субстрата к
активному центру.
При значительном отклонении от оптимального значения рН может происходить денатурация белковой молекулы с полной потерей ферментативной активности.
Оптимум значения рН у разных ферментов различный. Ферменты, работающие в кислых условиях среды (например, пепсин в желудке или лизосомальные ферменты), эволюционно приобретают конформацию, обеспечивающую работу фермента при кислых значениях рН. Однако большая часть ферментов организма человека имеет оптимум рН, близкий к нейтральному, совпадающий с физиологическим значением рН.
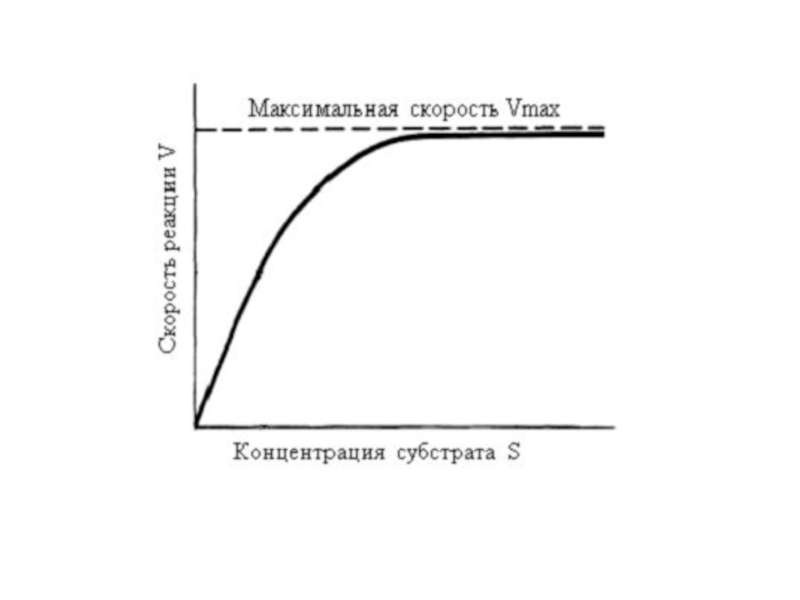
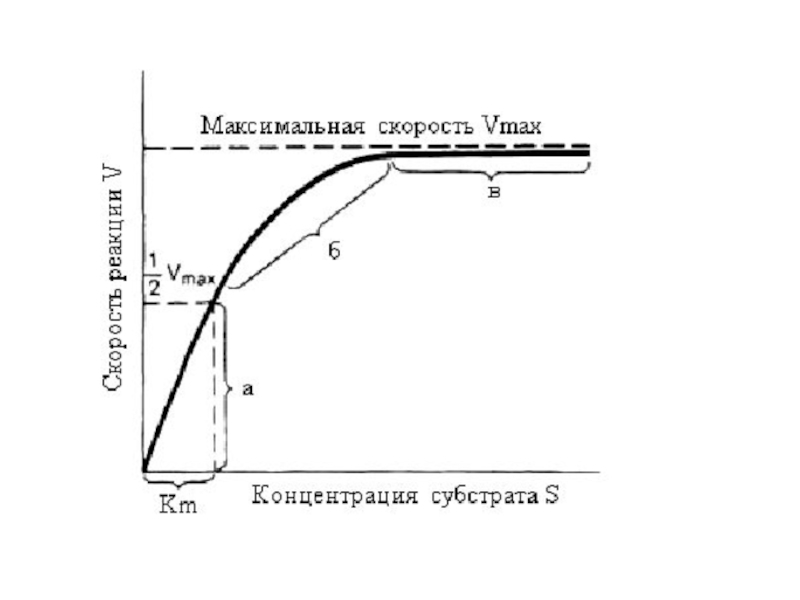
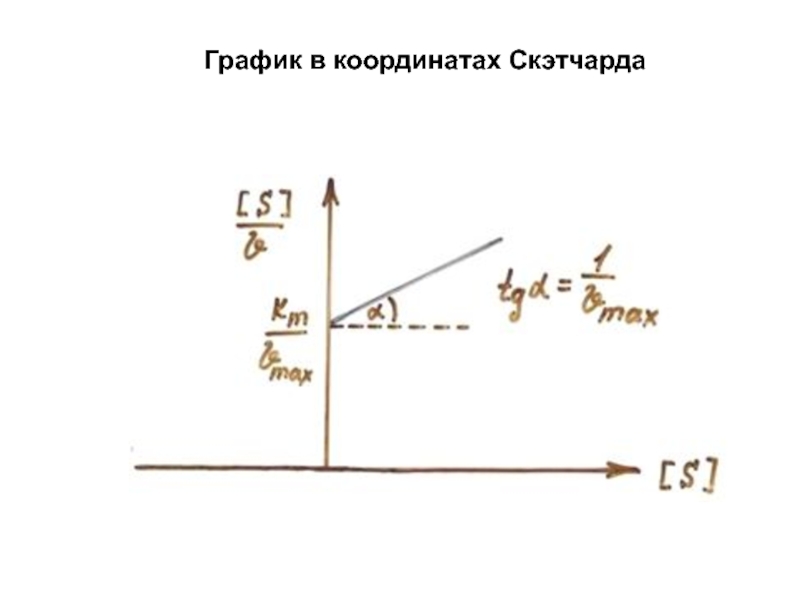
Слайд 16Зависимость скорости ферментативной реакции от количества субстрата
Одним из наиболее существенных
факторов, определяющих скорость ферментативной реакции, является концентрация субстрата (или субстратов)
и продукта(продуктов).
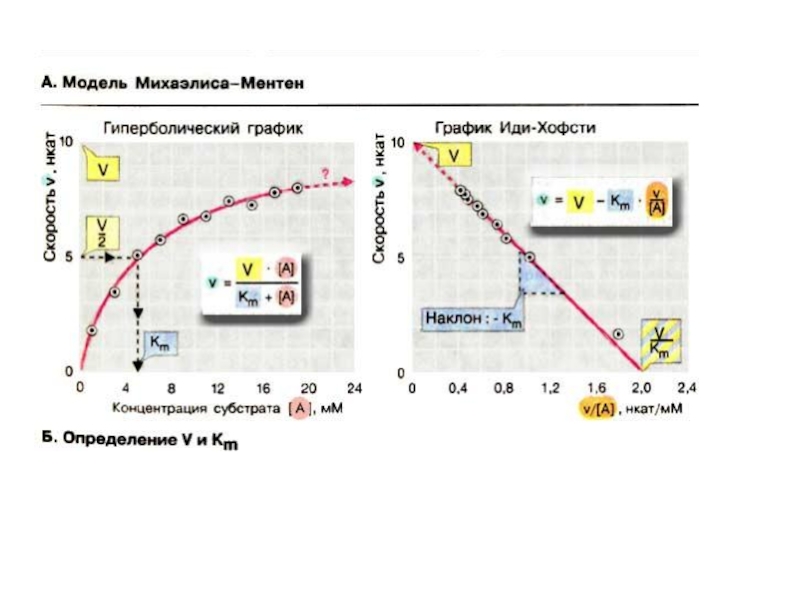
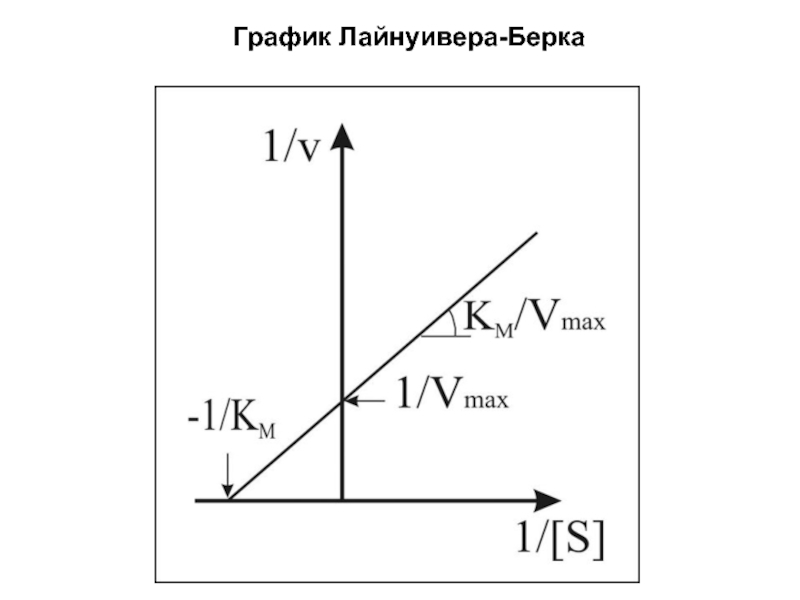
В случае постоянной концентрации фермента скорость реакции постепенно увеличивается, достигая определенного максимума, при котором дальнейшее увеличение количества субстрата практически не оказывает влияния на скорость ферментативной реакции.
В таких случаях принято считать, что субстрат находится в избытке, а фермент полностью насыщен, т. е. все молекулы фермента связаны с субстратом.
Фактором, ограничивающим скорость реакции, при этом становится концентрация фермента.


![Основы кинетики ферментативных реакции Математически скорость ферментативной реакции выражается в изменении концентрации субстрата (уменьшение) или Математически скорость ферментативной реакции выражается в изменении концентрации субстрата (уменьшение) или продукта (увеличение) за единицу времени:V= D[S]/t](/img/thumbs/c458c3f14aff12f12dc54f43eba154f0-800x.jpg)