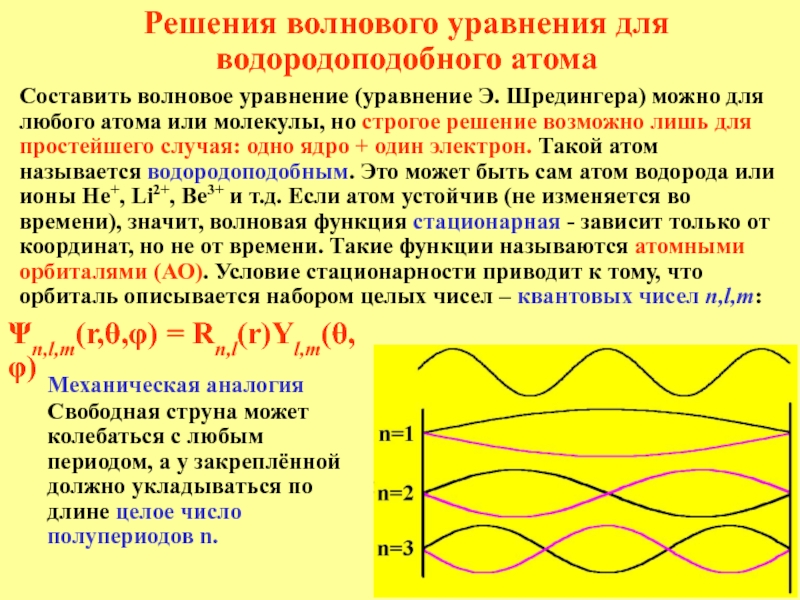
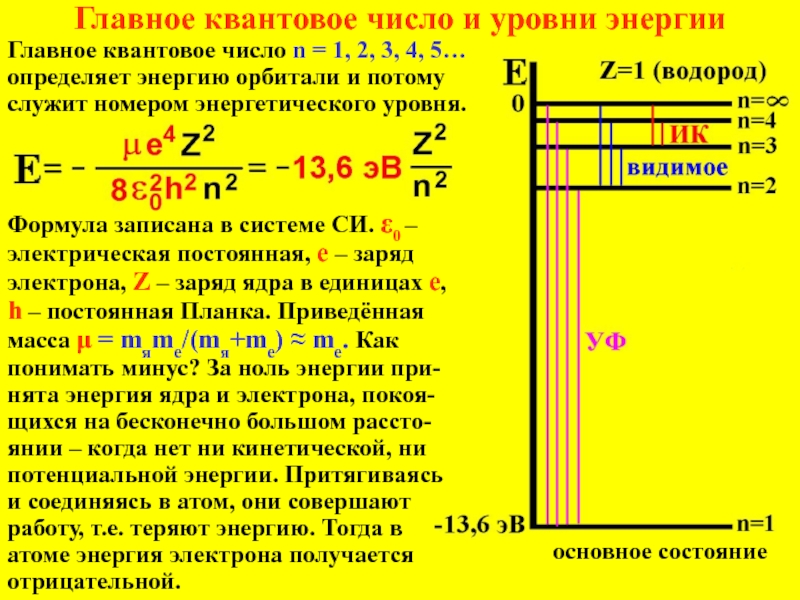
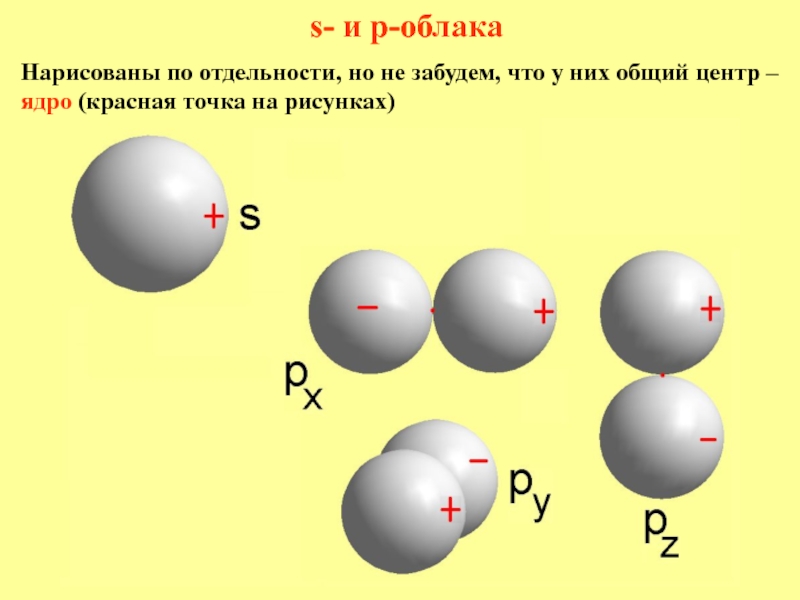
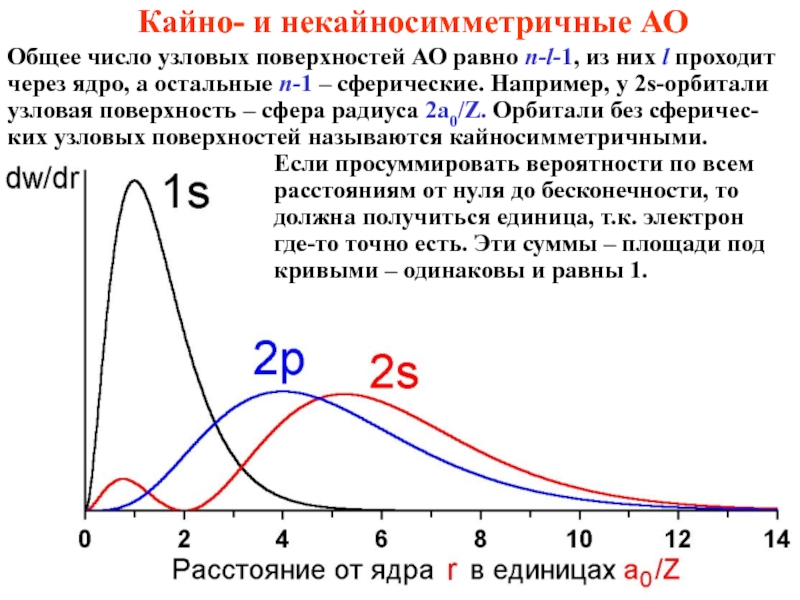
лишь при не очень высоких скоростях и не очень малых
массах. Когда скорости тел приближаются к световой – вступает в действие теория относительности; когда массы тел уменьшаются – вступает в действие квантовая механика; релятивистская квантовая механика рассматривает оба этих случая вместе.Корпускулярно-волновой дуализм (двойственность частица-волна)
Объекты Электроны, нейтроны Электромагнитные волны
Признаки Есть масса покоя, Энергия переносится
частиц импульс порциями (фотоэффект);
есть импульс (давление
света, эффект Комптона)
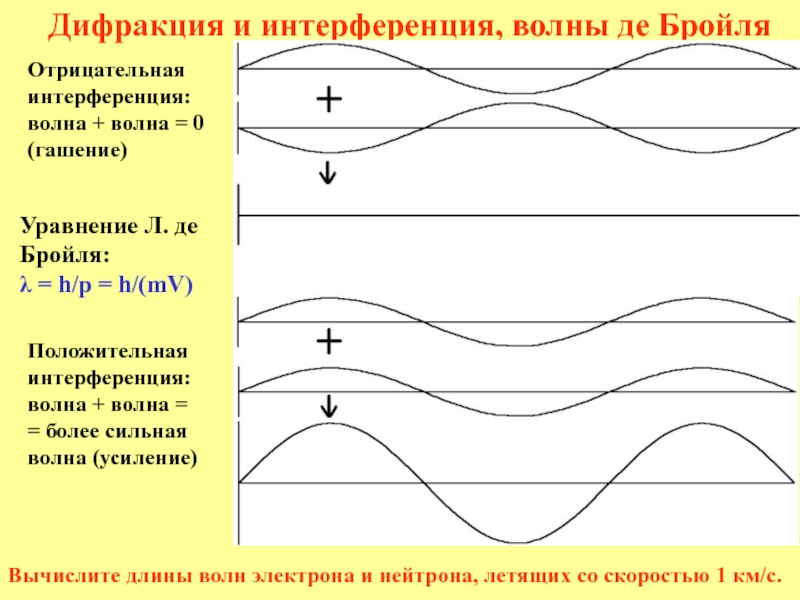
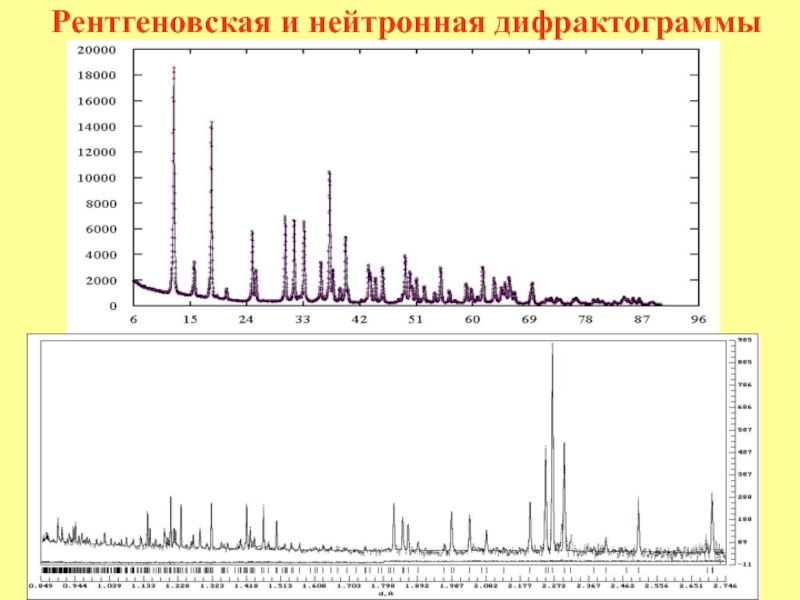
Признаки Дифракция и интерференция электронов, нейтронов,
волн рентгеновских лучей – на кристалле, света – на
искусственной дифракционной решетке
Закон фотоэффекта: h = A + Eкин, где А – работа выхода электрона, Eкин - кинетическая энергия выбитого светом электрона. Красная граница фотоэффекта 0 = А/h.