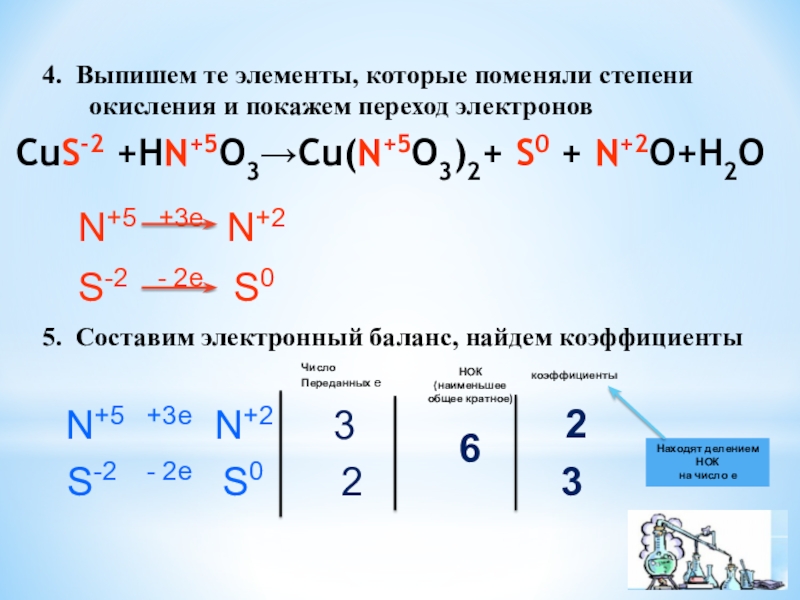
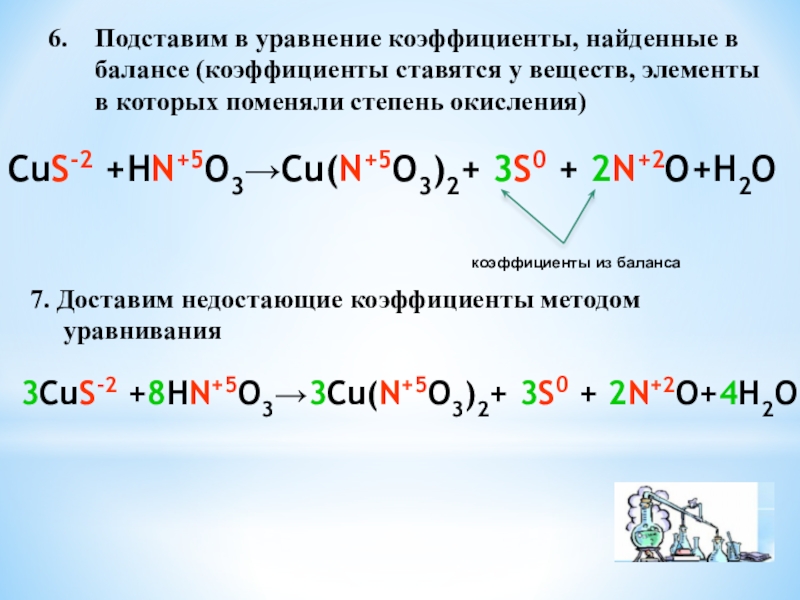
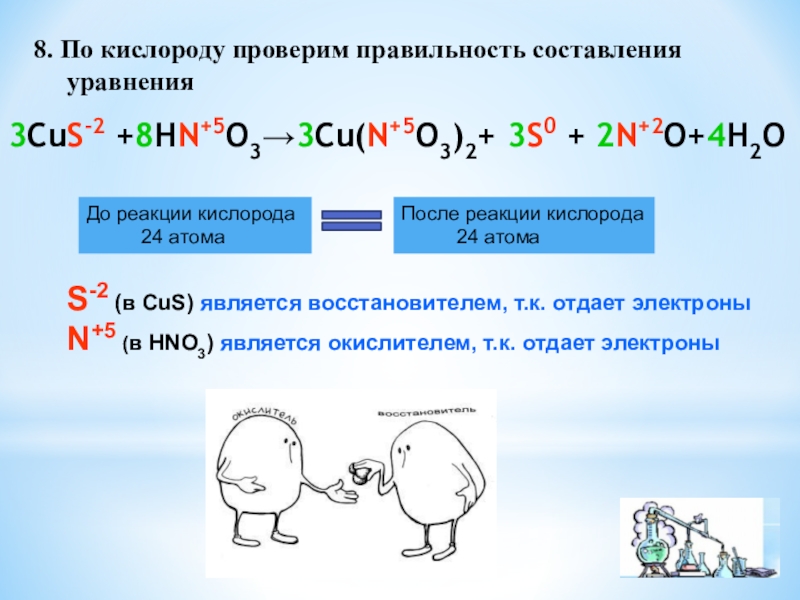
степень окисления двух элементов, один из которых является окислителем, а
другой – восстановителемОкислитель – это тот элемент, который
в процессе реакции принимает электроны
и сам при этом восстанавливается
Восстановитель – это тот элемент, который
в процессе реакции отдает электроны
и сам при этом окисляется