Слайд 1ПЕРВИННА І ВТОРИННА СТРУКТУРА БІЛКІВ. ДОМЕНИ І ТРЕТИННА СТРУКТУРА БІЛКІВ
Слайд 2Вступ
•Всі процеси в клітині здійснюються за участю
білків. Структурні білки утворюють з’єднувальні тканини, входять до складу шкіри,
волосся і т.д. Білки здійснюють імунологічну функцію. Транспортні білки відповідають за перенесення іонів та інших речовин через мембрану. Найбільш важлива роль належить ферментам, які є каталізаторами і регулюють всі процеси в організмі.
• Унікальні властивості білків визначаються їх просторовою структурою, яка в залежності від послідовності одних і тих самих амінокислот може бути різною.
• Білки є динамічними структурами, які можуть в процесі функціонування конформаційно змінюватися.
Слайд 3Амінокислоти
Амінокислоти - це органічні кислоти, у яких атом водню α-вуглецевого
атома заміщений на аміногрупу - NH2. Отже, за хімічною природою-це
α-амінокислоти з загальною формулою:
З цієї формули видно, що до складу всіх амінокислот входять такі загальні групи: - CH2 , - NH2, - COOH. Бічні ж ланцюги (радикали - R) амінокислот різняться. Хімічна природа радикалів різноманітна: від атома водню до циклічних сполук. Саме радикали визначають структурні і функціональні особливості амінокислот.
Слайд 4Карбоксильна група
Карбоксильна група (карбоксил)-СООН - функціональна одновалентна
група, що входить до складу карбонових кислот і визначає їх
кислотні властивості.
Карбоксильна група поєднує в собі дві функціональні групи –
карбоніл = CO і гідроксил-ОН, що взаємно впливають одна на одну.
Слайд 5Білки являють собою нерегулярні полімери, побудовані із залишків α -амінокислот-,
загальну формулу яких у водному розчині при значеннях рН близьких
до нейтральних можна записати як NH3+CHRCOO- Залишки амінокислот в білках з'єднані між собою амідним зв'язком між α-аміно-і
α-карбоксильними групами. Зв'язок між двома α-амінокислотними залишками зазвичай називається пептидним зв'язком, а полімери, побудовані із залишків α-амінокислот, з'єднаних пептидними зв'язками, називають поліпептидами. Білок як біологічна структура може являти собою як один поліпептид, так і декілька поліпептидів, що утворюють в результаті не ковалентних взаємодій єдиний комплекс.
Хімічний аналіз показав наявність у всіх білках вуглецю (50-55%), кисню (21-23%), азоту (15-17%), водню (6-7%), сірки (0,3-2,5%) . У складі окремих білків виявлено також фосфор, йод, залізо, мідь і деякі інші макро-і мікроелементи, в різних, часто дуже малих кількостях
В складі білків може міститися до 20 амінокислот (напр. гліцин в желатині, лейцин в м’язових волокнах, оксилізин в білках риб.
Слайд 6Структура білка
Схематичне зображення утворення пептидного зв’язку.
Кристали різних білків, вирощені
на космічній станції «Мир»
Слайд 7Рівні структурної організації білка
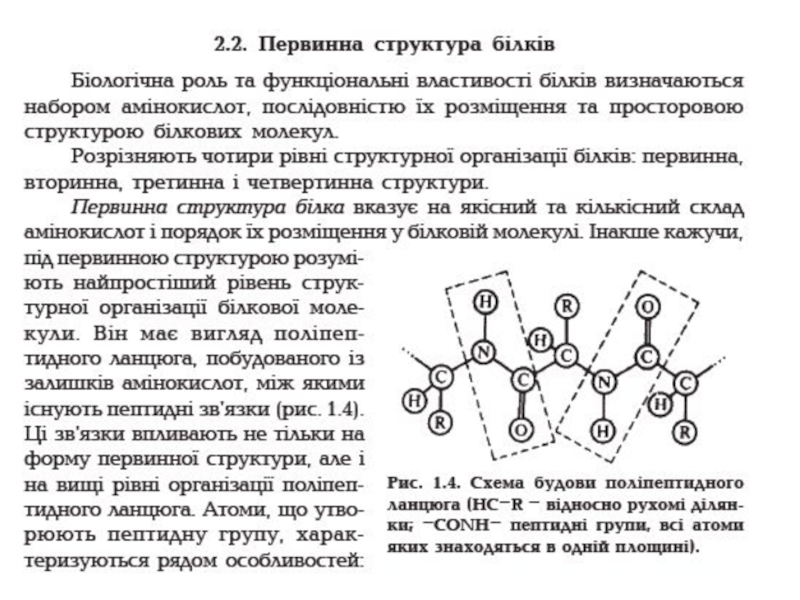
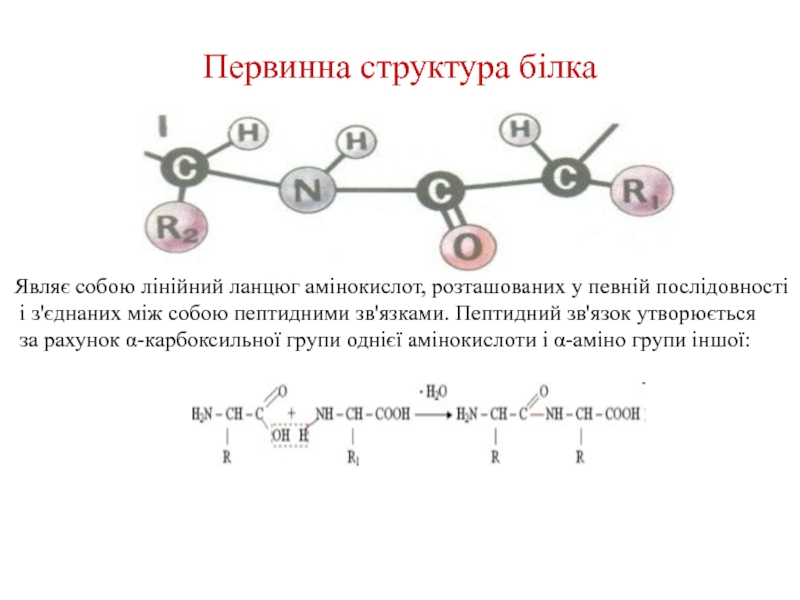
Слайд 10Первинна структура білка
Являє собою лінійний ланцюг амінокислот, розташованих у певній
послідовності
і з'єднаних між собою пептидними зв'язками. Пептидний зв'язок утворюється
за рахунок α-карбоксильної групи однієї амінокислоти і α-аміно групи іншої:
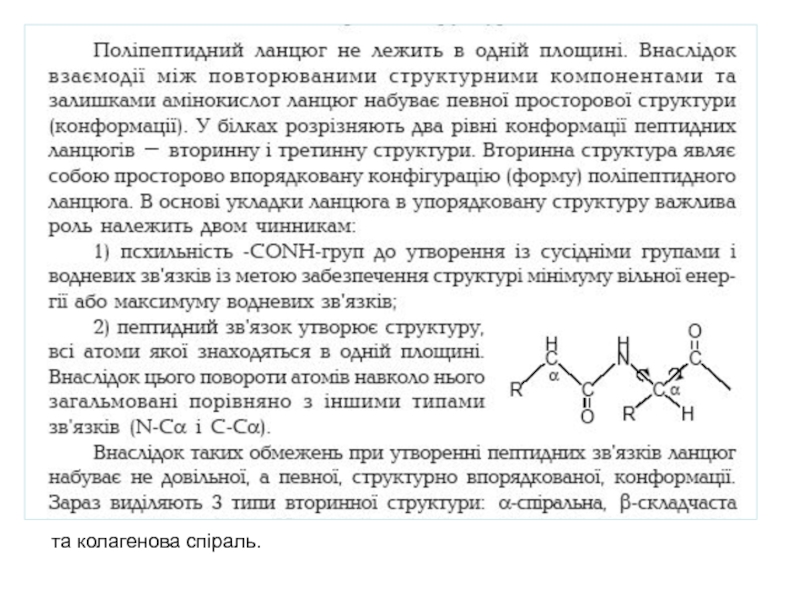
Слайд 11Вторинна структура білків
Фрагменти просторової структури білка, що мають періодичну будову,
розглядають
як елементи вторинної структури. Якщо на деякій ділянці
ланцюга однотипні
кути приблизно однакові, то структура поліпептидного
ланцюга набуває періодичний характер. Існує два класи таких
структур - спіральні і розтягнуті (плоскі або складчасті).
Слайд 12Спіральні структури білка
Для поліпептидних ланцюгів відомо кілька різних типів спіралей.
Серед них найбільш поширена права α-спіраль. Ідеальна-спіраль має крок 0,54
нм і кількість однотипних атомів на один виток спіралі 3,6, що означає повну періодичність на п'яти витках спіралі через кожні 18 амінокислотних залишків. Значення кутів для ідеальної-спіралі = φ- 57 градусів ψ= - 47 градусів, а відстані від атомів, що утворюють поліпептидний ланцюг, до осі спіралі становлять для N 0,15 нм, для Сα 0,23 нм , для Ск 0,17 нм. Будь конформація існує за умови, що є чинники, які стабілізують її. У випадку α -спіралі такими чинниками є водневі зв'язки, утворені кожним карбонільним атомом.
Слайд 13Складчасті структури білка
β-складчасті листи, що складаються з двох фрагментів,
кожен з яких представлений поліпептидом.
β -складки також стабілізуються водневими
зв'язками між атомом водню амінної групи одного фрагмента і атомом кисню карбоксильної групи іншого фрагмента. При цьому фрагменти можуть мати як паралельну, так і антипаралельну орієнтацію відносно один одного.
Структура, що утворюється в результаті таких взаємодій, являє собою гофровану структуру. Якщо структура є плоскою, повністю розтягнутою, то кути повинні були б скласти 180 градусів, але в реальних β -шарах вони мають значення φ = - 119 градусів і ψ = + 113 градусів.
Слайд 15Можливість вигинів в ланцюзі і наявність у молекулах білків різних
взаємодій (іонних, гідрофобних, утворення дисульфідних і водневих зв'язків) між групами,
далеко віддаленими один від одного в поліпептидному ланцюзі, призводять до компактного укладання цього ланцюга.
Розташування в просторі елементів вторинної структури і невпорядкованих ланок поліпептидного ланцюга називається третинною структурою білка.
Відмінність між вторинною і третинною структурами певною мірою умовно, оскільки насправді ми маємо справу з єдиною просторовою структурою (конформацією) білка, що складається із регулярних ділянок і невпорядкованих ланок.
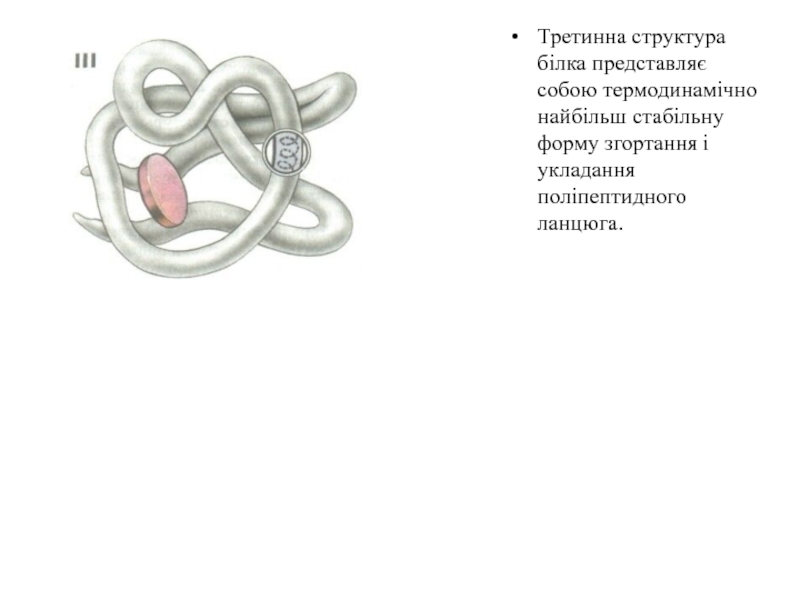
Слайд 16Третинна структура білка представляє собою термодинамічно найбільш стабільну форму згортання
і укладання поліпептидного ланцюга.
Слайд 17 За формою третинної структури білки діляться на глобулярні й
фібрилярні. Глобулярні білки мають еліпсоїдну форму, а фібрилярні – видовжену
(палички, нитки). Більшість білків у нативному стані має компактну структуру.
Які сили сприяють формуванню третинної структури білка?
Доведено, що у формуванні просторової структури білків, крім ковалентних зв'язків (пептидні й дисульфідні), основну роль відіграють так звані нековалентні зв'язки: водневі, іонні, вандерваальсові сили, гідрофобна взаємодія та інші. За сучасними даними, інформація для утворення третинної структури закладена генетично в первинній структурі.
Рушійною силою для утворення тривимірної структури білка є взаємодія амінокислот із молекулами води. За цих умов неполярні (гідрофобні) радикали таких амінокислот, як лейцин, ізолейцин, фенілаланін, триптофан, виштовхуються з води і занурюються всередину білкової молекули. Разом із тим, полярні, або іоногенні, радикали (особливо аспарагінової і глутамінової кислот, аргініну і лізину) розміщуються на зовнішній поверхні молекули і перебувають у гідратованому стані.

Слайд 18У стабілізації третинної структури білків значну роль відіграють і дисульфідні
зв'язки, за рахунок яких віддалені ділянки одного поліпептидного ланцюга (або
двох суміжних ланцюгів) наближаються та фіксуються. Дисульфідні зв'язки існують у багатьох, але не у всіх білках. Наприклад, їх немає в гемоглобіні та міоглобіні. Вони виникають за рахунок сульфгідрильних (тіолових) груп цистеїну. Сполука, яка утворюється в результаті окиснення 2-х молекул цистеїну, названа циститом.
Прикладом білкових структур, що містять дисульфідні зв'язки, можуть бути інсулін та рибонуклеаза. Інсулін містить два дисульфідні зв'язки між пептидними ланцюгами та один – у самому пептидному ланцюзі. В рибонуклеазі дисульфідні зв'язки існують між віддаленими ділянками поліпептидного ланцюга.
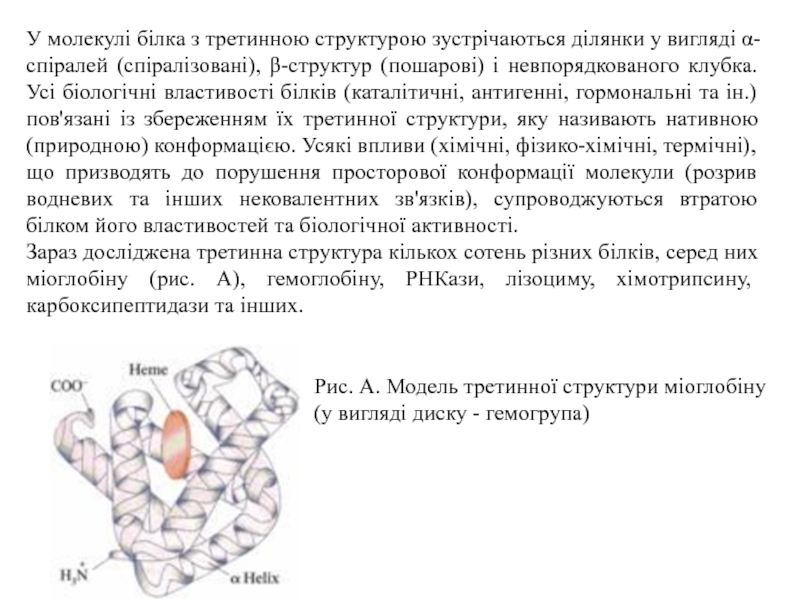
Слайд 19У молекулі білка з третинною структурою зустрічаються ділянки у вигляді
α-спіралей (спіралізовані), β-структур (пошарові) і невпорядкованого клубка. Усі біологічні властивості
білків (каталітичні, антигенні, гормональні та ін.) пов'язані із збереженням їх третинної структури, яку називають нативною (природною) конформацією. Усякі впливи (хімічні, фізико-хімічні, термічні), що призводять до порушення просторової конформації молекули (розрив водневих та інших нековалентних зв'язків), супроводжуються втратою білком його властивостей та біологічної активності.
Зараз досліджена третинна структура кількох сотень різних білків, серед них міоглобіну (рис. А), гемоглобіну, РНКази, лізоциму, хімотрипсину, карбоксипептидази та інших.
Рис. А. Модель третинної структури міоглобіну
(у вигляді диску - гемогрупа)
Слайд 20Для всіх білків із третинною структурою є характерною, так звана
"мозаїчна" будова поверхні білка. Це означає, що поверхня білка в
основному гідрофільна, але містить невеликі неполярні ділянки (отже, не всі гідрофобні залишки амінокислот розміщені всередині білкової молекули).
Саме через "мозаїчну" структуру поверхні білка зв'язування ферменту з його субстратом або коферментом завжди відбувається за допомогою невеликої гідрофобної ділянки на поверхні білка.
Ця ділянка, як правило, негідратована (або мало гідратована), що створює умови для виникнення гідрофобної взаємодії. Треба мати на увазі, що білкова глобула не є абсолютно жорсткою структурою: в певних межах окремі ділянки пептидного ланцюга можуть взаємно переміщуватися, що супроводжується розривом незначної кількості слабких зв'язків і утворенням нових. Ці зміни можна розглядати як теплові рухи окремих ділянок пептидного ланцюга, вони не викликають порушення конформації молекули.
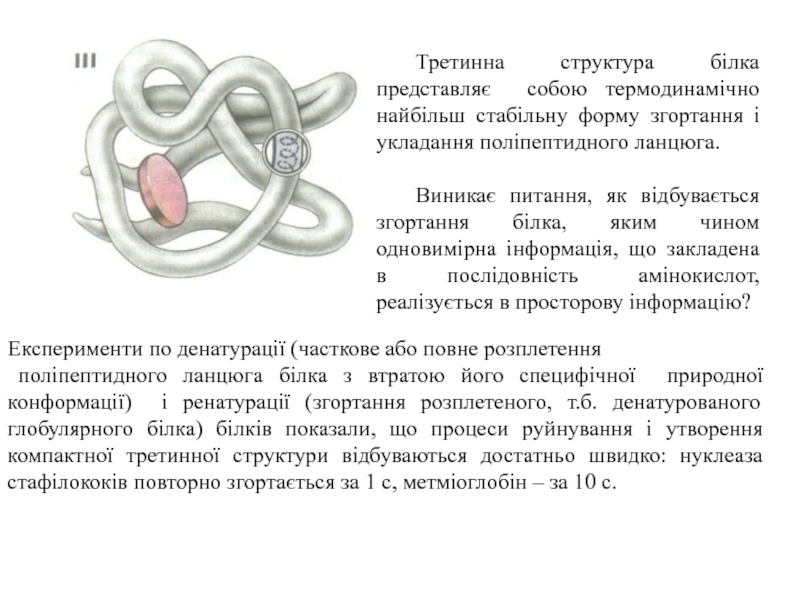
Слайд 21Третинна структура білка представляє собою термодинамічно найбільш стабільну форму згортання
і укладання поліпептидного ланцюга.
Виникає питання, як відбувається згортання білка,
яким чином одновимірна інформація, що закладена в послідовність амінокислот, реалізується в просторову інформацію?
Експерименти по денатурації (часткове або повне розплетення
поліпептидного ланцюга білка з втратою його специфічної природної конформації) і ренатурації (згортання розплетеного, т.б. денатурованого глобулярного білка) білків показали, що процеси руйнування і утворення компактної третинної структури відбуваються достатньо швидко: нуклеаза стафілококів повторно згортається за 1 с, метміоглобін – за 10 с.
Слайд 22 Для пояснення процесів згортання використовується нуклеаційна модель.
Нуклеаційна
модель згортання білка. а- конформація невпорядкованого клубка,
б- утворення α-спіралей
і β-структур, в-компактна третинна структура білка.
Слайд 23 Припускається, що короткі сегменти поліпептидного ланцюга дуже
швидко згортаються незалежно один від одного, а на другому етапі
зближуються , утворюючи компактну тримірну структуру. Сегменти білка утворюють α-спіралі і β-листи з великою швидкістю. Перехід спіраль-клубок 10-6-10-8с.
Поділяють: глобулярні білки- просторова структура цих білків в грубому наближенні може бути представлена у вигляді кулі чи не сильно витягнутого еліпсоїда - глобули. Як правило, значна частина поліпептидного ланцюга таких білків формує α-спіралі і β-листи. Співвідношення між ними може бути самим різним (міоглобін).
Фібрилярні білки- Ці білки мають витягнуту ниткоподібну форму, вони виконують в організмі структурну функцію.(α- креатин).
Домени-область одного поліпептидного ланцюга, що знаходиться в
об’ємі. Ці ділянки ланцюга згортаються і розгортаються незалежно одна
від одної. Домен-автономна структурна одиниця, зв’язана обмеженою
кількістю пептидних зв’язків, які легко розриваються (міозин,
імуноглобулін).
Слайд 24Невеликі зміни просторової структури білків відбуваються і при взаємодії їх
з іншими молекулами. Наприклад, конформація гемоглобіну з приєднаним до нього
киснем дещо відмінна від конформації гемоглобіну без кисню. Білкова молекула характеризується кооперативними властивостями, тобто відповідає на впливи як єдине ціле: зміна в одній частині молекули призводить до зміни у всіх частинах її.
В основі кооперативної зміни білка лежить об'єднання амінокислотних залишків в єдину структуру за допомогою пептидних та інших взаємодій.
Для вивчення третинної структури білка найчастіше використовують метод рентгеноструктурного аналізу та електронної мікроскопії.
Слайд 25Рентгеноструктурний аналіз вирішує дві проблеми хімії білків: закономірності чергування послідовності
амінокислотних залишків у поліпептиді та закономірності конформації білкової молекули.
Міжатомні віддалі
в молекулах органічних речовин складають 0,1‑0,2 нм, а максимальна роздільна здатність сучасних апаратів для рентгеноструктурного аналізу дорівнює 0,2 нм. Таким чином, метод дає можливість розрізнити окремі скупчення атомів, особливо при введенні в молекулу білків атомів важких металів.
Останні внаслідок високої електронної густини використовуються як точки відліку при математичній обробці рентгенограм.
Для визначення конфігурації білків і окремих частин їх молекул, наприклад спіральних ділянок, використовується електронна мікроскопія. При цьому для підвищення електронної густини (контрастності) білків застосовують спеціальні речовини, які адсорбуються на поверхні білка. Якщо тепер на такий білок спрямувати пучок електронів, то відбувається поглинання їх контрастними речовинами (на плівці вони світлі).
Слайд 26Класифікація білків
Всі білки в залежності від будови діляться
на прості - протеїни, що складаються тільки з амінокислот (альбуміни,
глобуліни), і складні - протеїди, які мають небілкову протеїстичну групу (гемоглобін).
Слайд 27Властивості білків
Білки мають високу молекулярну масу, деякі
розчиняються у воді, здатні до набухання, характеризуються оптичною активністю, рухливістю
в електричному полі і активно вступають в хімічні реакції. Молекулярна маса білків знаходиться в межах
10 000 - 1 000 000. Розмір білка може вимірюватися в числі амінокислот або в дальтонах.
Денатурація-втрата білком первинної
структури в результаті нагріву або хім.
реакцій.