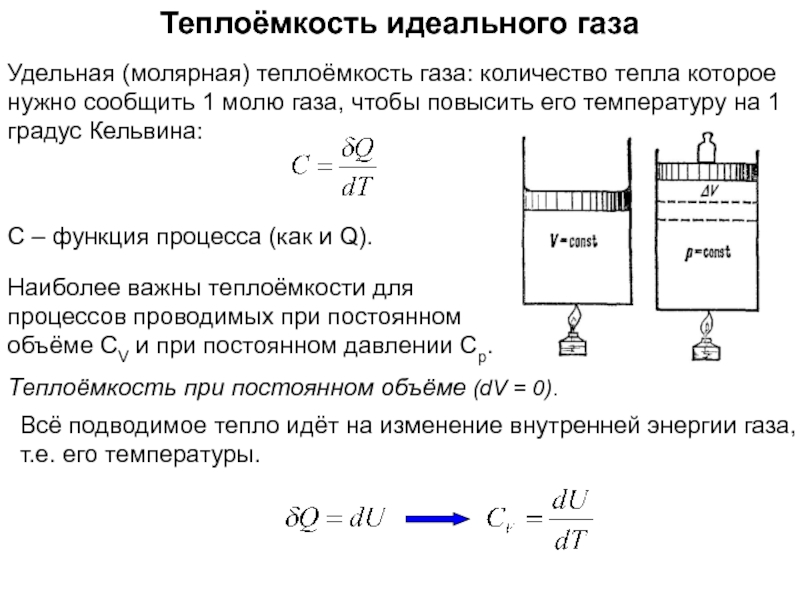
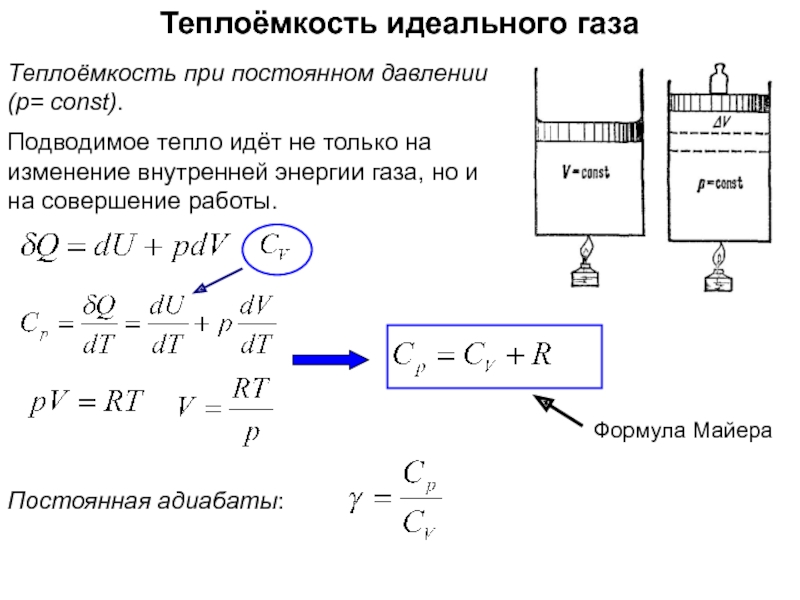
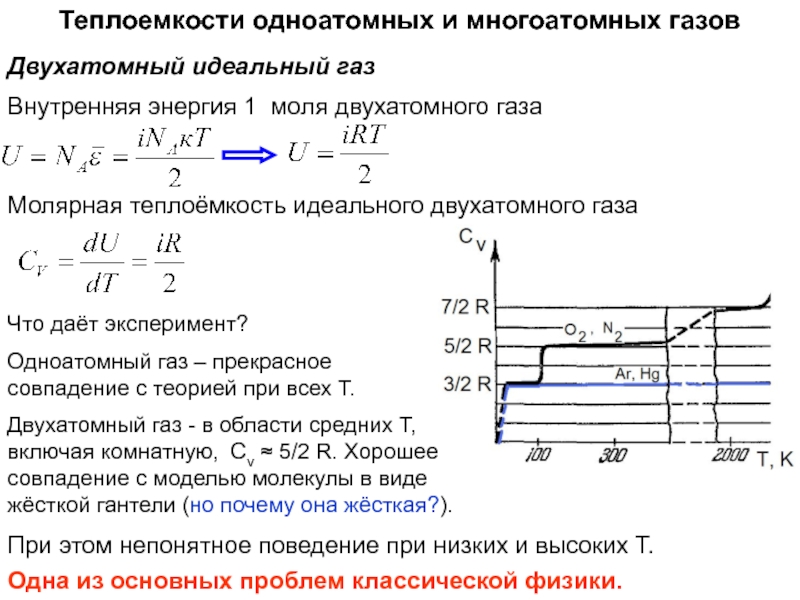
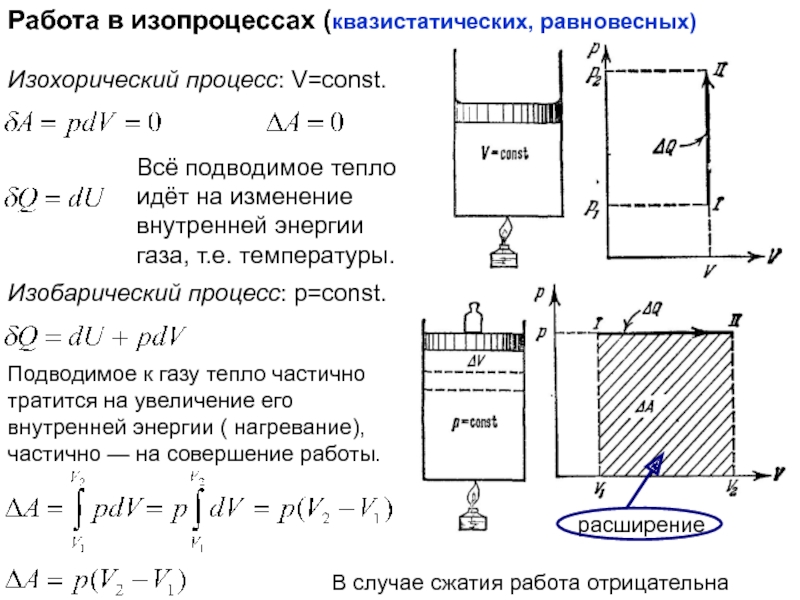
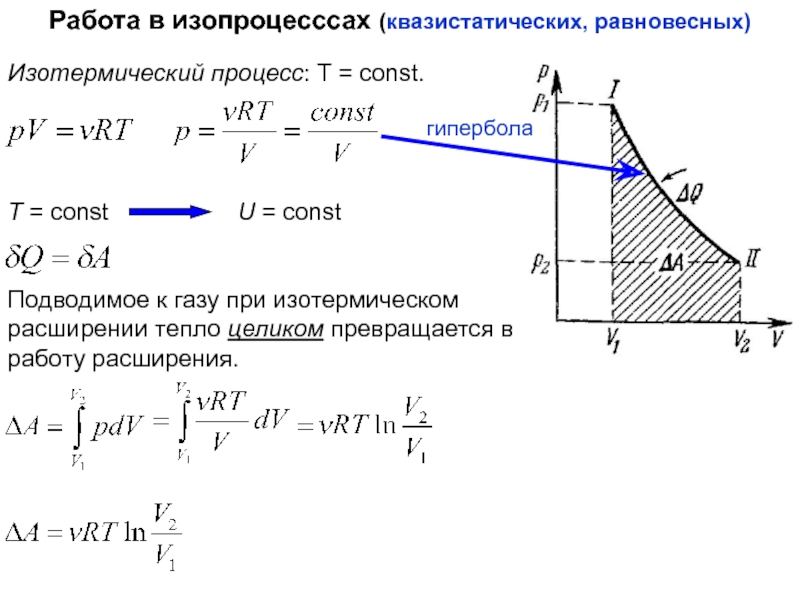
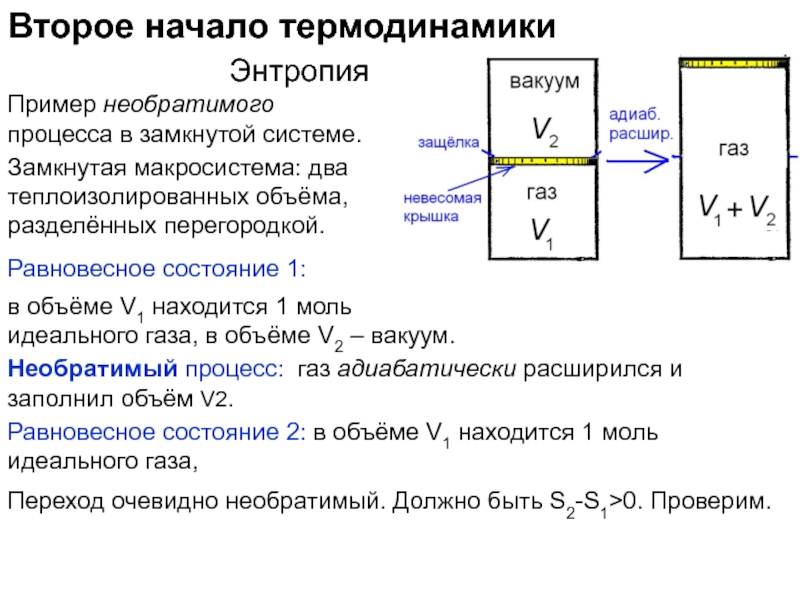
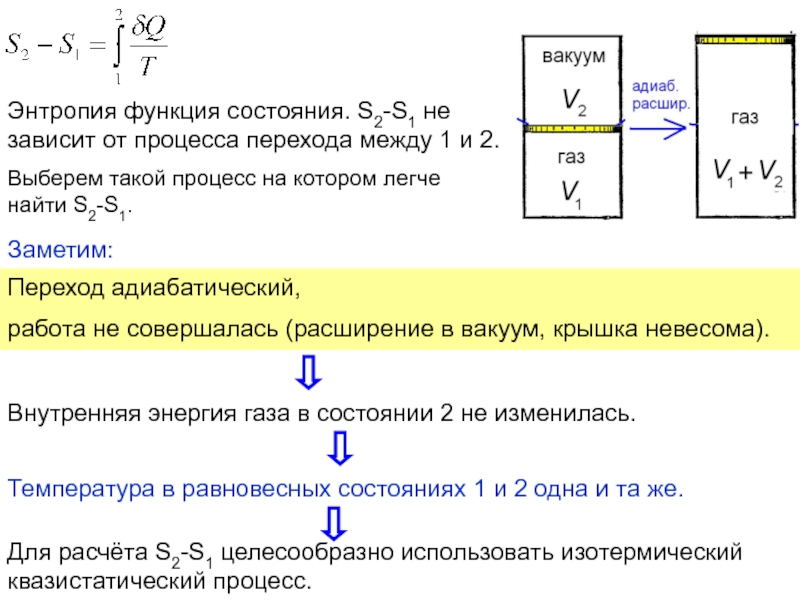
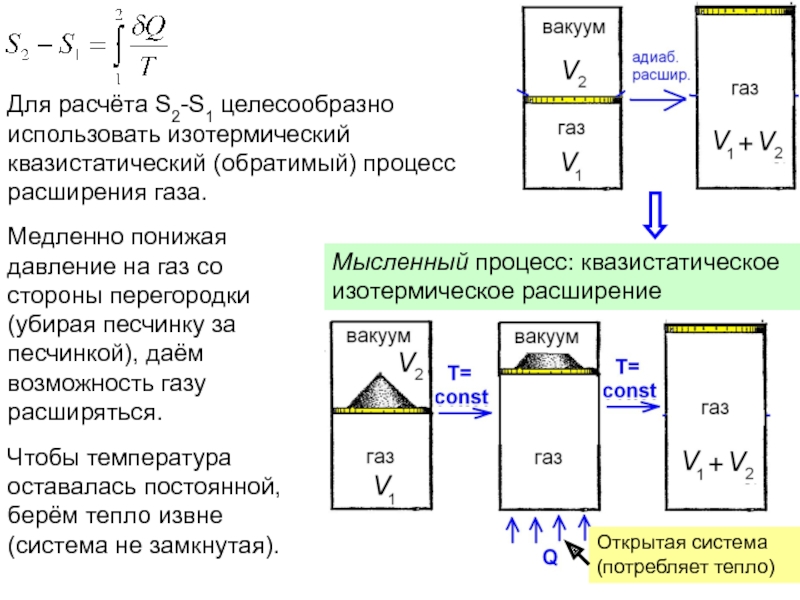
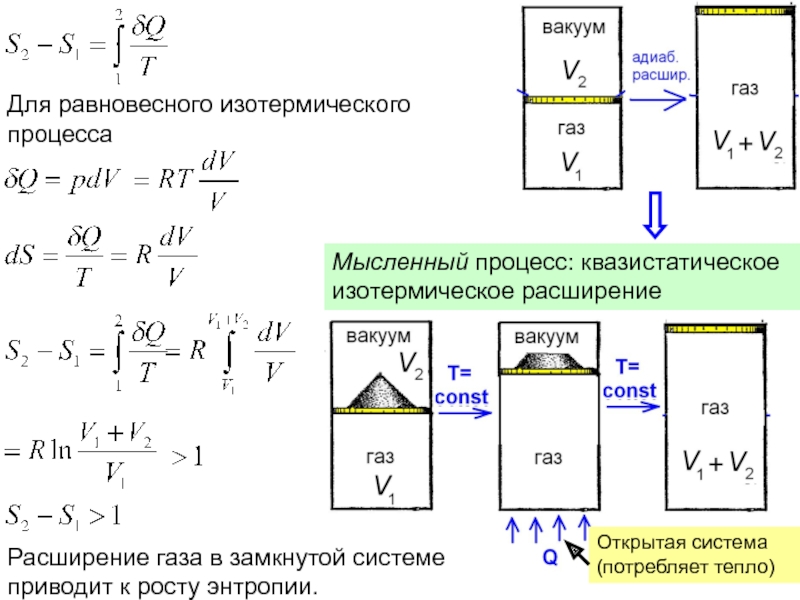
функций состояния
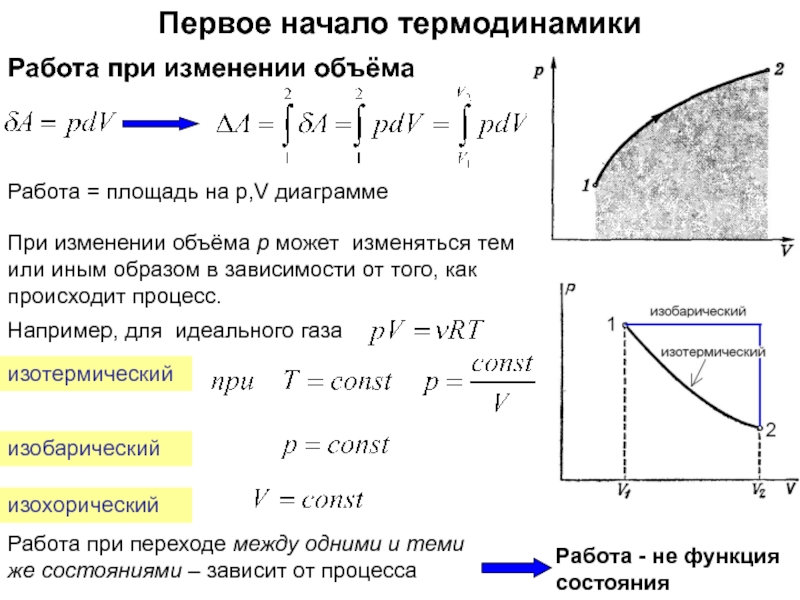
Работа при изменении объёма
«δ» обозначение бесконечно малых в
случае, когда функция не является функцией состояния.dV – приращение объёма макросистемы (например, газа)
p – давление оказываемое на соседние тела (стенки)
Элементарная работа сил, действующих со стороны газа на стенки
δA=Fdh
не функции состояния
=pSdh
=pdV
С учётом выражения для работы при изменении объёма первое начало термодинамики может быт записано в форме