Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ И ДИСПЕРСНЫЕ СИСТЕМЫ
Содержание
- 1. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ И ДИСПЕРСНЫЕ СИСТЕМЫ
- 2. Содержание лекцииАдсорбция как поверхностное явление.Виды адсорбции.Количественные характеристики
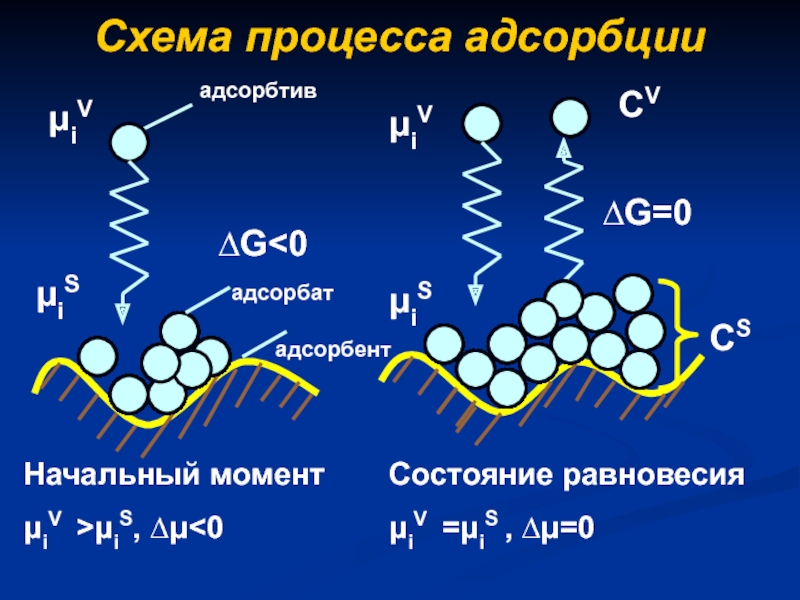
- 3. Схема процесса адсорбции∆GμiS, ∆μ
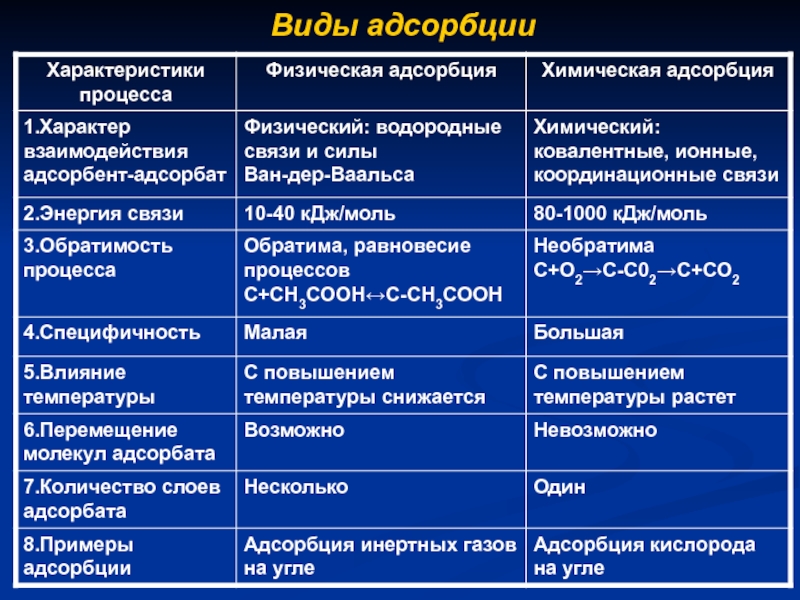
- 4. Виды адсорбции
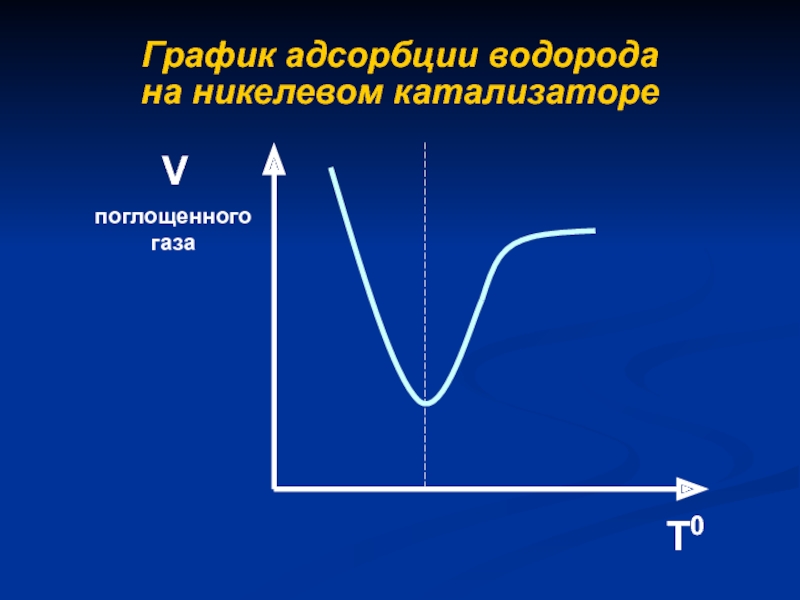
- 5. График адсорбции водорода на никелевом катализатореТ0Vпоглощенного газа
- 6. Количественные характеристики адсорбцииГi=ni/S или Гi=ni/m , ni
- 7. Фундаментальное уравнение адсорбции ГиббсаВ условиях равновесия
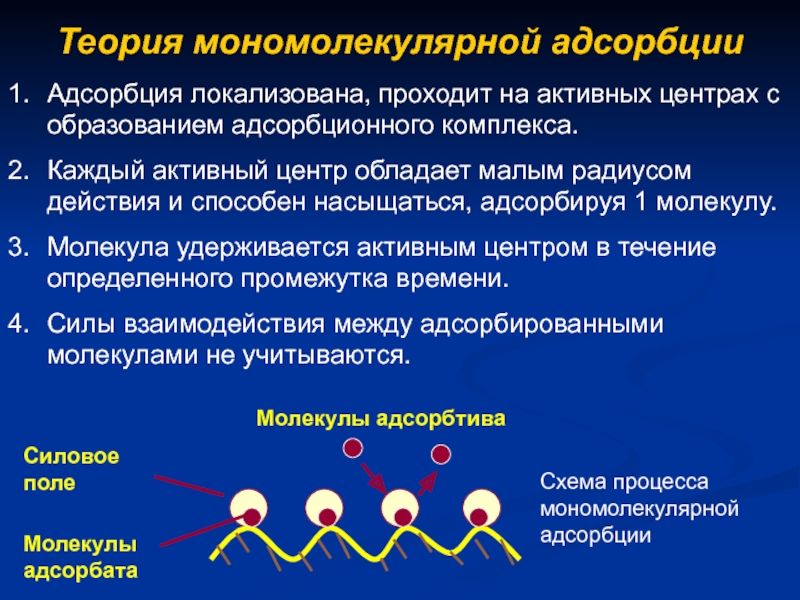
- 8. Теория мономолекулярной адсорбцииАдсорбция локализована, проходит на активных
- 9. Уравнение изотермы адсорбцииПусть поверхность имеет площадь равную
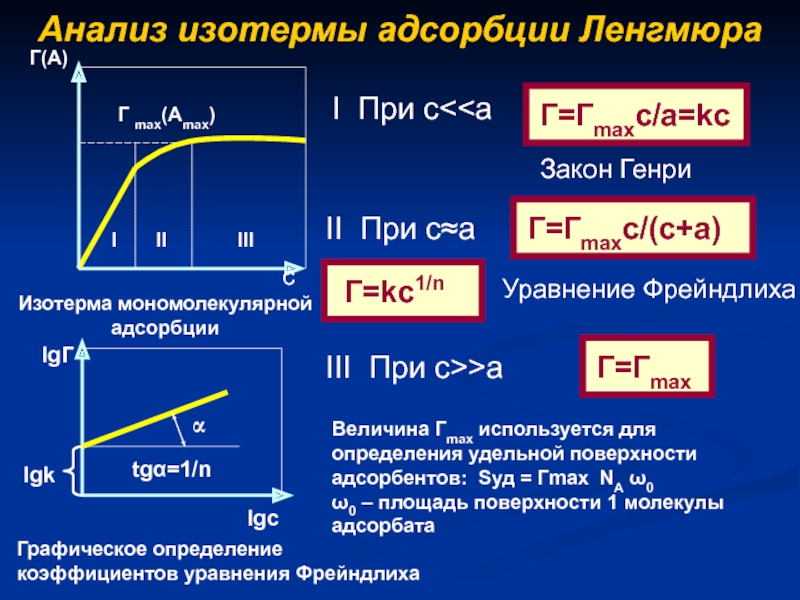
- 10. Анализ изотермы адсорбции ЛенгмюраcИзотерма мономолекулярной адсорбцииВеличина Гmax
- 11. Теория полимолекулярной адсорбцииАдсорбция не локализована и обусловлена
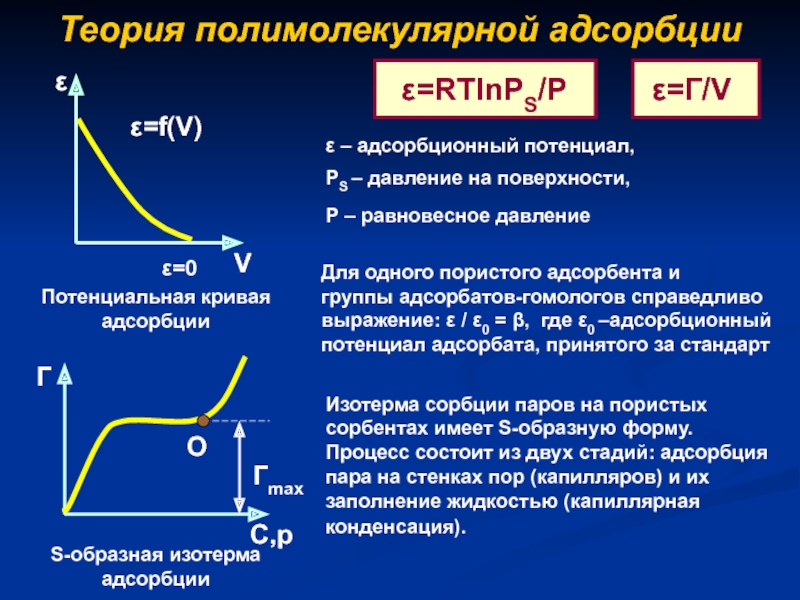
- 12. Теория полимолекулярной адсорбцииS-образная изотерма адсорбцииС,рPS – давление
- 13. Обобщенная теория адсорбции БЭТ (Брунауэра, Эммета, Теллера)На
- 14. Уравнение теории БЭТр (рS) – давление пара
- 15. Вопросы к лекции 41. Дайте определение процессам адсорбции
- 16. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Содержание лекции
Адсорбция как поверхностное явление.
Виды адсорбции.
Количественные характеристики адсорбции. Причины адсорбции.
Теория
мономолекулярной адсорбции.
Слайд 6Количественные характеристики адсорбции
Гi=ni/S или Гi=ni/m , ni – избыточное число
молей адсорбата i– го компонента,S - площадь поверхности раздела фаз,
m – масса адсорбентаСлайд 7Фундаментальное уравнение
адсорбции Гиббса
В условиях равновесия при dT=0, dp=0, dq=0
При
неизменных значениях n и S, подставив вместо n\S=Г , получим:
фундаментальное
уравнение адсорбции ГиббсаДля адсорбции одного компонента:
Слайд 8Теория мономолекулярной адсорбции
Адсорбция локализована, проходит на активных центрах с образованием
адсорбционного комплекса.
Каждый активный центр обладает малым радиусом действия и способен
насыщаться, адсорбируя 1 молекулу.Молекула удерживается активным центром в течение определенного промежутка времени.
Силы взаимодействия между адсорбированными молекулами не учитываются.
Молекулы адсорбтива
Силовое поле
Схема процесса мономолекулярной адсорбции
Молекулы адсорбата
Слайд 9Уравнение изотермы адсорбции
Пусть поверхность имеет площадь равную 1.
Θ – занятая
доля поверхности,
(1- Θ) – свободная доля поверхности
Скорость адсорбции
Скорость десорбцииk1,k2 – константы скорости
С - концентрация адсорбтива
При равновесии:
Vа=Vд
Θ=k1с/(k2+k1c)
или
Θ=с/(а+с)
а=k1/k2
Так как
Θ=Г/Гmax
Так как
Г=Гmax(c/(c+a))
- уравнение изотермы адсорбции Ленгмюра
Гmax – максимальная адсорбция при полном заполнении поверхности
Слайд 10Анализ изотермы адсорбции Ленгмюра
c
Изотерма мономолекулярной адсорбции
Величина Гmax используется для определения
удельной поверхности адсорбентов: Sуд = Гmax NA 0
0 –
площадь поверхности 1 молекулы адсорбатаСлайд 11Теория полимолекулярной адсорбции
Адсорбция не локализована и обусловлена физическими силами
На поверхности
нет активных центров, а действует непрерывное силовое поле, распространяющееся на
значительное расстояниеАдсорбционный слой полимолекулярен, его плотность убывает по нормали от поверхности
Адсорбционные силы не зависят от температуры
Слайд 12Теория полимолекулярной адсорбции
S-образная изотерма адсорбции
С,р
PS – давление на поверхности,
Р –
равновесное давление
ε – адсорбционный потенциал,
Изотерма сорбции паров на пористых сорбентах
имеет S-образную форму. Процесс состоит из двух стадий: адсорбция пара на стенках пор (капилляров) и их заполнение жидкостью (капиллярная конденсация). Для одного пористого адсорбента и
группы адсорбатов-гомологов справедливо
выражение: / 0 = , где 0 –адсорбционный
потенциал адсорбата, принятого за стандарт
Потенциальная кривая адсорбции
Слайд 13Обобщенная теория адсорбции БЭТ (Брунауэра, Эммета, Теллера)
На поверхности адсорбента имеется
определенное число равных в энергетическом отношении активных центров.
Каждая молекула
первого слоя представляет активный центр для молекул второго, что приводит к образованию второго, третьего и т.д. слоев.Построение последующих слоев возможно при незаполненном первом.
Взаимодействием соседних адсорбированных молекул в рамках одного слоя пренебрегают.
Слайд 14Уравнение теории БЭТ
р (рS) – давление пара адсорбтива в объеме
(в поверхностном слое) при данной температуре
С=kp/kL
kp=ka/kд – равновесная константа адсорбции
kL=1/p0
– константа конденсации параСлайд 15Вопросы к лекции 4
1. Дайте определение процессам адсорбции и десорбции. Какие
виды адсорбции Вы знаете?
2. Приведите примеры адсорбционных процессов.
3. Что называют
адсорбатом, адсорбтивом, адсорбентом?4. Назовите количественные характеристики процесса адсорбции.
5. Что такое изотерма адсорбции?
6. Какие величины связывает между собой фундаментальное уравнение адсорбции Гиббса?
7. Какие положения лежат в основе мономолекулярной теории адсорбции Ленгмюра?
8. Проанализируйте уравнение Ленгмюра и покажите его взаимосвязь с уравнением Фрейндлиха.
9. Какие положения лежат в основе полимолекулярной теории адсорбции Поляни?
10. Назовите область применения теории полимолекулярной адсорбции.
11. Какие положения лежат в основе теории полимолекулярной адсорбции БЭТ?
12. Что такое капиллярная конденсация?
13. Как можно определить удельную поверхность адсорбентов на основании теории БЭТ?