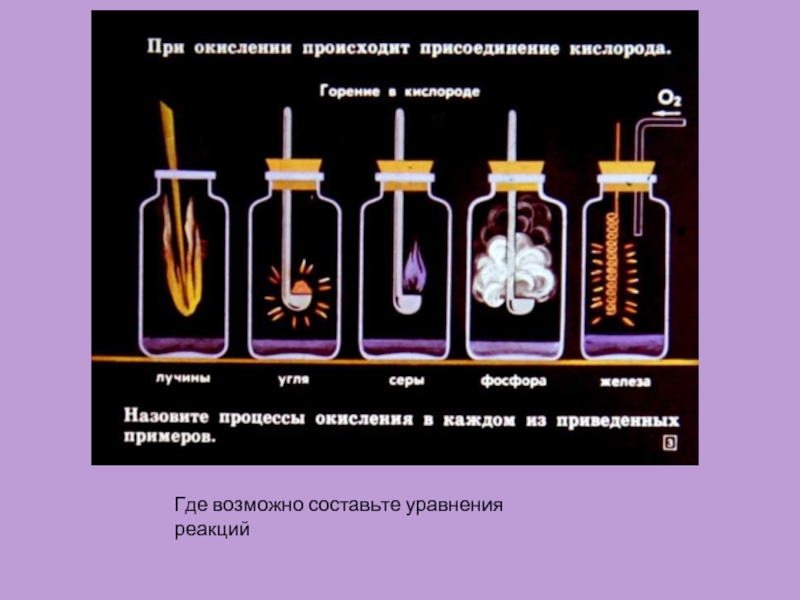
дойти. Нужно многое постичь, надо много сил вложить: Не бояться
отвечать и вопросы задавать. Уравнения химических реакций писать, Знать, как их отличать, Все задания выполнять, друг у друга проверять. Цель свою тогда достигнем – О типах реакций все постигнем!8 класс
По типу превращений реагирующих частиц
разложения:
замещения:
разложения:
обмена (в т.ч. тип реакции-нейтрализация):
замещения:
соединения: