Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ № 3
Содержание
- 1. ПРАКТИЧЕСКОЕ ЗАНЯТИЕ № 3
- 2. ПЛАН ЗАНЯТИЯ1. Определение чувствительности микроорганизмов к антибиотикам.2.
- 3. Определение чувствительности микроорганизмов к антибиотикам Для
- 4. Взвесь изучаемой «чистой» культуры засеять на специальную
- 5. Диски пропитанные разными антибиотиками
- 6. МЕТОД ДИСКОВ
- 7. УЧЕТ РЕЗУЛЬТАТОВ Действие АБ оценивают по явлению
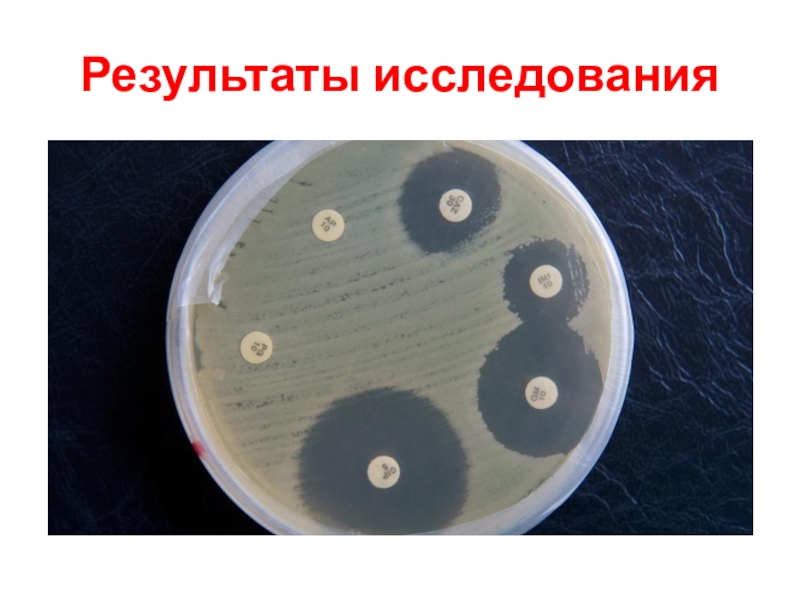
- 8. Результаты исследования
- 9. Виды стерилизации I.Физическая 1. Действием температуры:а) воздушный
- 10. Виды стерилизации II. Химическая 1. Газовый стерилизатор (газы
- 11. Дезинфекция – уничтожение патогенных микроорганизмов в окружающей
- 12. Использование при дезинфекции део-хлора
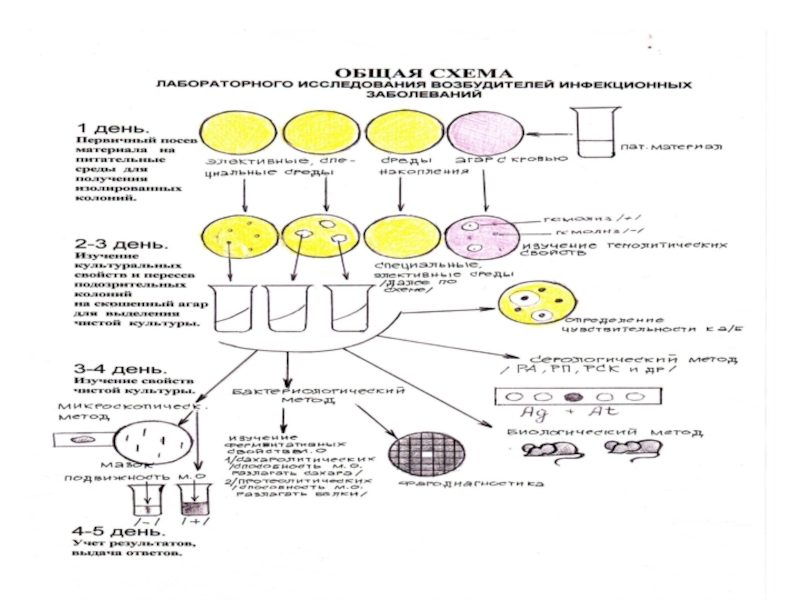
- 13. Общая схема лабораторных исследований возбудителей инфекционных заболеваний1
- 14. продолжение исследования3-4 день Исследование «чистой» культуры:приготовление микропрепарата
- 15. Слайд 15
- 16. Скачать презентанцию
ПЛАН ЗАНЯТИЯ1. Определение чувствительности микроорганизмов к антибиотикам.2. Стерилизация и дезинфекция в бактериологической практике.3. Изучение свойств «чистой» патогенной культуры.
Слайды и текст этой презентации
Слайд 1ПРАКТИЧЕСКОЕ ЗАНЯТИЕ № 3
ТЕМА:
Изучение свойств чистой культуры при БАКТЕРИОЛОГИЧЕСКОЙ диагностике
Слайд 2ПЛАН ЗАНЯТИЯ
1. Определение чувствительности микроорганизмов к антибиотикам.
2. Стерилизация и дезинфекция
в бактериологической практике.
Слайд 3Определение чувствительности микроорганизмов к антибиотикам
Для рационального проведения антибиотикотерапии необходимо
до начала лечения больного производить проверку чувствительности его патогенной микрофлоры
к антибиотикам.Это исследование дает возможность установить, какие АБ оказывают самое эффективное бактерицидное или бактериостатическое действие на м.о. в очаге инфекции, тем более, что в последние годы появились виды микробов устойчивые к различным АБ.
Существуют различные способы определения чувствительности бактерий к АБ, чаще всего используется «метод дисков». Для испытания чувствительности надо:
Слайд 4Взвесь изучаемой «чистой» культуры засеять на специальную питательную среду -
агар ,в чашку Петри «газоном» при помощи шпателя Дригальского.
На поверхность
засеянного агара пинцетом разместить диски, пропитанные раствором различных антибиотиков (диски фабричного изготовления находятся во флаколнах, могут быть различных цветов);Диски необходимо расположить на расстоянии 2 см. друг от друга от края чашки и слегка прижать к среде пинцетом;
Обозначить на чашке цифрами номера дисков и записать соответствующее название антибиотиков;
Засеянные чашки с нанесенными дисками поместить в термостат при t=370С на 1 сутки.
1
3
Слайд 7УЧЕТ РЕЗУЛЬТАТОВ
Действие АБ оценивают по явлению задержки роста микроорганизмов
вокруг диска.
Диаметр зон задержки роста измеряют линейкой в мм,
включая диаметр диска.Оценка результатов проводится по специальным таблицам (для каждого вида антибиотика), в них указывается значение диаметров зон задержки роста для устойчивых, умеренно устойчивых и чувствительных видов м.о.
В среднем это:
чувствительные –D> 10 мм.
умеренно чувствительные- D< 10 мм.
устойчивые- нет зоны отсутствия роста. - данные АБ не действуют на микробов, не убивают их.
Слайд 9Виды стерилизации
I.Физическая
1. Действием температуры:
а) воздушный стерилизатор (сухожаровой шкаф)
160 Со 2,5ч; 180 Со 1ч; 200 Со 30 мин.
б)
паровой стерилизатор (автоклав) Р=1,1 ат 120 Со 45 мин ( для полимеров и резины); Р=2,2 ат 135 Со 20 мин.(металлические изделия, ткани).в) гласперленовый стерилизатор( шарики из кварца )
180 Со -230С, в течение 15 мин.
г) тиндализация (дробная стерилизация) 60Со, по 1 часу в течение 5 дней ( витамины, сыворотки).
д) пастеризация (уничтожение бесспоровых м.о.) 70 Со, 1час.
е) фламбирование (стерилизация в пламени бак.петлей, шпателей, пипеток).
ж) кипячение 100 Со 30-60 мин. (не надежный, устаревший способ).
2. Действием УФ-лучей (бактерицидные лампы), рентгеновские лучи.
3. Использованием бактериологических фильтров – механическая стерилизация. Освобождение жидкостей от бактерий, грибов, простейших, вирусов (в зависимости от размеров пор фильтра). Фильтры бывают керамические, асбестовые, мембранные. Это фильтры Зейтца, Шамберлана и др. Пример: стерилизация сыворотки крови
Слайд 10Виды стерилизации
II. Химическая
1. Газовый стерилизатор (газы – этиленоксид ,
озон ,формалин, формальдегид) 50-80 Со. Проводят в специальных камерах.
2. Действие
дезинфицирующих растворов (лизоформин-3000; если 2% р-р – 15 мин. дезинфекция; если 8% р-р – 1час стерилизация, время по инструкции).3. Действие веществ антисептиков (6% р-р перекиси водорода, вещество первомур).
III.Биологическая
1. Действие антибиотиков.
2. Действие бактериофагов.
Слайд 11Дезинфекция – уничтожение патогенных микроорганизмов в окружающей среде
В микробиологической практике
используются различные дезин-фицирующие вещества: 3-5%растворы фенола, р-ры лизола (фенол с
добавлением зеленого мыла), 1-5% растворы хлорамина (устаревшее средство), 2-3% раствор соды, 70% этиловый спирт, р-р део-хлора, р-р дюльбака и другие средства.Отработанный материал перед тем, как удалить его в канализацию, автоклавируется или засыпается сухой хлорной известью на несколько часов.
Загрязненные предметные стекла, пипетки, шпатели опускают в различные дез.средства (время и концентрация – по инструкции). Столы после работы лаборант протирает дез.средством, руки моют мылом (двойное намыливание) или протирают 70% этиловым спиртом.
Воздух в лаборатории наиболее просто дезинфицировать проветриванием (не менее 30-60 минут). Более эффективный способ дезинфекции воздуха — облучение УФ-лучами с длиной волны от 200 до 400 нм. Эти лучи могут вызывать гибель не только вегетативных клеток, но и спор микроорганизмов. Бактерицидные лампы устанавливают над рабочим местом лаборанта, в моечных помещениях.
Слайд 13Общая схема лабораторных исследований возбудителей инфекционных заболеваний
1 день : первичный
посев патогенного материала от больного на питательные среды (возможно использование
сред накопления)2 день : изучение культуральных свойств «подозрительных» колоний и их пересев на специальные среды для выращивания «чистой» патогенной культуры
Слайд 14продолжение исследования
3-4 день
Исследование «чистой» культуры:
приготовление микропрепарата по Граму;
определение подвижности
– посев «уколом»;
проведение серологических реакций;
заражение лабораторных животных;
изучение на средах ДДС
биохимических (ферментативных) свойств выделеных микробов;определение чувствительности микробов к антибиотикам.
ЗАКЛЮЧЕНИЕ ИССЛЕДОВАНИЯ