Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Проект на тему: Рак молочной железы профилактика и ранняя диагностика
Содержание
- 1. Проект на тему: Рак молочной железы профилактика и ранняя диагностика
- 2. Слайд 2
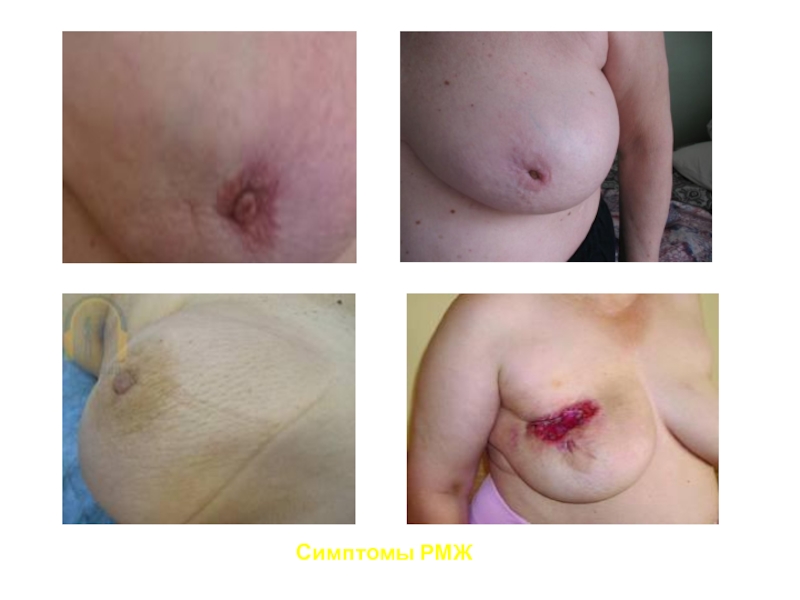
- 3. Симптомы РМЖ
- 4. Проблема Ежегодно в мире регистрируются более 1
- 5. По PICOP- Пациент 49 лет с раком
- 6. Вопрос:Увеличится ли продолжительность жизни женщин больных РМЖ
- 7. Главная страница сайт PubMed
- 8. Ключевые слова Скрининг РМЖBreast Cancer Screening
- 9. Поиск по ключевым словам
- 10. Поиск по ключевым словам
- 11. Это обсервационное исследование так как: Клиническое исследование
- 12. Место проведения исследование: Women's Integrated Healthcare Center-University
- 13. METHODS:Clinical trial with 106 women undergoing radical BC
- 14. RESULTS:The incidence of seroma, dehiscence and infection
- 15. CONCLUSION:Lymphatic abnormalities precede lymphedema formation in BC
- 16. Мое мнение Я думаю, что если женщина
- 17. СПАСИБО ЗА ВНИМАНИЕ!
- 18. Скачать презентанцию
Симптомы РМЖ
Слайды и текст этой презентации
Слайд 1Проект на тему: Рак молочной железы
профилактика и ранняя диагностика
ФА-14-002-01
Приготовила:
Байсапар А.К.
Слайд 4Проблема
Ежегодно в мире регистрируются более 1 миллиона новых случаев рака
молочной железы.
Наиболее высокая заболеваемость наблюдается в США и в Западной
Европе, промежуточное положение занимают Восточная Европа и Южная Америка, а самая низкая заболеваемость в Азии и Африке.В РК рак молочной железы занимает 1 место в структуре онкологической заболеваемости и смертности среди женщин.
Ежегодно от рака груди умирают более 20 тысяч россиянок (т.е. умирают 55 женщин ежедневно).
Наиболее часто заболевают раком молочной железы в возрасте 50-59 лет (40,3%) и 70 лет и старше (59,4%), т.е. чем женщина старше, тем больше риск развития рака молочной железы.
По заболеваемости рак молочной железы находится на I месте у женщин, а у мужчин на I месте рак легких.
По смертности рак молочной железы находится на 4 месте ежегодно за последние 10 лет
Слайд 5По PICO
P- Пациент 49 лет с раком молочный железы.
I- назначена
ингибиторы ароматаза против РМЖ.
C- Сравнение эффективности ингибиторы ароматаза в против
РМЖ у больных и без данного заболевания.O- снижение смертности от РМЖ.
Слайд 6Вопрос:
Увеличится ли продолжительность жизни женщин больных РМЖ от 50-70 лет,
при регулярном проведении скрининговых исследований?
Следует ли всем больным на ранней
стадии РМЖ назначать ингибиторы ароматаза ?Слайд 11Это обсервационное исследование так как:
Клиническое исследование с участием 106
женщин, перенесших радикальную хирургию РМЖ
Есть контрольная группа
Наблюдение за женщинами в
течение 30 месяцевСлайд 12Место проведения исследование:
Women's Integrated Healthcare Center-University of Campinas
Автор: Oliveira
MMF1, Gurgel MSC1, Amorim BJ2, Ramos CD2, Derchain S1, Furlan-Santos N1, Dos Santos CC1, Sarian LO1.
Дата публикации:
2018 Jan 5Слайд 13METHODS:
Clinical trial with 106 women undergoing radical BC surgery, in the
Women's Integrated Healthcare Center-University of Campinas. Women were matched for
staging, age and body mass index and were allocated to performed AE or MLD, 2 weekly sessions during one month after surgery. The wound was evaluated 2 months after surgery. ROM, upper limb circumference measurement and upper limb lymphoscintigraphy were performed before surgery, and 2 and 30 months after surgery.МЕТОДЫ:
Клиническое исследование с участием 106 женщин, перенесших радикальную хирургию РМЖ, в Центре комплексной медицинской помощи женщин в Кампинасе. Женщины были сопоставлены с индексом постановки, возрастом и массой тела и были выделены для выполнения AE или MLD, 2 еженедельных сеанса в течение одного месяца после операции. Рану оценивали через 2 месяца после операции. ПЗУ, измерения окружности верхней конечности и лимфосцинтиграфии верхних конечностей были выполнены до операции и через 2 и 30 месяцев после операции.
Слайд 14RESULTS:
The incidence of seroma, dehiscence and infection did not differ
between groups. Both groups showed ROM deficit of flexion and
abduction in the second month postoperative and partial recovery after 30 months. Cumulative incidence of lymphedema was 23.8% and did not differ between groups (p = 0.29). Concerning the lymphoscintigraphy parameters, there was a significant convergent trend between baseline degree uptake (p = 0.003) and velocity visualization of axillary lymph nodes (p = 0.001) with lymphedema formation. A reduced marker uptake before or after surgery predicted lymphedema formation in the long run (>2 years). None of the lymphoscintigraphy parameters were shown to be associated with the study group. Age ≤39 years was the factor with the greatest association with lymphedema (p = 0.009). In women with age ≤39 years, BMI >24Kg/m2 was significantly associated with lymphedema (p = 0.017). In women over 39 years old, women treated with MLD were at a significantly higher risk of developing lymphedema (p = 0.011).РЕЗУЛЬТАТЫ:
Частота серозмы, исчезновения и инфекции не различалась между группами. Обе группы показали ПЗУ дефицит сгибания и абдукции во втором месяце послеоперационного и частичного восстановления через 30 месяцев. Кумулятивная частота лимфедемы составила 23,8% и не отличалась между группами (р = 0,29). Что касается параметров лимфосцинтиграфии, наблюдался значительный сходящийся тренд между поглощением базовой линии (p = 0,003) и визуализацией скорости подмышечных лимфатических узлов (p = 0,001) с образованием лимфедемы. Снижение поглощения маркеров до или после операции предсказывало формирование лимфедемы в течение длительного времени (> 2 года). Показано, что ни один из параметров лимфосцинтиграфии не связан с исследуемой группой. Возраст ≤39 лет был фактором с наибольшей ассоциацией с лимфедемой (p = 0,009). У женщин с возрастом ≤39 лет ИМТ> 24 кг / м2 значительно ассоциировалось с лимфедемой (p = 0,017). У женщин старше 39 лет у женщин, получавших MLD, был значительно более высокий риск развития лимфедемы (p = 0,011).
Слайд 15CONCLUSION:
Lymphatic abnormalities precede lymphedema formation in BC patients. In younger
women, obesity seems to be the major player in lymphedema
development and, in older women, improving muscle strength through AE can prevent lymphedema. In essence, MLD is as safe and effective as AE in rehabilitation after breast cancer surgery.ВЫВОД:
Лимфатические аномалии предшествуют формированию лимфедемы у пациентов с ВС. У молодых женщин ожирение, похоже, является основным игроком в развитии лимфедемы, и у пожилых женщин улучшение мышечной силы через AE может предотвратить лимфедему. По сути, MLD столь же безопасен и эффективен, как AE в реабилитации после операции на раке молочной железы.