Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Производство гипериммунных сывороток
Содержание
- 1. Производство гипериммунных сывороток
- 2. Знание усваивается в полной мере лишь тогда,
- 3. 1901 год. Первая Нобелевская премия по медицине
- 4. понимание, что это обусловлено в значительной мере
- 5. Возбудитель дизентерии относят к роду Corynebacterium,
- 6. Исследования Беринга, проведен-ные на кроликах, показали, что
- 7. В до прививочный период заболевае-мость дифтерией составляла
- 8. Таким образом, с 1901 г начали разработку
- 9. Промышленное производство и примене-ние антисывороток привело к
- 10. В 1923 г Г.Рамон (ветврач) получил дифтерийный
- 11. Вскоре Г. Рамон заметил, что если на
- 12. Эти вещества получили в последствии наз-вание адьювантов,
- 13. В качестве адьювантов используют: неорганические вещества –
- 14. сложные масляные адьюванты – полный и неполный
- 15. Минеральное масло не метаболизи-руется и внутри капель
- 16. Механизмы действия адьювантов разнообразные и до конца
- 17. они должны быть не токсичными в используемых
- 18. Своевременная нейтрализация токсина при введении сыворотки предотвращает
- 19. Производство лечебно-профилакти-ческих сывороточных препаратов представляет сложный и
- 20. Различают три группы лечебно-профилактических сывороток: антитоксические, антибактериальные
- 21. противовирусные против б.Ауески, бешенства (антирабическая сыворотка), противоящурный иммунолактон и сыворотки, вирусного гепатита утят.
- 22. По направлению применения различа-ют лечебные, профилактические и
- 23. Схема цеха по производству специфи-ческих сывороток Иммунизационное
- 24. Для изготовления лечебно-профилактических гетерологичных сывороток используют крупных
- 25. Для изготовления диагностических сывороток, требующихся в значительно
- 26. Схема получения сывороток: Отбор животных продуцентовГрундированиеГипериммунизацияПолучение и обработка сыворотокПолучение иммуноглобулинов На качество сывороток влияют множество факторов
- 27. индивидуальные особенности живот-ных-продуцентов, в частности их спо-собность
- 28. Качество антигенов зависит от следующих
- 29. Требования к животнымЖивотных, применяемых для получения сывороток,
- 30. Всех завезенных животных выдерживают в карантине 45
- 31. Лошадей исследуют на сап, трихомо-ноз, бруцеллез, туберкулёз,
- 32. При отборе животных-продуцентов надо учитывать их физиологические
- 33. волов - в возрасте от 3 до
- 34. Учитывая, что введение антигенов и перио-дическое кровопускание
- 35. Рационы для них должны содержать по 11-12
- 36. железа 145-165 мг, меди-15-18 мг, кобальта 1,2-1,4
- 37. Грундиммунизация (грундирование) - это метод отбора животных-продуцентов,
- 38. Например, отбор лошадей-продуцентов для производства противодифтерийной сыворотки
- 39. При проведении грундиммунизации животным дважды вводят убитый
- 40. Выявление в сыворотке крови антител в титрах
- 41. Предварительное, правильно проведенное грундирование животных обеспечивает повышение
- 42. Гипериммунизация - это метод парентерального введения
- 43. При гипериммунизации в сыворотке крови животных, обычно
- 44. Успех гипериммунизации животных-продуцентов во многом зависит не
- 45. Антигены вводятся обычно подкожно и внутримышечно в
- 46. Цикл гипериммунизации обычно длительный и составляет 1-2
- 47. создания стойкого иммунитета (грундиммуни-зация), а потом лошадей
- 48. Обычно бывает достаточным ввести антиген 13 раз,
- 49. Разнообразие схем иммунизации определяются следующим:1. различием методов
- 50. Введение антигенов обычно не вызывает резких отклонений
- 51. По окончании гипериммунизации, когда в сыворотке крови
- 52. Метод Института Пастера Франция, рекомендован ВОЗI. С
- 53. IV. С 89-го по 98-ой – 2
- 54. V. 136 день- инъекция целого мозга
- 55. Количество забираемой крови зависит: от массы
- 56. . Обычно при каждом крововзятии берут кровь
- 57. фагоцитарную активность лейкоцитов, повышает превентивные
- 58. Обработка сыворотокСыворотку получают методом цитрирования крови с
- 59. В последующем сыворотку расфасовывают во флаконах емкостью
- 60. 1 – сепаратор; 2 – дефибринатор; 3
- 61. Очистка сывороток проводится с целью удаления иммунологически
- 62. Необходимость в получении концентри-рованных сывороток связана: 1.
- 63. 2. С необходимостью повышать специфическую активность антисыво-роток,
- 64. Применение сывороточных препаратовЛечебный эффект от применения гипериммунных
- 65. Для изготовления диагностических сывороток выделяют фракцию иммуноглобулинов
- 66. Очистка и концентрация антитоксических сывороток методом Диаферм
- 67. добавляют СА 140 г/л – в осадок
- 68. Антитоксические сывороткиих растворяют, диализуют, подкисляют НСl и
- 69. Спиртовой метод 3 стадииСыворотка + аna этанол
- 70. Контроль сывороточных препаратовСывороточные препараты и иммуноглобулины контролируют
- 71. Контроль стерильности на тиогликолев среде или на
- 72. Пирогенность -3 кролика, в ушную вену вводят
- 73. С-ки против диплококковой септицемии телят,ягнят и поросят,
- 74. Поливалентная антитоксическая с-ка против паратифа телят, ягнят,
- 75. МКАТехнология получения МКА
- 76. Вещество, вызывающее опухоли.Минеральное масло пристан –
- 77. Слайд 77
- 78. Скачать презентанцию
Знание усваивается в полной мере лишь тогда, когда видишь процесс его зарождения Джеймс Кларк Максвел
Слайды и текст этой презентации
Слайд 31901 год. Первая Нобелевская премия по медицине была присуждена за
разработку метода лечения дифтерии с помощью антисыворотки Эмилю фон Берингу
и Шабосабуро Китазато. После работ Луи Пастера по созданию вакцин было известно, что после переболева-ния или вакцинации животные или человек становятся невосприимчивы к последующему заражению этим же возбудителем и сформировалосьСлайд 4понимание, что это обусловлено в значительной мере веществами, которые выработало
переболевшее животное. Появилась идея, что, если кровь или сыворотку крови
переболев-шего животного ввести не болевшему животному, то введенные вещества должны защитить это животное от последующего развития болезни при заражении этим возбудителем.Слайд 5Возбудитель дизентерии относят к роду Corynebacterium, выделен в чистом
виде Лефлером в 1884 г. Основным фактором патогенности Corynebacterium diphtheriae
является очень мощный экзотоксин - термолабильный белок с м.м. 72 000. Его впервые в 1888 г получил Эмиль Ру – французский бактериолог и иммунолог. Экзотоксин состоит из двух фракций - А и В. Фракция А ответственна за токсическое действие- нейротоксин, фракция В фиксирует токсин на чувствительных к нему тканях орга-низма
Слайд 6Исследования Беринга, проведен-ные на кроликах, показали, что в ответ на
введение культуры микро-организмов в организме кроликов вырабатываются защитные антите-ла. Вывод
– дифтерию можно лечить, вводя больному готовые антитела. Это положило начало иммунотерапии и позволило резко снизить смертность от дифтерииСлайд 7В до прививочный период заболевае-мость дифтерией составляла 500 случаев на
100 000 детей, летальность более 50%. В 1994 г. в
РФ заболело 13 996 детей и26 011 взрослых. Заболеваемость среди привитых составила 8,1%, среди не привитых - 20%, летальность в 1993 г среди привитых составила – 2.2%, а среди не привитых 8,4%. Это результат снижения охвата прививками в РФ до 65%, в США - отсутствует дифтерия при охвате прививками 95% населения.
Слайд 8Таким образом, с 1901 г начали разработку промышленного производства антитоксических
противодифтерийных сывороток. Первоначально использовали сыворотку реконвалесцентов или лошадиную антисыворотку, лошадей
при этом иммунизировали нативной дифтерийной культурой. Однако полученные лошадиные антисыворотки обладали значительной анафилактогенностью, что снижало эффективность этих антисывороток.Слайд 9Промышленное производство и примене-ние антисывороток привело к открытию сывороточной болезни.
Неоднократное парентеральное введение антисывороток другого вида приводило к анафилакти-ческому шоку.
Впервые сывороточную болезнь наблюдал Смит в 1905 г, когда он внутрибрюшинно повторно вводил морс-ким свинкам лошадиную сыворотку, то у них, спустя несколько минут или часов, появлялось беспокойство, одышка, гипотермия и животное погибало от анафилактического шокаСлайд 10В 1923 г Г.Рамон (ветврач) получил дифтерийный анатоксин обработкой токсина
формалином (0.3-0.4% при t = 37оС в течение 30
дней), при этом он (токсин) теряет токсиногенность, но сохраняет антигенные свойства. Это значительно продвинуло технологию производства, так как для иммунизации стали использовать фактически чистый препарат анатоксина и снизили реакции на введение.Слайд 11Вскоре Г. Рамон заметил, что если на месте введения токсина
образуется воспалительный очаг -абсцесс, то такие лошади имели более высокий
титр антител. Он объяснил возникновение абсцессов заносом микроорганизмов при инъекциях и решил вызывать при инъекциях стерильные абсцессы. Для этих целей он использовал ряд ингредиентов, таких как крахмал, крошки хлеба и др.Слайд 12Эти вещества получили в последствии наз-вание адьювантов, что означает помогаю-щий.
В это время другой ветврач Гленни А.Т. показал, что дифтерийный
анатоксин сорби-рованный алюмоквасцами является более активным (в сотни раз) , чем нативный. С тех пор метод сорбции антигенов широко исполь-зуется и в настоящее время. Под адьюванта-ми понимают вещества разнообразной хими-ческой природы, неспецифически стимули-рующие иммунный ответ к различным антигенам.Слайд 13В качестве адьювантов используют:
неорганические вещества – гидроокись алюминия, фосфат
алюминия, алюмо-калиевые квасцы, аэросил и др.- стимули-руют преимущественно гуморальный иммунитет;
Растительные - сапонины (ISCOM)
органические вещества – минеральные масла, альгинаты, сапонин, ДЭАЭ-декстран;
бактериальные клетки – коклюшные бактерии – Bordetella pertussis, вакцинный штамм микобактерий туберкулеза – БЦЖ;
Слайд 14сложные масляные адьюванты – полный и неполный адьювант Фрейнда. Полный
адьювант состоит из Арлацела- эмульгатор, производное олеиновой кислоты и маннита
(1,5 мл), и Байола– производное ланолина (8,5 мл) с добавлением БЦЖ (5 мг на 10 мл). В неполном адьюванте Фрейнда отсут-ствуют микобактерии.Слайд 15Минеральное масло не метаболизи-руется и внутри капель антиген удерживается длительное
время.
В последние годы синтезированы вещества, используемые в качестве адьювантов,
не имеющие природных аналогов, - это мурамилдипептид, полианионы, поликатионы, полиоксидоний. Слайд 16Механизмы действия адьювантов разнообразные и до конца не изу-чены. Одни
из них вызывают воспа-лительную реакцию, другие способ-ствуют депонированию антигенов и
замедляют их гидролиз, третьи способствуют усилению поглощения антигенов макрофагами и антиген представляющими клетками. К адьювантам предъявляются следующие требования:Слайд 17они должны быть не токсичными в используемых дозах, не вызывать
побочных реакций в организме, сами не должны обладать антигенной актив-ностью,
стимулировать развитие длительного гуморального иммунитета. Антитоксические сыворотки применяют для лечения заболеваний, в патогенезе которых ведущим фактором является интоксикация.Слайд 18Своевременная нейтрализация токсина при введении сыворотки предотвращает развитие заболевания –
столбняк, ботулизм, дифтерию, газовую гангрену. За единицу измерения антитоксинов принята
антитоксическая единица, т.е. минималь-ное количество антитоксической сыво-ротки способное нейтрализовать одну единицу токсина. За единицу токсина принимается минимально смертельное количество токсина.Слайд 19Производство лечебно-профилакти-ческих сывороточных препаратов представляет сложный и многогранный процесс с
длительной технологией. Различают 2 источника получения специфических сывороток: гипериммунизация животных
других видов ( гетерологичные сыворотки) и вакцинация доноров (гомологичные сыворотки).Слайд 20Различают три группы лечебно-профилактических сывороток: антитоксические, антибактериальные и противовирусные. В
ветеринарии применяют
антитоксические сыворотки против - анаэробной дизентерии и инфекционной энтеротоксемии
овец;антибактериальные - против сибирской язвы, рожи свиней, лептоспироза, геморрагической септицемии, диплококковой инфекции, паратифа и колибактериоза;
Слайд 21противовирусные против б.Ауески, бешенства (антирабическая сыворотка), противоящурный иммунолактон и сыворотки,
вирусного гепатита утят.
Слайд 22По направлению применения различа-ют лечебные, профилактические и диагностические гипериммунные сыворотки.
Диагностические сыворотки по использованию в различных реак-циях подразделяют на: нейтрализую-щие,
преципитирующие, агглютиниру-ющие, лизирующие и связывающие комплемент (для постановки РСК).Слайд 23Схема цеха по производству специфи-ческих сывороток
Иммунизационное отделение
Отделение технической
и химической
обработки сывороток
Карантинная клиника
Изолятор, ветеринарная аптека
Слайд 24Для изготовления лечебно-профилактических гетерологичных сывороток используют крупных животных – лошадей,
волов, быков, коров, мулов, так как от них можно получить
большое количество крови. Наиболее подходящим видом считают лошадей, так как они отличаются высокой иммунологической реактивностью к большинству необходимых антигенов. От них также, в сравнительно короткий срок, можно получить сыворотку, содержащую высоко аффинные специфические антитела в достаточно высоких титрах. Преимуществом их является и то, что они удобны в отношении технических манипуляций и ухода.Слайд 25Для изготовления диагностических сывороток, требующихся в значительно меньших количествах, используют
более мелких животных- овец, коз, кроликов, реже морских свинок и
крыс, а также птиц- петухов,уток,голубей. Животные должны приобретаться из хозяйств, благополучных по инфекционным заболеваниям, свободных от лейкоза и быть здоровыми, в возрасте от 1 года до 3 лет.Слайд 26Схема получения сывороток:
Отбор животных продуцентов
Грундирование
Гипериммунизация
Получение и обработка сывороток
Получение иммуноглобулинов
На
качество сывороток влияют множество факторов
Слайд 27индивидуальные особенности живот-ных-продуцентов, в частности их спо-собность к иммунобиологической
перестройке при создании у них грунд-иммунитета, содержание и кормление животных
в период их подготовки и эксплуатации.Существует прямая связь между качеством антигена, силой антигенного раздражения и уровнем накопления специфических антител в крови животных
Слайд 28 Качество антигенов зависит от следующих факторов:
Клеточный или
растворимый антиген
Степень чистоты антигена - отсутствие балластных белков;
Концентрация - чем выше, тем лучше, можно вводить в меньшем объеме.Безвредность для животного – продуцента (инфекционный или нет)
Необходимость в адьювантах
Слайд 29Требования к животным
Животных, применяемых для получения сывороток, завозят из стационарно
благополучных по заразным заболеваниям районов. При этом они должны быть
клинически здоровыми, средней и выше средней упитанности, свободными от накожных препаратов.Слайд 30Всех завезенных животных выдерживают в карантине 45 суток. За это
время их все-сторонне обследуют с ежед-невным (утром и вечером) двукратным
измерением температуры тела и проверя-ют пораженность гельмин-тами и при необходимости дегельминтизируют.Слайд 31Лошадей исследуют на сап, трихомо-ноз, бруцеллез, туберкулёз, пироп-лазмидозы и инфекционную
анемию;
КРС - на туберкулёз, бруцеллез, лептоспироз;
свиней - на туберкулёз, бруцеллез; овец - на бруцеллез, туберкулёз, паратуберкулёз и другие инфекцион-ные заболевания согласно требова-ниям НТД.
Слайд 32При отборе животных-продуцентов надо учитывать их физиологические и иммуноло-гические показатели.
На активность лечебно-профилактических и диагностических сыво-роток влияют порода, пол, конструкция
и возраст животного.Лошадей используют в возрасте от 3 до 12 лет, помеси донской и казахской пород, массой 450-500 кг;
Слайд 33волов - в возрасте от 3 до 8 лет, массой
не менее 350 кг, красно-степной, калмыцкой, симментальской, швицкой астраханской пород;
свиней - в возрасте 5-6 месяцев, массой не менее 80 кг, крупной белой породы; овец, баранов и валухов - в возрасте 2-3 лет и массой 30-45 кг (для получения диагностических сывороток и сывороточных сред).
Слайд 34Учитывая, что введение антигенов и перио-дическое кровопускание приводит к нарушению
обмена веществ и анемии, а в ряде случаев и к
снижению титров антител, большое внимание нужно уделять вопросам полноценного, сбалансированного кормления животных-продуцентов.Слайд 35Рационы для них должны содержать по 11-12 кормовых единиц и
по 1000-1200 г перевариваемого протеина, они должны включать сочно-витаминные корма
и быть сбалансированными по минеральному составу.Для восстановления крови после крововзятия немаловажное значение имеет правильно организованное минеральное кормление животных-продуцентов: на кг сухого кормового рациона лошадей должно приходиться:
Слайд 36железа 145-165 мг, меди-15-18 мг, кобальта 1,2-1,4 мг, марганца -
не менее 9 мг.
Для восстановления красной крови лошадям вводят в
рацион эритроциты, фибрин, кормовые антибиотики, проращенный овес. Иногда проводят реинфузию эритроцитов.Кормят животных-продуцентов 3-5 раз в день. Крупных животных содержат индивидуально, мелкий рогатый скот и свиней - группами.
Слайд 37Грундиммунизация (грундирование) - это метод отбора животных-продуцентов, обладающих высокой реактивностью
организма и способных выработать антитела против введенного антигена в высоких
титрах.При отборе животных - продуцентов, их проверяют на наличие антител к тому или иному антигену серологическими методами.
Слайд 38Например, отбор лошадей-продуцентов для производства противодифтерийной сыворотки проводят по титру
естественного противодифтерийного антитоксина в крови животных, выявляемого в РН.
Если антител
в крови животных не обнаруживают, их грундируют, т.е. вводят антиген и по нарастанию титра антител, в результате грундимму-низации, отбирают лошадей-продуцентов сывороткиСлайд 39При проведении грундиммунизации животным дважды вводят убитый антиген или живые
атенуированные микроорганизмы (убитые или живые вакцины), с интервалом в 2-3
недели, внутримышечно или подкожно. До начала грундиммунизации и через 7-8 суток после последнего введения антигена у животных берут кровь и определяют в ее сыворотке наличие антител к тому антигену, с помощью которого в последующем готовят гипериммунную сыворотку.Слайд 40Выявление в сыворотке крови антител в титрах 1:800 и выше
указывает на то, что данное животное может быть использовано как
продуцент гипериммунной сыворотки, т.е. такое животное обладает высокой реактивностью организма и иммунная система его способна вырабатывать антитела в необходимых титрах.Слайд 41Предварительное, правильно проведенное грундирование животных обеспечивает повышение (в 5 paз
и более) титров специфических антител при последующей гиперимунизации тем же
антигеном, увеличивает выход высокоактивного препарата и создает условия получения сывороток в более короткие сроки.Всех животных, у которых при грундимму-низации не обнаруживают достаточного уровня антител или обнаруживают в титре ниже необходимого 1:800, подвергают выбраковке.
Слайд 42Гипериммунизация - это метод парентерального введения животным нарастающих доз
соответствующих антигенов с целью получения наивысшей ответной иммунологической реакции организма,
а следовательно, и максимального увеличения в крови животных специфических антител, которое должно обеспечивать лечебный, профилактический и диагностический эффект препаратов.Слайд 43При гипериммунизации в сыворотке крови животных, обычно нарастает количество общего
белка, увеличиваетя количество гамма- и бета-глобулиновых фракций, уменьшается содержание альбуминов.
Так, если в нормальной сыворотке крови лошади альбумины составляют 50% общего количества белков, то в иммунной сыворотке их бывает 35% и ниже.Слайд 44Успех гипериммунизации животных-продуцентов во многом зависит не только от тщательного
их подбора, качества антигена и адъювантных веществ, но и от
правильно выбранной схемы гипериммунизации, правильно выбранной технологии выполнения этих схем иммунизации, а также технологии кровопускания и обескровливания продуцентов в конце их эксплуатации.Слайд 45Антигены вводятся обычно подкожно и внутримышечно в несколько мест с
таким расчетом, чтобы точки инъекции находились вблизи лимфатических узлов. При
этом в иммуногенез быстрее вовлекается большое количество лимфоузлов, что повышает общую и иммунологическую реактивность организмаСлайд 46Цикл гипериммунизации обычно длительный и составляет 1-2 и более месяцев.
В каждом случае цикл иммунизации во многом зависит от вида
гипериммунной сыворотки.Например, для получения гипериммунной противосибиреязвенной сыворотки используют лошадей в возрасте от 3 до 10 лет. Вначале здоровым животным вводят, четырех-кратно вакцину Ценковского 2 для
Слайд 47создания стойкого иммунитета (грундиммуни-зация), а потом лошадей подвергают гипер-иммунизации вирулентным
возбудителем сибирской язвы. Всего используют 12 штам-мов, комбинируя их по
четыре в виде смеси для каждой иммунизации. Гипериммунизацию лошадей начинают с малых доз: 0,5; 2,5 и 5,5 мл с интервалом в трое суток. Затем куль-туры сибирской язвы вводят с интервалами в 3-4 суток и в дозах 10,0; 20,0; 40,0; 80; 100; 110; 130; 140; 150 мл.Слайд 48Обычно бывает достаточным ввести антиген 13 раз, и сыворотка лошадей-продуцентов
становится активной. При введении доз в объёме от 10 до
80 мл к культуре добавляют 0,2% квасцов, а к дозам, от 100 до 150 мл-0,1% квасцов. При повышении у животных темпера-туры интервал между инъекциями увеличивают до 4 - 5 суток. В каждом конкретном случае схемы иммунизаций могут быть разными.Слайд 49Разнообразие схем иммунизации определяются следующим:
1. различием методов введения антигена;
2. дозировкой
антигена;
3. количеством инъекций;
4. интервалами между инъекциями;
5. объектом и кратностью цикловых
кровопусканий.Слайд 50Введение антигенов обычно не вызывает резких отклонений в состоянии здоровья
животных, лишь иногда наблюдается местные и общие реакции. Эффективность иммунизации
животных повышается при дробном введении антигенов одновременно в различные участки тела животного.Слайд 51По окончании гипериммунизации, когда в сыворотке крови животного установлен максимальный
титр специфических антител, у него берут кровь обычно через 7-8
суток после последней инъекции антигена.Приведем пример получения антирабической сыворотки (применяется для лечения людей).
Слайд 52Метод Института Пастера Франция, рекомендован ВОЗ
I. С 1-го дня по
60-й -20 мл вакцины, инактивированной β – пропиолактоном,
через день (30 инъекций).II. С 61-го дня по 72-ой- 4 инъекции по ¼ мозга кролика, зараженным фиксированным вирусом с интервалом в 3 дня.
III. С 73-го дня по 88-ой- 4 инъекции по ½ мозга кролика, зараженным фиксированным вирусом с интервалом в 4 дня.
Слайд 53IV. С 89-го по 98-ой – 2 инъекции по целому
мозгу кролика зараженным фиксированным вирусом с интервалом в 5 дней.
Всего 40 инъекций106-й день – первое кровопускание
Слайд 54V. 136 день- инъекция целого мозга кролика зараженным
фиксированным вирусом.
144 –й - второе кровопускание
Таким образом, период иммунизации длится 98 дней, а первое кровопускание проводится спустя 8 дней, бустер дозу вводят спустя 30 дней, через 8 дней делают второе кровопускание.Слайд 55Количество забираемой крови зависит:
от массы животного;
от
реакции животного на крововзятие с учетом начального и последующих циклов;
количества предолагаемых кровоспус-каний в данном цикле;титра антител;
состояния здоровья животного
Слайд 56. Обычно при каждом крововзятии берут кровь из яремной вены
из расчета 800 мл на каждые 50кг массы животного (или
13% к общей массе крови животного).Установлено, что двукратное крово-пускание стимулируют образование иммуноглобулинов, повышает синтез пропердина, лизоцима и бета-лизинов, увеличивает бактерицидность сыворотки крови и
Слайд 57 фагоцитарную активность лейкоцитов, повышает превентивные (защитные) свойства сыворотки
и сопротивляе-мость организма инфекции. Тотальное обескровливание проводят тогда, когда решается
вопрос о прекращении использования животных как продуцентов. Обычно это делают в момент максимального накопления антител и появления тенденции снижения их синтеза.Слайд 58Обработка сывороток
Сыворотку получают методом цитрирования крови с последующим сепарированием и
дефибринированием плазмы на 1 л крови +35 мл 10% цитрата
Na. Для дефибринирова-нияна 1 л плазмы +1,5 мл 30% СаСl2 и шутте-лируют и при 4-8оС 20 час и фильтруютСыворотку крови консервируют 0,5 %-ным раствором фенола и отстаивают в специальных емкостях в течение двух месяцев. Отстоявшуюся сыворотку фильтруют а затем стерилизуют.
Слайд 59В последующем сыворотку расфасовывают во флаконах емкостью по 100 мл.
Флаконы закрывают пробками и для герметичности их обкатывают алюминиевыми колпачками.
На флаконы наносят этикетку и часть продукции сдают на контроль.Гипериммунные сыворотки, получаемые из крови путем удаления форменных элементов и фибрина, называются нативными в отличие от сывороток, подвергнутых дополнительной очистке и концентрации специальными методами
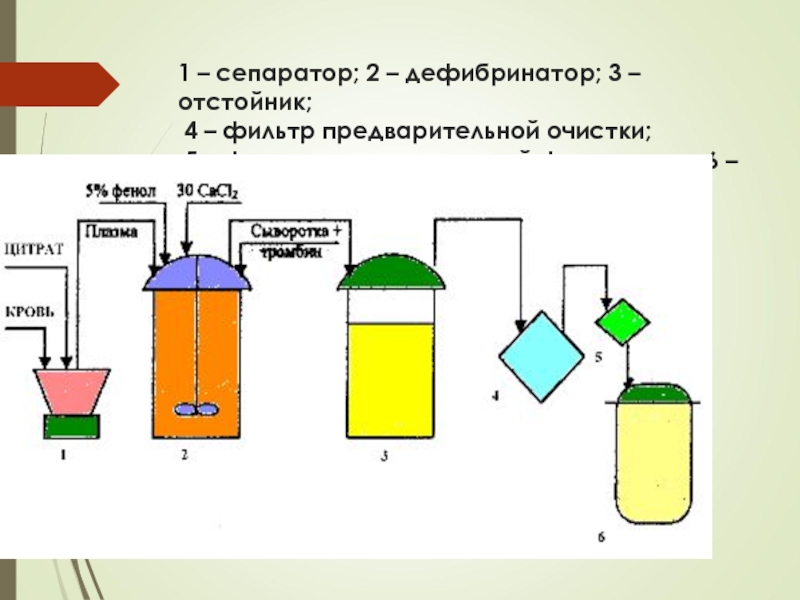
Слайд 601 – сепаратор; 2 – дефибринатор; 3 – отстойник; 4
– фильтр предварительной очистки; 5 – фильтр -стерилизующей фильтрации;
6 – сборник готовой продукции.Слайд 61Очистка сывороток проводится с целью удаления иммунологически неактивных белковых фракций
например, альбуминов, альфа глобулинов и др.
Выделенные фракции растворяют в меньшем
объеме растворителя, по сравнению с исходным объемом, что позволяет препарат сконцентрировать и вводить в меньших дозах. Слайд 62Необходимость в получении концентри-рованных сывороток связана: 1.
со значительными
объемами выпус-каемых лечебных сывороток, исчисля-емыми сотнями тонн. Для расфасовки сывороток
требуется большое количес-тво флаконов, пробок, колпачков, ящи-ков для упаковки и эта процедура значительно снижает затраты на транспортировку.Слайд 632. С необходимостью повышать специфическую активность антисыво-роток, снижая при этом
вводимую дозу.
Первоначально иммуноглобулины высали-вали т.е. осаждали сульфатом натрия или аммония,реже
риванолом, в настоящее время осаждают этиловым спиртом. Кон -центрирование и очистку антитоксических сывороток производят методом Диафрем-3- т.е обработкой пепсином. При такой обработ-ке удаляется до 80-85 % балластных белков сыворотки. Слайд 64Применение сывороточных препаратов
Лечебный эффект от применения гипериммунных сывороток наступает очень
быстро. Своевременное приме-нение не даст развиться болезни. Однако длительность иммунитета
не большая 10-14 дней для гетероло-гичных препаратов и до 20 дней для гомологичных.Повторное введение гетерологичных глобулинов приводит к быстрому исчезновению пассивного иммунитета.Слайд 65Для изготовления диагностических сывороток выделяют фракцию иммуноглобулинов G, используя более
сложные методы- ионообменную хроматографию, гель фильтрацию др.
Слайд 66Очистка и концентрация антитоксических
сывороток методом Диаферм 3
Кровь- Плазма - удаление
фибрина в присут-ствии хлористого Са - Сыворотка –добавляют СА 450
г/ л, в осадок выпадает глобулиновая фракция, альбумины остаются в НЖ, ее удаляют, осадок растворяют в меньшем объеме, добавляют пепсин и инкубируют 1 час при Рн =3.2. – второй час при рН =4.2,Слайд 67добавляют СА 140 г/л – в осадок выпадают эуглобулины, их
удаляют, НЖ содержит иммунные глобулины –фильтруют и добавляют СА 200
г/л, в осадке иммунные глобулины,Слайд 68Антитоксические сыворотки
их растворяют, диализуют, подкисляют НСl и добавляют хлороформ -30%
к объему, выдерживают на холоду, в осадок выпадают балластные белки,
их удаляют, в НЖ Иммунные Глобулины. Контроль - белок, активность антиток-сина в МЕ, нормализация в соответст-вии с ФСП, стерилизующая фильтра-ция, контроль на апирогенность.Слайд 69Спиртовой метод 3 стадии
Сыворотка + аna этанол до 25% рН
6.4 - центрифугируют осаждаются глобулины.
Осадок р-ряют в aq.d в 25
V + 1М NaCl 10 мл на 1 л рН доводят до 5.0 + этанол до 17% олажденный до минус 20оС и центрифугируют, используют надосадочную жидкость К НЖ + 1М NaCl 50 мл/л, содой доводят рН до 7,0-7,2 и + этанол до 25% , выдерживают час , центрифугируют , в осадке чистый иммунный глобулин
Слайд 70Контроль сывороточных препаратов
Сывороточные препараты и иммуноглобулины контролируют на безвред-ность, специфическую
активность, апироген-ность на кроликах или Лал тестом и стериль-ность. Безвредность
контролируют на лабор.животных- пример к-ля противорожист с-ки: 5 бел. мышам (п/к 0.5 мл) и 2 морск. свинкам масс. 250-300 г. по 10 мл Все должны выжить в течение 10 дн.возб рожи Erysipelothrix rhusiopathiaeСлайд 71Контроль стерильности на тиогликолев среде или на МПА, МПБ, МППБ
– по 5 пробирок, агар Сабуро 5 чаш.Посевы по 1
мл 10 дней 37о и 20о- агар Сабуро. Все должны стерильными.Контроль специф.активн.-15 бел мыш массой 17-20 г вводят внутрибрюшинно 0.01, 0.02, 0.03 мл по 5 мыш на дозу сыворотки глобулина , через 2 часа 0.1, 0.2 мл вирулент культуры (ЛД ) Все жив живые а конт погибают