Слайд 1противомикробные лекарственные средства
Слайд 21. Противомикробные лекарственные средства
Это препараты, которые применяют при инфекционных заболеваниях
для этиотропного лечения (направленного на причину болезни), а также (редко
и осторожно) для профилактики заболевания.
Обладают избирательностью действия (селективной токсичностью, термин П.Эрлиха), т.е. разной степенью токсичности для паразитов и клеток макроорганизма
Слайд 3классификация
По спектру действия:
- противовирусные
- противогрибковые
- противопротозойные
- антибактериальные
узкого
спектра
широкого спектра
2. По типу действия:
- микробоцидные (вызывающие необратимые повреждения),
- микробостатические (ингибируют рост и размножение).
3. По происхождению:
- антибиотики (биологического происхождения, действуют только на клеточные микроорганизмы),
- синтетические химиопрепараты (действуют на клеточные и неклеточные микроорганизмы).
Слайд 42. антибиотики
Антибиотики – противомикробные препараты биологического происхождения, их полусинтетические производные
или синтетические аналоги, обладающие высокой физиологической активностью по отношению к
определенным группам микроорганизмов (вирусам, бактериям, актиномицетам, грибам, водорослям, простейшим) или к злокачественным опухолям, избирательно задерживая их рост или полностью подавляя развитие.
В настоящее время известно около 40.000 антибиотиков, применяется примерно 60.
Слайд 5История открытия антибиотиков
1871-72гг. – В.А. Манассеин и А.Г.Полотебнов наблюдали эффект
при лечении зараженных ран плесенью.
1887г. - Л. Пастер наблюдал явление
антагонизма бактерий и плесени.
1928-29гг. - А. Флеминг открыл, что вещество, выделяемое Penicillum notatum в культуральную жидкость, задерживает рост стафилококка.
1940г. – Х. Флори и Э. Чейн получили стабилизированный препарат очищенного пенициллина.
1945г. – А.Флемминг, Х.Флори и Э Чейн получили Нобелевскую премию.
В России большой вклад в учение об антибиотиках внесли З.В. Ермольева и Г.Ф. Гаузе.
Термин «Антибиотик» предложен С. Ваксманом в 1942г. Для обозначения природных веществ в низких концентрациях антагонистичных росту микроорганизмов.
Слайд 6продуценты антибиотиков
Актиномицеты (особенно стрептоактиномицеты) - примерно 80% АБ,
Гифальные (плесневые грибы) -
β-лактамные АБ и фузидиевая кислота,
Бактерии (бациллы, псевдомонады и др.) - полимиксины, бацитрацин и др.
Слайд 7Способы получения антибиотиков
Биологический (ферментация),
Биосинтез с последующими
химическими модификациями (полусинтетические АБ) для улучшения противомикробного действия и
фармакологических
характеристик,
Химический синтез (синтетические аналоги), например хлорамфеникол – синт. аналог левомицетина
Слайд 8Уникальность антибиотиков
Мишень-рецептор находится не в тканях человека, а в клетке
микроорганизма.
Активность антибиотиков не является постоянной, а снижается со временем,
что обусловлено формированием лекарственной устойчивости (резистентности).
Антибиотикорезистентные микроорганизмы представляют опасность не только для пациента, у которого они были выделены, но и для многих других людей, даже разделенных временем и пространством.
Слайд 9Общие принципы реализации антимикробного эффекта
Препарат должен быть доставлен к месту
действия;
Препарат должен связаться с бактериями и пройти через их оболочку;
Препарат
должен вступить во взаимодействие с внутриклеточными мишенями.
Слайд 10Классификация антибиотиков по химическому строению
β-лактамы (бактерицидное действие)
Пенициллины, чаще на
грам+, инактивируются пенициллиназами (кроме оксациллина, метициллина), есть широкого спектра (ампициллин,
амоксициллин),
Цефалоспорины, чаще на грам-, 4 поколения:
- цефазолин, цефалотин
- цефуроксим, цефаклор
- цефотаксим, цефтазидим (уст. к β-лактамазам)
- цефепим (уст. к β-лактамазам)
Карбопенемы (имипенем), широкого спектра, уст. к β-лактамазам
Монобактамы (азтреонам), узкий спектр, очень активны против грам-, резистентны к β-лактамазам
Слайд 112) Гликопептиды (ванкомицин, тейкопланин), крупные молекулы, на грам+, используют при
резистентности или аллергии к β-лактамам.
3) Аминогликозиды (стрептомицин, гентамицин), сизомицин, тобрамицин,
бактерицидные, широкого спектра (особенно грам-, на некоторых простейших), несколько поколений.
4) Тетрациклины (тетрациклин, доксициклин), крупные молекулы, бактериостатические, широкий спектр, действуют на внутриклеточные паразиты (риккетсии, хламидии, микоплазмы, бруцеллы).
5) Макролиды (эритромицин, олеандомицин, азитромицин, кларитромицин), бактериостатические и бактерицидные, макроциклические молекулы, широкий спектр (в т.ч. на внутриклеточные паразиты).
.
Классификация антибиотиков по химическому строению
Слайд 126) Линкозамиды (линкомицин, клиндамицин), бактериостатические, спектр как у макролидов, особенно
активны против анаэробных бактерий.
7) Левомицетин (хлорамфеникол), бактериостатические, токсичные, широкий спектр
(в т.ч. на внутриклеточные паразиты).
8) Рифамицины (рифампицин), бактерицидные, широкий спектр (в т.ч. на внутриклеточные паразиты), очень эфективны против микобактерий.
9) Полипептиды (полимиксины), узкий спектр (грам-), очень токсичны (используют только наружно), сейчас не используются.
10) Полиены (амфотерицин В, нистатин), противогрибковые, токсичны, чаще применяют местно.
Классификация антибиотиков по химическому строению
Слайд 133. Синтетические противомикробные препараты
По механизму действия, типу и спектру действия
аналогичны антибиотикам.
1908г. – П. Эрлих на основе органических соединений мышьяка
синтезировал сальварсан для лечения сифилиса.
1935г. – Г. Домагк получил пронтозил («красные стрептоцид»).
Слайд 14Классификация синтетических противомикробных препаратов
Сульфаниламиды (активная парааминогруппа), действуют как аналоги и
конкурентные антагонисты ПАБ кислоты (необходима для синтеза тетрагидрофолиевой кислоты) –
предшественника пуриновых и пиримидиновых оснований. Бактериостатические, широкий спектр, очень много побочных эффектов, низкая активность, многие м/о резистентны. Сейчас используют только ко-тримоксазол (бактрим, бисептол) и его аналоги (бактерицидны) при инфекциях мочевыделительного тракта (грам-).
Хинолоны (налидиксовая кислота), узкий спектр, мало эффективна, много резистентных м/о.
Слайд 153) Фторхинолоны (ципрофлоксацин, норфлоксацин и др.), спектр широкий, бактерицидные, чаще
на грам- (в т.ч. на внутриклеточные паразиты, микобактерии).
4) Нитроимидазолы
(метронидазол, трихопол), бактерицидны, особенно активны в отношении анаэробов, и простейших.
5) Имидазолы (клотримазол), противогрибковые.
6) Нитрофураны (фуразолидон, фурагин, фурадонин), бактерицидные, широкий спектр, уросептики, эффективны при инфекции мочевыводящих путей и ЖКТ.
Классификация синтетических противомикробных препаратов
Слайд 164. Механизм действия антибиотиков
Большинство противомикробных препаратов вмешивается в метаболизм микробной
клетки и обычно не повреждают готовые структуры.
Следовательно особенно активно действуют
на м/о в фазе активного роста и размножения.
Изучены следующие механизмы действия:
1) нарушение синтеза клеточной стенки (β-лактамы и гликопептиды). Инактивируют ферменты, участвующие в синтезе пептидогликана на внешней поверхности ЦПМ накопление его предшественников запуск системы их уничтожения расщепление пептидогликана при делении клетки лизис бактериальной клетки.
Слайд 172) нарушение синтеза белка на различных этапах:
Присоединение тРНК с образованием
инициального комплекса на 70s рибосоме (аминогликозиды),
Перемещение тРНК с акцепторного сайта
на донорский сайт, присоединение нового аминоацила тРНК к акцепторному сайту (тетрациклины),
Формирование пептида, катализируемого пептидил-трансферазой (хлорамфеникол, линкозамиды),
Транслокация пептидил тРНК (эритромицин).
Таким образом, аминогликозиды и тетрациклины связываются с 30s субъединицей рибосомы и блокируют начало синтеза белка;
Макролиды, хлорамфеникол и линкозамиды – соединяются с 50s субъединицей рибосомы, что приводит к обрыву удлинения пептидных цепей.
Механизм действия антибиотиков
Слайд 183) нарушение функции мембран (полимиксины, полиены). Плимиксины повреждают фосфолипиды клеточных
мембран лизис клеток. Полиены повреждают эргостеролы
и ингибируют один из ключевых ферментов биосинтеза эргостерола лизис клеток.
4) подавление синтеза (обмена) нуклеиновых кислот:
- ингибируют синтез предшественников пурин-пиримидиновых оснований (сульфаниламиды, триметоприм),
- подавляют репликацию и функции ДНК (хинолоны, фторхинолоны, нитроимидазолы, нитрофураны),
- ингибируют РНК-полимеразу (рифамицины).
Механизм действия антибиотиков
Слайд 205. Осложнения терапии противомикробными препаратами
1) Токсическое действие (побочные явления):
нейротоксическое
(гликопептиды, аминогликозиды),
нефротоксическое (полиены, полипептиды, аминогликозиды, макролиды, гликопептиды, СА),
общетоксическое
(противогрибковые , полиены, имидазолы),
угнетение кроветворения (тетрациклины, СА, левомицетин/хлорамфеникол),
тератогенное (аминогликозиды, тетрациклины, левомицетин/хлорамфеникол, хинолоны и фторхинолоны).
Проявляются чаще, если мишенью действия препарата являются процессы или структуры, близкие к аналогичным клеток макроорганизма.
Слайд 21Осложнения терапии противомикробными препаратами
2) Дисбактериоз (дизбиоз) – нарушение функций ЖКТ,
авитаминоз, присоединение вторичной инфекции (в т.ч. эндогенной).
3) Отрицательное действие на
иммунную систему – аллергические реакции, развиваются в 10% случаев. Причина – сам препарат, продукты его метаболизма, комплекс препарата с сывороточными белками. Часто дают β-лактамы, рифамицины, СА. Кроме того, АБ обладают некоторым иммунодепрессивным действием вторичные иммунодефициты.
Слайд 22Осложнения терапии противомикробными препаратами
4) Эндотоксический шок при лечении инфекций, вызванных
грам- м/о. Введение АБ гибель и разрушение клеток м/о
высвобождение эндотоксина в большом количестве ухудшение состояния больного.
5) Взаимодействие с другими препаратами – потенциирование или инактивация других препаратов (например, эритромицин стимулирует выработку ферментов печени, что укорачивает период выведения других ЛС).
6) Побочное действие на м/о:
формирование атипичных форм м/о, затр. диагностику,
формирование персистирующих форм м/о,
формирование антибиотикозависимости (редко),
формирование антибиотикорезистентности (часто!).
Слайд 236. Устойчивость бактерий к антибиотикам
Слайд 24Гены резистентности к антимикробным препаратам могут передаваться в процессе:
конъюгации (плазмидами,
транспозоны);
трансдукции (бактериофаги, которые извлекают ген из одной бактериальной клетки и
вводят его в другую);
трансформации (после гибели бактерии
ее содержимое попадает в окружающую среду, и другая бактерия может
иногда забирать освободившийся
ген).
Реализация приобретенной резистентности возможна на любом этапе взаимодействия препарата с бакт. клеткой: связывание препарата с клеткой проникновение сквозь оболочку доставка к мишени взаимодействие с мишенью.
Слайд 25Механизмы резистентности
1) Нарушение проницаемости клеточных оболочек для антибиотика и подавление
его транспорта к внутриклеточным мишеням. Причина – полная или частичная
утрата пориновых белков.
Система MAR (multiple antibiotic resistance − множественная устойчивость к антибиотикам): снижение количества одного из пориновых белков (OmpF) + повышение активности одной из систем активного выведения → тетрациклины или хлорамфеникол → β-лактамы и хинолоны.
Слайд 262) Модификация мишеней
фермент-мишень изменяется так, что его
способность связываться с препаратом (афинность) резко снижается или в бакериальной
клетке включается «обходной» путь метаболизма.
(хинолоны/фторхинолоны → модификация ДНК-гиразы и топоизомеразы IV, макролиды и линкозамиды → метилирование 50S субъединицы рибосомы.
Устойчивость S.pneumoniae к
β–лактамам посредством перестройки мишени
Слайд 273) Инактивация антибиотика
а) β-лактамазы → гидролиз
β-лактамного кольца:
β-лактамазы расширенного действия → цефалоспорины I-IV
поколения;
β-лактамазы класса С → S цефалоспорины IV поколения, группа карбопинема;
β-лактамазы класса В → R цефалоспорины IV поколения, группа карбопинема.
б) Ферментативная инактивация
Модифицированные молекулы аминогликозидов теряют способность связываться с рибосомами и подавлять биосинтез белка. Россия – гентамицин и тобрамицин.
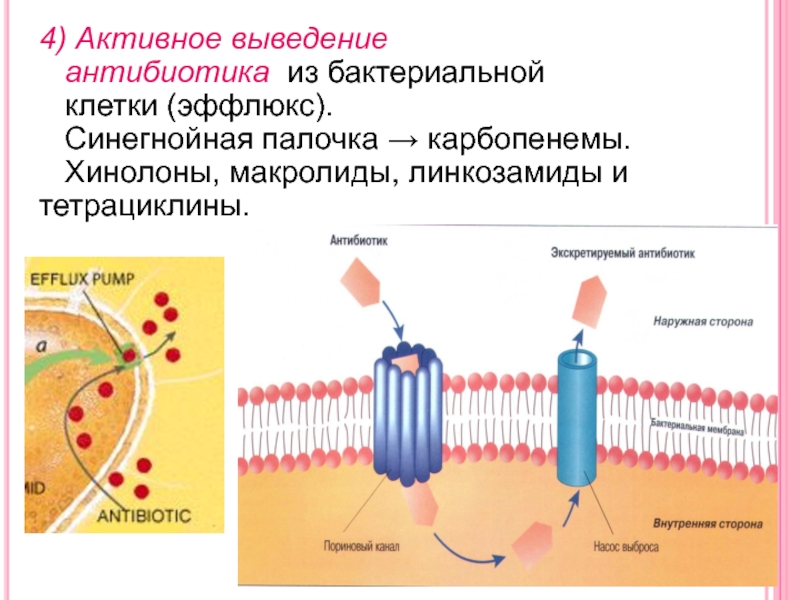
Слайд 284) Активное выведение
антибиотика из бактериальной
клетки
(эффлюкс).
Синегнойная палочка → карбопенемы.
Хинолоны, макролиды,
линкозамиды и тетрациклины.
Слайд 295) Формирование метаболического шунта → триметоприм, сульфаниламиды.
6) Конкурентное связывание или
перехват антимикробного агента.
Слайд 30Механизмы устойчивости к хинолонам у грамотрицательных бактерий
Слайд 31Наиболее распространенные
механизмы резистентности
Сем. Enterobacteriaceae.
продукция β-лактамаз
расширенного спектра действия (Klebsiella spp.), обусловливающая клиническую неэффективность всех цефалоспоринов;
очень высокая частота ассоциированной устойчивости к гентамицину/тобрамицину;
в некоторых лечебных учреждениях тенденция к росту ассоциированной резистентности к фторхинолонам, амикацину.
эффективность сохраняют карбопенемы.
гиперпродукция хромосомных β-лактомаз (чаще всего среди Enterobacter spp., Citrobacter spp., Serratia spp.) – сохраняют эффективность цефалоспорины IV поколения, карбопенемы.
Слайд 32Категории чувствительности микроорганизмов
Чувствительные: лечение инфекции, вызванной данным микроорганизмом при применении
данного антибиотика вероятно будет эффективным
Промежуточные: лечение инфекции, вызванной данным
микроорганизмом при применении данного антибиотика может быть эффективным при использовании повышенных доз и при локализации очага инфекции в том участке, где возможно формирование повышенных концентраций антибиотика
Устойчивые: лечение инфекции, вызванной данным микроорганизмом при применении данного антибиотика вероятно будет неэффективным
Слайд 33Абсолютная резистентность
Enterococcus faecalis
Mycobacterium tuberculosis
Pseudomonas aeruginosa
Слайд 34Поэтому необходимо использовать противомикробные препараты таким образом, чтобы не способствовать
развитию и распространению резистентности:
Применять препараты строго по показаниям,
Избегать их использования
с профилактической целью,
Через 10-15 дней терапии заменять препарат,
По возможности использовать препараты узкого спектра,
Ограниченно применять противомикробные препараты в ветеринарии.
Слайд 357. Методы изучения чувствительности м/о к противомикробным препаратам
Метод серийных разведений
По
способу проведения:
- в агаре, в бульоне,
- макровариант, микровариант
2) По количеству концентраций:
«длинный ряд», по пограничным концентрациям
3) По способу регистрации роста:
визуально, спектрофотометрически
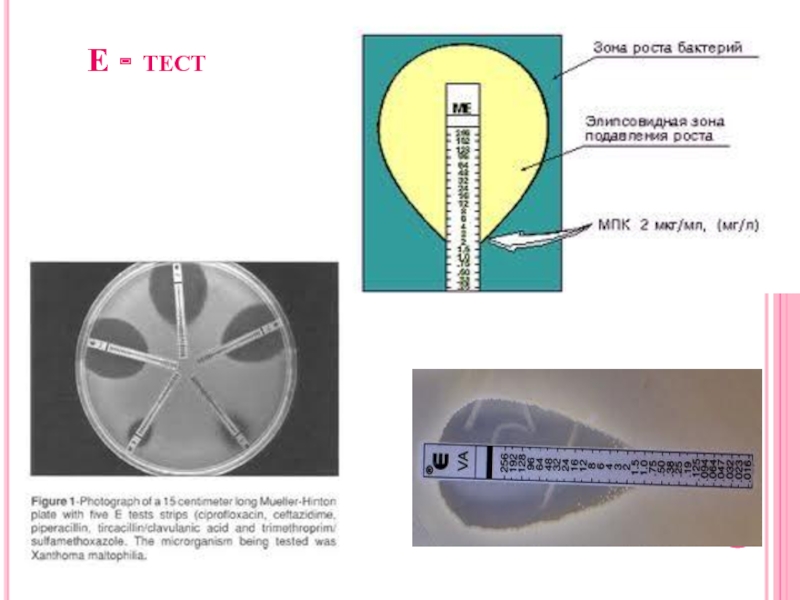
Диффузионные методы
Диско-диффузионный
С помощью Е-тестов
Слайд 36Закономерности диффузии антибиотиков из дисков
В процессе диффузии по поверхности агара
движется фронт концентрации антибиотика равной МПК
Слайд 37Закономерности зонообразования
Рост культуры на поверхности агара происходит в той
области, где концентрация антибиотика не достигает критической.
Граница видимого роста
культуры находится в той области, где концентрация антибиотика в начале фазы логарифмического роста равна критической, коррелирующей с МПК
Слайд 39Преимущества коммерческих тест-систем
1) Исключение трудоемких этапов
2) Обеспечение стандартных
питательных сред
растворов антибиотиков
3) Длительные сроки хранения
Слайд 40Турбидиметрические
методы
Основа: логарифмическая зависимость степени угнетения роста тест-микроорганизма от концентрации
антибиотика.
Метод: измерение концентрации клеток тест-микроба, образующих определенную оптическую плотность
среды в результате роста в присутствии небольших количеств антибиотика. При небольших количествах антибиотика полной задержки роста микроба не происходит и лишь задерживается темп роста, что и сказывается на оптической плотности бульона.
Автоматизированные системы: кюветы с антибиотиками в одной концентрации, соответсвующей критерию принадлежности бактерий к группе «чувствительных» к антибиотику. Результаты регистрируют спектрофотометрически или кондуктометрически сразу при появлении размножения бактерий в контроле без антибиотиков.
Слайд 418. Основы рациональной противомикробной терапии
Микробиологический принцип.
до назначения препарата надо
установить возбудителя инфекции и определить его индивидуальную чувствительность к препаратам.
По
результатам антибиотикограммы назначают препарат узкого спектра в дозе, в 2-3 раза превышающей МПК.
Если возбудитель неизвестен, назначают препарат широкого спектра, активные против м/о, наиболее часто вызывающих данную инфекцию. Через 2-3 дня проводят коррекцию лечения с учетом результатов бактериологического исследования.
Назначать лечение нужно как можно раньше!
Слайд 422. Фармакологический принцип.
необходимо учитывать фармакокинетику и фармакодинамику препарата, обеспечить
оптимальную кратность приема.
доза препарата должна быть достаточна для обеспечения
в биологических жидкостях микробостатической и микробоцидной концентрации.
продолжительность лечения должна быть оптимальна, клиническое улучшение состояние – не основание для отмены препарата.
пути введения должны быть оптимальны, так как многие противомикробные препараты плохо всасываются в ЖКТ и проникают через ГЭБ.
Слайд 433. Клинический принцип.
учет безопасности препарата для пациента (необходимо учитывать
тяжесть инфекции, иммунный статус, пол, наличие беременности, возраст, состояние функций
печени и почек, сопутствующие заболевания)
при тяжелых, угрожающих жизни инфекциях нужна своевременная антибиотикотерапия. При использовании комбинаций из 2-3 препаратов нужно учитывать суммирование их побочных эффектов.
Слайд 444. Эпидемиологический принцип.
необходимо учитывать состояние резистентности микробных штаммов, циркулирующих
в лечебном учреждении, регионе.
5. Фармацевтический принцип.
нужно учитывать срок годности
препарата,
соблюдать правила хранения,
Учитывать стоимость препарата.
Слайд 459. Противовирусные препараты
По структуре и механизму действия выделяют несколько групп:
химиопрепараты, интерфероны, индукторы эндогенных интерферонов, иммуномодуляторы.
Химиопрепараты – синтетические ЛС, используемые
для этиотропной терапии. Механизм действия – избирательное подавление отдельных этапов репродукции вирусов без существенного нарушения жизнедеятельности клеток макроорганизма.
Основной показатель их клинической пригодности – химиотерапевтический индекс
ХТИ= специфическая эффективность/токсичность
Слайд 46Противовирусные препараты
Противовирусные препараты имеют два недостатка:
высокую токсичность,
участие в
формировании резистентных штаммов.
В настоящее время разработаны противовирусные препараты, угнетающие репродукцию
вирусов на следующих стадиях:
депротеинизация (производные адамантана),
синтез «ранних» вирусных белков (гуанидин),
синтез нуклеиновых кислот вируса (аномальные нуклеозиды),
синтез «поздних» вирусных белков (производные пептидов),
сборку вирионов (производные тиосемикарбазона).
Разработаны противовирусные препараты для лечения гриппа, ОРВИ, герпеса, СПИДа. Практически отсутствуют препараты для лечения энтеровирусных инфекций, вирусных энцефалитов .