Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электрохимические методы анализа
Содержание
- 1. Электрохимические методы анализа
- 2. Слайд 2
- 3. Электрохимические методы основаны на процессе электролиза –
- 4. Электроаналитические методы основаны на использовании электрохимических процессов,
- 5. В основе электрохимических методов анализа лежит изучение
- 6. Для выполнения электрохимических определений нужна электрическая цепь,
- 7. Индикаторный электрод. Один из электродов электрохимической ячейки
- 8. Электрод сравнения должен иметь известный потенциал, сохраняющийся
- 9. Электрохимические методы анализа можно классифицировать следующим образом:1)
- 10. Метод кулонометрии основан на измерении количества электричества
- 11. Слайд 11
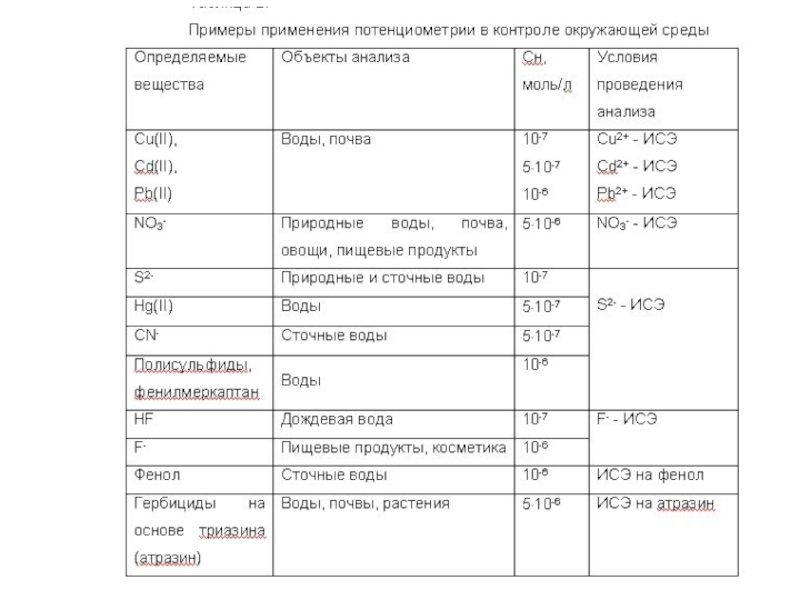
- 12. Потенциометрический метод основан на измерении электродвижущей силы
- 13. Слайд 13
- 14. В зависимости от типа мембраны ионселективные
- 15. Ионоселективные электроды
- 16. Вольтамперометрия основана на записи процесса поляризации электрода
- 17. Вольтамперометрические методы, особенно такие чувствительные варианты, как
- 18. В основе вольтамперометрии лежит изучении зависимости силы
- 19. Электрохимическая ячейка с капающим ртутным электродом: 1
- 20. Классическая полярография. Электролитическую ячейку (ЭЯ) включают с
- 21. Если с помощью полярографической установки записать зависимость
- 22. В вольтамперометрии предпочитают использовать трехэлектродные ячейки. Третий
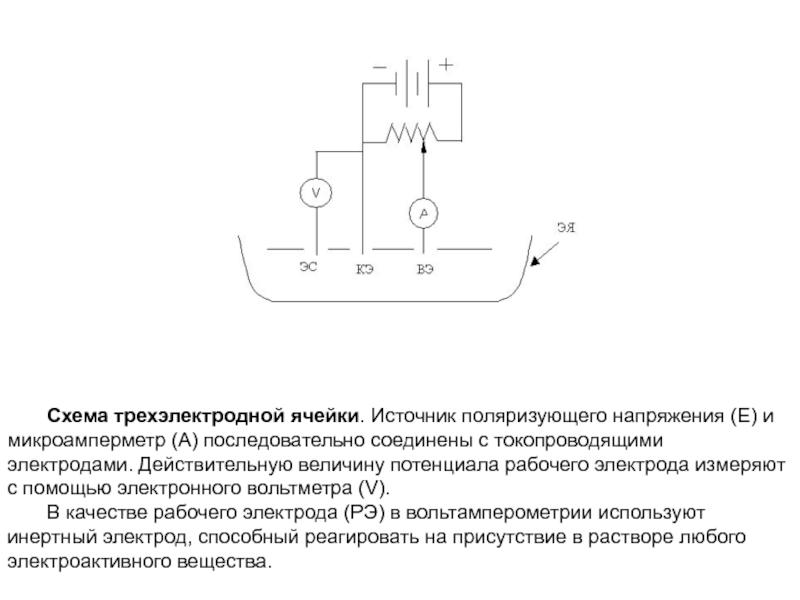
- 23. Схема трехэлектродной ячейки. Источник поляризующего напряжения (Е)
- 24. Качественный и количественный составы раствора могут быть
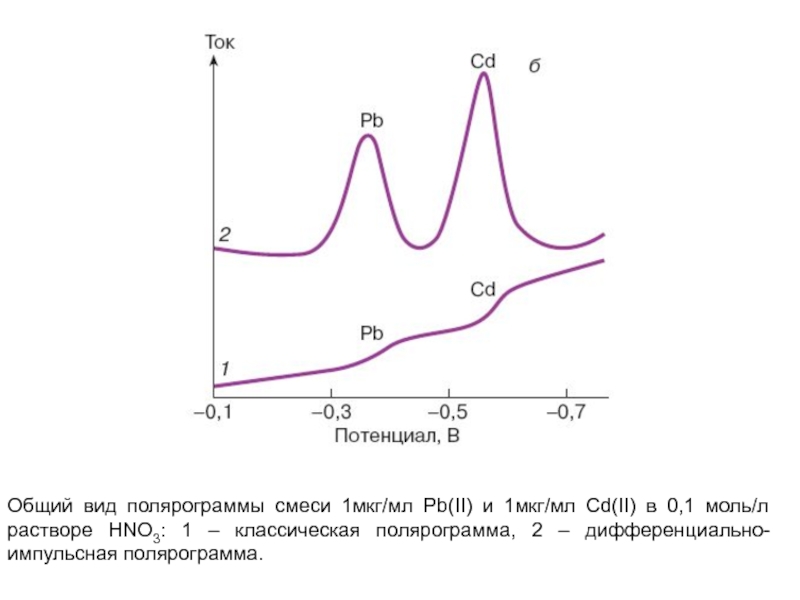
- 25. Общий вид полярограммы смеси 1мкг/мл Pb(II) и
- 26. При этом потенциал полуволны Е1/2 является характерной
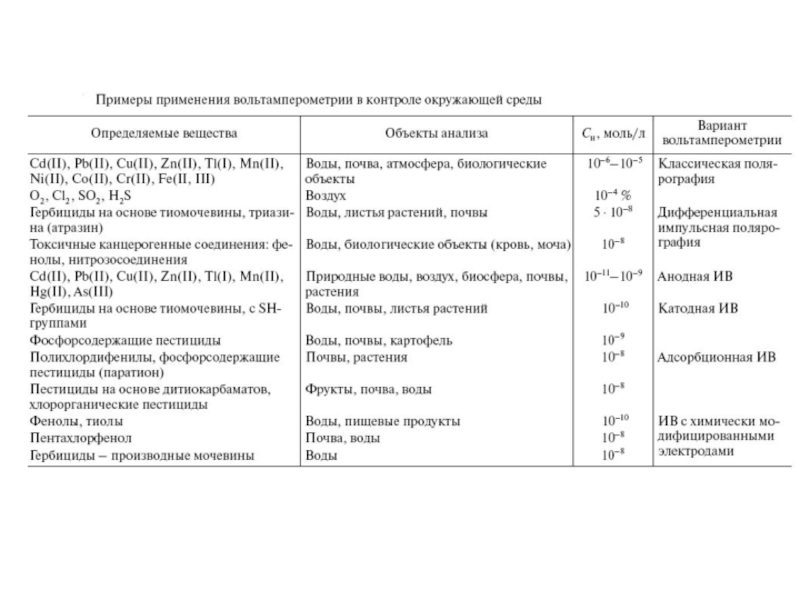
- 27. Наиболее радикальным способом повышения чувствительности метода вольтамперометрии
- 28. ТА-2М Анализатор вольтамперометрическийКраткое описание :Для проведения анализа
- 29. ТА-2М Анализатор вольтамперометрический УФ-облучение для устранения
- 30. Слайд 30
- 31. Однако, несмотря на высокую чувствительность и селективность,
- 32. Тем не менее, электрохимические методы нашли свое
- 33. Скачать презентанцию
Слайды и текст этой презентации
Слайд 4Электроаналитические методы основаны на использовании электрохимических процессов, происходящих в электролитической
ячейке (гальваническом элементе, цепи). Электролитическая ячейка представляет собой электрохимическую систему,
состоящую из электродов и электролитов, контактирующих между собой. На границе раздела фаз может происходить электродная реакция между компонентами этих фаз, в результате которой электрический заряд переходит из одной фазы в другую, и на межфазной границе устанавливается потенциал.В отсутствие электрического тока (I=0) в замкнутой гальванической цепи на межфазной границе устанавливается равновесие и потенциал достигает равновесного значения. Если через ячейку проходит электрический ток (I0), на межфазной границе равновесие не достигается и в результате электродного процесса электроны переходят из электрода в раствор (или положительный заряд в обратном направлении).
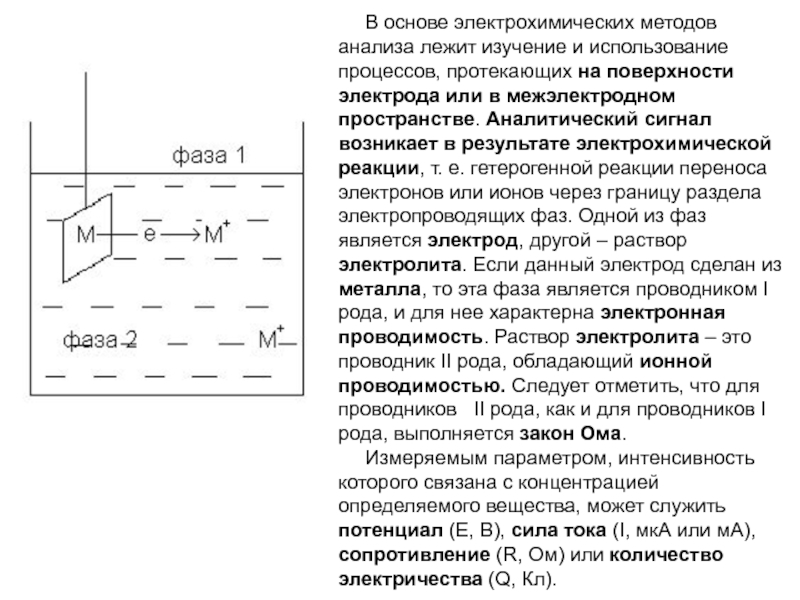
Слайд 5В основе электрохимических методов анализа лежит изучение и использование процессов,
протекающих на поверхности электрода или в межэлектродном пространстве. Аналитический сигнал
возникает в результате электрохимической реакции, т. е. гетерогенной реакции переноса электронов или ионов через границу раздела электропроводящих фаз. Одной из фаз является электрод, другой – раствор электролита. Если данный электрод сделан из металла, то эта фаза является проводником рода, и для нее характерна электронная проводимость. Раствор электролита – это проводник рода, обладающий ионной проводимостью. Следует отметить, что для проводников рода, как и для проводников рода, выполняется закон Ома.Измеряемым параметром, интенсивность которого связана с концентрацией определяемого вещества, может служить потенциал (Е, В), сила тока (I, мкА или мА), сопротивление (R, Ом) или количество электричества (Q, Кл).
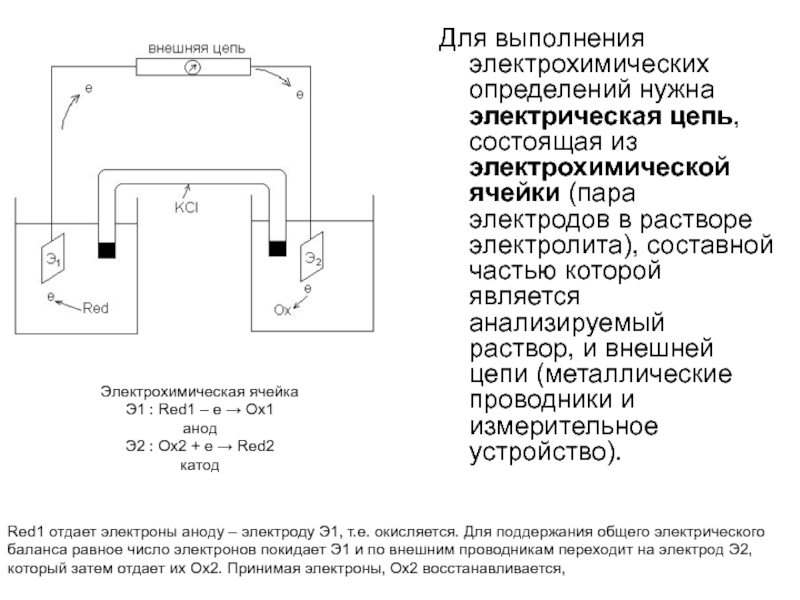
Слайд 6Для выполнения электрохимических определений нужна электрическая цепь, состоящая из электрохимической
ячейки (пара электродов в растворе электролита), составной частью которой является
анализируемый раствор, и внешней цепи (металлические проводники и измерительное устройство).Электрохимическая ячейка
Э1 : Red1 – e Ox1
анод
Э2 : Ox2 + e Red2
катод
Red1 отдает электроны аноду – электроду Э1, т.е. окисляется. Для поддержания общего электрического баланса равное число электронов покидает Э1 и по внешним проводникам переходит на электрод Э2, который затем отдает их Ох2. Принимая электроны, Ох2 восстанавливается,
Слайд 7Индикаторный электрод. Один из электродов электрохимической ячейки называют индикаторным. Он
обратимо реагирует на изменение состава анализируемого раствора, и эта реакция
позволяет получить ответ на вопросы: есть определяемый компонент в растворе и, если есть, то сколько его там. Если электрод отвечает поставленному требованию, то ответом на первый вопрос послужит наличие сигнала, а ответом на второй вопрос – его интенсивность.Индикаторный электрод не должен реагировать с компонентами анализируемого раствора. Поэтому для изготовления таких электродов используют инертные токопроводящие материалы (ртуть, серебро, золото, платина и др.) и различные разновидности графита или применяют капающие металлические электроды (ртуть, амальгамы и т.п.).
В различных электрохимических методах используют индикаторные электроды, различающиеся не только по форме, размеру и материалу, из которого они изготовлены, но и по выполняемой функции.
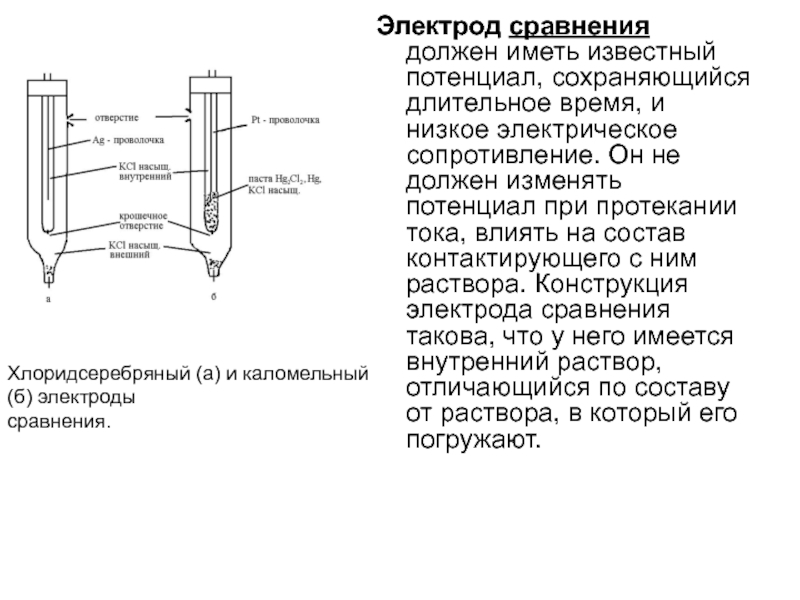
Слайд 8Электрод сравнения должен иметь известный потенциал, сохраняющийся длительное время, и
низкое электрическое сопротивление. Он не должен изменять потенциал при протекании
тока, влиять на состав контактирующего с ним раствора. Конструкция электрода сравнения такова, что у него имеется внутренний раствор, отличающийся по составу от раствора, в который его погружают.Хлоридсеребряный (а) и каломельный (б) электроды сравнения.
Слайд 9Электрохимические методы анализа можно классифицировать следующим образом:
1) методы без протекания
электродной реакции (кондуктометрия);
2) методы, основанные на электродных реакциях: в отсутствие
тока (потенциометрия) или под током (вольтамперометрия, кулонометрия, электрогравиметрия).Слайд 10Метод кулонометрии основан на измерении количества электричества (Q, Кл), затраченного
на электрохимическую реакцию. Последняя приводит к количественному окислению или восстановлению
определяемого вещества.Основой метода кулонометрического анализа является закон Фарадея
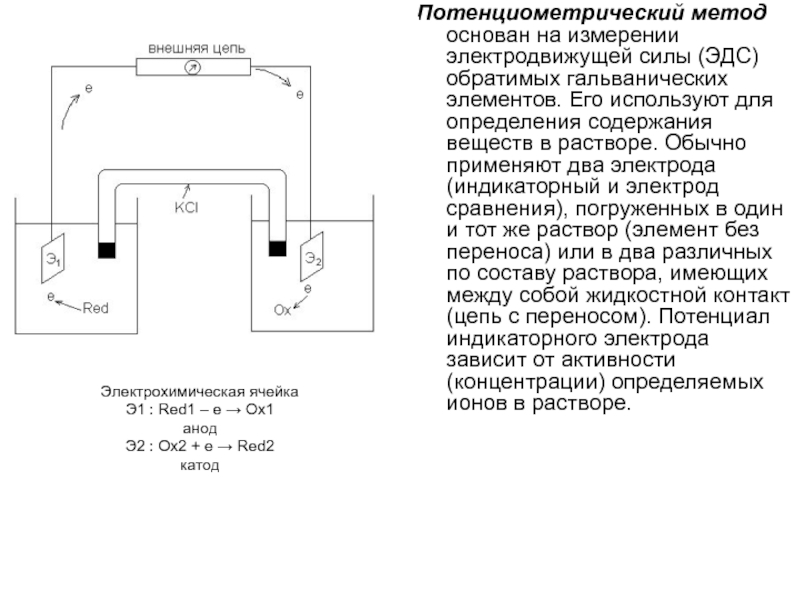
Слайд 12Потенциометрический метод основан на измерении электродвижущей силы (ЭДС) обратимых гальванических
элементов. Его используют для определения содержания веществ в растворе. Обычно
применяют два электрода (индикаторный и электрод сравнения), погруженных в один и тот же раствор (элемент без переноса) или в два различных по составу раствора, имеющих между собой жидкостной контакт (цепь с переносом). Потенциал индикаторного электрода зависит от активности (концентрации) определяемых ионов в растворе.Электрохимическая ячейка
Э1 : Red1 – e Ox1
анод
Э2 : Ox2 + e Red2
катод
Слайд 14 В зависимости от типа мембраны ионселективные электроды можно разделить
на следующие группы:
твердые электроды - гомогенные, гетерогенные, на основе
ионообменных смол, стекол, осадков, моно- и поликристаллов;жидкостные электроды на основе жидких ионитов хелатов - нейтральные переносчики, биологически активных веществ;
газовые и энзимные электроды
Слайд 16Вольтамперометрия основана на записи процесса поляризации электрода и дальнейшей расшифровке
вольтамперной кривой (зависимость силы тока от потенциала (напряжения) интересующего нас
(рабочего, индикаторного) электрода). Термин полярография относится только к вольтамперометрии с использованием ртутного капающего электрода.Слайд 17Вольтамперометрические методы, особенно такие чувствительные варианты, как дифференциальная импульсная полярография
и инверсионная вольтамперометрия, постоянно используются во всех областях химического анализа
и наиболее полезны при решении проблем охраны окружающей среды. Эти методы применимы для определения и органических и неорганических веществ, например, для определения большинства химических элементов. С помощью метода инверсионной вольтамперометрии чаще всего решают проблему определения следов тяжелых металлов в водах и биологических материалах.Слайд 18В основе вольтамперометрии лежит изучении зависимости силы тока в электролитической
ячейке от величины потенциала, приложенного к погруженному в анализируемый раствор
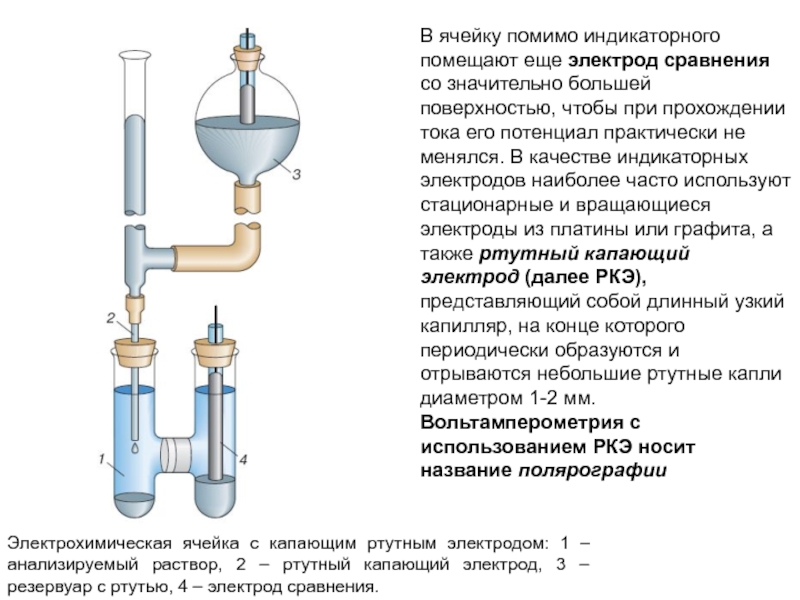
индикаторному электроду, а также принцип электролиза: присутствующие в растворе определяемые вещества окисляются или восстанавливаются на индикаторном электроде.Слайд 19Электрохимическая ячейка с капающим ртутным электродом: 1 – анализируемый раствор,
2 – ртутный капающий электрод, 3 – резервуар с ртутью,
4 – электрод сравнения.В ячейку помимо индикаторного помещают еще электрод сравнения со значительно большей поверхностью, чтобы при прохождении тока его потенциал практически не менялся. В качестве индикаторных электродов наиболее часто используют стационарные и вращающиеся электроды из платины или графита, а также ртутный капающий электрод (далее РКЭ), представляющий собой длинный узкий капилляр, на конце которого периодически образуются и отрываются небольшие ртутные капли диаметром 1-2 мм. Вольтамперометрия с использованием РКЭ носит название полярографии
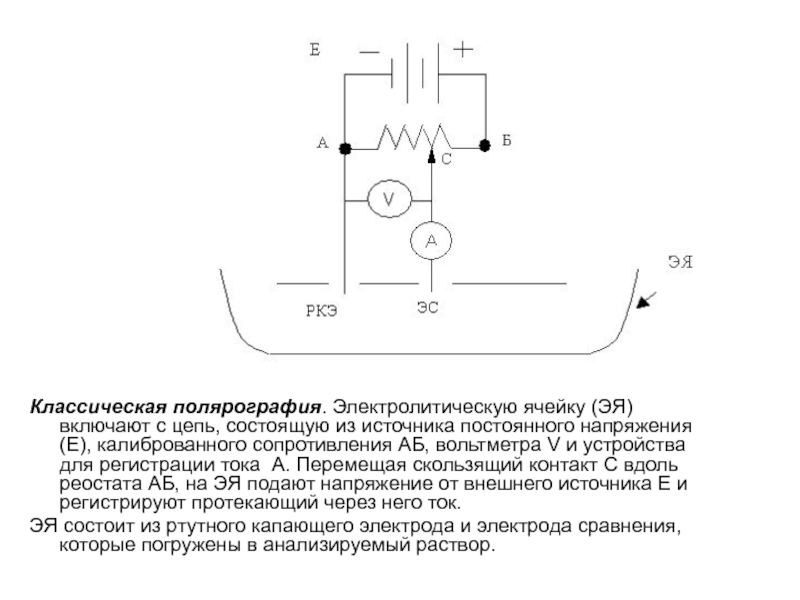
Слайд 20Классическая полярография. Электролитическую ячейку (ЭЯ) включают с цепь, состоящую из
источника постоянного напряжения (Е), калиброванного сопротивления АБ, вольтметра V и
устройства для регистрации тока А. Перемещая скользящий контакт С вдоль реостата АБ, на ЭЯ подают напряжение от внешнего источника Е и регистрируют протекающий через него ток.ЭЯ состоит из ртутного капающего электрода и электрода сравнения, которые погружены в анализируемый раствор.
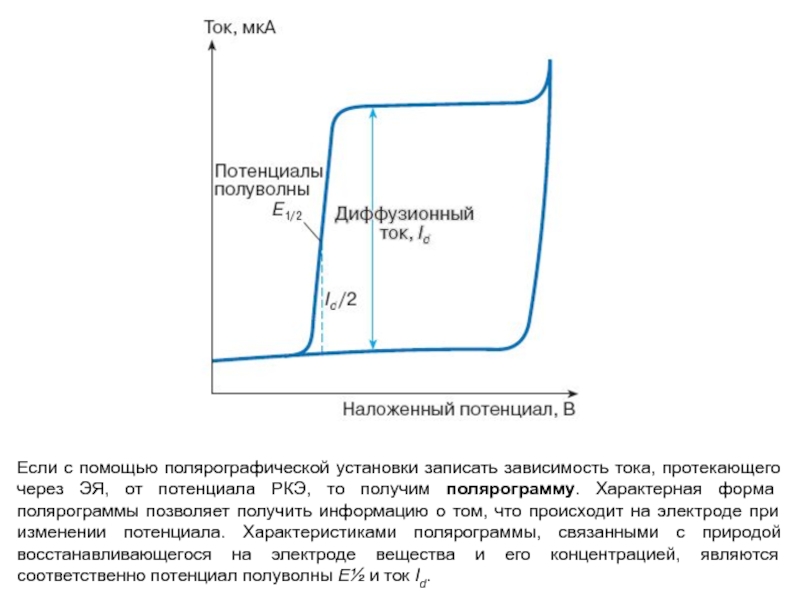
Слайд 21Если с помощью полярографической установки записать зависимость тока, протекающего через
ЭЯ, от потенциала РКЭ, то получим полярограмму. Характерная форма полярограммы
позволяет получить информацию о том, что происходит на электроде при изменении потенциала. Характеристиками полярограммы, связанными с природой восстанавливающегося на электроде вещества и его концентрацией, являются соответственно потенциал полуволны E½ и ток Id.Слайд 22В вольтамперометрии предпочитают использовать трехэлектродные ячейки. Третий вспомогательный электрод проводит
ток, тогда как электрод сравнения только контролирует потенциал, а ток
не проводит. Вспомогательным электродом (ВЭ) служит платиновая или серебряная проволока, или большой слой ртути. Преимущество трехэлектродной ячейки состоит в том, что она позволяет проводить измерения не только в обычных водных растворах с низким сопротивлением, но и в растворах с высоким сопротивлением в неводных или смешанных средах.Слайд 23Схема трехэлектродной ячейки. Источник поляризующего напряжения (Е) и микроамперметр (А)
последовательно соединены с токопроводящими электродами. Действительную величину потенциала рабочего электрода
измеряют с помощью электронного вольтметра (V).В качестве рабочего электрода (РЭ) в вольтамперометрии используют инертный электрод, способный реагировать на присутствие в растворе любого электроактивного вещества.
Слайд 24Качественный и количественный составы раствора могут быть установлены из вольтамперограмм
- кривых зависимости тока от приложенного к электролитической ячейке напряжения,
регистрируемых специальными приборами.Слайд 25Общий вид полярограммы смеси 1мкг/мл Pb(II) и 1мкг/мл Cd(II) в
0,1 моль/л растворе HNO3: 1 – классическая полярограмма, 2 –
дифференциально-импульсная полярограмма.Слайд 26При этом потенциал полуволны Е1/2 является характерной для данного вещества
величиной (качественной характеристикой), а величина тока Id пропорциональна концентрации определяемого
вещества в растворе (количественная характеристика). Важным достоинством методов вольтамперометрии является возможность одновременного определения нескольких компонентов в одном растворе.Нижняя граница определяемых концентраций (Сн) в методе вольтамперометрии с линейным изменением потенциала индикаторного электрода (классической вольтамперометрии) составляет 10 - 6 -10 - 5 моль/л. Для ее снижения до 10-8- 10-7 моль/л используют усовершенствованные инструментальные варианты вольтамперометрии: переменно-токовую (с наложением переменного напряжения) и дифференциальную импульсную (с наложением импульсов напряжения