Слайд 1ПРОЦЕССЫ АЛКИЛИРОВАНИЯ
Алкилированием называются процессы замещения атома водорода или металла в
молекуле субстрата на алкил. Обычно различают С-, N- и О-алкилирование.
Если в молекулу вводится арил, реакция называется арилированием.
Алкилирующими агентами являются, главным образом, галогенпроизводные, непредельные соединения, спирты, простые эфиры и эфиры серной и сульфокислот.
Процессы алкилирования используют для построения углеродного скелета молекулы, а также временной защиты функциональных групп (чаще всего гидроксильной или аминогрупп). Имеют большое значение в химическом синтезе лекарственных веществ и витаминов.
Реакции С-, N- и О-алкилирования аренов и алифатических соединений отличаются. Единого механизма алкилирования, нет.
Слайд 2Алкилирование аренов по Фриделю-Крафтсу
Часто встречается в промышленности, но используется только
для алкилирования активированных аренов; фенолы и амины в ряде случаев
затрудняют реакцию.
Механизм – обратимое SE.
Реакционная способность субстрата определяется устойчивостью -комплекса, существование которого доказано экспериментально. Электронодонорные заместители в ядре, ускоряют реакцию, а электроноакцепторные — затрудняют реакцию.
В кинетической области скорость реакции можно рассчитать по уравнению, в котором учитывается строение субстрата (k), концентрации реагирующих веществ и функция катализатора () :
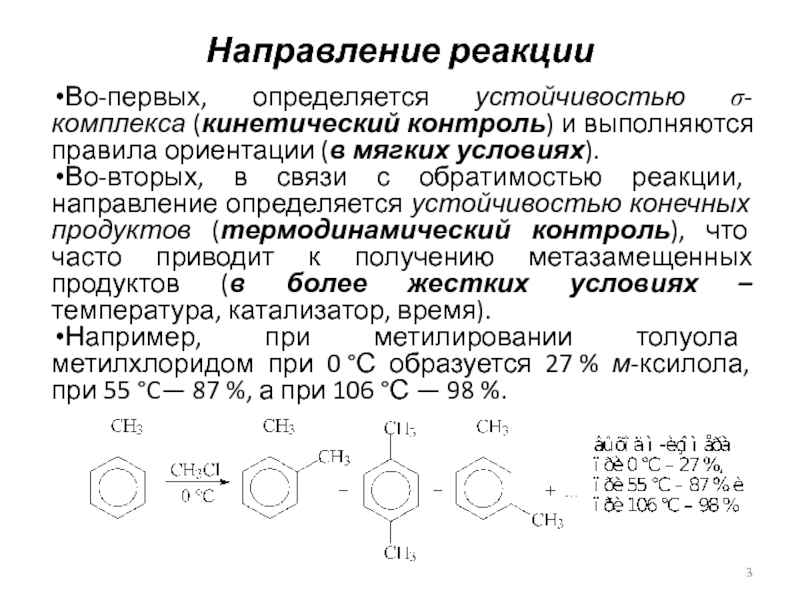
Слайд 3Направление реакции
Во-первых, определяется устойчивостью s-комплекса (кинетический контроль) и выполняются правила
ориентации (в мягких условиях).
Во-вторых, в связи с обратимостью реакции,
направление определяется устойчивостью конечных продуктов (термодинамический контроль), что часто приводит к получению метазамещенных продуктов (в более жестких условиях – температура, катализатор, время).
Например, при метилировании толуола метилхлоридом при 0 °С образуется 27 % м-ксилола, при 55 °C— 87 %, а при 106 °С — 98 %.
Слайд 4Катализаторы процессов алкилирования
Протонные кислоты – при алкилировании спиртами и алкенами.
Активность падает в ряду HF > H2SO4 > H3PO4.
Апротонные
кислоты (кислоты Льюиса) при алкилировании алкилгалогенидами и алкенами. Их активность уменьшается в ряд: AlBr3 > AlCl3 > FeCl3 > BF3 > TiCl3 > ZnCl2 > TiCl4.
Оксиды металлов и бора, активированные борной кислотой, трифторидом бора и фтором. Наиболее активные амфотерные оксиды (Al2O3, Cr2O3 и др.).
Цеолиты имеют общую формулу M2/nО.Al2O3.xSiO2.yH2O, где М — металл. Их активность можно менять, изменяя объем пор от 0,2 до 1,0 нм введением катионов Li+, Na+, K+, Ca2+ и других методом ионного обмена; алюмосиликатный состав хSiO2:Al2O3, где х ≈ 36; чем больше величина х, тем активнее цеолит.
Катиониты полистирольные полимеры, содержащие –SO3H, –COOH, –PO(OH)2 и другие группы.
Слайд 5Особенности катализа
Активность катализатора зависит от строения субстрата, природы алкилирующего агента
и условий реакции. Так, BF3 активен при алкилировании спиртами, алкенами,
фторпроизводными, но другими алкилгалогенидами его активность мала.
Твердофазный предпочтительнее жидкофазного катализа, т. к. упрощается технология (отделение и регенерация катализатора); уменьшаются затраты на подготовку сырья, промывку массы и нейтрализацию кислых вод; уменьшается коррозия оборудования и т.д.
В случае апротонных кислот, выбор того или иного вида катализа зависит от растворителя и свойств кислоты Льюиса. При наличии двух жидких фаз реакция, в основном, проходит в кислотно-солевом слое.
При алкилировании спиртами количество кислоты Льюиса должно быть не менее эквимолярного, так как образующаяся в результате реакции вода дезактивирует его.
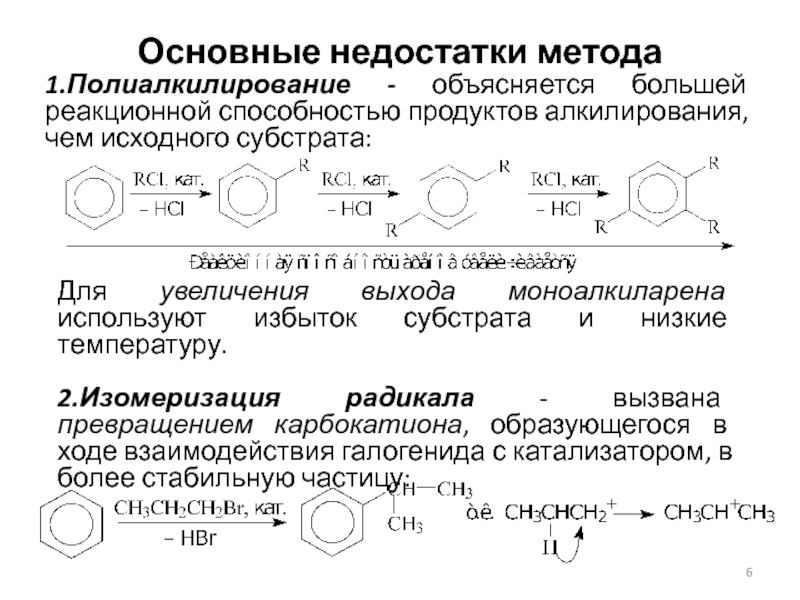
Слайд 6Основные недостатки метода
1.Полиалкилирование - объясняется большей реакционной способностью продуктов алкилирования,
чем исходного субстрата:
Для увеличения выхода моноалкиларена используют избыток субстрата и
низкие температуру.
2.Изомеризация радикала - вызвана превращением карбокатиона, образующегося в ходе взаимодействия галогенида с катализатором, в более стабильную частицу:
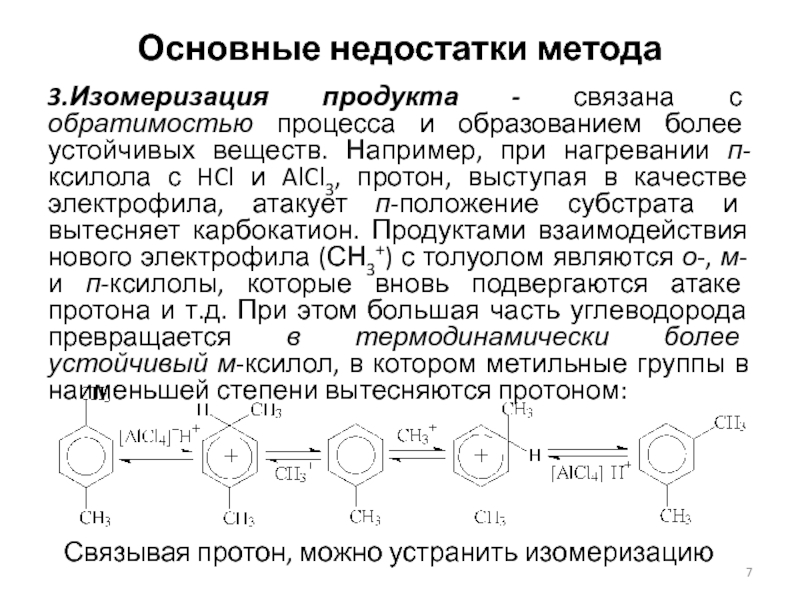
Слайд 7Основные недостатки метода
3.Изомеризация продукта - связана с обратимостью процесса и
образованием более устойчивых веществ. Например, при нагревании п-ксилола с HCl
и AlCl3, протон, выступая в качестве электрофила, атакует п-положение субстрата и вытесняет карбокатион. Продуктами взаимодействия нового электрофила (СН3+) с толуолом являются о-, м- и п-ксилолы, которые вновь подвергаются атаке протона и т.д. При этом большая часть углеводорода превращается в термодинамически более устойчивый м-ксилол, в котором метильные группы в наименьшей степени вытесняются протоном:
Связывая протон, можно устранить изомеризацию
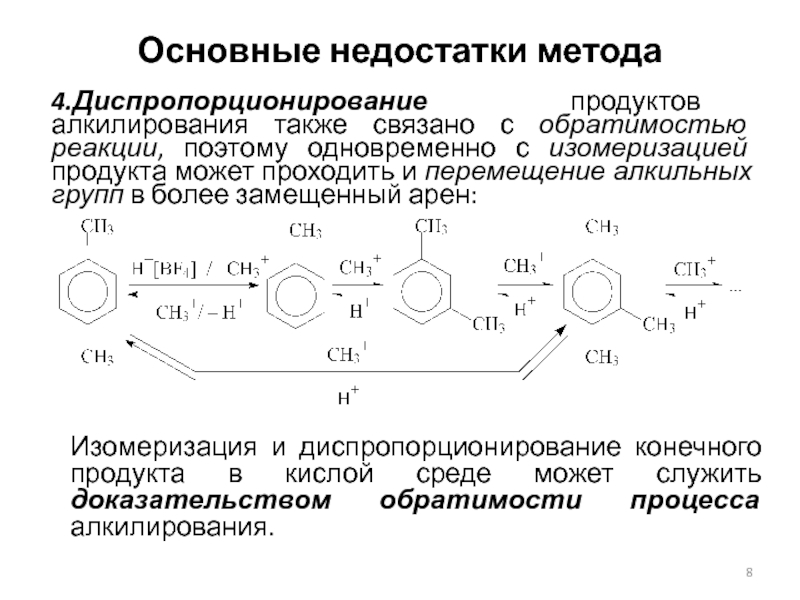
Слайд 8Основные недостатки метода
4.Диспропорционирование продуктов алкилирования также связано с обратимостью реакции,
поэтому одновременно с изомеризацией продукта может проходить и перемещение алкильных
групп в более замещенный арен:
Изомеризация и диспропорционирование конечного продукта в кислой среде может служить доказательством обратимости процесса алкилирования.
Слайд 9Алкилирование аренов алкилгалогенидами
Проводится в безводном инертном растворителе (нитробензоле) или
в избытке субстрата в присутствии кислот Льюиса;
Активность алкилгалогенидов увеличивается от
первичных к третичным, но зависит и от катализатора.
Кислота Льюиса определяет: а)строение и полярность электрофильной частицы (поляризованный комплекс, ионная пара или карбокатион); б) скорость реакции, состав продуктов реакции и возможность изомеризации алкилгалогенида и продукта реакции.
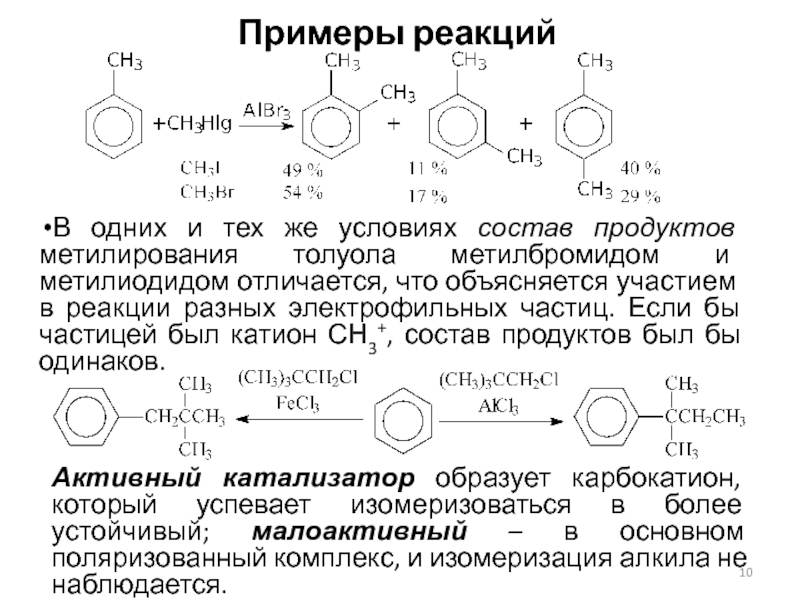
Слайд 10Примеры реакций
В одних и тех же условиях состав продуктов метилирования
толуола метилбромидом и метилиодидом отличается, что объясняется участием в реакции
разных электрофильных частиц. Если бы частицей был катион СН3+, состав продуктов был бы одинаков.
Активный катализатор образует карбокатион, который успевает изомеризоваться в более устойчивый; малоактивный – в основном поляризованный комплекс, и изомеризация алкила не наблюдается.
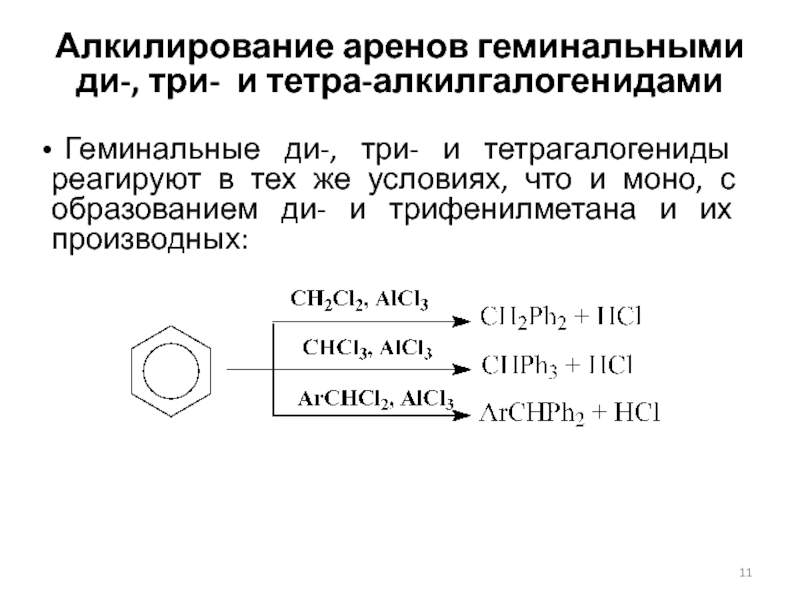
Слайд 11Алкилирование аренов геминальными ди-, три- и тетра-алкилгалогенидами
Геминальные ди-, три- и тетрагалогениды реагируют в тех же условиях,
что и моно, с образованием ди- и трифенилметана и их производных:
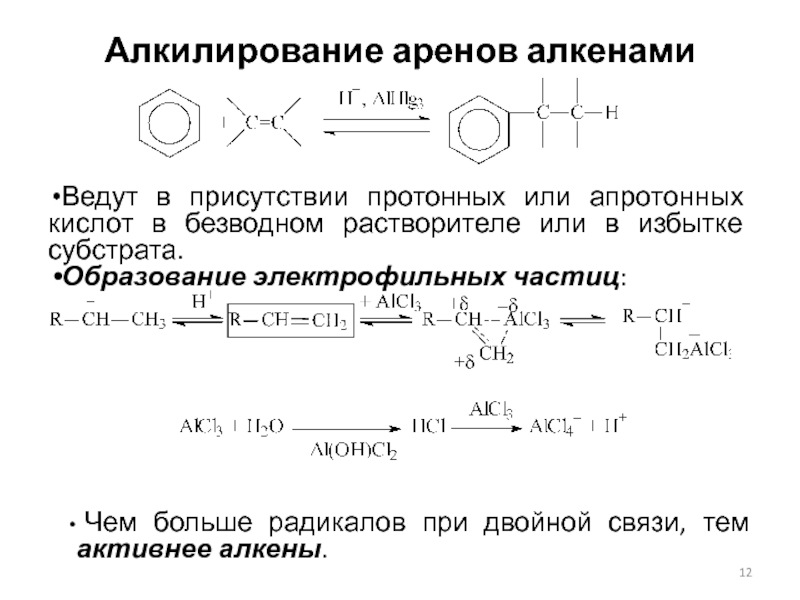
Слайд 12Алкилирование аренов алкенами
Ведут в присутствии протонных или апротонных кислот в
безводном растворителе или в избытке субстрата.
Образование электрофильных частиц:
Чем больше
радикалов при двойной связи, тем активнее алкены.
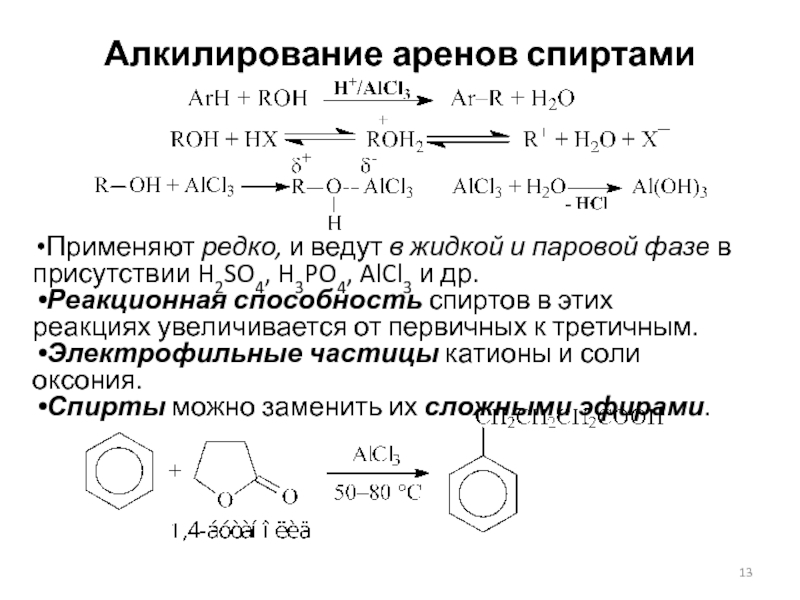
Слайд 13Алкилирование аренов спиртами
Применяют редко, и ведут в жидкой и паровой
фазе в присутствии H2SO4, H3PO4, AlCl3 и др.
Реакционная способность
спиртов в этих реакциях увеличивается от первичных к третичным.
Электрофильные частицы катионы и соли оксония.
Спирты можно заменить их сложными эфирами.
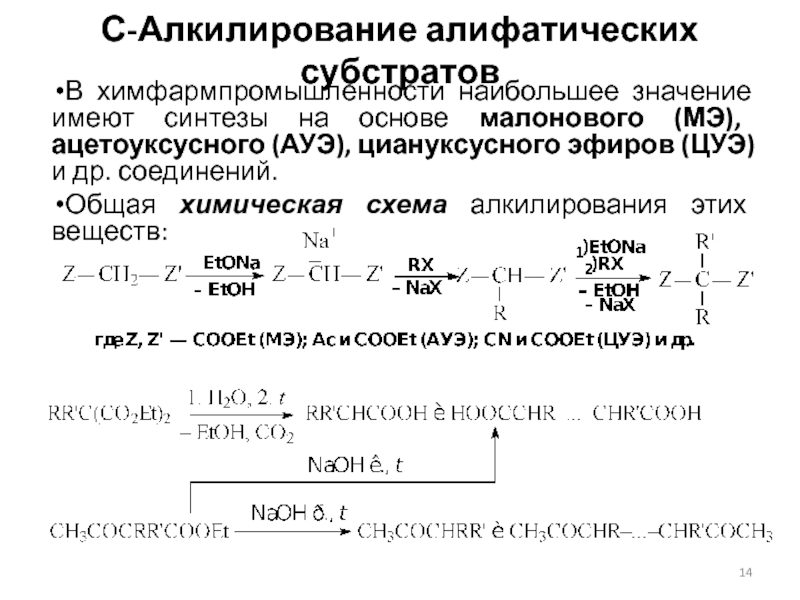
Слайд 14С-Алкилирование алифатических субстратов
В химфармпромышленности наибольшее значение имеют синтезы на основе
малонового (МЭ), ацетоуксусного (АУЭ), циануксусного эфиров (ЦУЭ) и др. соединений.
Общая химическая схема алкилирования этих веществ:
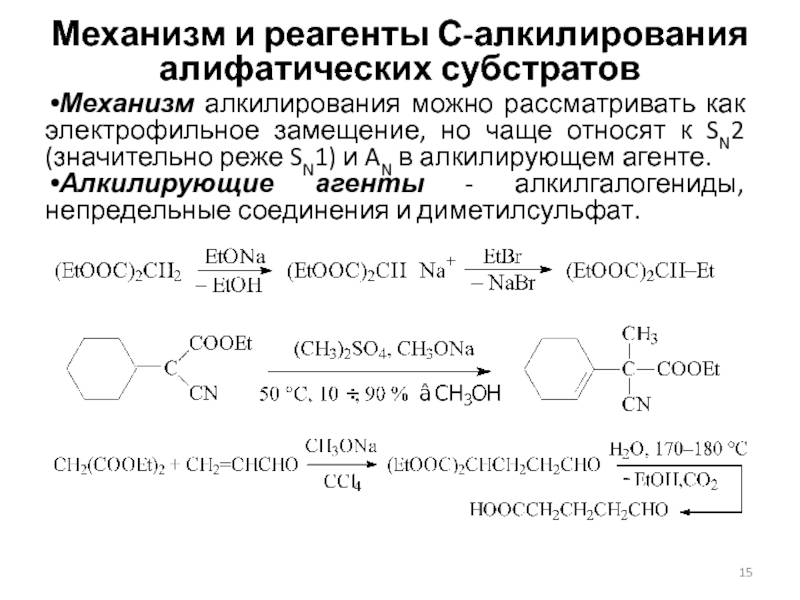
Слайд 15Механизм и реагенты С-алкилирования алифатических субстратов
Механизм алкилирования можно рассматривать как
электрофильное замещение, но чаще относят к SN2 (значительно реже SN1)
и AN в алкилирующем агенте.
Алкилирующие агенты - алкилгалогениды, непредельные соединения и диметилсульфат.
Слайд 16N-Алкилирование (арилирование) галогенидами (механизмы SN2, SNAr и др.)
Выделяется галогеноводород, что
затрудняет реакцию, поэтому в реакционную массу добавляют вещества, связывающие кислоту
(амин, карбонаты или щелочь).
Нуклеофильность субстрата и его активность увеличивается от сульфамида до третичного амина (как и его pKa):
–SO2NH2 < –CONH2 < ArNH2 < C5H5N < NH3 < RNH2 < R2NH < R3N
Амиды кислот, нуклеофильность которых очень низкая, алкилируются трудно, но зато селективно, что позволяет синтезировать чистые первичные и вторичные амины.
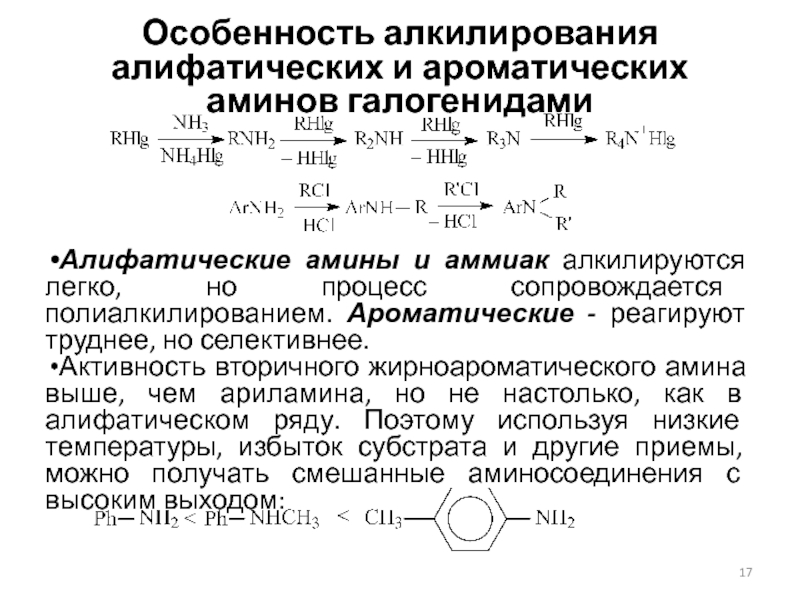
Слайд 17Особенность алкилирования алифатических и ароматических аминов галогенидами
Алифатические амины и аммиак
алкилируются легко, но процесс сопровождается полиалкилированием. Ароматические - реагируют труднее,
но селективнее.
Активность вторичного жирноароматического амина выше, чем ариламина, но не настолько, как в алифатическом ряду. Поэтому используя низкие температуры, избыток субстрата и другие приемы, можно получать смешанные аминосоединения с высоким выходом:
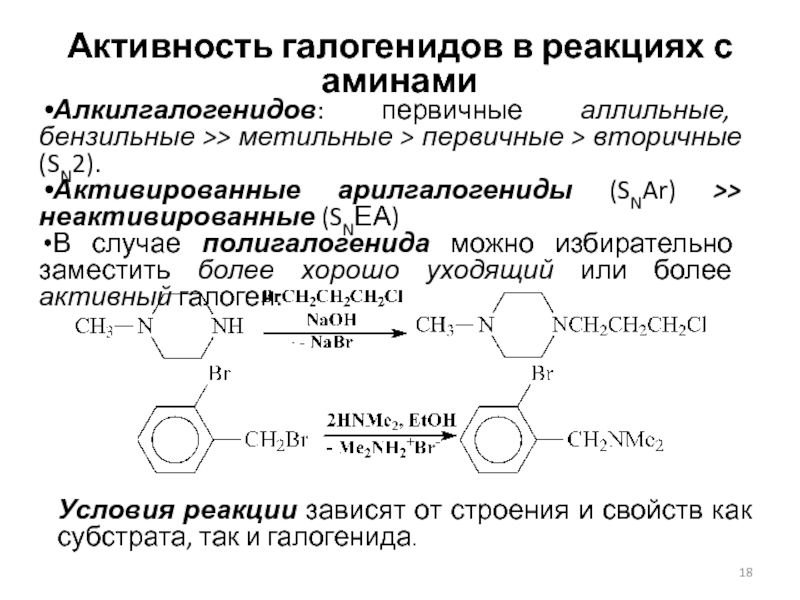
Слайд 18Активность галогенидов в реакциях с аминами
Алкилгалогенидов: первичные аллильные, бензильные >>
метильные > первичные > вторичные (SN2).
Активированные арилгалогениды (SNAr) >> неактивированные
(SNЕА)
В случае полигалогенида можно избирательно заместить более хорошо уходящий или более активный галоген:
Условия реакции зависят от строения и свойств как субстрата, так и галогенида.
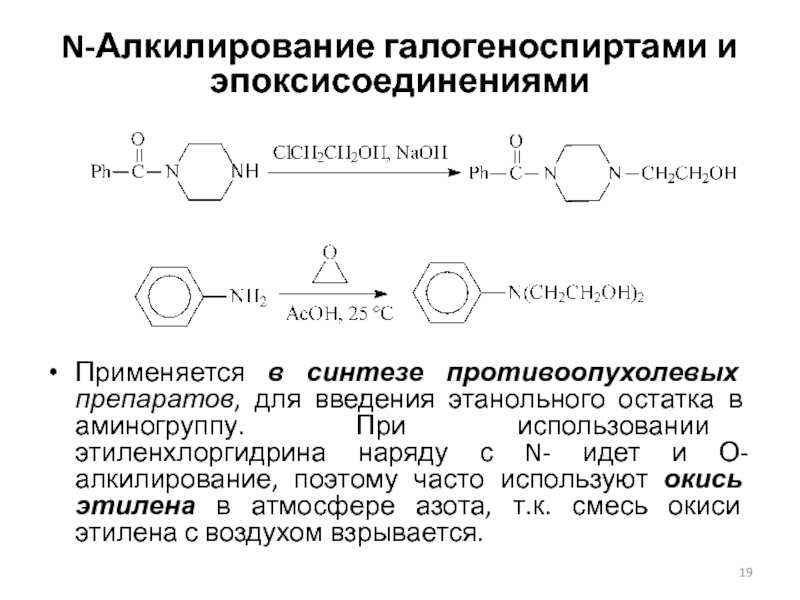
Слайд 19N-Алкилирование галогеноспиртами и эпоксисоединениями
Применяется в синтезе противоопухолевых препаратов, для
введения этанольного остатка в аминогруппу. При использовании этиленхлоргидрина наряду с
N- идет и О-алкилирование, поэтому часто используют окись этилена в атмосфере азота, т.к. смесь окиси этилена с воздухом взрывается.
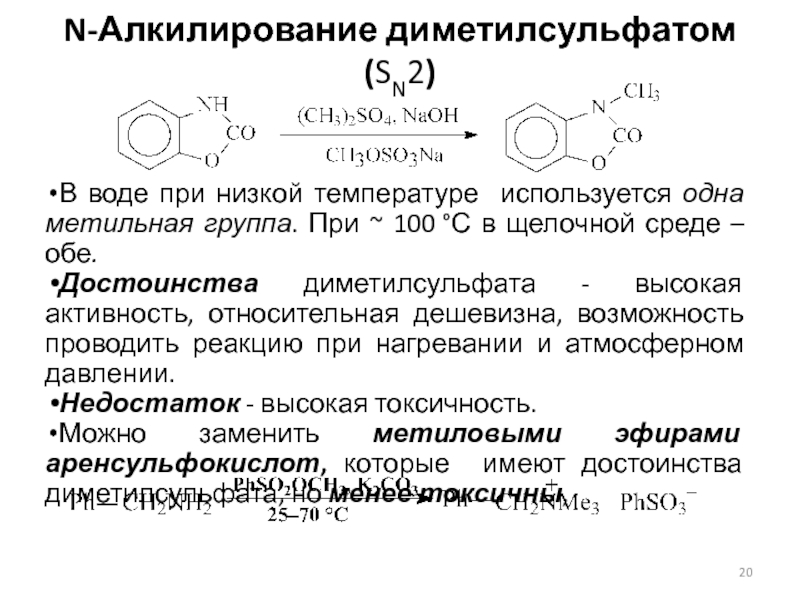
Слайд 20N-Алкилирование диметилсульфатом (SN2)
В воде при низкой температуре используется одна метильная
группа. При ~ 100 °С в щелочной среде – обе.
Достоинства диметилсульфата
- высокая активность, относительная дешевизна, возможность проводить реакцию при нагревании и атмосферном давлении.
Недостаток - высокая токсичность.
Можно заменить метиловыми эфирами аренсульфокислот, которые имеют достоинства диметилсульфата, но менее токсичны,
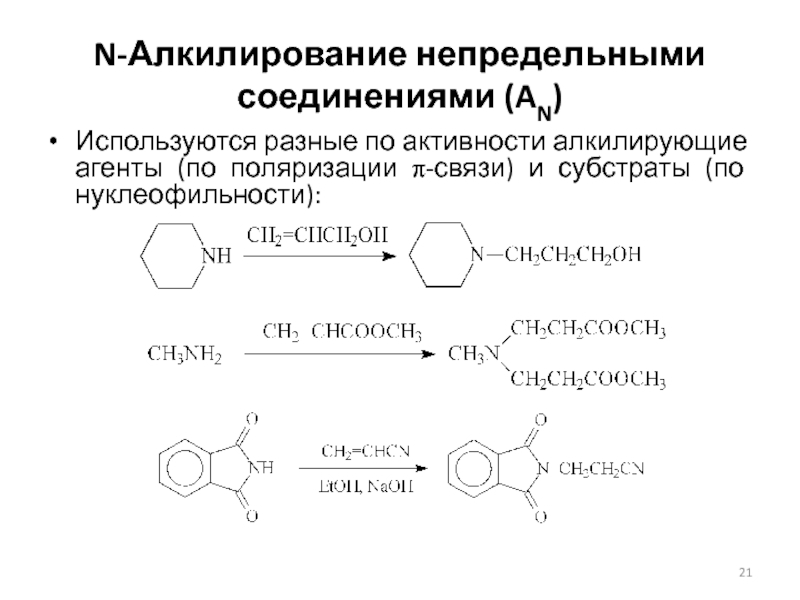
Слайд 21N-Алкилирование непредельными соединениями (AN)
Используются разные по активности алкилирующие агенты (по
поляризации p-связи) и субстраты (по нуклеофильности):
Слайд 22N-Алкилирование спиртами и эфирами
Обычно алкилируют ароматические амины по SN1- и
SN2 механизму избытком спирта:
В жидкой фазе – используют минеральные кислоты,
давление выше 3 МПа, 180—220 °С, время до 10 часов. Кислота (лучше HBr, но H2SO4 и HCl дешевле) протонирует спирт и образует хорошо уходящую группу.
В паровой фазе - 300—400 °С в присутствии Al2O3.
N-Алкилирование простыми эфирами осуществляют в газовой фазе пропуская смесь паров амина и эфира при 250—350 °С через слой Al2O3. Практический интерес представляет реакция анилина с метиловым эфиром, который является побочным продуктом в производстве метилового спирта:
Слайд 23Синтез аминов по Эшвайлеру-Кларку
Достоинства: выход до 100 %, можно метилировать
многие амины при температурах около 100 °С.
Недостатки: длительный (до 10—15
ч), «дорогой», агрессивная среда и токсичные вещества, ограничения для ароматических аминов.
Используется тогда, когда другие способы не дают хороших результатов.
Слайд 24О-Алкилирование (арилирование)
Алкил(арил)галогениды широко применяются для О-алкилирования (арилирования). При этом используется
реакция Вильямсона или реакция гидроксисоединений с галогенидами в присутствии щелочей
(SN2, SNAr):
Непредельные соединения для О-алкилирования используются реже и, обычно, наиболее активные (AN)
Эти реакции используют для синтеза карбоксиметил, карбамоилэтил и др. производных полисахаридов:
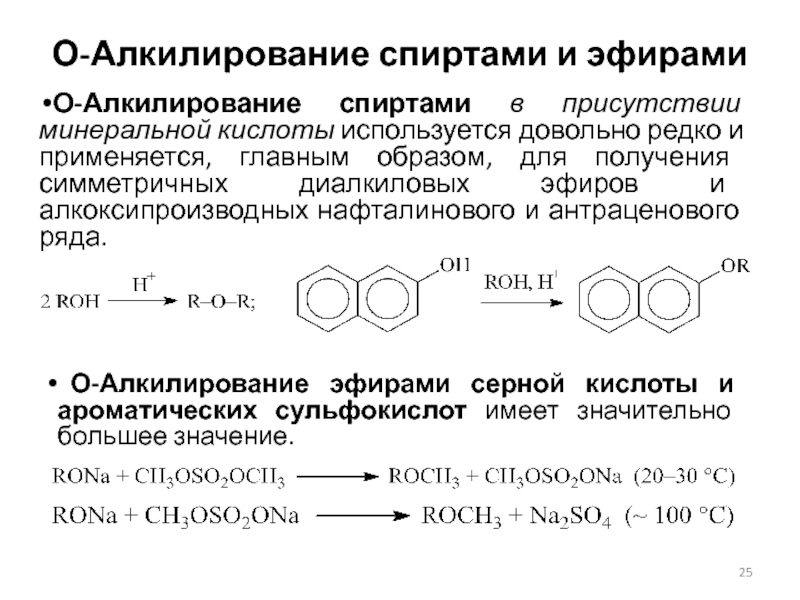
Слайд 25О-Алкилирование спиртами и эфирами
О-Алкилирование спиртами в присутствии минеральной кислоты используется
довольно редко и применяется, главным образом, для получения симметричных диалкиловых
эфиров и алкоксипроизводных нафталинового и антраценового ряда.
О-Алкилирование эфирами серной кислоты и ароматических сульфокислот имеет значительно большее значение.
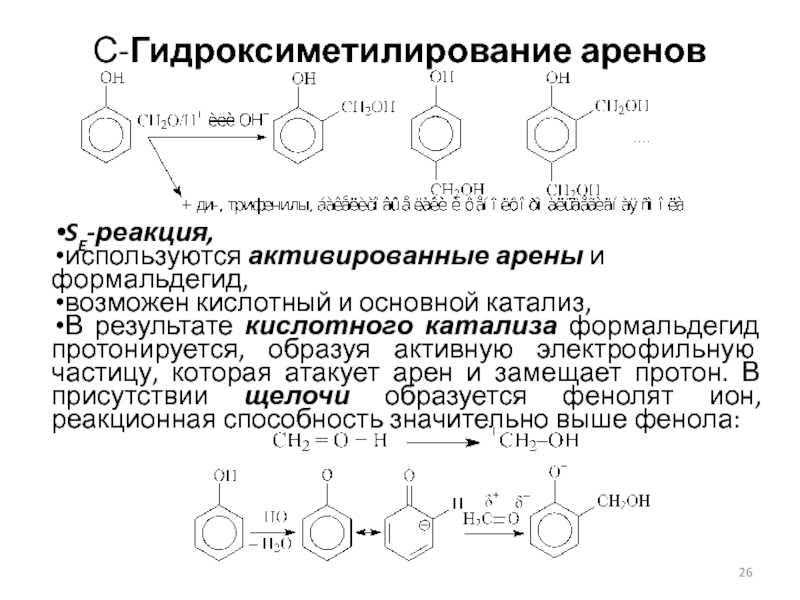
Слайд 26С-Гидроксиметилирование аренов
SE-реакция,
используются активированные арены и формальдегид,
возможен кислотный и основной
катализ,
В результате кислотного катализа формальдегид протонируется, образуя активную электрофильную
частицу, которая атакует арен и замещает протон. В присутствии щелочи образуется фенолят ион, реакционная способность значительно выше фенола:
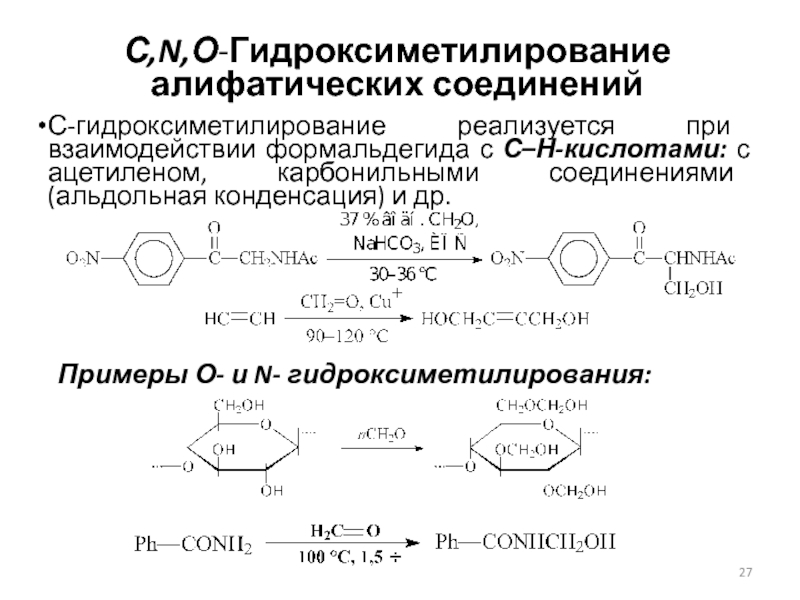
Слайд 27С,N,О-Гидроксиметилирование алифатических соединений
С-гидроксиметилирование реализуется при взаимодействии формальдегида с С–Н-кислотами: с
ацетиленом, карбонильными соединениями (альдольная конденсация) и др.
Примеры О- и N-
гидроксиметилирования:
Слайд 28Реакция галогенметилирования
Для получения бензилгалогенидов из аренов.
Реагенты: формальдегид, галогеноводород и
катализатор.
При пропускании хлористого водорода через смесь арена и формалина
в присутствии хлорида цинка при температурах не более 50—60 °С образуются производные хлористого бензила (последовательно реализуются электрофильное и нуклеофильное замещение).
Получение хлористого бензила этим методом безопаснее и экологичнее хлорирования толуола. В готовом продукте отсутствуют примеси веществ, содержащих атом хлора в ароматическом ядре.
Слайд 29С-, N-, O-Аминометилирование алифатических и ароматических соединений (реакция Манниха)
Однородный продукт
образуется лишь при использовании формальдегида и вторичных аминов.
С-Аминоалкилирование аренов идет
лишь с активированными соединениям, например, с фенолом.
С-Аминоалкилирование алифатических соединений идет при наличии С–Н-кислотности субстрата (кетонов, производных ацетилена).
О-, N-Аминоалкилирование проходит при использовании в реакции Манниха спиртов и аминов