Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Радиобиология 6
Содержание
- 1. Радиобиология 6
- 2. © В.С. МартинюкРАДІОБІОЛОГІЯ● Клітинна радіобіологія. ● Теорія
- 3. © В.С. МартинюкРАДІОБІОЛОГІЯ● Теорія мішеней в клітинній радіобіології.
- 4. © В.С. МартинюкРАДІОБІОЛОГІЯ● Клітинна радіобіологіяКлітини організму навіть
- 5. © В.С. МартинюкРАДІОБІОЛОГІЯЧутливими є також функціонально активні
- 6. © В.С. МартинюкРАДІОБІОЛОГІЯ● Клітинна радіобіологіяЧутливими є також
- 7. © В.С. МартинюкРАДІОБІОЛОГІЯНегайних морфологічних змін у клітинах
- 8. © В.С. МартинюкРАДІОБІОЛОГІЯВ ядрі відбувається:● збільшення розмірів
- 9. © В.С. МартинюкРАДІОБІОЛОГІЯІснує група променевих ушкоджень клітини,
- 10. © В.С. МартинюкРАДІОБІОЛОГІЯЧас затримки мітозів строго залежить
- 11. © В.С. МартинюкРАДІОБІОЛОГІЯ
- 12. © В.С. МартинюкРАДІОБІОЛОГІЯ● Зворотні, незворотні і летальні
- 13. © В.С. МартинюкРАДІОБІОЛОГІЯ● Летальні реакції клітин. Головною
- 14. © В.С. МартинюкРАДІОБІОЛОГІЯ● Клітинна радіочутливість і радіорезистентність.
- 15. © В.С. МартинюкРАДІОБІОЛОГІЯ● Клітинна радіочутливість і радіорезистентність.
- 16. © В.С. МартинюкРАДІОБІОЛОГІЯ● Основні клітинні механізми радіаційної
- 17. © В.С. МартинюкРАДІОБІОЛОГІЯ● Основні клітинні механізми радіаційної
- 18. © В.С. МартинюкРАДІОБІОЛОГІЯМакроаутофагія - перетравлення ділянки цитоплазми
- 19. © В.С. МартинюкРАДІОБІОЛОГІЯ● Основні клітинні механізми радіаційної
- 20. © В.С. МартинюкРАДІОБІОЛОГІЯАпоптоз - це сукупність клітинних процесів, що призводять до загибелі клітини.
- 21. РАДІОБІОЛОГІЯ
- 22. РАДІОБІОЛОГІЯ
- 23. РАДІОБІОЛОГІЯ
- 24. РАДІОБІОЛОГІЯ
- 25. РАДІОБІОЛОГІЯ
- 26. РАДІОБІОЛОГІЯ
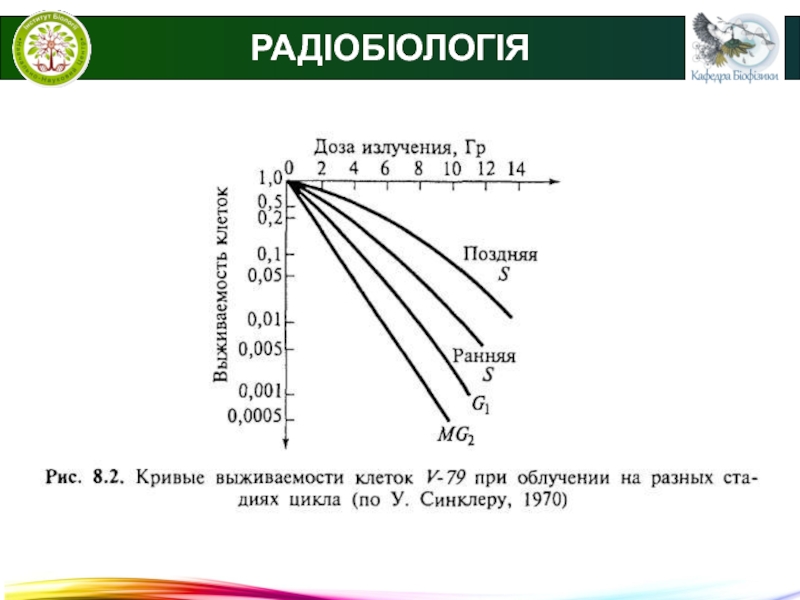
- 27. © В.С. МартинюкРАДІОБІОЛОГІЯ● Моделі виживання клітин. Графічне
- 28. © В.С. МартинюкРАДІОБІОЛОГІЯ● Моделі виживання клітин. Крива
- 29. © В.С. МартинюкРАДІОБІОЛОГІЯ● Моделі виживання клітин. Крива
- 30. © В.С. МартинюкРАДІОБІОЛОГІЯ● Віддалені ефекти радіаційного ушкодження клітин.
- 31. © В.С. МартинюкРАДІОБІОЛОГІЯ● Віддалені ефекти і генетична
- 32. © В.С. МартинюкРАДІОБІОЛОГІЯ● Генетичні і епігенетичнні ефекти
- 33. © В.С. МартинюкРАДІОБІОЛОГІЯ● Генетичні і епігенетичнні ефекти
- 34. © В.С. МартинюкРАДІОБІОЛОГІЯ● Генетичні і епігенетичнні ефекти радіації.
- 35. © В.С. МартинюкРАДІОБІОЛОГІЯ● Генетичні і епігенетичнні ефекти радіації.
- 36. РАДІОБІОЛОГІЯ● Генетичні і епігенетичнні ефекти радіації.
- 37. РАДІОБІОЛОГІЯ● Генетичні і епігенетичнні ефекти радіації. Епігенетика
- 38. © В.С. МартинюкРАДІОБІОЛОГІЯ● Генетичні і епігенетичнні ефекти
- 39. © В.С. МартинюкРАДІОБІОЛОГІЯ● Генетичні і епігенетичнні ефекти
- 40. © В.С. МартинюкРАДІОБІОЛОГІЯ● Радіаційний канцерогенезРадіаційний канцерогенез (онкогенез
- 41. © В.С. МартинюкРАДІОБІОЛОГІЯ● Радіаційний канцерогенезНа цей час
- 42. РАДІОБІОЛОГІЯ● Радіаційний канцерогенезСтадія ініціації. Матеріальним субстратом пухлинної
- 43. © В.С. МартинюкРАДІОБІОЛОГІЯ● Радіаційний канцерогенезСтадія промоції. Для
- 44. © В.С. МартинюкРАДІОБІОЛОГІЯ● Радіаційний канцерогенезСтадія стовбурової лінії.
- 45. © В.С. МартинюкРАДІОБІОЛОГІЯ● Радіаційний канцерогенезСтадія пухлинної прогресії.
- 46. РАДІОБІОЛОГІЯ● Радіаційний канцерогенез
- 47. РАДІОБІОЛОГІЯ● Методи досліджень радіаційних ушкоджень біомолекулЕлектрофорез ДНККометний
- 48. Дякую за увагу
- 49. Скачать презентанцию
© В.С. МартинюкРАДІОБІОЛОГІЯ● Клітинна радіобіологія. ● Теорія мішеней в клітинній радіобіології. ● Зворотні, незворотні і летальні реакції клітин. ● Клітинна радіочутливість і радіорезистентність. ● Основні клітинні механізми радіаційної загибелі клітин (некроз,
Слайды и текст этой презентации
Слайд 1д.б.н., професор кафедри біофізики
Мартинюк Віктор Семенович
Київ
2014
© В.С. Мартинюк
mavis
ННЦ «ІНСТИТУТ БІОЛОГІЇ»
Слайд 2© В.С. Мартинюк
РАДІОБІОЛОГІЯ
● Клітинна радіобіологія.
● Теорія мішеней в клітинній
радіобіології.
● Зворотні, незворотні і летальні реакції клітин.
● Клітинна
радіочутливість і радіорезистентність. ● Основні клітинні механізми радіаційної загибелі клітин (некроз, апоптоз, аутофагія).
● Проліферативна та інтерфазна загибель клітин.
● Моделі виживання клітин.
● Ефекти клітинного циклу.
● Відносна біологічна ефективність дії іонізуючого випромінювання.
● Генетичні і епігенетичнні ефекти радіації.
Слайд 4© В.С. Мартинюк
РАДІОБІОЛОГІЯ
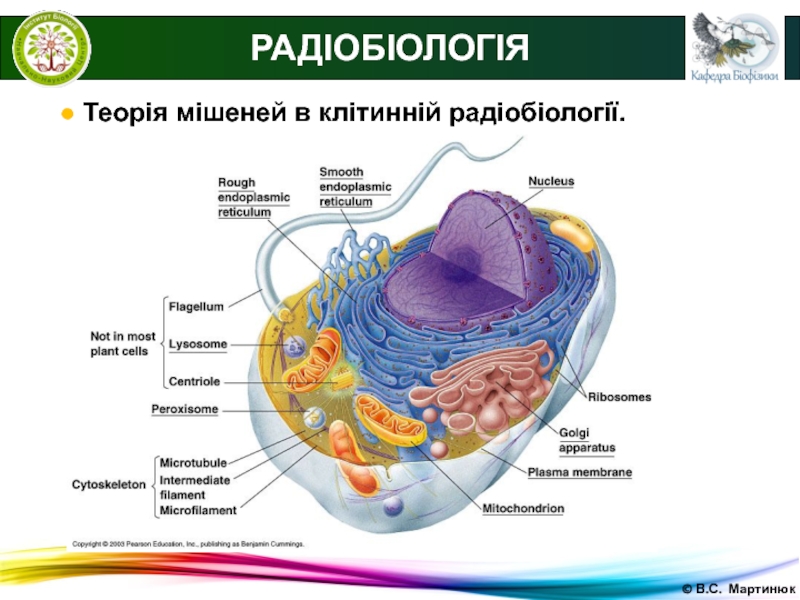
● Клітинна радіобіологія
Клітини організму навіть в межах однієї
тканини мають різну радіочутливість, яка залежить від стадії їх розвитку,
віку, функціонального стану.Компоненти самої клітини також мають різну радіочутливість.
Найбільша чутливість властива ядру.
Чутливими є також функціонально активні органели, що мають мембрану, в першу чергу мітохондрії.
Слайд 5© В.С. Мартинюк
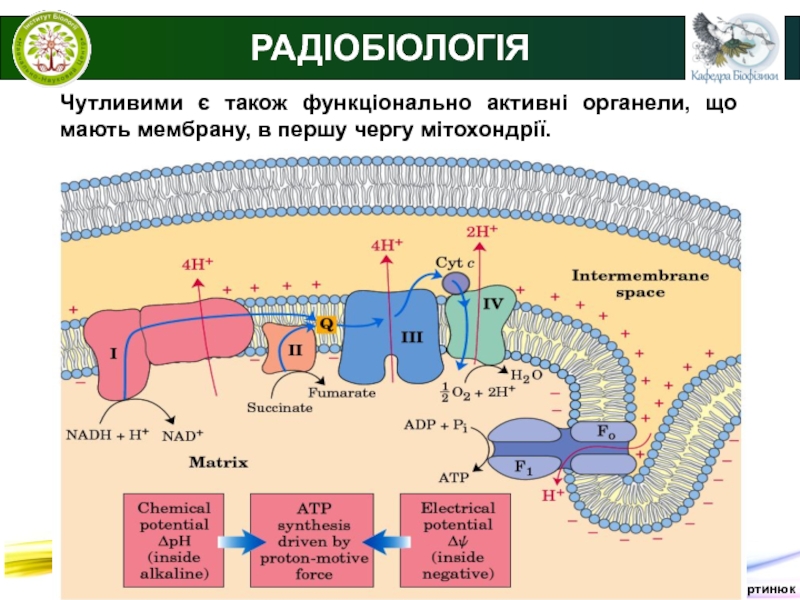
РАДІОБІОЛОГІЯ
Чутливими є також функціонально активні органели, що мають
мембрану, в першу чергу мітохондрії.
Слайд 6© В.С. Мартинюк
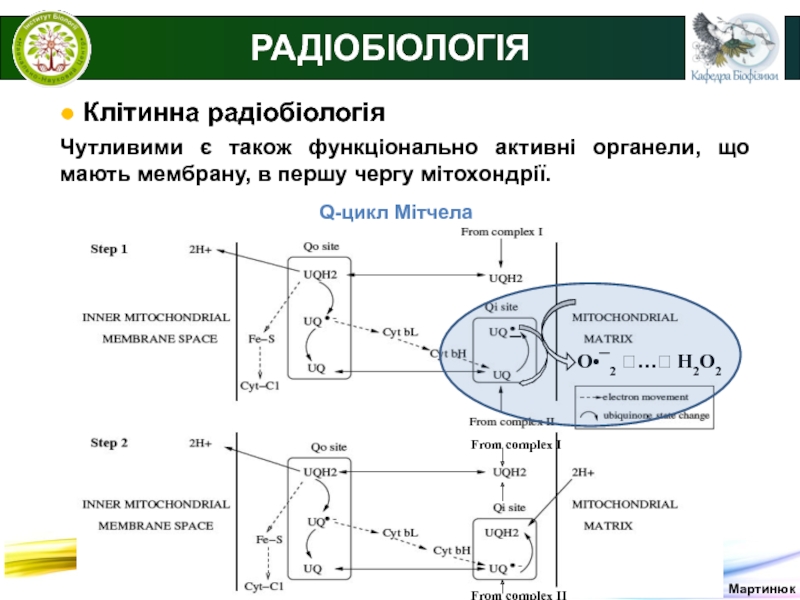
РАДІОБІОЛОГІЯ
● Клітинна радіобіологія
Чутливими є також функціонально активні органели,
що мають мембрану, в першу чергу мітохондрії.
О2
Q-цикл
Мітчела
Слайд 7© В.С. Мартинюк
РАДІОБІОЛОГІЯ
Негайних морфологічних змін у клітинах при опроміненні в
невеликих дозах не виявляється. При великих дозах залежно від їх
величини морфологічні з'являються на 2-3 добу.У цитоплазмі після опромінення відбувається :
● зміна в'язкості - при малих дозах вона знижується , при великих -
підвищується;
● вакуолизация цитоплазми (чітко проглядається у клітин крові,
червоного кісткового мозку, паренхіматозних органів);
● підвищення проникності мембран для електролітів і води - з клітини виходить калій, а в ній накопичується натрій (в еритроцитах це призводить до гемолизу);
● підвищення коефіцієнта заломлення, що пов'язано з денатурацією білків плазми і зміною стану води.
Водночас спостерігатися й інші прижиттєві зміни цитоплазми: різні ступені прижиттєвого фарбування, зміни сприйняття кислих і основних барвників, тощо.
Рухливі клітини після опромінення зазвичай приймають округлу форму.
Слайд 8© В.С. Мартинюк
РАДІОБІОЛОГІЯ
В ядрі відбувається:
● збільшення розмірів ядер;
● змінюється форма
ядра;
● з'являються гігантські ядра;
● сегментація ядер: з'являються трьох-, чотириядерні
і багатоядерні клітини;● некротичні явища - пікноз і рідше лізис ядра.
Слайд 9© В.С. Мартинюк
РАДІОБІОЛОГІЯ
Існує група променевих ушкоджень клітини, які не призводять
до загибелі. Ці клітинні реакції називають фізіологічними або кумулятивними ефектами
опромінення. Вони проявляються після опромінення і з часом зникають.Універсальним прикладом променевих реакцій клітин є радіаційне блокування мітозів - кількість клітин, які діляться в популяції після опромінення різко знижується.
На основі цього факту виникла ідея променевого пригнічення розвитку пухлин.
Слайд 10© В.С. Мартинюк
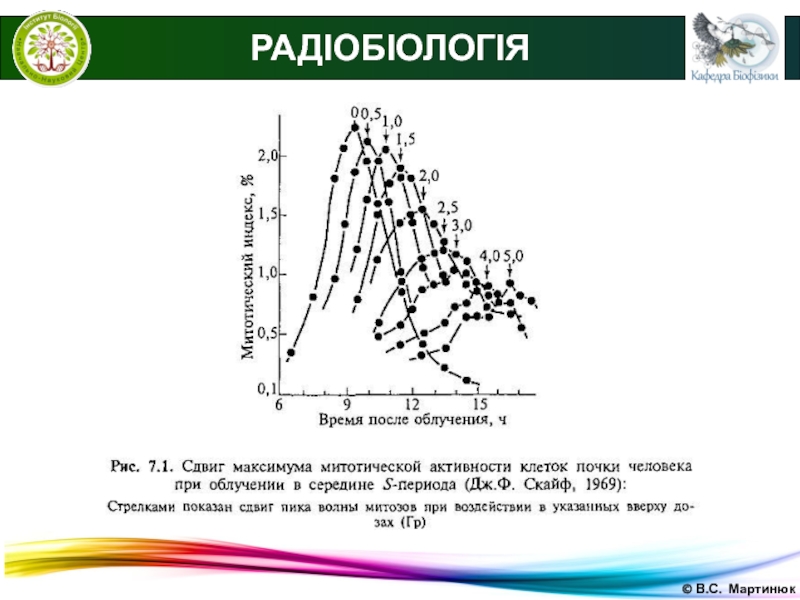
РАДІОБІОЛОГІЯ
Час затримки мітозів строго залежить від дози опромінення
і цей ефект проявляється у всіх клітин, незалежно, виживуть вони
після опромінення або загинуть.У дослідах несинхронізованих культурах клітин було знайдено, що затримка клітинного поділу становить приблизно 1 годину на 1 Гр, причому із збільшенням дози опромінення зростає не частка реагуючих клітин, а величина реакції (тривалість затримки поділу) кожної опроміненої клітини.
Найбільш суттєва затримка поділу при опроміненні клітин в синтетичної та постсинтетичній фазах клітинного циклу.
Радіаційне блокування мітозів є захисною реакцією клітин на опромінення.
Затримку мітозів слід відрізняти від повного пригнічення мітозів, коли клітина зберігає життєздатність, але повністю втрачає здатність до поділу.
Слайд 12© В.С. Мартинюк
РАДІОБІОЛОГІЯ
● Зворотні, незворотні і летальні реакції клітин.
Летальні реакції клітин.
У радіобіології під клітинною загибеллю розуміють втрату
клітиною здатності до проліферації. Клітини, які виживають після опромінення можуть мати здатність до необмеженого поділу.Типи (форми) радіаційної клітинної загибелі:
1 . Інтерфазна (інтеркінетична) загибель:
до поділу (під променем);
без поділу.
2 . Мітотична (репродуктивна) загибель:
після першого поділу;
в наступних поділах;
загибель клітин популяції, що діляться.
Чим вище доза опромінення, тим раніше гинуть клітини.
Однією з формклітинної загибелі є злиття двох клітин і утворення гігантської клітини. Такі клітини здатні до 2-3 поділів, після чого все одно гинуть.
Слайд 13© В.С. Мартинюк
РАДІОБІОЛОГІЯ
● Летальні реакції клітин.
Головною причиною репродуктивної загибелі
клітин є пошкодження ДНК.
Типи променевих ушкоджень ДНК:
одиночні і
подвійні розриви (саме вони відповідальні за летальний результат опромінення); ушкодження азотистих основ нуклеотидів з подальшим їх видаленням з ДНК;
внутрішньо-і міжмолекулярні зшивки типу ДНК-ДНК, ДНК-білок.
Слайд 14© В.С. Мартинюк
РАДІОБІОЛОГІЯ
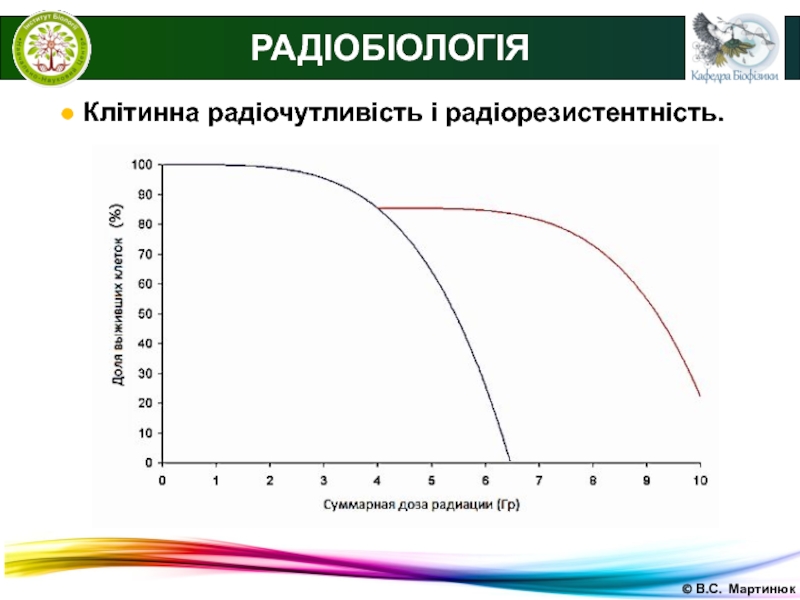
● Клітинна радіочутливість і радіорезистентність.
Радіочутливість -
сприйнятливість клітин, тканин, органів або організмів до впливу іонізуючого випромінювання
(для молекул використовують термін радіоураженості).Мірою радіочутливості служить доза випромінювання, що викликає певний рівень загибелі опромінюваних об'єктів: для інактивації клітин - показник D37 або D0 на кривій виживаності; для організмів - доза, що викликає загибель 50% особин за певний термін спостереження (LD50).
Радіорезистентність - поняття, протилежне радіочутливості, тобто це стійкість клітин, тканин, органів або організмів до впливу іонізуючого випромінювання.
Радіорезистентність є природною властивістю клітин, тканин або організму в цілому. Але її також можна викликати, піддаючи досліджуваний об'єкт невеликим дозам іонізуючого випромінювання. Такий вплив активує клітинні радіозахисні механізми, що захищає біологічний об'єкт від пошкодження при подальшому впливі іонізуючої радіації.
Слайд 16© В.С. Мартинюк
РАДІОБІОЛОГІЯ
● Основні клітинні механізми радіаційної загибелі клітин (некроз,
апоптоз, аутофагія).
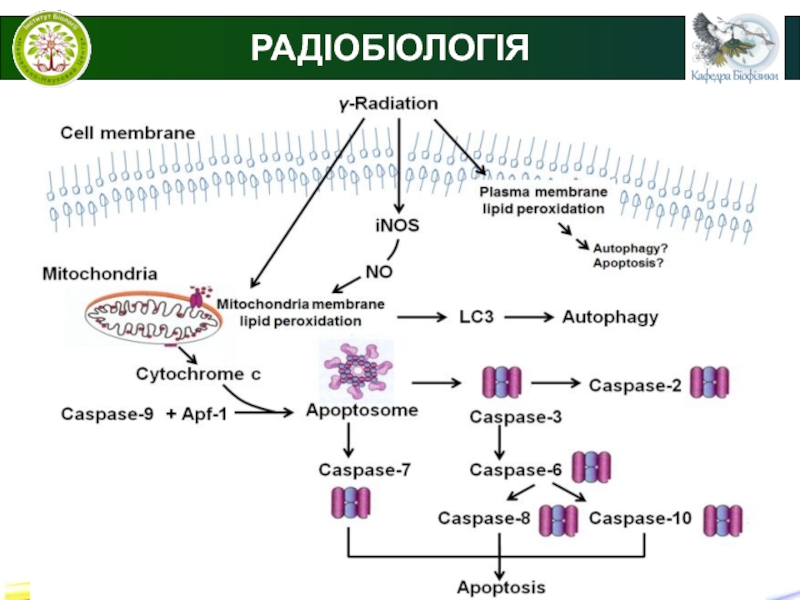
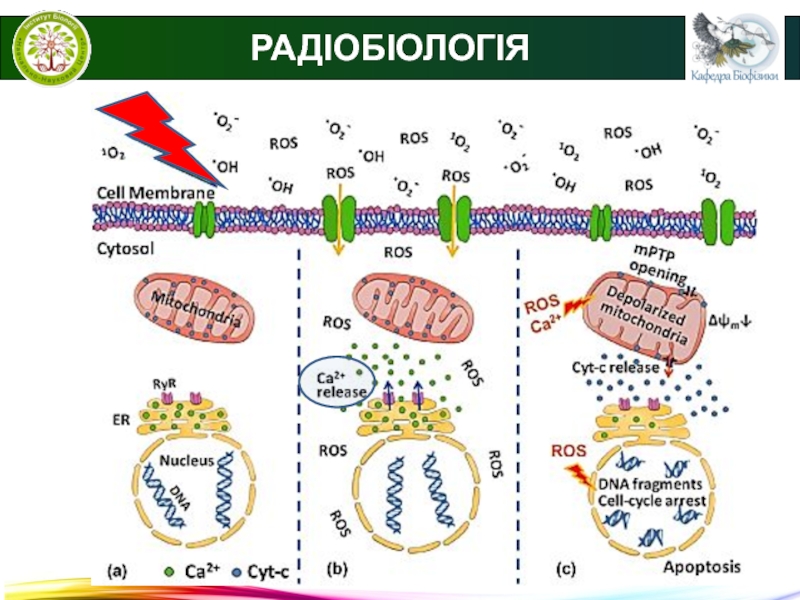
Некроз - це один з видів клітинної
загибелі при якому відбувається денатурація внутрішньоклітинних протеїнів та ферементативне перетравлення змертвілих клітин. При некрозі клітини втрачають здатність підтримувати цілісність мембрани, внаслідок чого копмоненти клітин виходять за її межі, що викликає запалення оточуючих некроз тканин.
Ферменти, що викликають перетравлення некротичних клітин надходять з їх лізосом, а також з лейкоцитів, що завжди супроводжуть запальну реакцію.
Слайд 17© В.С. Мартинюк
РАДІОБІОЛОГІЯ
● Основні клітинні механізми радіаційної загибелі клітин (некроз,
апоптоз, аутофагія).
Аутофагія
це процес перетравлення клітиною власних органел та ділянок цитоплаз ми за
допомогою лізосом з метою позбавлення від старих і пошкоджених частин. Розрізняють три типи аутофагії - мікроаутофагію, макроаутофагію і шаперон-залежну аутофагию .
Мікроаутофагія – перетрвлення макромолекул і уламок клітинних мембран лізосомами.
Шаперон-опосередкована аутофагія - перетрвлення макромолекул білків в лізосомах, яке відбувається за участю цитоплазматичних білків-шаперонов сімейства hsр – 70 і допоміжних білків і LAMP-2, що є мембранними рецепторами комплексу шаперона і білка, що підлягає транспорту в лізосому .
Слайд 18© В.С. Мартинюк
РАДІОБІОЛОГІЯ
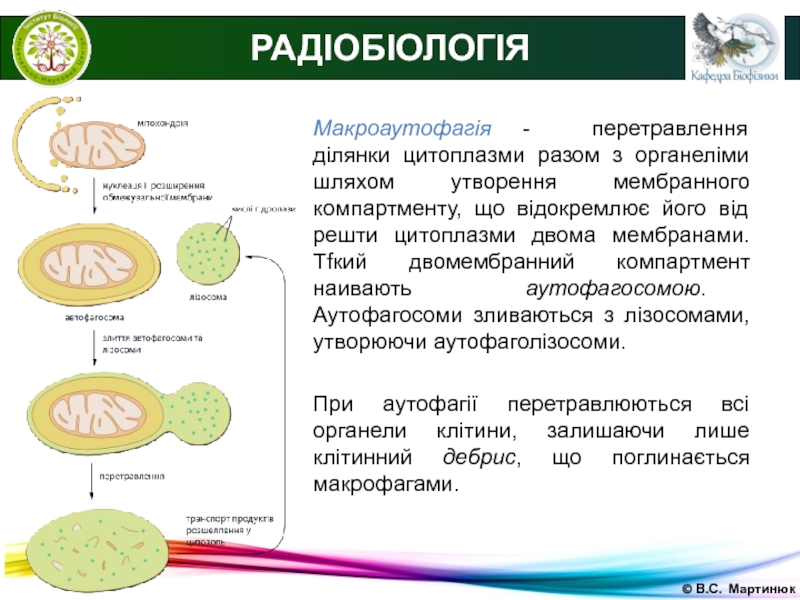
Макроаутофагія - перетравлення ділянки цитоплазми разом з органеліми
шляхом утворення мембранного компартменту, що відокремлює його від решти цитоплазми
двома мембранами. Тfкий двомембранний компартмент наивають аутофагосомою. Аутофагосоми зливаються з лізосомами, утворюючи аутофаголізосоми.При аутофагії перетравлюються всі органели клітини, залишаючи лише клітинний дебрис, що поглинається макрофагами.
Слайд 19© В.С. Мартинюк
РАДІОБІОЛОГІЯ
● Основні клітинні механізми радіаційної загибелі клітин (некроз,
апоптоз, аутофагія).
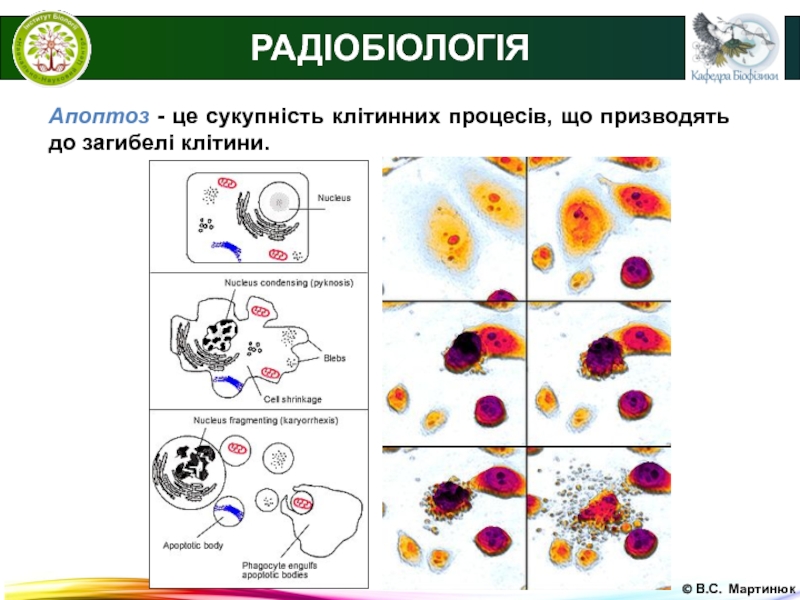
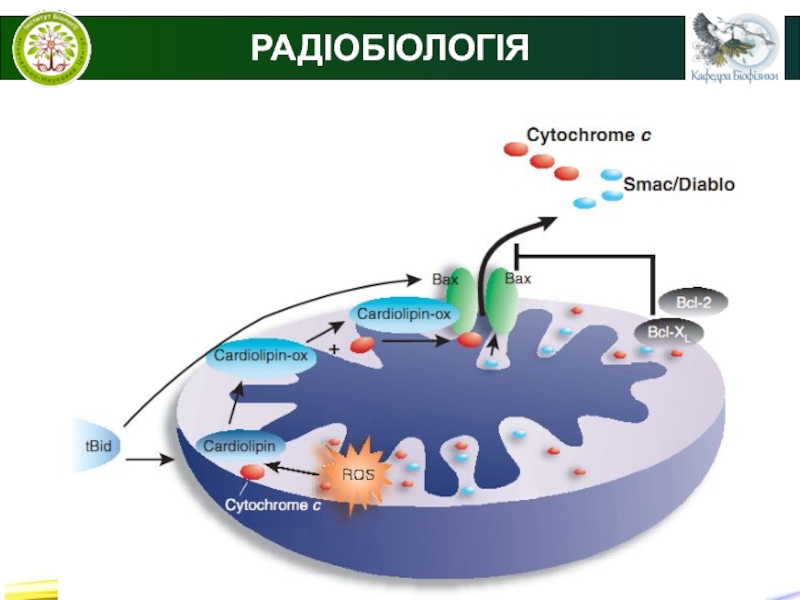
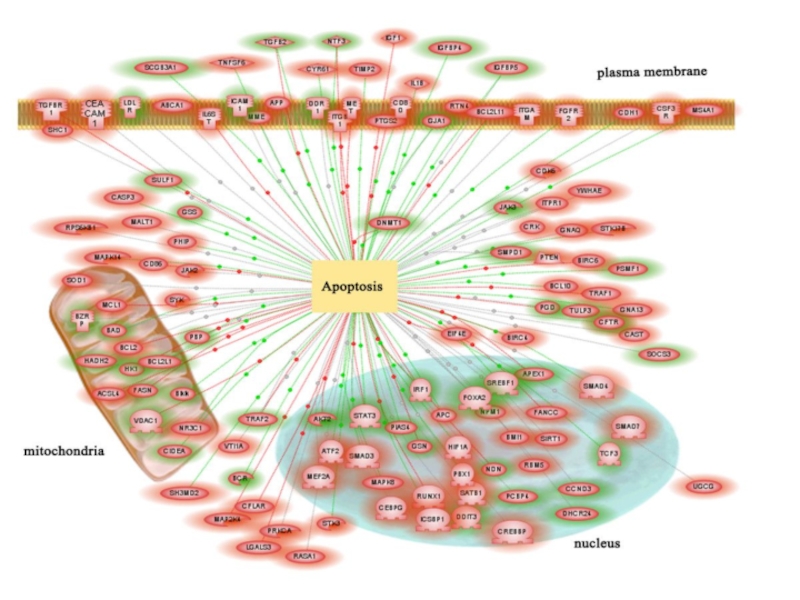
Апоптоз - найбільш розповсюджений тип запрограмованої клітинної
смерті. Апоптоз - це сукупність клітинних процесів, що призводять до загибелі клітини.
На відміну від некрозу при апоптозі не відбувається руйнування цитоплазматичної клітинної мембрани і, відповідно, вміст клітини не потрапляє в позаклітинне середовище.
Слайд 20© В.С. Мартинюк
РАДІОБІОЛОГІЯ
Апоптоз - це сукупність клітинних процесів, що призводять
до загибелі клітини.
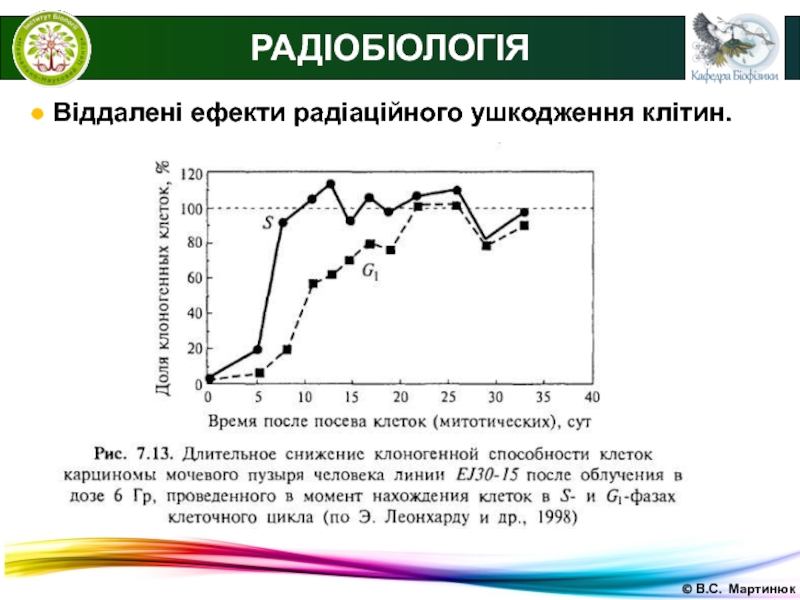
Слайд 27© В.С. Мартинюк
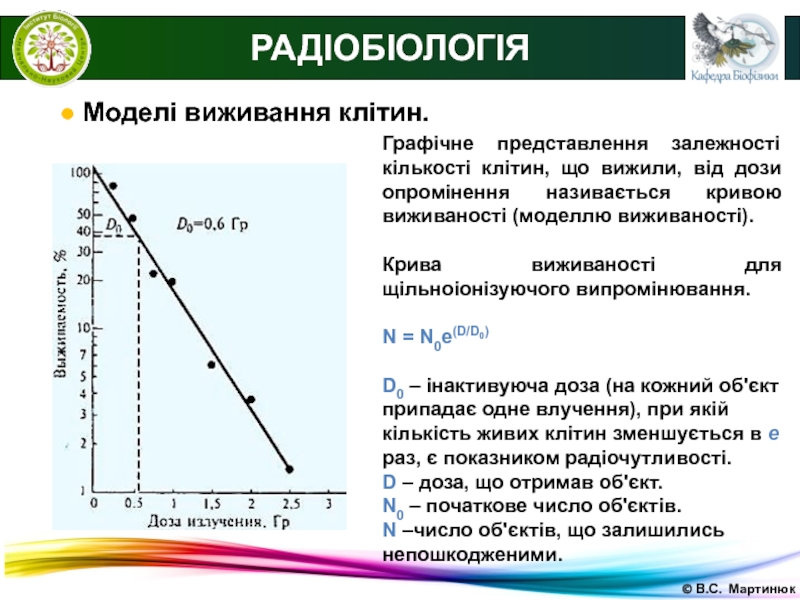
РАДІОБІОЛОГІЯ
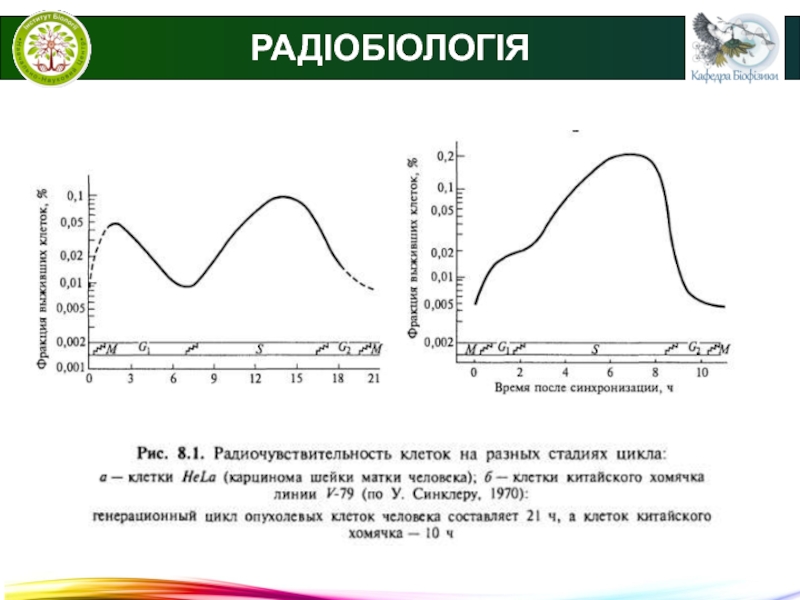
● Моделі виживання клітин.
Графічне представлення залежності кількості
клітин, що вижили, від дози опромінення називається кривою виживаності (моделлю
виживаності).Крива виживаності для щільноіонізуючого випромінювання.
N = N0e(D/D0)
D0 – інактивуюча доза (на кожний об'єкт припадає одне влучення), при якій кількість живих клітин зменшується в е раз, є показником радіочутливості.
D – доза, що отримав об'єкт.
N0 – початкове число об'єктів.
N –число об'єктів, що залишились непошкодженими.
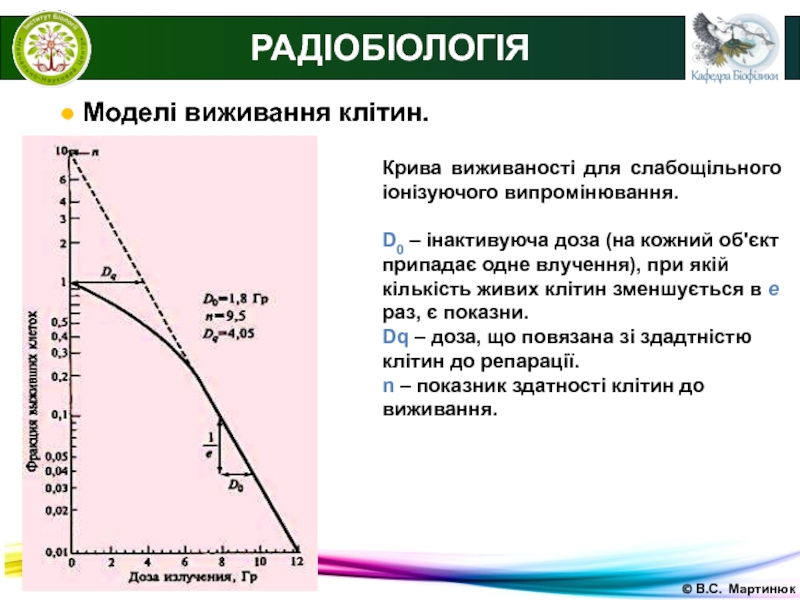
Слайд 28© В.С. Мартинюк
РАДІОБІОЛОГІЯ
● Моделі виживання клітин.
Крива виживаності для слабощільного
іонізуючого випромінювання.
D0 – інактивуюча доза (на кожний об'єкт припадає одне
влучення), при якій кількість живих клітин зменшується в е раз, є показни.Dq – доза, що повязана зі здадтністю клітин до репарації.
n – показник здатності клітин до виживання.
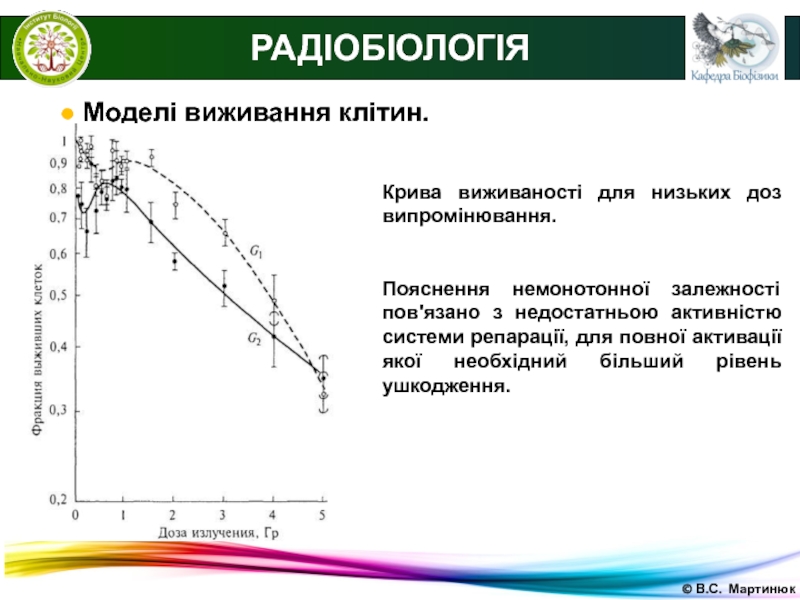
Слайд 29© В.С. Мартинюк
РАДІОБІОЛОГІЯ
● Моделі виживання клітин.
Крива виживаності для низьких
доз випромінювання.
Пояснення немонотонної залежності пов'язано з недостатньою активністю системи репарації,
для повної активації якої необхідний більший рівень ушкодження.Слайд 31© В.С. Мартинюк
РАДІОБІОЛОГІЯ
● Віддалені ефекти і генетична нестабільність
Генетична нестабільність
- зміна з високою частотою локалізації, структури або числа копій
генів (або їх частин) в геномі протягом онтогенезу особин.Генетична нестабільність має різні прояви:
дестабілізація хромосом;
обміни сестринських хроматид;
Анеуплоїдія;
мутації і ампліфікації генів;
клональная гетерогенність;
неопластична трансформація.
активність мобільних генетичних елементів;
Генетична нестабільність негативно позначається на життєдіяльності організмів, зокрема сприяє пухлиноутворенню і старінню.
Слайд 32© В.С. Мартинюк
РАДІОБІОЛОГІЯ
● Генетичні і епігенетичнні ефекти радіації.
Основні
постулати радіаційної генетики:
● всі види іонізуючих випромінювань, що діють на
гамети, підвищують частоту виникнення мутацій;● іонізуючі випромінювання викликають мутації у всіх вивчених живих організмів, тобто мутагенний ефект цього фізичного фактору є загальним в живій природі;
● іонізуючі випромінювання викликають мутації у всіх соматичних тканинах;
● іонізуючі випромінювання викликають всі відомі типи мутацій - генні , хромосомні і геномні;
● якісно спонтанний та індукований мутагенез не відрізняються один від одного, але є кількісні відмінності в спектрах спонтанних та індукованих мутацій, що проявляється у зрушеннях відносних частот різних мутацій і типів мутацій;
● частота мутацій, що виникають під впливом іонізуючих випромінювань, приблизно пропорційна дозі.
Слайд 33© В.С. Мартинюк
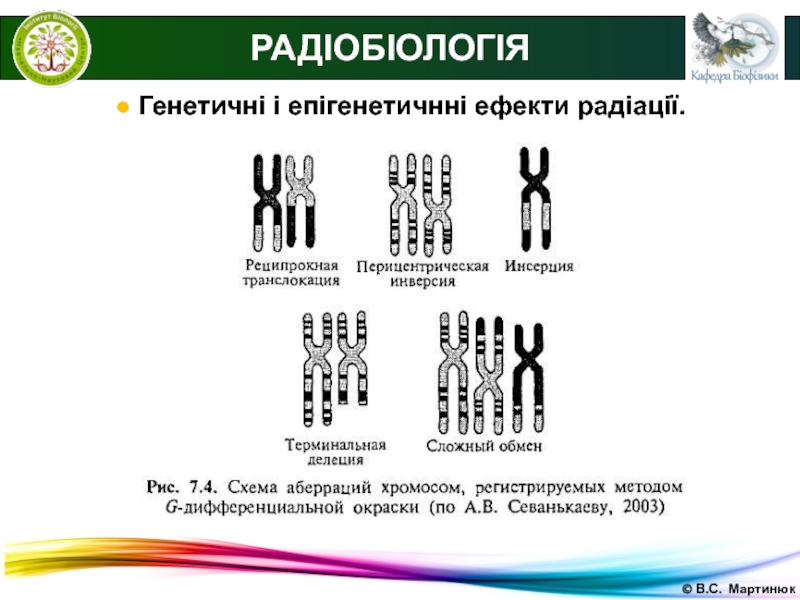
РАДІОБІОЛОГІЯ
● Генетичні і епігенетичнні ефекти радіації.
Хромосомні
аберації при радіаційному ушкодженні:
фрагментація хромосом;
Утворення хромосомних містків, дицентриків,
кільцевих хромосом;поява всередині - і міжхромосомних обмінів.
Частина аберацій (хромосомні місткі та інші) механічно перешкоджають поділу клітини.
Деякі аберації призводять до нерівномірного поділу хромосом і втрати генетичного матеріалу, що викликає загибель клітин через порушення метаболічних ланок, робота яких контролювалась втраченими частинами ДНК.
Слайд 37
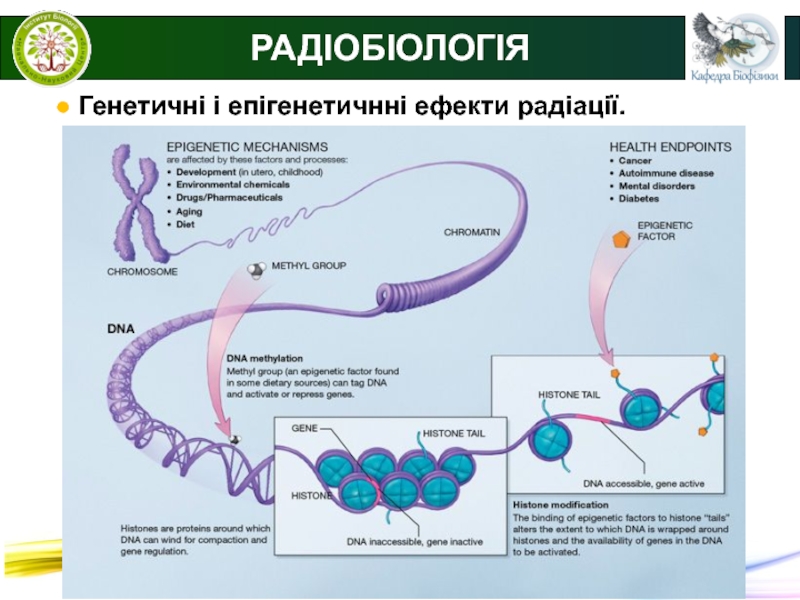
РАДІОБІОЛОГІЯ
● Генетичні і епігенетичнні ефекти радіації.
Епігенетика – наука
(розділ генетики), що вивчає спадкові зміни в фенотипі або в
експресії генів, що зумовлені іншими механізмами, ніж зміна послідовності нуклеотидів ДНК.Основні епігенетичні механізми:
метилювання ДНК;
ремоделювання хроматину (ацетилювання та деацетилювання гістонів);
регуляція на рівні РНК, зокрема РНК-інтерференція;
пріонізація білків;
інактивація X-хромосоми.
Слайд 38© В.С. Мартинюк
РАДІОБІОЛОГІЯ
● Генетичні і епігенетичнні ефекти радіації.
Іонізуюча
радіація може бути не тільки шкідливою, а й корисною.
Невеликі
дози впливають на механізм метилювання ДНК, завдяки чому активність генів стає такою, якою вона має бути при нормальної життєдіяльності клітини.Autumn J. Bernal, Dana C. Dolinoy, Dale Huang, David A. Skaar, Caren Weinhouse and Randy L. Jirtle Adaptive radiation-induced epigenetic alterations mitigated by antioxidants . The FASEB Journal article fj.12-220350. Published online November 1, 2012.
Слайд 39© В.С. Мартинюк
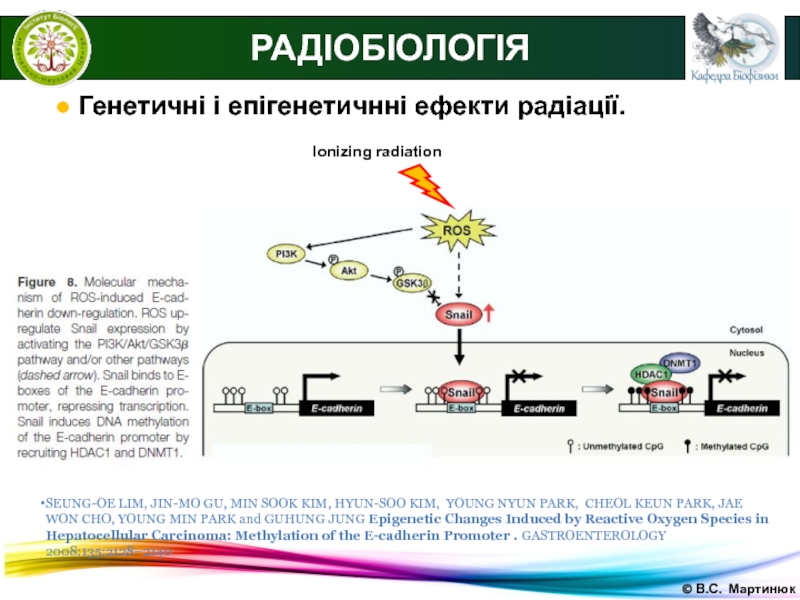
РАДІОБІОЛОГІЯ
● Генетичні і епігенетичнні ефекти радіації.
SEUNG-OE
LIM, JIN-MO GU, MIN SOOK KIM, HYUN-SOO KIM, YOUNG NYUN
PARK, CHEOL KEUN PARK, JAE WON CHO, YOUNG MIN PARK and GUHUNG JUNG Epigenetic Changes Induced by Reactive Oxygen Species in Hepatocellular Carcinoma: Methylation of the E-cadherin Promoter . GASTROENTEROLOGY 2008;135:2128–2140Ionizing radiation
Слайд 40© В.С. Мартинюк
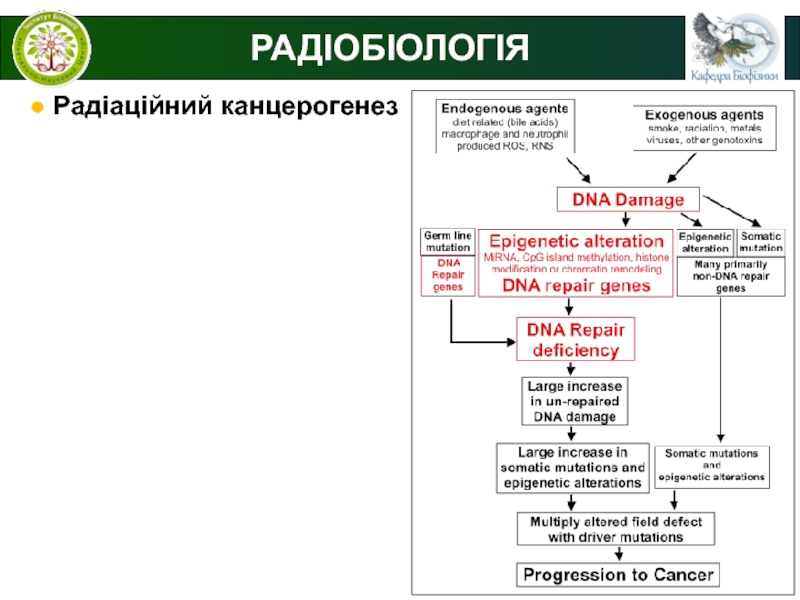
РАДІОБІОЛОГІЯ
● Радіаційний канцерогенез
Радіаційний канцерогенез (онкогенез або бластомогенез) -
це процес перетворення нормальних клітин і тканин організму в пухлинні
під впливом іонізуючої радіації.Радіаційному канцерогенезу передує ряд передпухлинних стадій, які завершуються пухлинним трансформуванням (переродженням).
Перший достовірно виявлений рак шкіри, індукований рентгенівським випромінюванням, був описаний німецьким рентгенологом X. Фрібеном в 1902 р. через 6 років після відкриття В. Рентгеном променів.
Пізніше з'явилися дані про виникнення злоякісних пухлин у медичних працівників - рентгенологів і радіологів (рак шкіри), шахтарів уранових рудників (рак легенів), робітниць, які наносили на циферблат годинника флюоресцентную фарбу, що містить радій.
Слайд 41© В.С. Мартинюк
РАДІОБІОЛОГІЯ
● Радіаційний канцерогенез
На цей час достовірно відомо, що
дія іонізуючого випромінювання не викликає специфічних форм раку.
Після опромінення збільшується
кількість тих видів ракових захворювань, які є типовими для даної популяції людей.Дія іонізуючого випромінювання збільшує частоту виникнення вже відомих видів ракових захворювань: найчастіше лейкозів, раку молочної залози, яєчників, шкіри і кісток.
Шкірні та кісткові пухлини виникають, як правило, при локальному опроміненні, інші види - в результаті тотального опромінення.
© В.С. Мартинюк
Слайд 42
РАДІОБІОЛОГІЯ
● Радіаційний канцерогенез
Стадія ініціації. Матеріальним субстратом пухлинної трансформації клітин є
різного типу радіаційні пошкодження генетичного апарату клітини (генні мутації, хромосомні
аберації, рекомбінації), що викликають перетворення протоонкогенов в онкогени або різко підвищують рівень їх експресії.Гіперекспрессія клітинних онкогенів, що викликає пухлинну трансформацію, може мати місце також і в разі стійкого деметилювання ДНК при відсутності яких би то не було ушкоджень самих онкогенів.
Наслідком цих змін є запуск внутрішньоклітинних сигнальних каскадів несанкціонованого пролиферативного сигналу, що викликає безконтрольне поділ клітин.
© В.С. Мартинюк
© В.С. Мартинюк
Слайд 43© В.С. Мартинюк
РАДІОБІОЛОГІЯ
● Радіаційний канцерогенез
Стадія промоції. Для пухлинної трансформації клітини
є необхідним повторний вплив на клітину або канцерогенного фактора (того
ж самого, що викликав ініціацію – іонізуюча радіація, або іншого), або фактора, який не є канцерогеном, але здатний викликати активацію змінених онкогенів. Такий фактор називають – промотором канцерогенезу.Як правило, промотори викликають проліферацію клітин за допомогою активації проліферативних сигнальних каскадів, частіше за участю протеїнкінази С.
© В.С. Мартинюк
© В.С. Мартинюк
Слайд 44© В.С. Мартинюк
РАДІОБІОЛОГІЯ
● Радіаційний канцерогенез
Стадія стовбурової лінії. Поява несанкціонованих сигналів
є необхідною, але не достатньою умовою утворення пухлини. Пухлинний ріст
стає можливим лише після ухилення трансформованих клітин від подальшого диференціювання, що зазвичай викликається несанкціонованої активністю генів деяких клітинних мікроРНК.МікроРНК перешкоджають функціонуванню білків, що відповідають за перебіг спеціалізації клітин. Дозрівання трансформованих клітин припиняється і вони в результаті безперервної проліферації і пригнічення апоптозу накопичуються, формуючи пухлину - клон клітин, що мають ряд особливостей, не властивих нормальним клітинам організму.
Для пухлинних клітин характерний високий рівень анеуплоїдії і поліплоїдії, що є результатом нестабільності геному.
Клітини пухлини з найбільш поширеним набором хромосом утворюють стовбурову лінію.
Слайд 45© В.С. Мартинюк
РАДІОБІОЛОГІЯ
● Радіаційний канцерогенез
Стадія пухлинної прогресії. У ході розвитку
пухлини, в силу її генетичної нестабільності, відбувається часта зміна її
клітинного складу і зміна стовбурової лінії. Така стратегія зростання має адаптатівний характер, так як виживають тільки найбільш пристосовані клітини.Пухлинні клітини не здатні реагувати на стимули мікрооточення, що призводить до порушення морфологічних характеристик тканин. Формується пухлинний клон (стовбурова лінія), який синтезує власні цитокіни і йде по шляху нарощування темпів поділу, ухилення від імунного контролю організму і забезпечення інтенсивного кровопостачання.
Біологічний сенс пухлинної прогресії полягає в остаточному подоланні перешкод на шляху пухлинної експансії. Пухлинна прогресія відбувається швидко і залежить від появи нової стовбурової лінії пухлинних клітин. Проростаючи в кровоносні і лімфатичні судини пухлинні клітини розносяться по всьому організму, вони осідають в капілярах різних органів і формують вторинні (метастатичні) вогнища пухлинного росту .
Слайд 47
РАДІОБІОЛОГІЯ
● Методи досліджень радіаційних ушкоджень біомолекул
Електрофорез ДНК
Кометний електрофорез
Показники структурної цілісності
білків (будь-які фізико-хімічні, біофізичні методи оцінки структурно-функціональних властивостей білків).
Показники
перекисного окиснення білків.Показники перекисного пошкодження ліпідів (дієнові коньюгаи, гідроперекиси, альдегідні і кетопохідні, Шифови основи та ін.)
Стан антиоксидантної системи (концентрація антиоксидантів, активність ферментів антиоксидантної і прооксидантної системи).