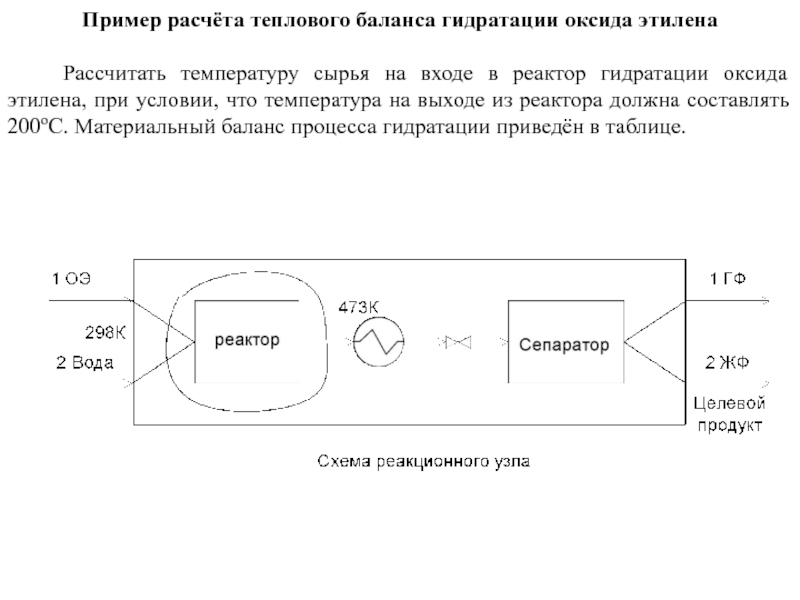
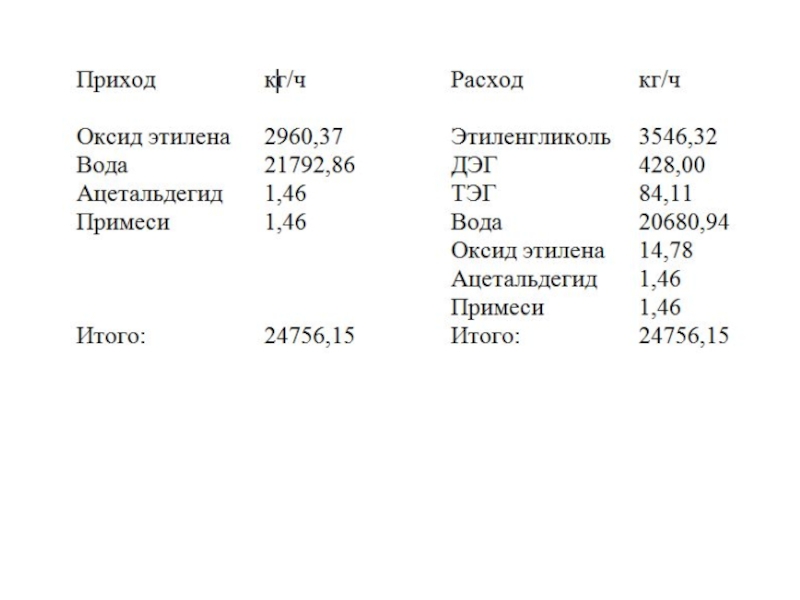
тепловую нагрузку на каждый аппарат технологической схемы.
Если процесс адиабатический –
рассчитывают температуру на выходе.При Р = const тепловая нагрузка Q равна разности энтальпий системы в конечном и исходном состояниях:
Q = Нкон - Нисх