Слайд 1Растворы.
Растворами называются гомогенные системы, состоящие из двух или более веществ,
состав которых может меняться в довольно широких пределах, допустимых растворимостью.
Раствор состоит из нескольких компонентов: растворителя (А) и растворенного вещества одного или нескольких (В).
Компонент – это однородная по химическим свойствам часть термодинамической системы, которая может быть выделена из нее и существовать в свободном виде сколь угодно долго.
Растворитель – это компонент, концентрация которого выше концентрации других компонентов в растворе. Он сохраняет свое фазовое состояние при образовании растворов.
Слайд 2Способы содержания вещества в растворе
Массовая доля растворенного вещества (процентная концентрация
()) показывает число г растворенного вещества (mв) в 100 г
раствора (mр), выражается в %, долях 1:
Мольная доля (молярная) – это отношение числа молей вещества к сумме чисел молей в растворе:
NА+ NВ = 1.
Слайд 3Молярная концентрация (С) показывает число моль растворенного вещества (n) в
1 дм³ раствора (V):
Выражается в моль/дм³, обозначается ,
0.1 М
С(Н2SO4) = 0,1 моль/дм³.
Слайд 4Молярная концентрация эквивалента (нормальная, нормальность, эквивалентная) – это число молей-эквивалентов
растворенного вещества в 1 дм³ раствора (V):
Выражается в моль/дм³. Обозначается
н,
С(1/2Н2SO4) = 0,1 моль/дм³ децинормальный раствор;
С(1/5 KМnO4) = 0,01 моль/дм³(сантинормальный).
Слайд 5Моляльность (Сm) показывает число моль (n) растворенного вещества в 1
кг (1000 г) растворителя (mр-ля):
Выражается в моль/кг растворителя, например Сm(NaCl) = 0,05 моль/кг.
Слайд 6Титр по растворённому веществу или просто титр — масса растворённого вещества
(в граммах), содержащаяся в одном миллилитре (см³) раствора.
где
Т— титр
раствора (в г/мл)
m — масса растворённого вещества (в г)
V — объём раствора (в мл, см³)
Слайд 7Взаимосвязь концентраций
Молярная концентрация эквивалента и Титр.
С (1/zА) М(1/zА) = Т
1000
Молярная концентрация эквивалента и массовая доля.
С (1/zА)=w ρ / М(1/zА)
100%
Слайд 8Правило смешения (КРЕСТА)
Правило креста (диагональная модель «конверта Пирсона») – диагональная схема
правила смешения:
При расчетах слева на концах отрезков записывают массовые
доли растворенного вещества в исходных растворах (ω1, ω2), на пересечении отрезков – массовую долю растворенного вещества в растворе, который нужно приготовить, справа (на концах отрезков) – разность: вычитают по диагонали из большего меньшее значение.
Получаемые значения (массовые части) показывают, в каком соотношении надо слить исходные растворы.
Слайд 9Приготовление растворов из кристаллогидратов
m кр m бс
Mкр
M бс
Слайд 10В практической работе важно уметь быстро переходить от одних единиц
концентрации к другим, поэтому важно помнить, что
mр-ра = Vр-ра
ρ, (7.7)
где mр-ра – масса раствора, г; Vр-ра – объем раствора, см3; ρ – плотность раствора, г/ см3.
Слайд 11Современная теория растворения
Процесс растворения является сложным физико-химическим процессом, в котором
наиболее ярко проявляется взаимодействие между частицами (молекулами или ионами) различной
химической природы.
Современная теория растворения основана на физической теории Вант-Гоффа и С. Аррениуса и химической теории Д. И. Менделеева. Согласно этой теории процесс растворения состоит из трех стадий:
1) механическое разрушение связей между частицами растворенного вещества, например, разрушение кристаллической решетки соли (это физическое явление);
2) образование сольватов (гидратов), т. е. нестойких соединений частиц растворенного вещества с молекулами растворителя (это химическое явление);
3) самопроизвольный процесс диффузии сольватированных (гидратированных) ионов по всему объему растворителя (это физический процесс). В растворе всякая заряженная частица (ион или полярная молекула) окружается сольватной оболочкой, которая состоит из ориентированных соответствующим образом молекул растворителя. Если растворителем является вода, то употребляется термин гидратная оболочка, а само явление носит название гидратация.

Слайд 12Коллигативные свойства растворов
В конце XIX века Рауль, Вант-Гофф, Аррениус установили
весьма важные закономерности, связывающие концентрацию раствора с давлением насыщенного пара
растворителя над раствором, температурой кипения и замерзания, осмотическим давлением.
Перечисленные свойства относят к общим свойствам раствора, которые зависят от концентрации и не зависят от природы растворенного вещества. Законы Рауля и Вант-Гоффа справедливы для сильно разбавленных растворов неэлектролитов (мольная доля растворенного вещества Nв << 0,005 или молярная концентрация C < 0,5 моль/дм3).
Растворы, которые подчиняются этим законом, получили название идеальных растворов.
Слайд 13Первый закон Рауля (1887):
относительное понижение давления насыщенного пара растворителя над
раствором нелетучего неэлектролита равно мольной доле растворенного вещества в растворе:
где РАо – давление насыщенного пара над чистым растворителем, Па;
РА – давление насыщенного пара над раствором, Па;
nВ – число молей растворенного вещества;
nА – число молей растворителя.
Слайд 14Второй закон Рауля
Абсолютное понижение температуры замерзания или абсолютное повышение температуры
кипения разбавленных растворов неэлектролитов прямо пропорционально его моляльной концентрации.
Тз
= EкСm и Тк = EэСm, (7.9)
где Тз – абсолютное понижение температуры замерзания раствора, К; Eк – криоскопическая постоянная, кгК/моль; Сm – моляльная концентрация раствора, моль/кг; Тк – абсолютное повышение температуры кипения раствора, К; Eэ – эбулиоскопическая постоянная, кгК/моль.
Тз = Тзр-ля – Т з р-ра; Тк = Тkр-ра–Тkр-ля,(7.10)
где tз р-ля – температура замерзания растворителя, К;
tз р-ра – температура замерзания раствора, К;
tk р-ра – температура кипения раствора, К;
tk р-ля – температура кипения растворителя, К.
Слайд 15Криоскопическая постоянная показывает абсолютное понижение температуры замерзания раствора неэлектролита, который
в одном кг растворителя содержит один моль растворенного вещества. Для
воды Ек = 1,86 кгК/моль, следовательно, раствор 1 моля неэлектролита в 1 кг воды замерзает при температуре -1,86 оС.
Эбулиоскопическая постоянная показывает абсолютное повышение температуры кипения раствора неэлектролита, который в одном кг растворителя содержит 1 моль растворенного вещества.
Для воды Eэ = 0,52 кгК/моль, следовательно, раствор 1 моля неэлектролита в 1 кг воды кипит при 100,52 оС. Уравнения (7.9) и (7.10) используют для определения молярной массы вещества.
Слайд 16Закон Вант-Гоффа
Осмотическое давление растворенного вещества в разбавленном растворе равно тому
газовому давлению, которое производило бы это вещество, если бы оно
в виде газа при той же температуре, занимало бы тот же объем, что и раствор.
Для осмотического давления можно применить уравнение состояние идеального газа
V = nRT или = nRT/V.
Откуда
= CRT,
где – осмотическое давление, Па;
С – молярная концентрация раствора,моль/дм3.
Слайд 17Осмотическое давление – это давление, которое наблюдается в растворах и
вызывается ударами частиц растворенного вещества о стенки сосуда.
Его измеряют
с помощью приборов- осмометров. Простейший осмометр состоит из широкого сосуда с растворителем и осмотической ячейки с раствором, дно ячейки затянуто полупроницаемой мембраной. Мембраны способны пропускать частицы растворителя и задерживать частицы растворенного вещества.
В осмометре действуют две противоположно направленные силы: сила осмотического давления, которая способствует всасыванию растворителя внутрь осмометра, и гидростатическое давление столба жидкости в осмометре, которая препятствует, и в конечном счете, прекращает осмотическое всасывание растворителя. В момент равновесия осмотическое давление можно рассчитать по уравнению:
= h, (7.12)
где – плотность раствора; h – высота поднятия коллоидного раствора в осмометре.
Схема осмометра:
1- вода;
2 - целлофановый
мешочек-
полупроницаемый
Слайд 19Принципиальная схема осмометра: А - камера для раствора; Б -
камера
Слайд 20Осмометр 3250 представляет собой прибор для измерения осмотической концентрации. Аппарат
разработан фирмой Advanced Instruments на основе многолетнего опыта и новейших
научно-технических достижений.
Слайд 21Для растворов электролитов осмотическое давление, определенное на осмометре всегда больше,
чем рассчитанное по уравнению (7.11).
Это связано с тем, что
в электролитах молекул диссоциируют на ионы, то есть, увеличивается общее число частиц в растворе, а, следовательно, и осмотическое давление.
Поэтому Вант-Гофф ввел изотонический коэффициент (i), который показывает во сколько раз осмотическое давление, определенное опытным путем больше рассчитанного:
i = оn/выч. (7.13)
Вычисляют изотонический коэффициент по уравнению Аррениуса:
i = 1 + (k – 1), (7.14)
где k – число ионов, на которое диссоциирует электролит (например, для AlCl3 = Al+3 + 3Cl-, k = 4); – степень диссоциации электролита, которая показывает долю продиссоциированных молекул электролита.
= число частиц, подвергнутых диссоциации
общее число частиц в растворе
Слайд 22Изотонический коэффициент меняется в пределах от 1 до 5 и
относится только к растворенному веществу. Для разбавленных растворов электролитов уравнения
(7.8; 7.9 и 7.11) имеют вид:
tз = iEкСm и tк = iEэСm, (7.16)
= iCRT (7.17)
Слайд 23Законы Рауля и Вант-Гоффа соблюдаются лишь в разбавленных растворах. C
повышением концентрации растворенного вещества возрастают отклонения от законов идеальных растворов.
Эти отклонения обусловлены взаимодействиями между частицами растворенного вещества, растворенного вещества и растворителя.
Учет влияния на свойства растворов этих взаимодействий очень сложен. Поэтому для описания свойств реальных растворов сохраняются общие закономерности, идеальных растворов, но вместо концентраций компонентов вводится активность.
Активность (а) связана с концентрацией следующим соотношением:
а = С, (7.18)
где – коэффициент активности, который формально учитывает все виды взаимодействия частиц в данном растворе, приводящие к отклонению от свойств идеального раствора. Его вычисляют по экспериментальным данным или, используя теоретические методы расчета.
Слайд 24Типы жидких растворов. Растворимость
Одни вещества способны растворяться неограниченно (вода и
спирт), другие – лишь в ограниченных количествах (поваренная соль в
воде).
Растворы газов в жидкостях. Растворимость газов зависит от их природы, характера жидкости, посторонних примесей, а также от давления и температуры. Растворимость одних и тех же газов в различных растворителях разная. Газы, молекулы которых неполярны, растворяются, как правило, лучше в неполярных растворителях. И, наоборот, в полярных растворителях лучше растворяются газы, молекулы которых полярны.
Например, растворимость аммиака выше всего в воде, как в сильно полярной жидкости (87,6 г в 100 г H2O),
в толуоле - как в неполярном растворителе, растворимость его ничтожна (0,048 г в 100 г толуола).
Слайд 25Закон Генри
Зависимость растворимости газов от давления выражается законом Генри (1803):
растворимость данного газа в жидкости при постоянной температуре прямо пропорциональна
его давлению над жидкостью:
C = KP, (7.19)
где С – концентрация газа в жидкости;
P – давление газа над раствором; K – коэффициент пропорциональности, зависящий от природы газа.
Растворимость газов в сильной степени зависит от температуры. Согласно принципу Ле-Шателье, который применим для равновесных систем, растворимость газов будет уменьшаться с нагреванием и увеличиваться при охлаждении.
Закон Генри справедлив только для разбавленных растворов и при малых давлениях, т.е. когда газы подчиняются законам идеальных газов. Газы, выступающие во взаимодействии с растворителем
(HCl, NH3, SO2 и др.), закону Генри не подчиняются.
Слайд 26Растворы жидкостей в жидкостях.
В зависимости от природы жидкости могут:
1)
смешиваются друг с другом в любых соотношениях с образованием совершенно
однородного раствора (вода и глицерин, вода и этиловый спирт). Для подобных растворов сохраняются общие свойства растворов и выполняются законы Рауля и Вант-Гоффа;
2) обладают ограниченной растворимостью друг в друге (вода и анилин, вода и эфир). Причем растворимость зависит от природы смешиваемых жидкостей, температуры, концентрации. В зависимости от концентрации могут образовываться три фазы: насыщенный раствор первой жидкости во второй; насыщенный раствор второй жидкости в первой и двухслойная система. Второй вариант наблюдается в том случае, когда силы сцепления между разнородными молекулами значительно меньше сил сцепления между однородными молекулами, т.е. когда положительные отклонения парциальных давлений пара раствора от закона Рауля велики и превосходят некоторую предельную величину;
3) практически не растворимы друг в друге (вода и бензол, вода и ртуть).
Слайд 27Закон распределения Нернста-Шилова
Если в систему, состоящую из двух взаимно нерастворимых
жидкостей, ввести третье вещество, которое растворимо в обеих жидкостях, то
оно распределится между ними. При этом выполняется закон распределения Нернста-Шилова (1890): при постоянной температуре соотношение равновесных концентраций между несмешивающимися жидкостями (фазами) является величиной постоянной, независимой от общего количества компонентов:
Kрас = CА/СВ, (7.20)
где Крас – коэффициент распределения (зависит от природы растворителей и растворяемого вещества, температуры);
CА и СВ – молярные концентрации вещества в жидкостях (фазах) А и В.
Закон распределения находится в основе методов экстракции (извлечения), в котором извлекается один из компонентов смесей (растворов) с помощью растворителя, не смешивающегося с раствором. Применяют, например, при очистке сточных вод, в распределительной хроматографии и т. д.
Слайд 28Растворы твердых тел в жидкостях.
Растворимость твердых веществ также определяется природой
растворителя и растворенного вещества и зависит от температуры и мало
изменяется с давлением.
Растворимостью (S) данного вещества называется количество его, выраженное в граммах, насыщающее 100 г растворителя.
К хорошо растворимым относят вещества, растворяющиеся более 1 г в 100 г воды; к малорастворимым относят соединения, растворяющиеся от 0,001 до 1 г в 100 г воды; к нерастворимым относят соединения, растворяющиеся менее 0,001 г в 100 г воды.
При растворении могут образоваться растворы:
1) ненасыщенные – это растворы, которые содержат растворяемое вещество в меньшем количестве, чем допустимо растворимостью;
2) насыщенные – растворы, содержащие максимальное количество вещества, допустимое растворимостью при данной температуре;
3) пересыщенные – это растворы, содержащие растворяемое вещество в большем количестве, чем насыщенные.
Пересыщенные растворы метастабильны, т. е. неустойчивы. Их получают путем охлаждения растворов близких к насыщению и применяют для перекристаллизации веществ при их очистке от примесей или выращивании кристаллов. В первом случае охлаждение проводят достаточно быстро, а во втором – медленно.
При растворении твердых веществ могут образовываться как растворы неэлектролитов, так и растворы электролитов. К ним применимы общие свойства растворов.

Слайд 29Свойства слабых электролитов
При растворении в воде или других растворителях, состоящих
из полярных молекул, электролиты подвергаются диссоциации, т.е. в большей или
меньшей степени распадаются на положительно и отрицательно заряженные ионы – катионы и анионы. Электролиты можно поделить на две группы: слабые и сильные.
Слабыми электролитами называют электролиты, диссоциирующие в растворах не полностью, т.е. не на сто процентов. В их растворах устанавливается равновесие между молекулами, которые подверглись диссоциации и продуктами их диссоциации – ионами. Для данной системы можно применить закон действующих масс. Для процесса диссоциации кислоты
НА Н+ + А-
Константа равновесия КС в общем виде равна
,
Слайд 30где аН+, аА-, аНА – активность ионов и кислоты (а
= αС).
Константа равновесия для процесса диссоциации называется константой диссоциации КД.
Например, константа диссоциации уксусной кислоты СН3СООН равна
СH3COOH CH3COO- + H+
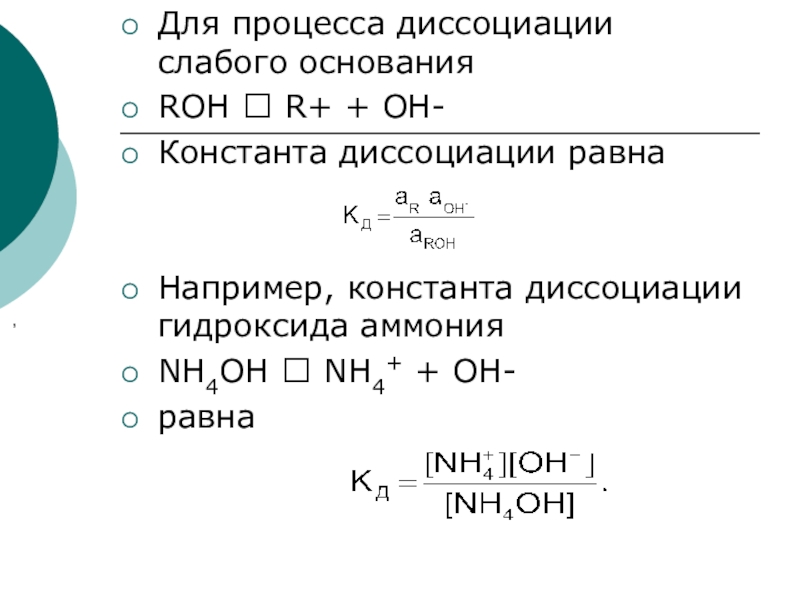
Слайд 31Для процесса диссоциации слабого основания
ROH R+ + OH-
Константа
диссоциации равна
Например, константа диссоциации гидроксида аммония
NH4OH NH4+ +
OH-
равна
,
Слайд 32Для слабых электролитов константа диссоциации зависит от природы диссоциирующего вещества
и растворителя, температуры, но не зависит от концентрации раствора. Кривая
зависимости константы диссоциации многих электролитов от температуры проходит через максимум.
Константа диссоциации является характеристикой силы электролита.
По величине константы диссоциации слабые электролиты делятся на умеренно слабые (КД = 10-2 – 10-4),
слабые (КД = 10-5 – 10-9)
и очень слабые (КД ≤ 10-10).
Чем константа диссоциации соединения больше, тем сильнее данный электролит. Например, уксусная кислота (КД = 1,85.10-5) сильнее цианисто-водородной
(КД = 4,8.10-10), но слабее муравьиной (КД = 1,8.10-4). Константа диссоциации имеет постоянное значение (при данной температуре) только для слабых электролитов. Подобного постоянства для сильных электролитов не наблюдается.
Слайд 33Для многоосновных слабых электролитов константа диссоциации расписывается для каждой ступени
диссоциации.
Например, для ортофосфорной кислоты (Н3РО4) константа диссоциации по первой
ступени КД1 = 7,51 . 10-3,
по второй ступени КД2 = 6,23 . 10-8
и по третьей КД3 = 2,2 . 10-13.
Для расчетов удобно пользоваться не константой диссоциации КД, а показателем константы диссоциации рК, который представляет собой отрицательный десятичный логарифм КД:
рК = -lgКД
Слайд 34Основываясь на законе действующих масс, можно вывести уравнение, которое связывает
константу диссоциации КД электролита со степенью его диссоциации () и
с концентрацией раствора (С). В случае электролита КА =К+ и А-.
Концентрации ионов (активности), рассчитывают по уравнению (7.18), концентрация вещества КА
[КА] = (1 – )С. [ К+] = [А-]= С
Слайд 35где С – молярная концентрация электролита, моль/дм³.
Выведенная формула (7.26) является
аналитическим выражением закона разбавления Оствальда.
Если степень диссоциации значительно меньше
единицы, то при приближенных вычислениях можно принять, что (1-α) 1. Тогда выражение закона разбавления упрощается:
КД = 2С ,
Слайд 36Последнее соотношение показывает, что при разбавлении раствора (т. е. при
уменьшении концентрации электролита С) степень диссоциации электролита возрастает.
Опыт показывает,
что для сильных растворов закон разведения Оствальда не применим, так как для них величина КД с увеличением концентрации непрерывно возрастает.
Слайд 37Ионное произведение воды
Химически чистая вода является очень слабым электролитом, который
при диссоциации образует ионы водорода (Н+) и гидроксид-ионы (ОН-):
Н2О
Н+ + ОН-.
Этому процессу соответствует константа диссоциации
Поскольку степень диссоциации воды мала, уравнение (7.28) можно записать в виде:
КД[Н2О] = [H+][OH-] = КW
Слайд 38где КW – ионное произведение воды.
При 295 К КW
= 10-14, поэтому [H+] = [OH-] = 10-7 моль/дм³.
С
увеличением температуры КW увеличивается. Если прологарифмировать уравнение (7.29) и умножить на -1, то получим
-рКW = рН + рОН = 14. (7.30)
где рКW – показатель ионного произведения воды; рН – водородный показатель или кислотность раствора; рОН – показатель гидроксид-ионов.
Величина рН используется для определения характера реакции раствора. Если рН = 7, то реакция нейтральная; если рН < 7, то реакция среды кислая; если рН > 7, то реакция щелочная.
Слайд 39Произведение растворимости
В насыщенном растворе малорастворимого электролита устанавливается равновесие между осадком
(твердой фазой) электролита и ионами электролита в растворе,
ВаSO4
Ва+2 + SO4-2
Поскольку в растворах электролитов состояние ионов определяется их активностями, то константа равновесия последнего процесса имеет вид:
Активность твердого сульфата бария есть величина постоянная, а, следовательно, произведение КДаВаSO4 тоже является при данной температуре константой.
Отсюда следует, что произведение активностей ионов так же представляет собой постоянную величину, называемую произведением растворимости (ПР):
а(Ва+2)а(SO4-2) = ПР(ВаSO4) = 1,08.10-10
Слайд 40Исходя из значений ПР, можно вычислить растворимость малорастворимых электролитов в
воде и растворах, содержащих другие электролиты. Значения ПР для большинства
электролитов – табличные величины.
Слайд 41Свойства сильных электролитов
Электролиты, практически полностью диссоциирующие в водных растворах,
называются сильными электролитами. К сильным электролитам относятся большинство солей, которые
уже в кристаллическом состоянии построены из ионов (они хорошо растворяются в воде), гидроксиды щелочных и щелочноземельных металлов (щелочи), некоторые кислоты (НСl, HBr, HI, HClO4, HNO3, H2SO4).
Слайд 42Теория сильных электролитов
Разработана П. Дебаем и Э. Хюккелем (1923). Согласно
этой теории, в растворах сильных электролитов действуют электростатические силы притяжения
между разноименными ионами и силы отталкивания – между одноименными.
Вокруг каждого иона образуется ионная атмосфера, состоящая из ионов противоположного знака. Каждый из ионов этой атмосферы находится в окружении другой ионной атмосферы. Поэтому раствор сильного электролита можно рассматривать как систему равномерно распределенных по всему объему раствора разноименных ионов, каждый из которых находится в центре силового поля создаваемого окружающими ионами.
Слайд 43По определению, для сильных электролитов истинная степень диссоциации =
1.В их растворах не обнаружено недиссоциированных молекул.
Несмотря на это экспериментальные
методы исследования степени диссоциации (самый простой основан на измерении электропроводности растворов) дают значения этой величины меньше 1.
Экспериментальное значение степени диссоциации сильного электролита называется кажущейся степенью ЭД (к), причем всегда
к = 1 ( - истинная степень ЭД).
Кажущаяся степень ЭД зависит от концентрации сильного электролита в растворе (чем больше концентрация, тем меньше к).
Несоответствие между и к объясняется взаимодействием сольватированных ионов электролита с образованием ионных пар.
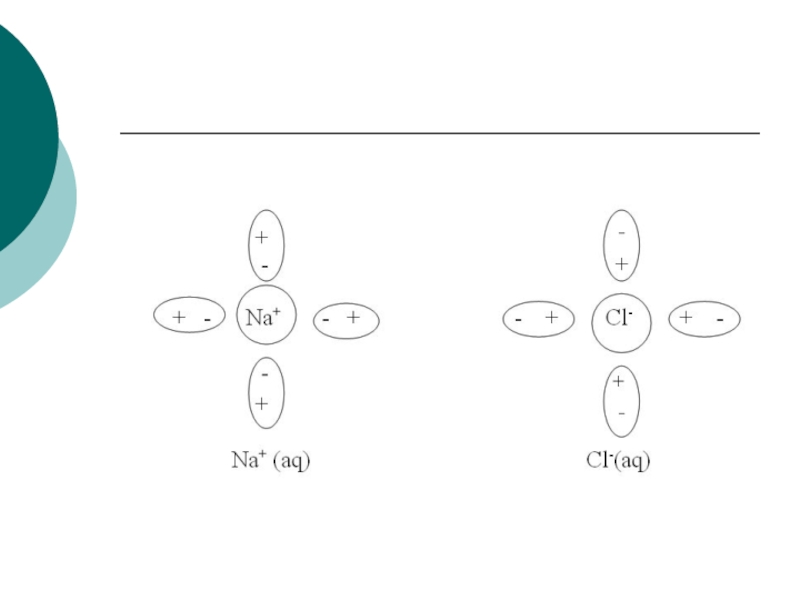
Например, явления происходящие в водном растворе хлорида натрия. Как и любой другой сильный электролит, твердый NaCl переходит в раствор только в виде ионов (Na+ и Cl-). Ионы эти гидратированы (окружены диполями молекул воды):
Слайд 45Внешняя поверхность гидратной оболочки имеет тот же по знаку заряд,
что и центральный ион. Сольватированные катион и анион в результате
столкновения друг с другом могут образовывать неустойчивую квазичастицу: Na+(aq) Cl- (aq). Эта квазичастица называется ионной парой. Ионные пары довольно легко разрушаются при соударении с другими частицами. Описанные выше явления можно изобразить в виде схемы:
Слайд 46Для описания состояния ионов в растворе пользуются их активностью, т.
е. условной (эффективной) концентрацией ионов, в соответствии с которой они
действуют в химических процессах (а = С). Коэффициенты активности зависят от природы растворителя и растворенного вещества, концентрации раствора и температуры.
В области разбавленных растворов (концентрация ниже 0,1 моль/дм3) коэффициенты активности зависят главным образом от концентрации и заряда ионов, присутствующих в растворе и мало зависят от природы растворенных веществ.
Правило ионной силы. Согласно этому правилу, ионы с одинаковыми зарядами, независимо от их природы, в разбавленных растворах с одинаковой ионной силой имеют равные коэффициенты активности. Ионной силой раствора (I) называется полусумма произведений концентраций всех ионов присутствующих в растворе, на квадрат их заряда:
I = 0,5Cizi2 (7.36)
Слайд 47Например, ионная сила раствора хлорида алюминия с концентрацией 0.01 моль/дм³,
диссоциирующего
AlCl3 Al+3 + 3Cl-,
I = 0,5(0,01 .
32 + 0, 03 . 1) = 0,06
Слайд 48Для разбавленных растворов, ионная сила которых не превышает 0,01, коэффициент
активности ионов связан с ионной силой раствора следующим соотношением:
lg = -0,5z2 √I (7.37)
Слайд 49Коэффициенты активности широко используются в практике и теоретических расчетах, но
сами по себе не раскрывают природу процессов, протекающих в реальных
системах. Они просто позволяют, используя простейшие соотношения, быстро и легко рассчитать реальные свойства разбавленных растворов сильных электролитов.
Таким образом, поведение растворов слабых электролитов описывается законом разведения Оствальда, а разбавленных растворов сильных электролитов – моделью ионной атмосферы Дебая-Хюккеля. Однако общая теория растворов, охватывающая все виды растворов электролитов и весь диапазон концентраций, до сих пор не создана.




































![Растворы где КW – ионное произведение воды. При 295 К КW = где КW – ионное произведение воды. При 295 К КW = 10-14, поэтому [H+] = [OH-] =](/img/tmb/7/631364/af7f0cca86f40192289b26364d687e2c-800x.jpg)