Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Растворы. Термодинамика процесса растворения. Способы выражения концентрации растворов.
Содержание
- 1. Растворы. Термодинамика процесса растворения. Способы выражения концентрации растворов.
- 2. Раствор – однофазная система переменного состава, состоящая
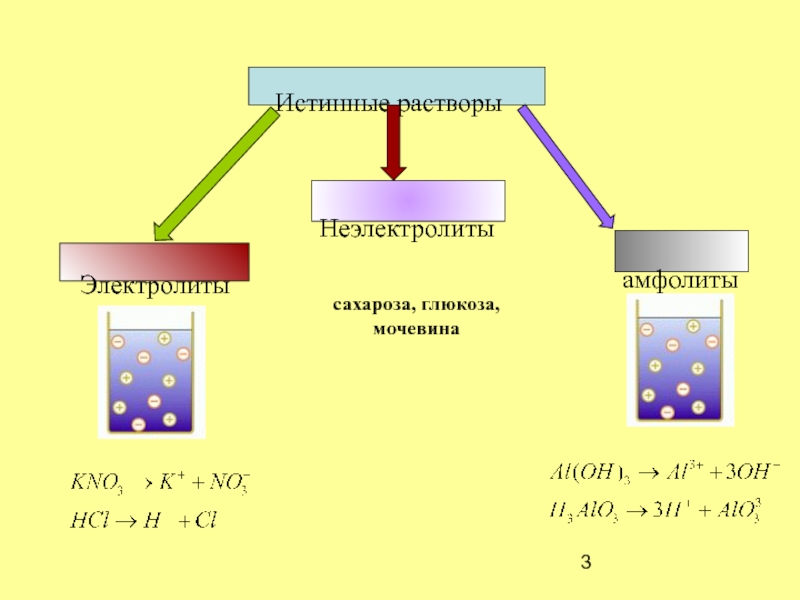
- 3. Истинные растворыамфолитыНеэлектролитысахароза, глюкоза,мочевина
- 4. Процесс растворенияФизическая модельЯкоб Хендрик Вант-Гофф (1852-1911)Сванте Август
- 5. Процесс растворенияХимическая модельРастворение – это процесс химического
- 6. 1. Тепловые явления1. Тепловые явленияэндотермические2. Изменение цветаБелые
- 7. Процесс растворенияСовременная (физико-химическая) модельРазрушение структуры исходного веществаСольватация
- 8. Разрушение структуры исходного веществаNaCl + nH2O → Na+xH2O + Cl-(n-x)H2OKA+ nH2O → K+xH2O + A-(n-x)H2O
- 9. Термодинамика процесса растворенияПри растворение жидкостей и твердых
- 10. Ненасыщенный раствор – раствор, в котором возможно
- 11. Коэффициент растворимости – отношение массы вещества, образующего
- 12. Влияние температуры∆H>0, повышение температуры приводит к увеличению растворимости – эндотермический процесс. (∆Hразр.кр.реш>∆Hгидр);∆H
- 13. Влияние давленияЗакон Генри:«При постоянной температуре растворимость газов
- 14. Закон Дальтона:«растворимость каждого компонента газовой смеси при
- 15. Растворимость газовЗакон Сеченова:«Растворимость газов в жидкостях в присутствии электролитов понижается, происходит высаливание газов»
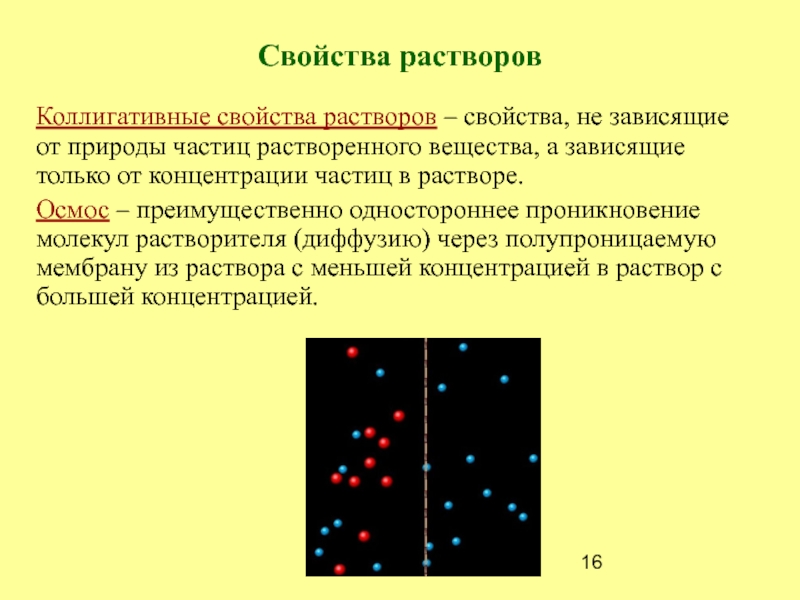
- 16. Свойства растворов Коллигативные свойства растворов – свойства,
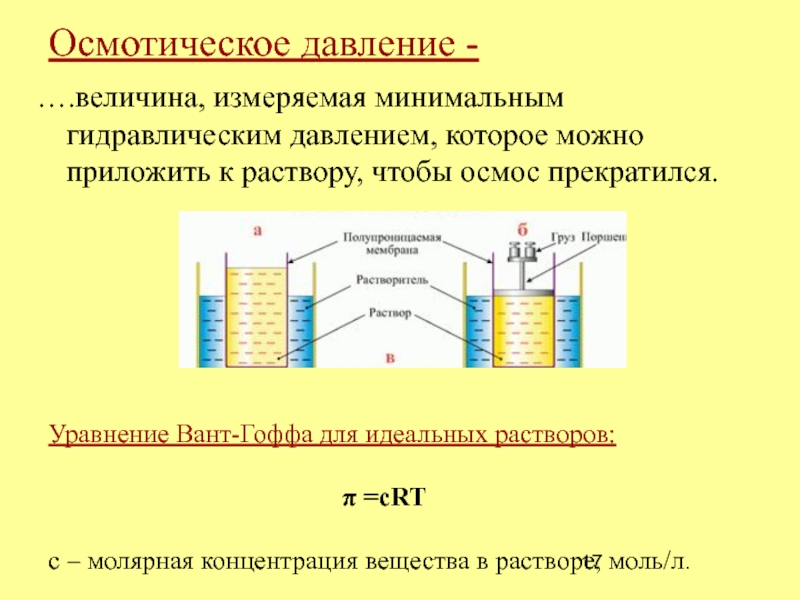
- 17. Осмотическое давление - ….величина, измеряемая минимальным гидравлическим
- 18. Уравнение Вант-Гоффа для реальных растворов:π=icRTi > 1,
- 19. Значение осмоса упругость, тургор клетокэластичность тканей, форма
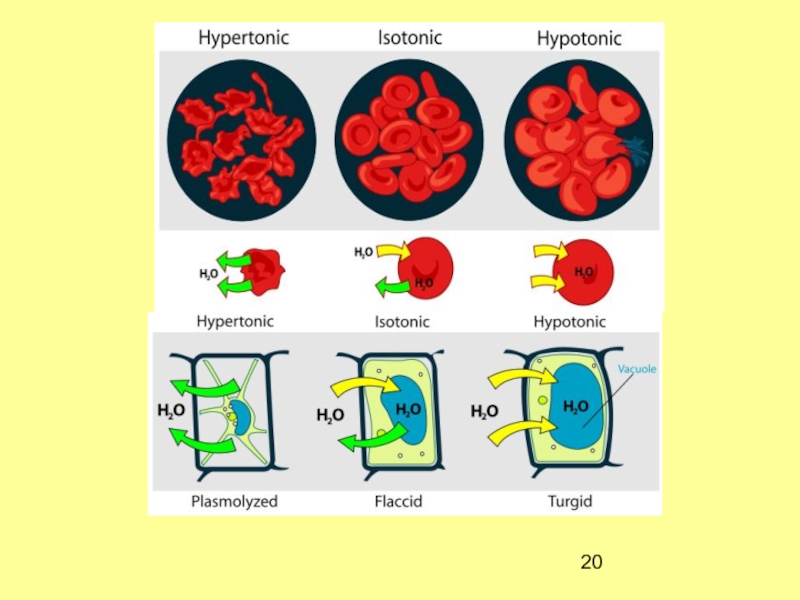
- 20. Слайд 20
- 21. Гемолиз – явление набухания и разрыва клеток
- 22. Спасибо за внимание !
- 23. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1 Растворы. Термодинамика процесса растворения. Способы выражения концентрации растворов. Коллигативные
свойства разбавленных растворов неэлектролитов и электролитов
Лектор: Задорожная А.Н.
Слайд 2Раствор – однофазная система переменного состава, состоящая из двух и
более компонентов.
Истинные растворы – термодинамически устойчивая гомогенная система с размером
частиц 10-10 – 10-9 м.Коллоидные растворы –
неоднородные гетерогенные
системы с размером частиц
10-9 – 10-6 м.
Слайд 4Процесс растворения
Физическая модель
Якоб Хендрик Вант-Гофф
(1852-1911)
Сванте Август Аррениус
(1859-1927)
Вильгельм-Фридрих Оствальд
(1853-1932)
Растворение – процесс диффузии.
Растворы – однородные смеси.
Слайд 5Процесс растворения
Химическая модель
Растворение – это процесс химического взаимодействия растворяемого вещества
с водой – процесс гидратации.
Растворы – это соединения-гидраты.
Дмитрий Иванович Менделеев
(1834-1907)
Иван
Алексеевич Каблуков(1857-1942)
Николай Семенович Курнаков
(1860-1941)
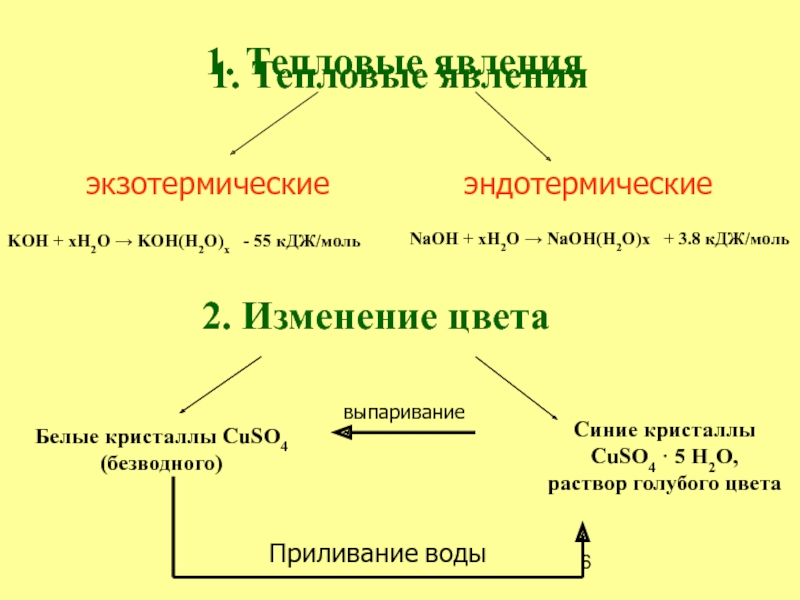
Слайд 61. Тепловые явления
1. Тепловые явления
эндотермические
2. Изменение цвета
Белые кристаллы CuSO4
(безводного)
Синие
кристаллы
CuSO4 · 5 H2O,
раствор голубого цвета
Приливание воды
выпаривание
экзотермические
KOH +
xH2O → KOH(H2O)x - 55 кДЖ/мольNaOH + xH2O → NaOH(H2O)x + 3.8 кДЖ/моль
Слайд 7Процесс растворения
Современная (физико-химическая) модель
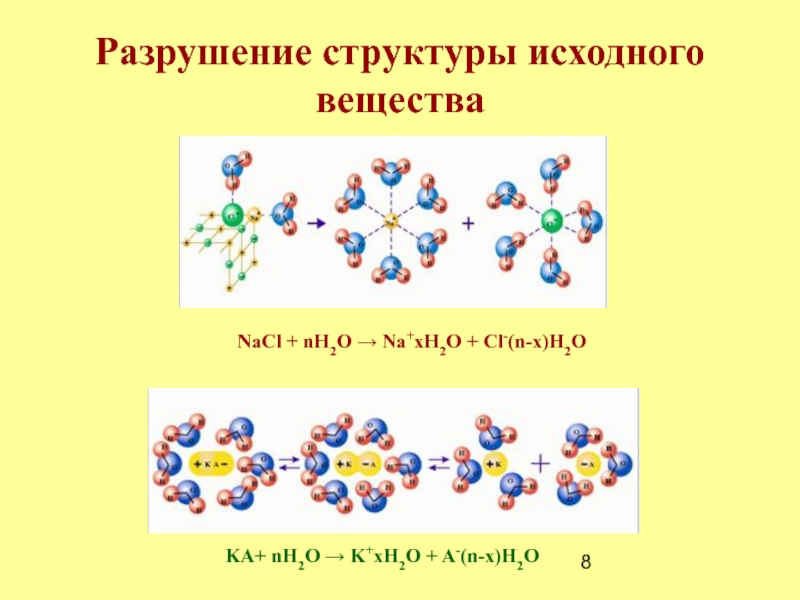
Разрушение структуры исходного вещества
Сольватация (гидратация)
Диффузия
Растворение – это
физико-химический процесс.
Растворы – это однородные (гомогенные) системы, состоящие из частиц
растворенного вещества, растворителя и продуктов их взаимодействия – гидратов.Слайд 8Разрушение структуры исходного вещества
NaCl + nH2O → Na+xH2O + Cl-(n-x)H2O
KA+
nH2O → K+xH2O + A-(n-x)H2O
Слайд 9Термодинамика процесса растворения
При растворение жидкостей и твердых веществ
Тепловой эффект растворения
∆H раств
Эндотермический процесс разрушения кристаллической решетки (∆H разр.кр.реш >0).
Экзотермического процесса
гидратации переходящих в раствор ионов или молекул (∆H гидр <0).∆Hраств. = ∆Hразр.кр.реш. + ∆Hгидр.
Слайд 10Ненасыщенный раствор – раствор, в котором возможно дальнейшее растворение вещества,
без изменения условий
Перенасыщенный раствор – раствор, в котором при
данных условиях содержится большее количество растворенного вещества, чем в насыщенном растворе.Насыщенный раствор – раствор, который содержит максимально возможное количество растворенного вещества, и находится в равновесии с твердой фазой растворенного вещества.
Растворимость
Слайд 11Коэффициент растворимости – отношение массы вещества, образующего насыщенный раствор при
данной температуре, к массе растворителя.
Ks=m(в-ва)/m(р-ра)
S=(m(в-ва)/m(р-ля))∙1000
Растворимость зависит:
Природы растворяемого вещества и растворителя
Температуры
Давления
Присутствия
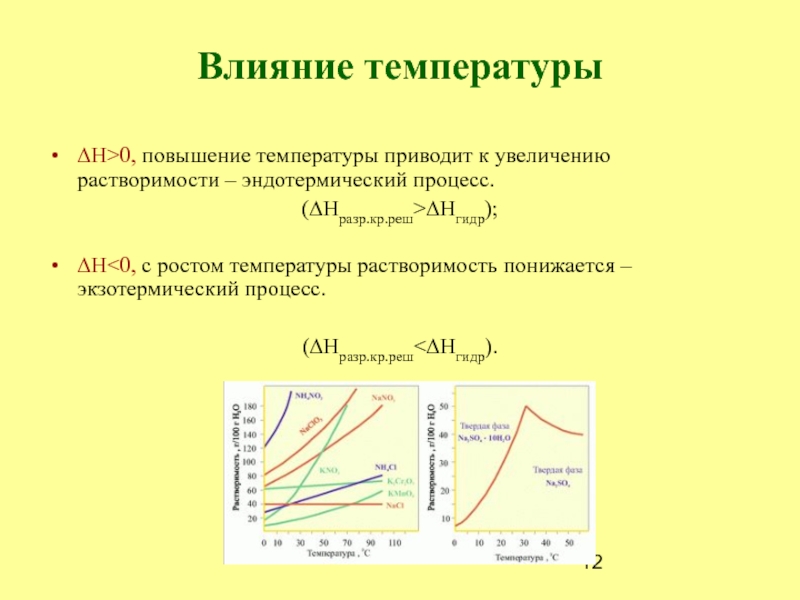
в растворе других веществСлайд 12Влияние температуры
∆H>0, повышение температуры приводит к увеличению растворимости – эндотермический
процесс.
(∆Hразр.кр.реш>∆Hгидр);
∆H
Слайд 13Влияние давления
Закон Генри:
«При постоянной температуре растворимость газов в жидкости прямо-пропорциональна
его давлению над жидкостью»
C(x)=Kг(x)∙Р(x)
C(x) – концентрация газа в насыщенном растворе,
моль/л;Kг(x) – постоянная Генри для газа Х, моль∙л-1∙Па-1;
Р(х) – давление газа над раствором, Па.
Растворимость газов
Слайд 14Закон Дальтона:
«растворимость каждого компонента газовой смеси при постоянной температуре пропорциональна
постоянному давлению компонента над жидкостью и не зависит от общего
давления смеси и индивидуальности других компонентов»Pi=Pобщ.∙X(Xi)
Pi - парциальное давление компонента i;
Pобщ. – общее давление над раствором;
X(Xi) – молярная доля i компонента.
Растворимость газов
Слайд 15Растворимость газов
Закон Сеченова:
«Растворимость газов в жидкостях в присутствии электролитов понижается,
происходит высаливание газов»
Слайд 16Свойства растворов
Коллигативные свойства растворов – свойства, не зависящие от
природы частиц растворенного вещества, а зависящие только от концентрации частиц
в растворе.Осмос – преимущественно одностороннее проникновение молекул растворителя (диффузию) через полупроницаемую мембрану из раствора с меньшей концентрацией в раствор с большей концентрацией.
Слайд 17Осмотическое давление -
….величина, измеряемая минимальным гидравлическим давлением, которое можно
приложить к раствору, чтобы осмос прекратился.
Уравнение Вант-Гоффа для идеальных растворов:
π
=cRTc – молярная концентрация вещества в растворе, моль/л.
Слайд 18Уравнение Вант-Гоффа для реальных растворов:
π=icRT
i > 1, для электролитов;
i =
1, для неэлектролитов;
i < 1, для веществ склонных к ассоциации;
i
= 1+α(m-1)m – число ионов, на которые распадается молекула электролита.
Слайд 19Значение осмоса
упругость, тургор клеток
эластичность тканей, форма органов
усвоение пищи, образование лимфы,
мочи, кала
действие лекарств
За счет осмоса вода в организме распределяется между
кровью, тканями, клетками.Слайд 21Гемолиз – явление набухания и разрыва клеток эритроцитов в гипотоническом
растворе. Идет осмос воды в клетки. Клетка набухает, оболочка разрывается.
Растворы, у которых π меньше, чем у π ПЛАЗМЫ, называются гипотоническими.Плазмолиз – явление сжатия, высушивания клеток в гипертоническом растворе. Идет осмос воды из клетки в раствор, где π больше. Растворы, у которых π больше, чем у π ПЛАЗМЫ, называются гипертоническими.