Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
РАСТВОРЫ ЭЛЕКТРОЛИТОВ и НЕЭЛЕКТРОЛИТОВ
Содержание
- 1. РАСТВОРЫ ЭЛЕКТРОЛИТОВ и НЕЭЛЕКТРОЛИТОВ
- 2. Растворы – это однородные смеси двух или большего числа веществ (компонентов), образующие термодинамически равновесные системы.
- 3. Пример: Вода – это растворитель, если
- 4. Содержание и распределение воды в организме человека~
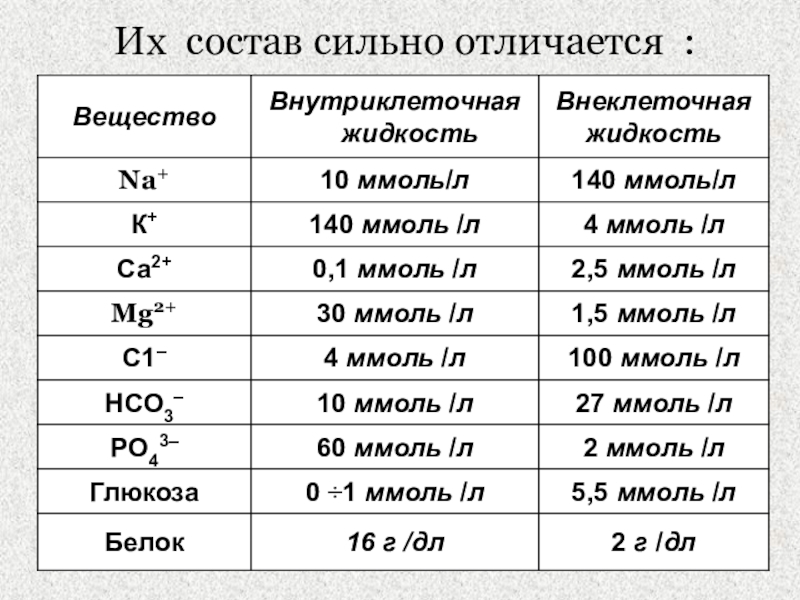
- 5. Их состав сильно отличается :
- 6. Внеклеточная жидкость (30%)Внутрисосудистая (7%)Межклеточная тканевая (23 %)Их
- 7. Н2О – универсальный растворитель, наличие аномальных свойств
- 8. В биохимических процессах вода выступает как :РастворительРеагентПродукт реакции
- 9. Вода- универсальный растворительСуществование межмолекулярных водородных связей определяет
- 10. Коллигативные свойства растворовРазбавленные растворы характеризуются отсутствием взаимодействия
- 11. Коллигативные свойства растворовосмотическое давление2. понижение давления насыщенного
- 12. ДиффузияДиффузией в растворе называется самопроизвольный направленный процесс
- 13. ОсмосРассмотрим случай, когда на пути диффузии частиц
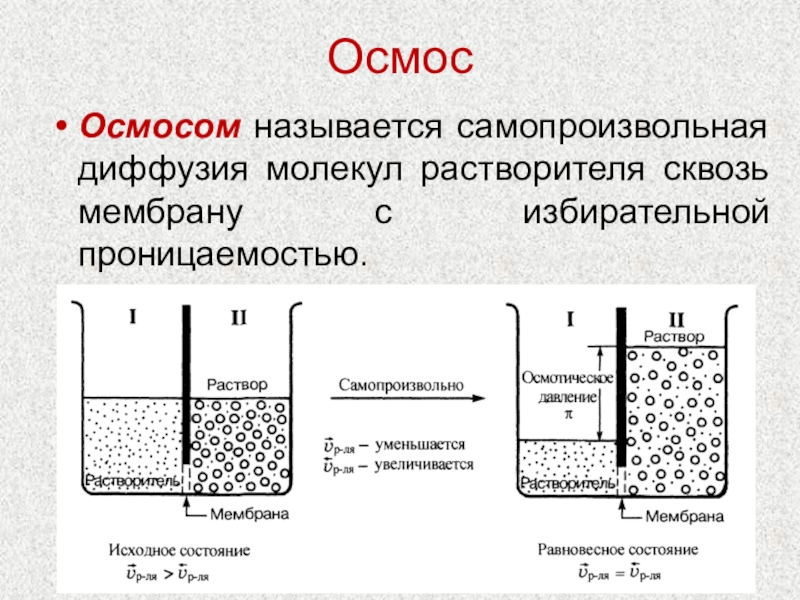
- 14. ОсмосОсмосом называется самопроизвольная диффузия молекул растворителя сквозь мембрану с избирательной проницаемостью.
- 15. Осмотическое давлениеПоявляющееся избыточное гидростатическое давление в системе
- 16. уравнение Вант-ГоффаР осм. =СМRT
- 17. Пример: Чему равно Росм раствора глюкозы С6Н12О6
- 18. Классификация растворов ИзотоническиеРастворы у которых осмотическое давление
- 19. Осмотическая ячейкаЭто система, отделенная от окружающей среды
- 20. Слайд 20
- 21. Слайд 21
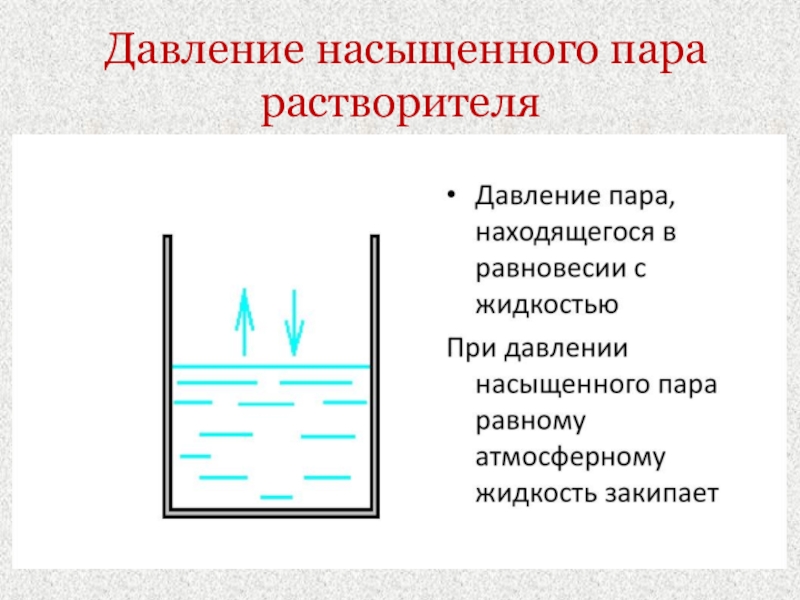
- 22. Давление насыщенного пара растворителя
- 23. Vиспарения = VконденсацииI закон Рауля: «Давление насыщенного
- 24. Р0 – Р = ΔР ;
- 25. Слайд 25
- 26. Е- эбулиоскопическая постоянная, К- криоскопическая постоянная, Сm-
- 27. Криоскопия, эбулиометрия
- 28. Слайд 28
- 29. Слайд 29
- 30. Коллигативные свойства разбавленных растворов электролитовРосм = См
- 31. Электролитами называются вещества, которые в растворе или
- 32. Вант-Гофф ввел изотонический коэффициент – i
- 33. Пример 5. Раствор, содержащий 0,85 г хлорида
- 34. Р е ш е н и е
- 35. Р е ш е н и е
- 36. Пример 6. Найти изотонический коэффи-циент для 0,2
- 37. Р е ш е н и е
- 38. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Растворы – это однородные смеси двух или большего числа веществ
(компонентов), образующие термодинамически равновесные системы.
Слайд 3Пример: Вода – это растворитель, если растворить твердое вещество (глюкозу)
или газ (СО2 ). - А если спирт и вода?
Если 3 % раствор спирта, то растворитель вода, если 90 % раствор спирта, то растворитель спирт, если 50 % раствор спирта, то есть право выбора растворителя. Самым распространенным растворителем на Земле является вода.Слайд 4Содержание и распределение воды в организме человека
~ 60 % от
общей массы тела человека составляет вода. (На 70 кг приходится
45 л воды).70% всей воды организма внутриклеточная
30% - внеклеточная
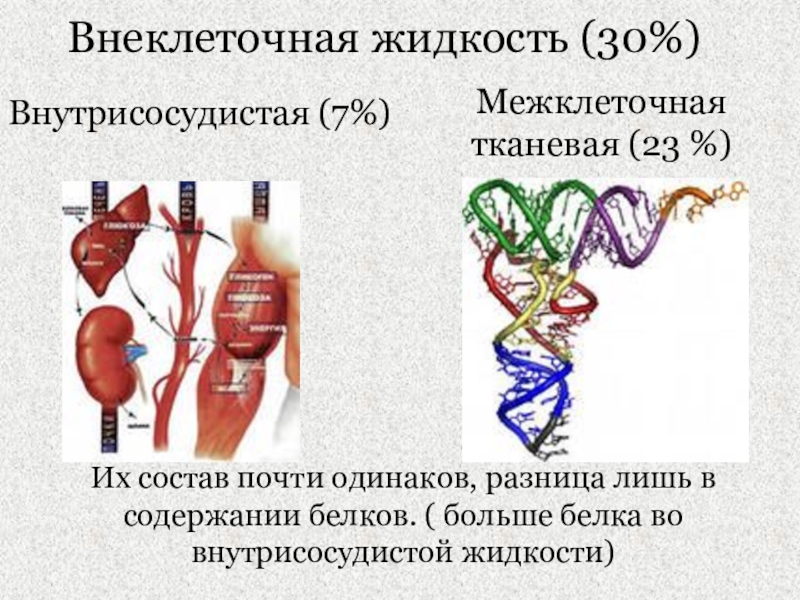
Слайд 6Внеклеточная жидкость (30%)
Внутрисосудистая (7%)
Межклеточная тканевая (23 %)
Их состав почти одинаков,
разница лишь в содержании белков. ( больше белка во внутрисосудистой
жидкости)Слайд 7Н2О – универсальный растворитель, наличие аномальных свойств ее играет важную
физиологическую и биологическую роль. Биохимические процессы в организме протекают в
водных растворах или при ее участии.Слайд 9Вода- универсальный растворитель
Существование межмолекулярных водородных связей определяет аномальные физические свойства
воды:
Высокая теплоемкость
Высокая температура кипения
Большая теплота испарения
Высокое поверхностное натяжение
Низкая вязкость
Более высокая
плотность в жидком состоянии, чем в твердомВысокая диэлектрическая проницаемость (ε = 80)
Слайд 10Коллигативные свойства растворов
Разбавленные растворы характеризуются отсутствием взаимодействия между частицами растворенного
вещества.
Коллигативными свойствами называются свойства растворов, не зависящие от природы
частиц растворенного вещества, а зависящие только от их концентрации в растворе.Слайд 11Коллигативные свойства растворов
осмотическое давление
2. понижение давления насыщенного пара растворителя над
раствором по сравнению с давлением насыщенного пара растворителя над чистым
растворителем.3. повышение температуры кипения раствора по сравнению с температурой кипения чистого растворителя
4. понижение температуры замерзания раствора по сравнению с температурой замерзания чистого растворителя.
Слайд 12Диффузия
Диффузией в растворе называется самопроизвольный направленный процесс переноса частиц растворенного
вещества и растворителя, который осуществляется при наличии градиента концентрации растворенного
вещества и приводит к выравниванию концентрации этого вещества по всему объему раствораСлайд 13Осмос
Рассмотрим случай, когда на пути диффузии частиц растворенного вещества и
растворителя находится мембрана с избирательной проницаемостью, через которую свободно проходят
молекулы растворителя, а молекулы растворенного вещества практически не проходят.Лучшей избирательной проницаемостью обладают мембраны, изготовленные из природных тканей животного и растительного происхождения (стенки кишок и мочевого пузыря, различные растительные ткани)
Слайд 14Осмос
Осмосом называется самопроизвольная диффузия молекул растворителя сквозь мембрану с избирательной
проницаемостью.
Слайд 15Осмотическое давление
Появляющееся избыточное гидростатическое давление в системе является следствием осмоса,
поэтому называется осмотическим
Осмотическим давлением называют избыточное гидростатическое давление, возникающее в
результате осмоса и приводящее к выравниванию скоростей взаимного проникновения молекул растворителя сквозь мембрану с избирательной проницаемостью.Слайд 17Пример:
Чему равно Росм раствора глюкозы С6Н12О6 с конценрацией 1
моль/л ?
чем М, тем ↓ Р осм. (белки)
Слайд 18Классификация растворов
Изотонические
Растворы у которых осмотическое давление одинаково и между
ними происходит равновесный обмен растворителем
Гипертонические
Растворы у которых осмотическое давление больше
Гипотонические
Растворы
у которых осмотическое давление меньшеСлайд 19Осмотическая ячейка
Это система, отделенная от окружающей среды мембраной с избирательно
проницаемостью.
Все клетки живых существ являются осмотическими ячейками, которые способны всасывать
растворитель из окружающей среды или, наоборот, его отдавать, в зависимости от концентрации растворов, разделенных мембраной.Слайд 23Vиспарения = Vконденсации
I закон Рауля: «Давление насыщенного пара над раствором
(Р) равно давлению насыщенного пара над чистым растворителем (Р0) умноженным
на мольную долю растворителя (Ns).» Давление насыщенного пара растворителя
Слайд 24Р0 – Р = ΔР ; ΔР- абсолютное понижение
давления насыщенного пара р-ля над р-ом
Р = Р0 Ns
относительное
понижение давления нас. пара над раствором.NS + Ni= 1, NS =1- Ni
Слайд 26Е- эбулиоскопическая постоянная,
К- криоскопическая постоянная,
Сm- моляльность раствора.
Для
Н2О: Е= 0,53 кгград / моль,
К=1,86 кгград / моль.Температура кипения и температура замерзания растворителя и раствора
Слайд 30Коллигативные свойства разбавленных растворов электролитов
Росм = См R
T
P = P0 Ns
Ткип.=Е Сm
Тзам.=К Сm
Только для р-ров неэлектролитов
Слайд 31Электролитами называются вещества, которые в растворе или в расплаве
частично или
полностью распадаются на ионы и проводят электрический ток за счет
движения ионов.Слайд 32Вант-Гофф ввел изотонический коэффициент – i (i>1) для электролитов
Росм
= i См R T
P = i
P0 NsТкип.= i Е Сm
Тзам.= i К Сm
i= (n-1) + 1
Слайд 33Пример 5. Раствор, содержащий 0,85 г хлорида цинка в 125
г воды кристаллизуется при -0,23°С. Определить кажущуюся степень диссоциации ZnCl2.
ПРИМЕРЫ
РЕШЕНИЯ ЗАДАЧСлайд 34Р е ш е н и е 5. Найдем прежде
всего моляльную концентрацию (го) соли в растворе. Поскольку мольная масса
ZnCl2 равна 136,3 г/моль, тоСm = 0,85 • 1000/(136,3•125) = 0,050 моль/кг.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Теперь определим понижение температуры кристал-лизации без учета диссоциации электролита (крио-скопическая постоянная воды равна 1,86):
∆Ткрист,выч = 1,86 • 0,050 = 0,093°С.
Сравнивая найденное значение с экспериментально определенным понижением температуры кристал-лизации, вычисляем изотонический коэффициент i:
Слайд 35Р е ш е н и е 5. Найдем прежде
всего моляльную концентрацию (го) соли в растворе. Поскольку мольная масса
ZnCl2 равна 136,3 г/моль, тоСm = 0,85 • 1000/(136,3•125) = 0,050 моль/кг.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Теперь определим понижение температуры кристал-лизации без учета диссоциации электролита (крио-скопическая постоянная воды равна 1,86):
∆Ткрист,выч = 1,86 • 0,050 = 0,093°С.
Сравнивая найденное значение с экспериментально определенным понижением температуры кристал-лизации, вычисляем изотонический коэффициент i:
Слайд 36Пример 6. Найти изотонический коэффи-циент для 0,2 М раствора электролита,
если известно, что в 1 л этого раствора содержится 2,18•1023
частиц (молекул и ионов) растворенного вещества.ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Слайд 37Р е ш е н и е 6. Число молекул
электролита, взятых для приготовления 1 л раствора, равно 6,02 •
1023 • 0,2 = 1,20 • 1023; при этом в растворе образовалось 2,18•1023 частиц растворенного вещества. Изотонический коэффициент показы-вает, во сколько раз последнее число больше числа взятых молекул, т. е.ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
i = 2,18 • 1023/(1,20 • 1023) = 1,82