Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Раздражимость и возбудимость клеток и тканей. Методы исследования
Содержание
- 1. Раздражимость и возбудимость клеток и тканей. Методы исследования
- 2. РАЗДРАЖИМОСТЬ – ОБЩЕЕ СВОЙСТВО ВСЕХ ЖИВЫХ ОРГАНИЗМОВ
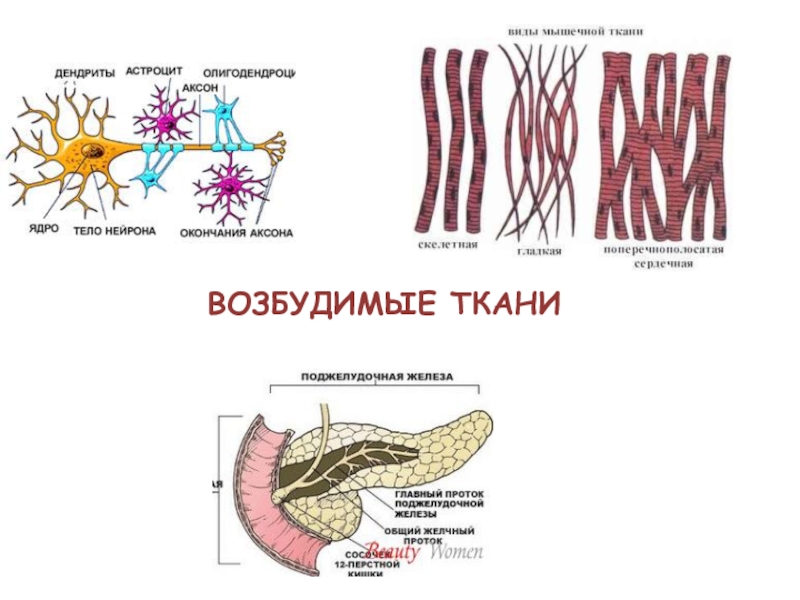
- 3. ВОЗБУДИМЫЕ ТКАНИ
- 4. Мера возбудимости – порог раздражения, т.е. минимальная
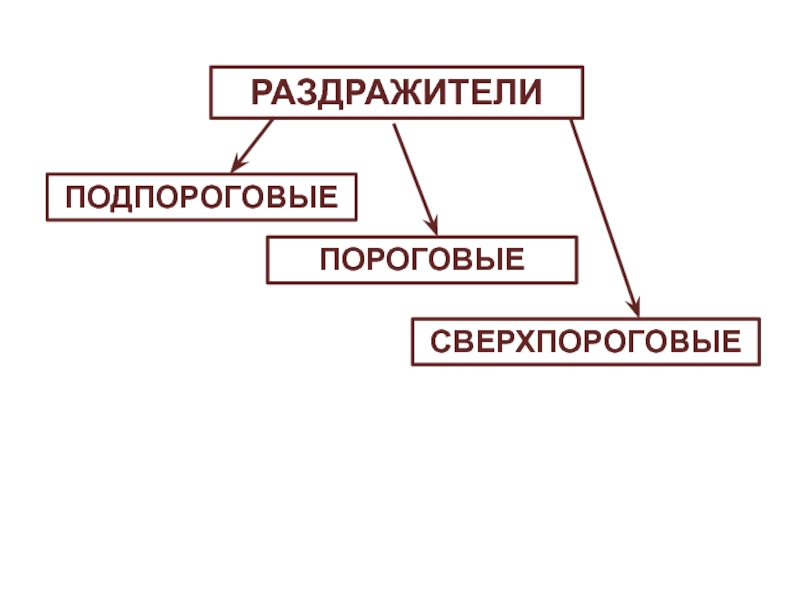
- 5. РАЗДРАЖИТЕЛИПОДПОРОГОВЫЕСВЕРХПОРОГОВЫЕПОРОГОВЫЕ
- 6. РАЗДРАЖИТЕЛИФИЗИЧЕСКИЕ (механические, звуковые, световые, температурные, электрические)ХИМИЧЕСКИЕ (щелочи,
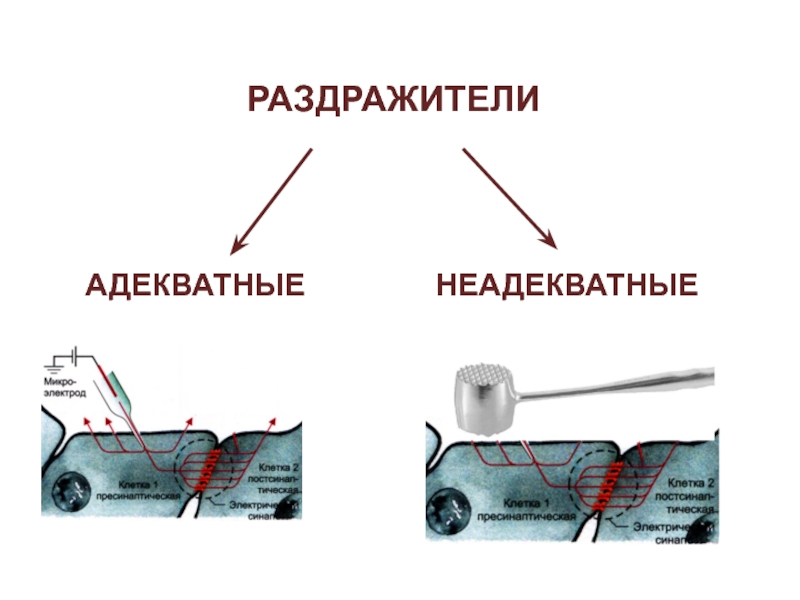
- 7. РАЗДРАЖИТЕЛИНЕАДЕКВАТНЫЕАДЕКВАТНЫЕ
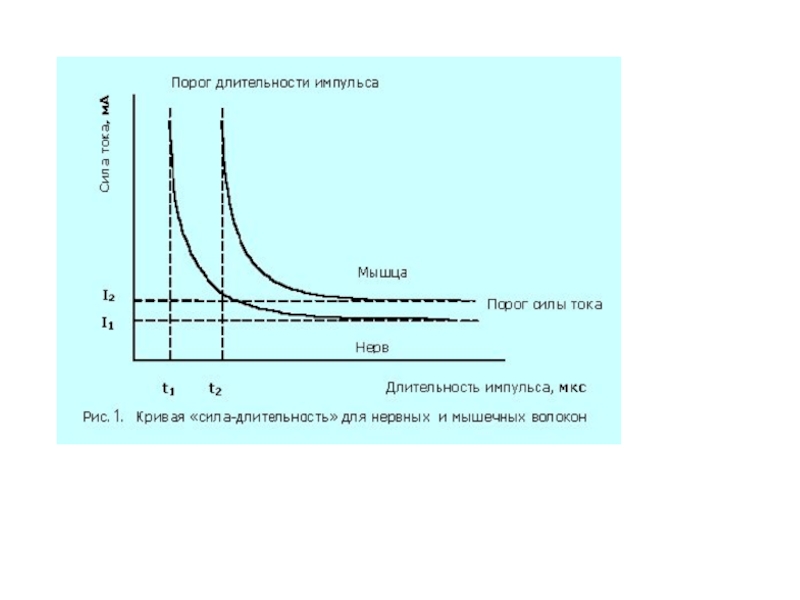
- 8. СООТНОШЕНИЕ МЕЖДУ ПОРОГОВОЙ СИЛОЙ РАЗДРАЖЕНИЯ И ЕГО ДЛИТЕЛЬНОСТЬЮ
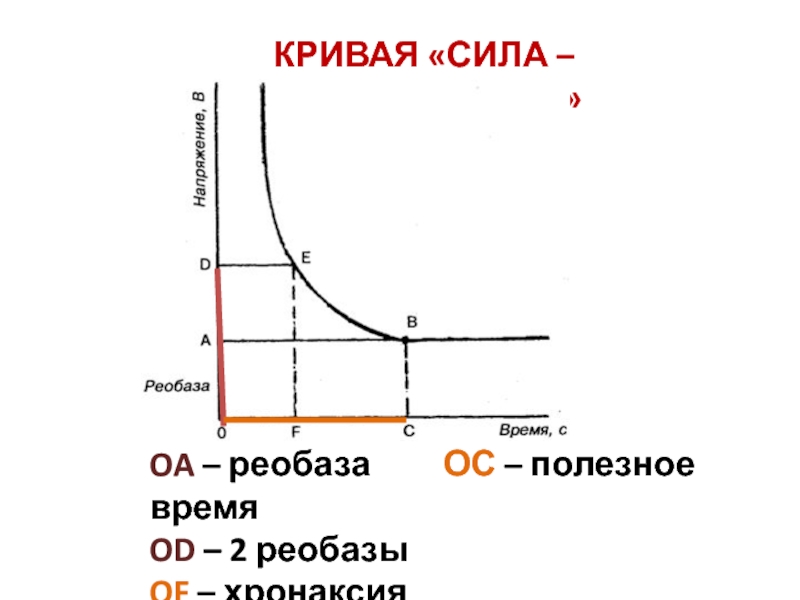
- 9. КРИВАЯ «СИЛА – ДЛИТЕЛЬНОСТЬ» OA – реобаза
- 10. Слайд 10
- 11. МЕТОДЫ ИССЛЕДОВАНИЯ ЭЛЕКТРОВОЗБУДИМЫХ ТКАНЕЙ
- 12. ПРОГРЕСС В ИССЛЕДОВАНИИ БИОПОТЕНЦИАЛОВ ОБЕСПЕЧЕНРАЗРАБОТКОЙ МИКРОЭЛЕКТРОДНОГО МЕТОДА ВНУТРИКЛЕТОЧНОГО ОТВЕДЕНИЯ ПОТЕНЦИАЛОВСОЗДАНИЕМ СПЕЦИАЛЬНЫХ УСИЛИТЕЛЕЙ БИОПОТЕНЦИАЛОВВЫБОРОМ УДАЧНЫХ ОБЪЕКТОВ ИССЛЕДОВАНИЯ
- 13. ДИАМЕТР гигантского аксона – 0,5 – 1 мм
- 14. Гигантский аксон кальмара в чашке Петри.
- 15. ОСНОВНЫЕ ЭЛЕМЕНТЫ УСТАНОВКИ ДЛЯ ИЗУЧЕНИЯ ВОЗБУДИМЫХ КЛЕТОК
- 16. a - внутриклеточное раздражение и отведение потенциалов
- 17. НЕПОЛЯРИЗУЮЩИЕСЯ ЭЛЕКТРОДЫ: хлорсеребряный электродХЛОРСЕРЕБРЯНЫЙ ЭЛЕКТРОД: серебряная пластинка
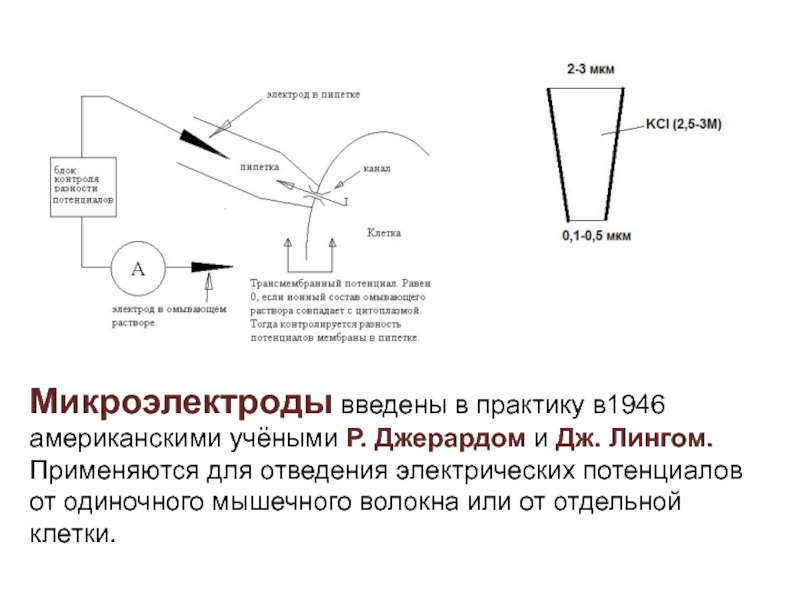
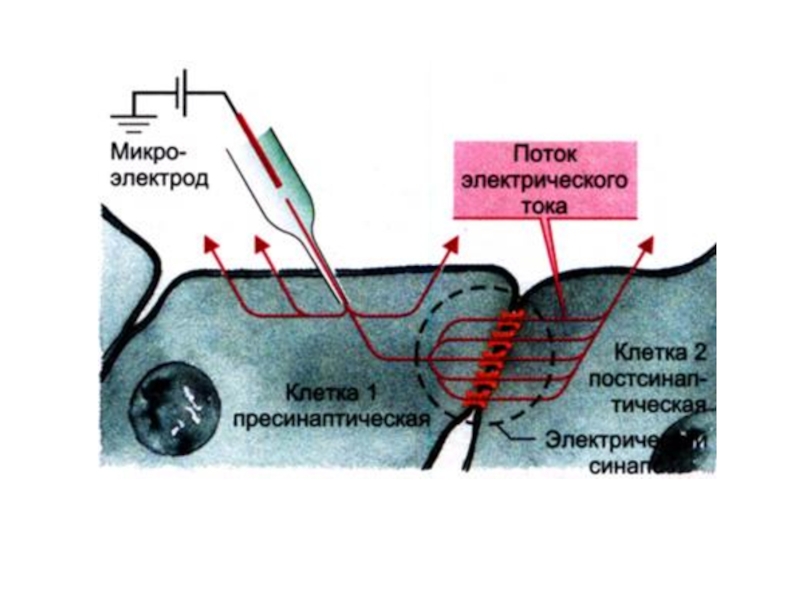
- 18. Микроэлектроды введены в практику в1946 американскими учёными
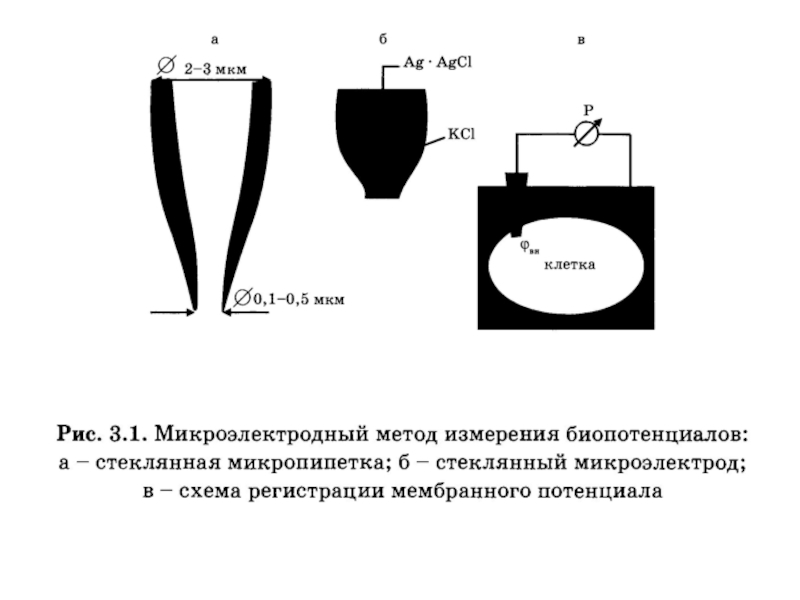
- 19. Микроэлектрод - тонкий стеклянный капилляр, кончик которого
- 20. Слайд 20
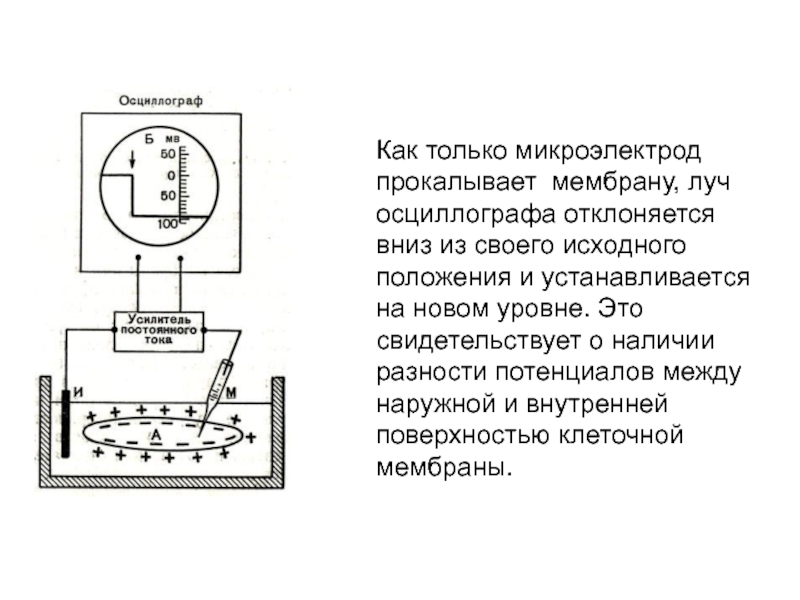
- 21. Как только микроэлектрод прокалывает мембрану, луч осциллографа
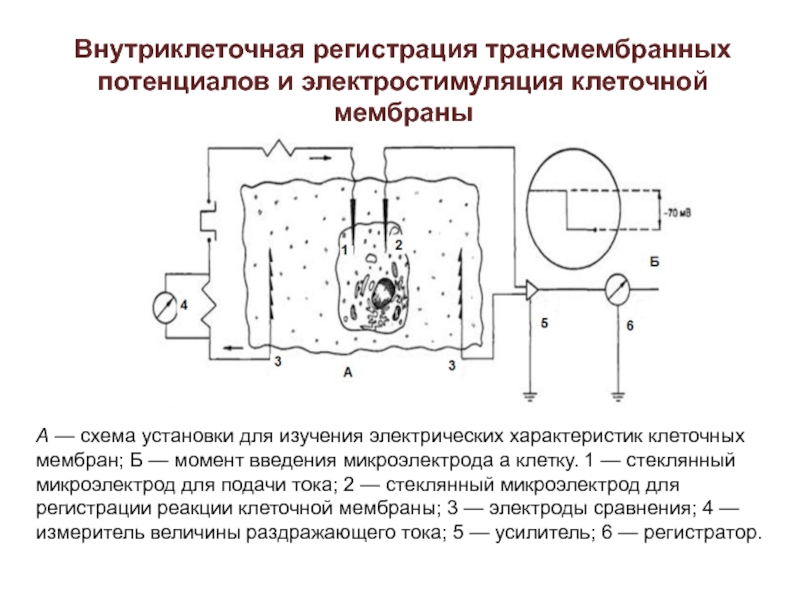
- 22. Внутриклеточная регистрация трансмембранных потенциалов и электростимуляция клеточной
- 23. В лабораторных исследованиях используются металлические микроэлектроды с
- 24. Слайд 24
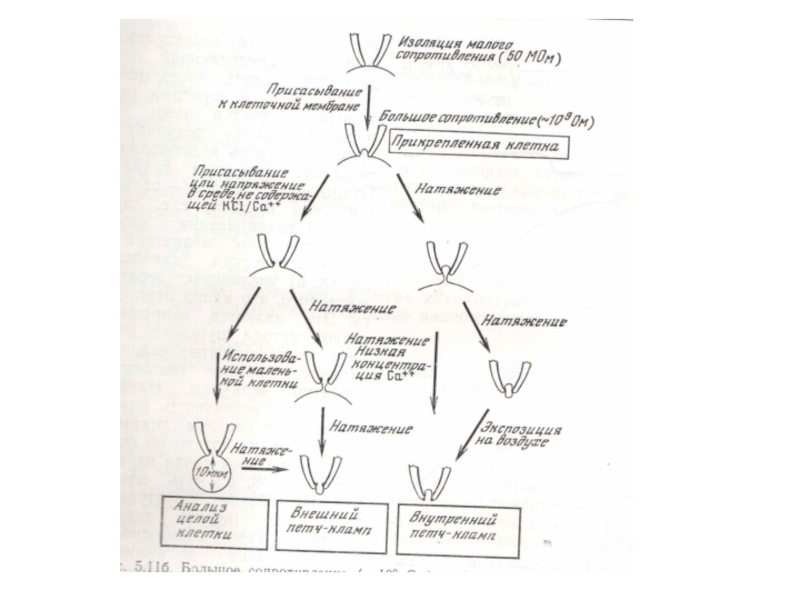
- 25. Метод пэтч-кламп (метод локальной фиксации потенциала) введен в лабораторную практику Э. Неером и Б. Сакманом в 1976 г.
- 26. Клеточная мембрана формирует очень плотный контакт с
- 27. Слайд 27
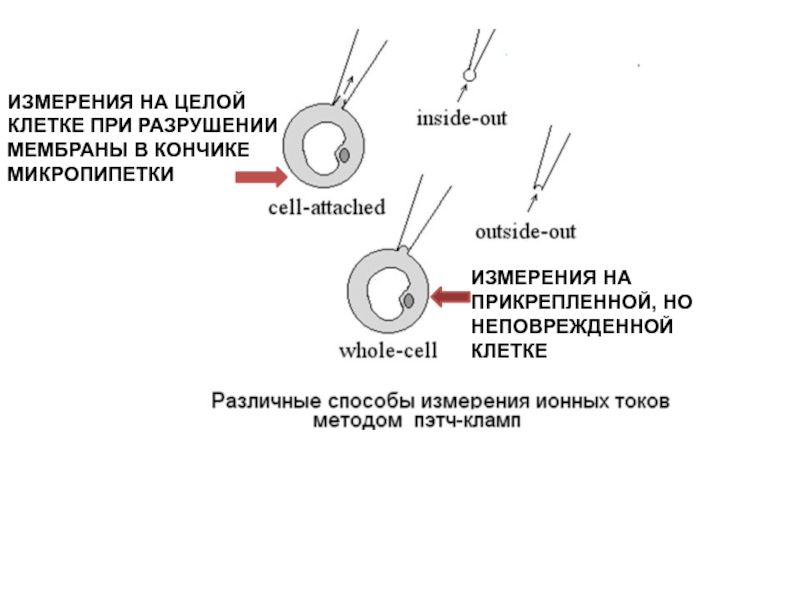
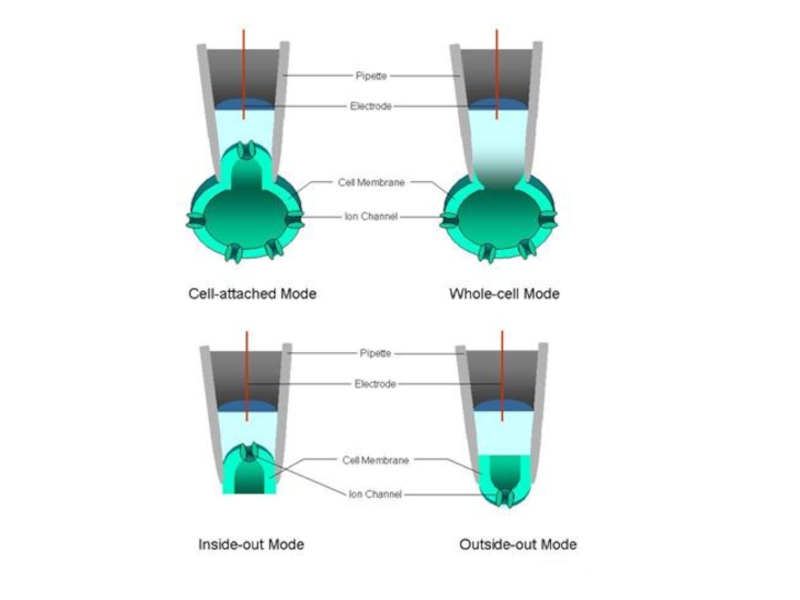
- 28. ИЗМЕРЕНИЯ НА ПРИКРЕПЛЕННОЙ, НО НЕПОВРЕЖДЕННОЙ КЛЕТКЕИЗМЕРЕНИЯ НА ЦЕЛОЙ КЛЕТКЕ ПРИ РАЗРУШЕНИИ МЕМБРАНЫ В КОНЧИКЕ МИКРОПИПЕТКИ
- 29. Слайд 29
- 30. Слайд 30
- 31. Мембранная теория возбуждения: при раздражении возбудимой клетки
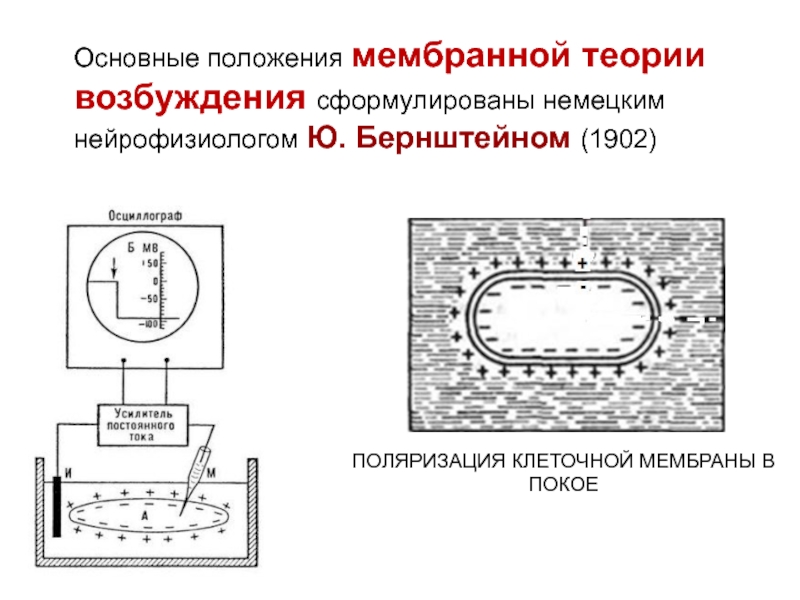
- 32. Основные положения мембранной теории возбуждения сформулированы немецким нейрофизиологом Ю. Бернштейном (1902) ПОЛЯРИЗАЦИЯ КЛЕТОЧНОЙ МЕМБРАНЫ В ПОКОЕ
- 33. Развитие мембранной теории возбуждения получило в трудах
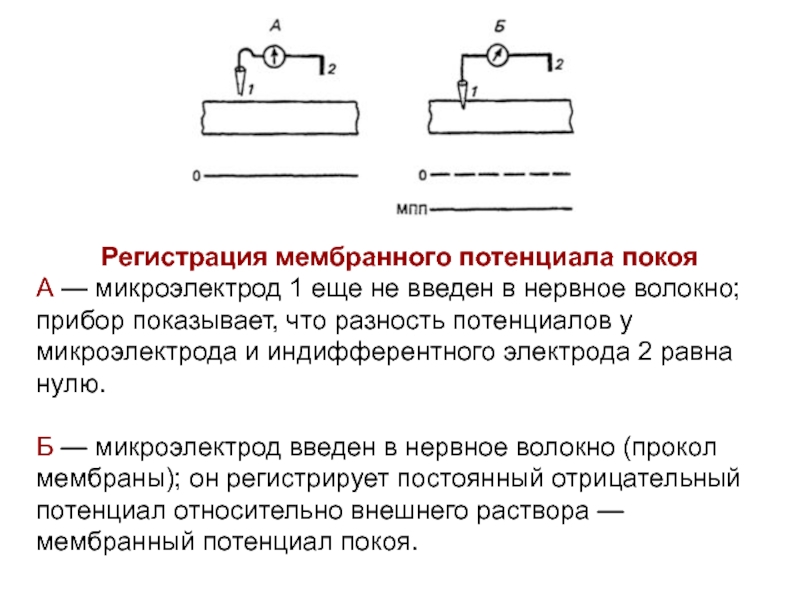
- 34. Регистрация мембранного потенциала покоя А — микроэлектрод 1
- 35. Потенциал покоя, механизм его формирования
- 36. Предположение Бернштейна:поверхностная мембрана возбудимой клетки в покое
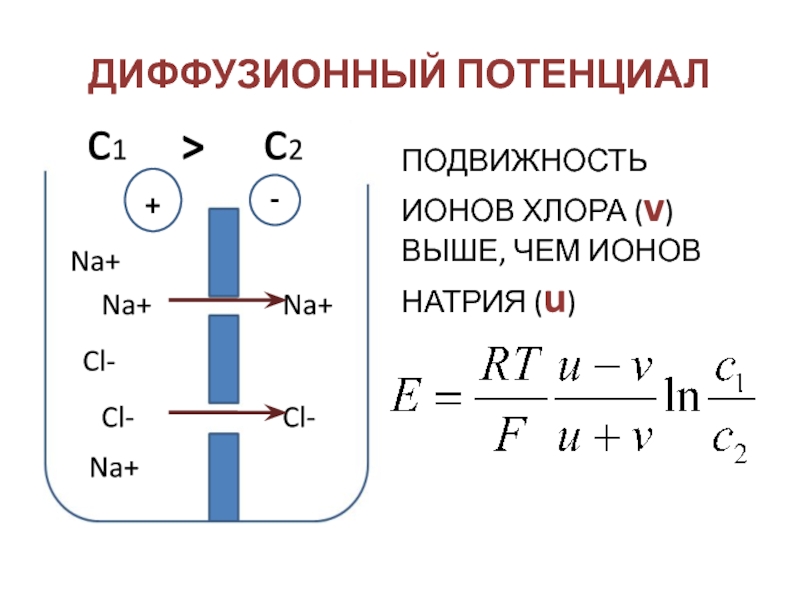
- 37. ДИФФУЗИОННЫЙ ПОТЕНЦИАЛNa+Na+Na+Na+Cl-Cl-Cl-+-ПОДВИЖНОСТЬ ИОНОВ ХЛОРА (v) ВЫШЕ, ЧЕМ ИОНОВ НАТРИЯ (u)
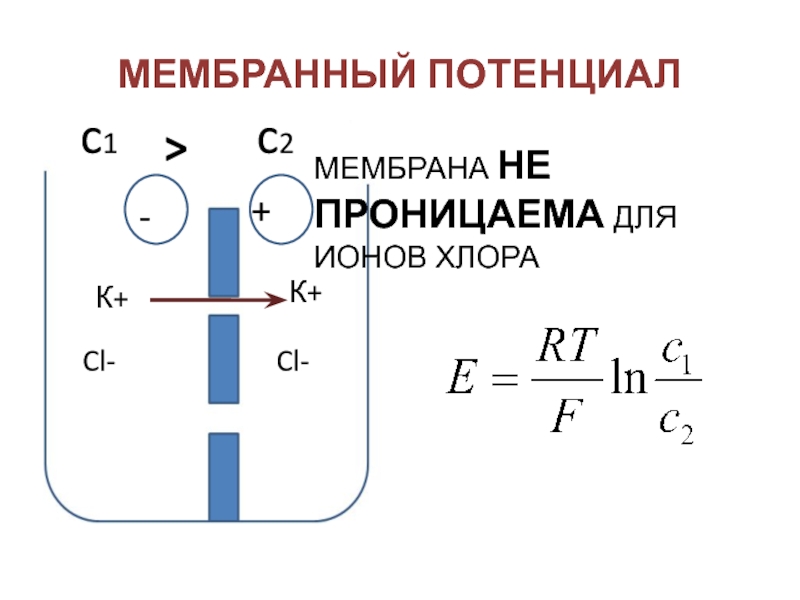
- 38. МЕМБРАННЫЙ ПОТЕНЦИАЛCl-Cl-К+К+МЕМБРАНА НЕ ПРОНИЦАЕМА ДЛЯ ИОНОВ ХЛОРА-+
- 39. ЭЛЕКТРОХИМИЧЕСКИЙ ПОТЕНЦИАЛУСЛОВИЕ РАВНОВЕСИЯРАВНОВЕСНЫЕ ПОТЕНЦИАЛЫ:ENa=+35…+65 мВEK = -70…-100 мВ
- 40. Возникновение электрохимического равновесия на полупроницаемой мембране. Диффузионное
- 41. состояние равновесия наступает в результате диффузии лишь
- 42. Слайд 42
- 43. Зависимость мембранного потенциала (МП) нервного волокна каракатицы
- 44. Зависимость величины ПП от [K+]е (расчетная и
- 45. Слайд 45
- 46. Слайд 46
- 47. А - структуры мембраны, формирующие потенциал покоя Б - измерительная схема. В - потенциал покоя
- 48. А: мембрана клетки, канал утечки, Nа+-канал, К+-канал
- 49. УРАВНЕНИЕ НЕРНСТАЗдесь и далее индекс «е» относится
- 50. Слайд 50
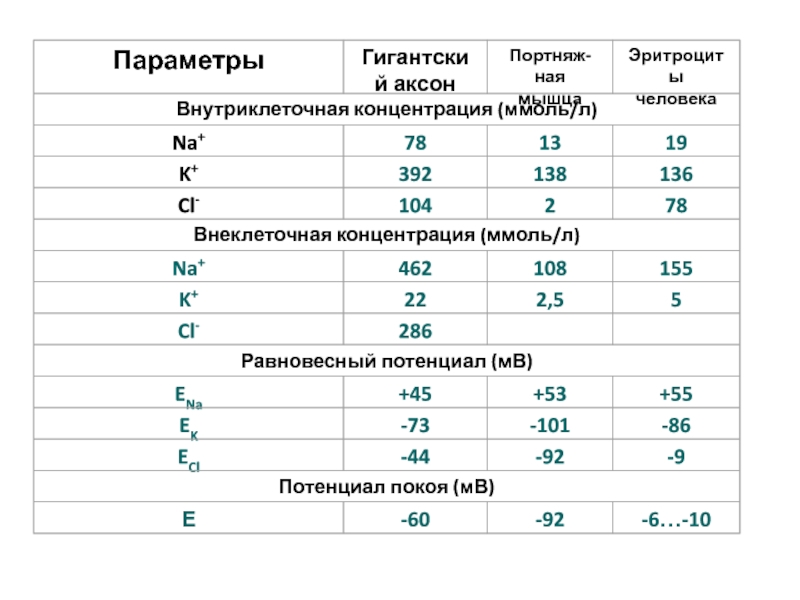
- 51. ПП гигантского аксона кальмара ( - 70
- 52. Итоговая величина ПП, обусловленного переносом многих ионов может быть достаточно точно рассчитана по формуле Гольдмана.
- 53. УРАВНЕНИЕ ГОЛЬДМАНАPK : PNa: PCl = 1
- 54. Вклад активного транспорта в формирование потенциала покоя
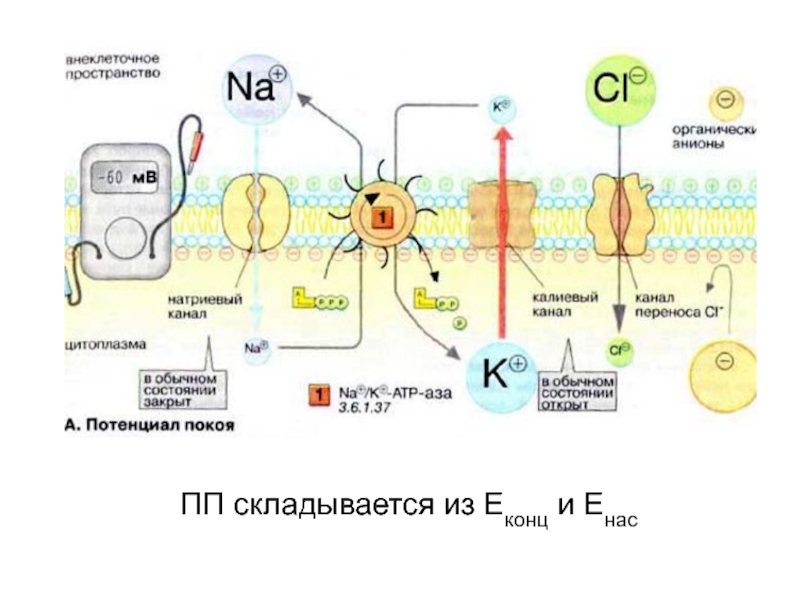
- 55. ПП складывается из Еконц и Енас
- 56. РОЛЬ Na/K НАСОСА В ГЕНЕРАЦИИ ПППоддержание высокой
- 57. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Раздражимость и возбудимость клеток и тканей. Методы исследования электровозбудимых мембран. Потенциал покоя
и механизм его формирования
Слайд 4Мера возбудимости – порог раздражения, т.е. минимальная сила раздражителя, вызывающая
ответ.
ВОЗБУЖДЕНИЕ – сложный биологический процесс, который характеризуется специфическим изменением обмена
веществ, временной деполяризацией мембраны клеток и проявляющейся специализированной реакцией ткани.Слайд 6РАЗДРАЖИТЕЛИ
ФИЗИЧЕСКИЕ (механические, звуковые, световые, температурные, электрические)
ХИМИЧЕСКИЕ (щелочи, кислоты, гормоны, продукты
обмена веществ)
ФИЗИКО-ХИМИЧЕСКИЕ (изменения осмотического давления, рН и т.п.)
Слайд 12ПРОГРЕСС В ИССЛЕДОВАНИИ БИОПОТЕНЦИАЛОВ ОБЕСПЕЧЕН
РАЗРАБОТКОЙ МИКРОЭЛЕКТРОДНОГО МЕТОДА ВНУТРИКЛЕТОЧНОГО ОТВЕДЕНИЯ ПОТЕНЦИАЛОВ
СОЗДАНИЕМ
СПЕЦИАЛЬНЫХ УСИЛИТЕЛЕЙ БИОПОТЕНЦИАЛОВ
ВЫБОРОМ УДАЧНЫХ ОБЪЕКТОВ ИССЛЕДОВАНИЯ
Слайд 15ОСНОВНЫЕ ЭЛЕМЕНТЫ УСТАНОВКИ ДЛЯ ИЗУЧЕНИЯ ВОЗБУДИМЫХ КЛЕТОК И ТКАНЕЙ
1) электроды
для регистрации и стимуляции;
2) усилители биоэлектрических сигналов;
3) регистратор;
4) стимулятор;
5) система для обработки физиологической информации.
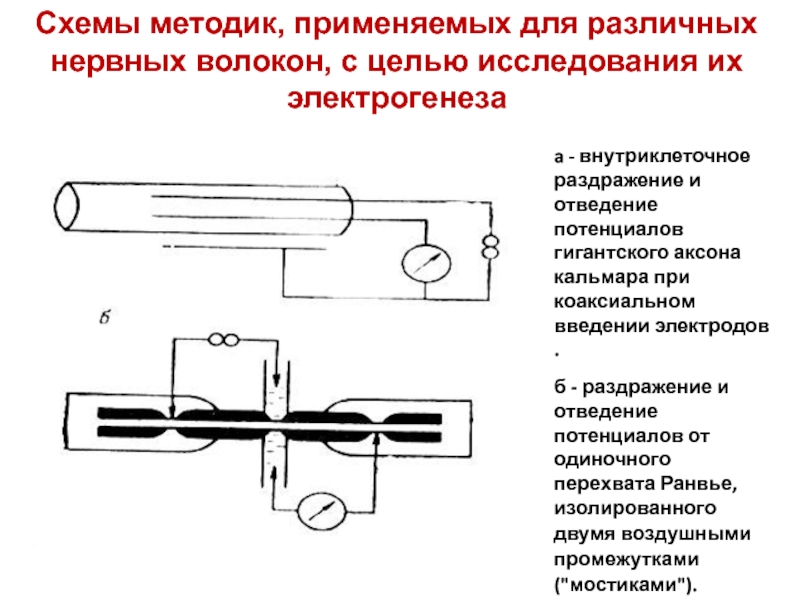
Слайд 16a - внутриклеточное раздражение и отведение потенциалов гигантского аксона кальмара
при коаксиальном введении электродов .
б - раздражение и отведение
потенциалов от одиночного перехвата Ранвье, изолированного двумя воздушными промежутками ("мостиками"). Схемы методик, применяемых для различных нервных волокон, с целью исследования их электрогенеза
Слайд 17НЕПОЛЯРИЗУЮЩИЕСЯ ЭЛЕКТРОДЫ: хлорсеребряный электрод
ХЛОРСЕРЕБРЯНЫЙ ЭЛЕКТРОД: серебряная пластинка (проволока), покрытая слоем
малорастворимой соли серебра и опущенная в насыщенный раствор хлорида калия.
Часто
используется, т.к. имеет стабильный потенциал, а также простую конструкцию. Слайд 18Микроэлектроды введены в практику в1946 американскими учёными Р. Джерардом и
Дж. Лингом.
Применяются для отведения электрических потенциалов от одиночного мышечного
волокна или от отдельной клетки. Слайд 19Микроэлектрод - тонкий стеклянный капилляр, кончик которого имеет диаметр около
1 мкм, заполненный солевым раствором с погруженным в него металлическим
электродом..
Стеклянные микроэлектроды:
А - одноканальный;
Б - двухканальный;
справа- кончик микроэлектрода около тела нейрона
Слайд 21Как только микроэлектрод прокалывает мембрану, луч осциллографа отклоняется вниз из
своего исходного положения и устанавливается на новом уровне. Это свидетельствует
о наличии разности потенциалов между наружной и внутренней поверхностью клеточной мембраны.Слайд 22Внутриклеточная регистрация трансмембранных потенциалов и электростимуляция клеточной мембраны
А — схема
установки для изучения электрических характеристик клеточных мембран; Б — момент
введения микроэлектрода а клетку. 1 — стеклянный микроэлектрод для подачи тока; 2 — стеклянный микроэлектрод для регистрации реакции клеточной мембраны; 3 — электроды сравнения; 4 — измеритель величины раздражающего тока; 5 — усилитель; 6 — регистратор.Слайд 23
В лабораторных исследованиях используются
металлические микроэлектроды с диаметром кончика порядка
1 мкм;
стеклянные микропипетки с диаметром кончика меньше 1 мкм,
заполненные раствором электролита.Слайд 25Метод пэтч-кламп (метод локальной фиксации потенциала) введен в лабораторную практику Э. Неером и
Б. Сакманом в 1976 г.
Слайд 26Клеточная мембрана формирует очень плотный контакт с поверхностью кончика микроэлектрода.
Между стеклом и мембранным фрагментом возникает контакт, имеющий гигаомное сопротивление.
В результате образуется электрически изолированный участок мембраны, и шум регистрирующего сигнала уменьшается на несколько порядков. К участку прикладывается напряжение и меряется возникший ионный ток.Слайд 28ИЗМЕРЕНИЯ НА ПРИКРЕПЛЕННОЙ, НО НЕПОВРЕЖДЕННОЙ КЛЕТКЕ
ИЗМЕРЕНИЯ НА ЦЕЛОЙ КЛЕТКЕ ПРИ
РАЗРУШЕНИИ МЕМБРАНЫ В КОНЧИКЕ МИКРОПИПЕТКИ
Слайд 31Мембранная теория возбуждения:
при раздражении возбудимой клетки в её поверхностной
мембране происходит молекулярная перестройка, которая приводит к изменению проницаемости мембраны
и появлению трансмембранных ионных токов.Слайд 32Основные положения мембранной теории возбуждения сформулированы немецким нейрофизиологом Ю. Бернштейном
(1902)
ПОЛЯРИЗАЦИЯ КЛЕТОЧНОЙ МЕМБРАНЫ В ПОКОЕ
Слайд 33Развитие мембранной теории возбуждения получило в трудах английских учёных: П.
Бойла и Э. Конуэя (1941), А. Ходжкина, Б. Каца, А.
Хаксли (1949).А. ХОДЖКИН
А. Хаксли
Нобелевская премия по физиологии и медицине, 1963 г
"За открытия, касающиеся ионных механизмов возбуждения и торможения в периферических и центральных участках мембраны нервных клеток"
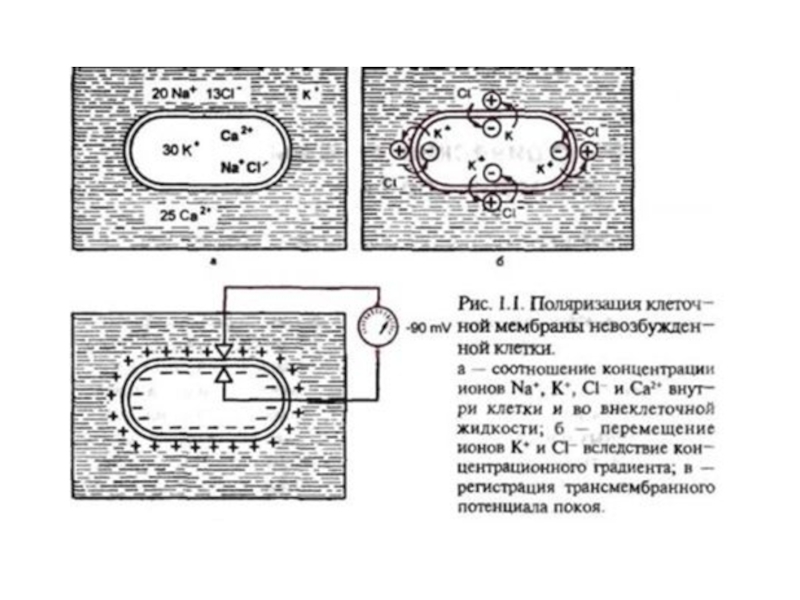
Слайд 34Регистрация мембранного потенциала покоя
А — микроэлектрод 1 еще не введен
в нервное волокно; прибор показывает, что разность потенциалов у микроэлектрода
и индифферентного электрода 2 равна нулю.Б — микроэлектрод введен в нервное волокно (прокол мембраны); он регистрирует постоянный отрицательный потенциал относительно внешнего раствора — мембранный потенциал покоя.
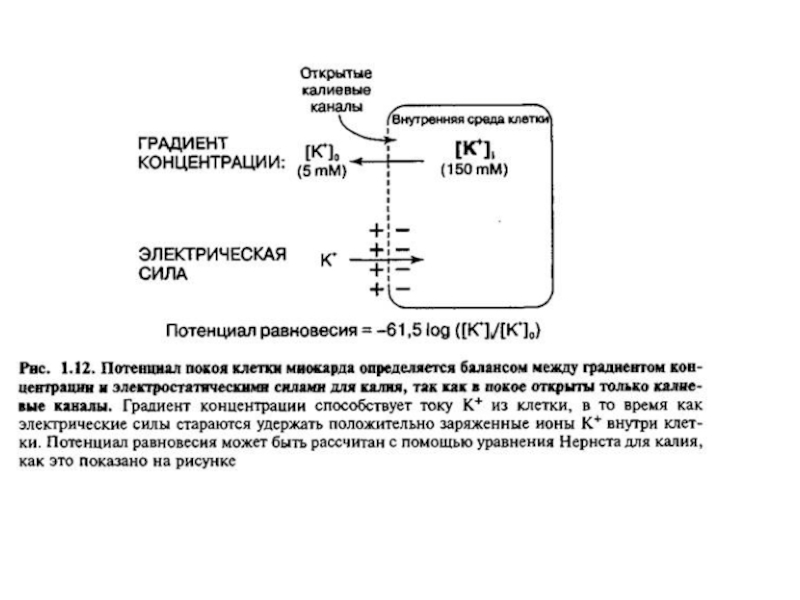
Слайд 36Предположение Бернштейна:
поверхностная мембрана возбудимой клетки в покое обладает избирательной проницаемостью:
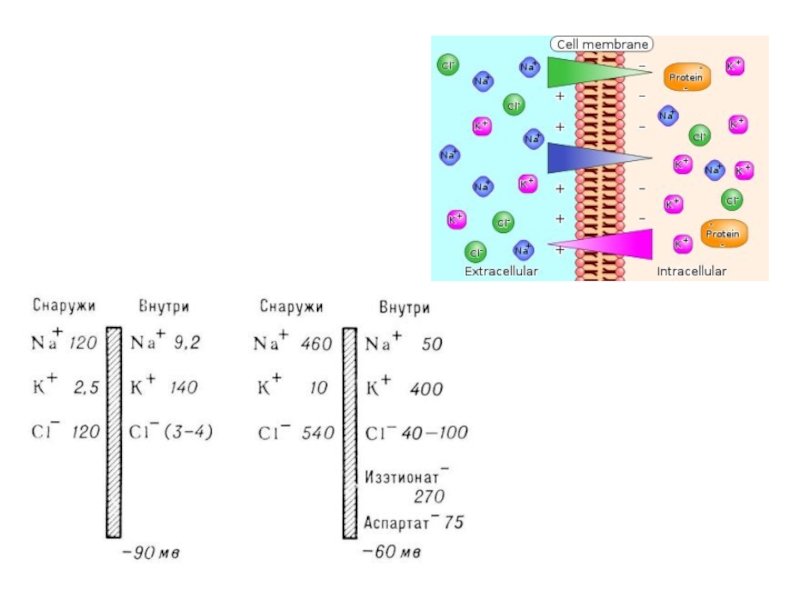
ионы K+ проходят через неё гораздо легче, чем ионы Na+
и Cl-.Т. к. концентрация K+ в клетке выше, чем во внеклеточной среде, диффузия этих ионов через мембрану создаёт на ней разность потенциалов —потенциал покоя (ПП), причём внутренняя сторона мембраны оказывается заряженной отрицательно, а внешняя — положительно.
Слайд 37ДИФФУЗИОННЫЙ ПОТЕНЦИАЛ
Na+
Na+
Na+
Na+
Cl-
Cl-
Cl-
+
-
ПОДВИЖНОСТЬ ИОНОВ ХЛОРА (v) ВЫШЕ, ЧЕМ ИОНОВ НАТРИЯ (u)
Слайд 39ЭЛЕКТРОХИМИЧЕСКИЙ ПОТЕНЦИАЛ
УСЛОВИЕ РАВНОВЕСИЯ
РАВНОВЕСНЫЕ ПОТЕНЦИАЛЫ:
ENa=+35…+65 мВ
EK = -70…-100 мВ
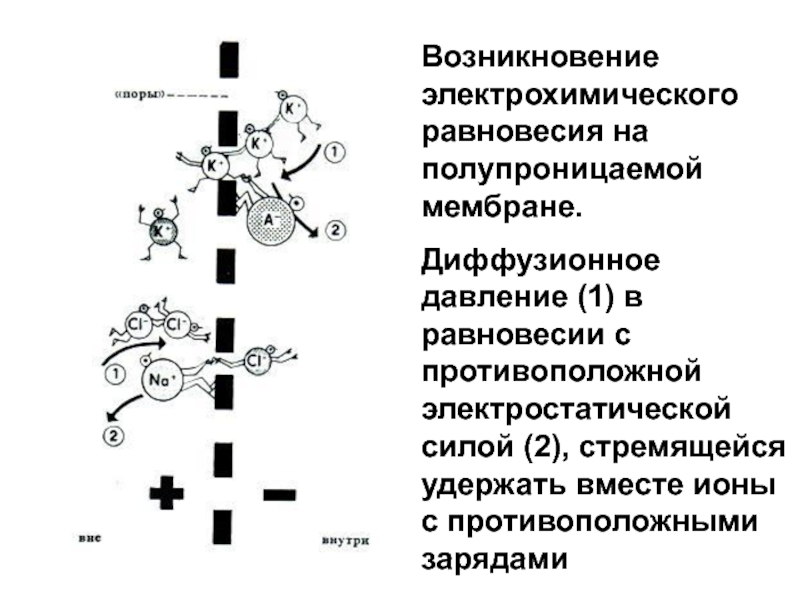
Слайд 40Возникновение электрохимического равновесия на полупроницаемой мембране.
Диффузионное давление (1) в
равновесии с противоположной электростатической силой (2), стремящейся удержать вместе ионы
с противоположными зарядамиСлайд 41состояние равновесия наступает в результате диффузии лишь очень небольшого количества
ионов (по сравнению с их общим содержанием);
калиевый равновесный потенциал всегда
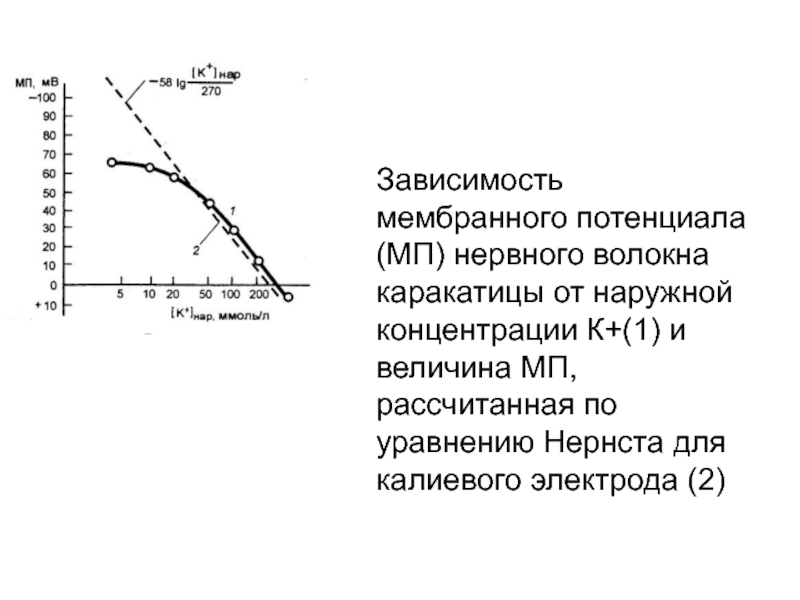
больше (по абсолютному значению) реального потенциала покояСлайд 43Зависимость мембранного потенциала (МП) нервного волокна каракатицы от наружной концентрации
К+(1) и величина МП, рассчитанная по уравнению Нернста для калиевого
электрода (2)Слайд 44Зависимость величины ПП от [K+]е (расчетная и экспериментальная кривые).
По
оси абсцисс – содержание калия во внешней среде в мМ,
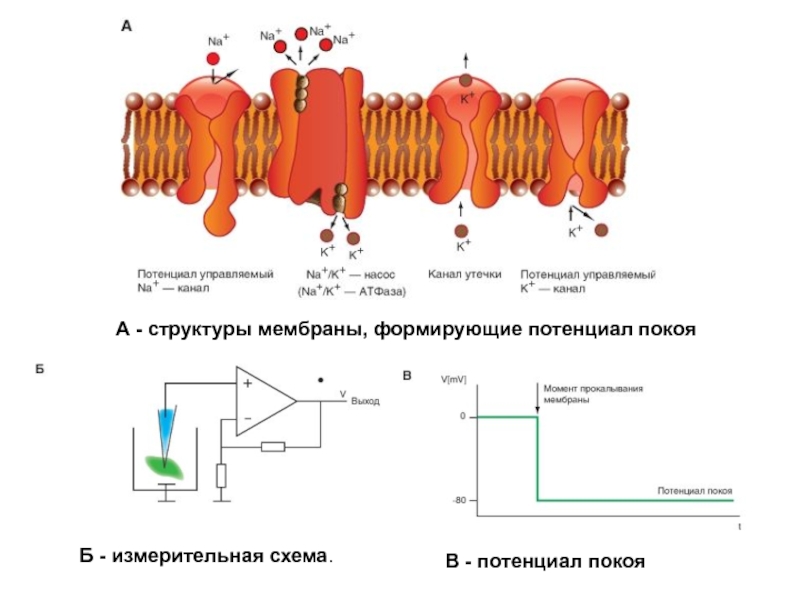
по оси ординат – величина мембранного потенциала в мВ.Слайд 47А - структуры мембраны, формирующие потенциал покоя
Б - измерительная
схема.
В - потенциал покоя
Слайд 48А: мембрана клетки, канал утечки, Nа+-канал, К+-канал и -АТФаза, которая
выкачивает ионы Na+ из клетки против его электрохимического градиента, одновременно вводя
ионы K+ в клетку также против его электрохимического градиента.Каналы утечки, через которые осуществляется очень незначительный вход ионов Na+ в клетку и превышающий его в 100 раз выход ионов К+ из клетки.
За счет каналов утечки и работы Na+/K+-АТФазы возникает негативный внутриклеточный потенциал мембраны клетки - потенциала покоя.
Слайд 49УРАВНЕНИЕ НЕРНСТА
Здесь и далее индекс «е» относится к внешним концентрациям
ионов, а индекс «i» - ко внутренним.
Слайд 51ПП гигантского аксона кальмара ( - 70 мВ) близок к
его Ек ( - 75 мВ), но не равен ему.
ПРИЧИНА:ПП
формирует утечка и других ионов: Na+, Cl-. При этом поступление Сl- в аксон, (Еcl> - 70 мВ) повышает, a Na+ понижает ПП (ENa=+55MB).
Слайд 52Итоговая величина ПП, обусловленного переносом многих ионов может быть достаточно
точно рассчитана по формуле Гольдмана.
Слайд 53УРАВНЕНИЕ ГОЛЬДМАНА
PK : PNa: PCl = 1 : 0,04 :
0,45
Соотношение проницаемостей потенциалообразующих ионов в состоянии покоя
Слайд 56РОЛЬ Na/K НАСОСА В ГЕНЕРАЦИИ ПП
Поддержание высокой концентрации К+ внутри
клетки, что обеспечивает постоянство величины ПП. Электрогенность насоса: вклад в
ПП.Поддержание низкой концентрации Na+ внутри клетки, что, с одной стороны, обеспечивает генерацию потенциала действия, с другой — обеспечивает сохранение нормальных осмолярности и объема клетки.






















![Раздражимость и возбудимость клеток и тканей. Методы исследования Зависимость величины ПП от [K+]е (расчетная и экспериментальная кривые). По оси Зависимость величины ПП от [K+]е (расчетная и экспериментальная кривые). По оси абсцисс – содержание калия во внешней](/img/thumbs/45ece6587b3773919a3da7f62863d971-800x.jpg)