Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Различные теории кислот и оснований
Содержание
- 1. Различные теории кислот и оснований
- 2. Различные теории кислот и основанийКислоты и основания.
- 3. Различные теории кислот и основанийТеории кислот и
- 4. Различные теории кислот и основанийТеория электролитической диссоциации
- 5. Различные теории кислот и основанийИонная теория кислот
- 6. Различные теории кислот и основанийПримеры. Кислота –
- 7. Различные теории кислот и основанийОбласть применимости. Ионная
- 8. Различные теории кислот и основанийСольвентная теория (теория
- 9. Различные теории кислот и основанийСольвентная теория (теория
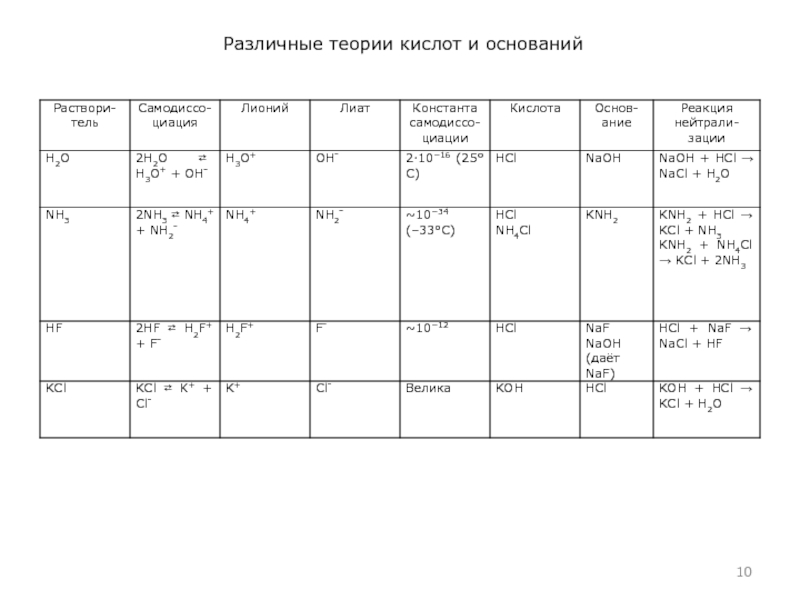
- 10. Различные теории кислот и оснований
- 11. Различные теории кислот и основанийКоличественные характеристики и
- 12. Различные теории кислот и основанийПротолитическая (протонная) теория
- 13. Различные теории кислот и основанийНапример, вода при
- 14. Различные теории кислот и основанийЭлектронная теория Г.Льюиса
- 15. Различные теории кислот и основанийКислота Льюиса –
- 16. Различные теории кислот и основанийПримеры химических реакций
- 17. Различные теории кислот и основанийВ случае взаимодействия
- 18. Различные теории кислот и основанийОбщая теория М.И. Усановича
- 19. Различные теории кислот и основанийОбщая теория М.И. Усановича
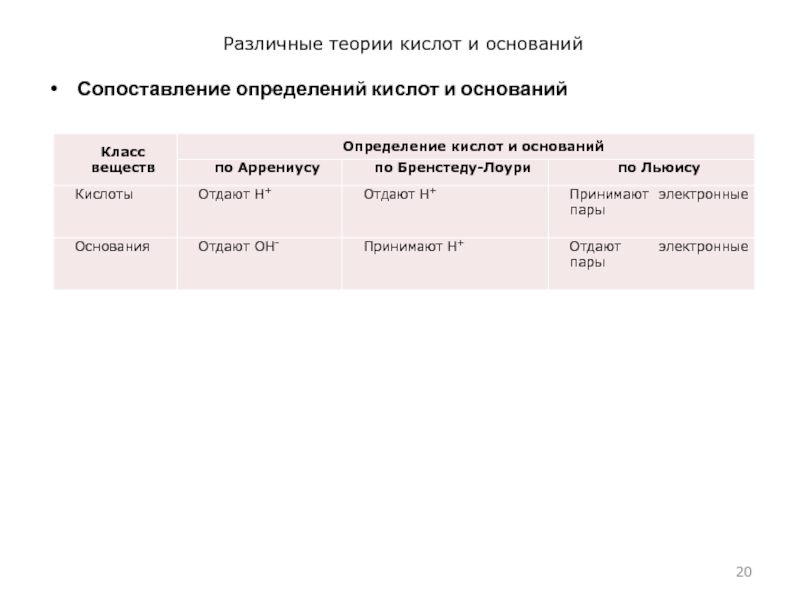
- 20. Различные теории кислот и основанийСопоставление определений кислот и оснований
- 21. Различные теории кислот и основанийСуперкислота (или сверхкислота)
- 22. Различные теории кислот и основанийКарборановая кислота –
- 23. Различные теории кислот и основанийМагические кислоты (Magic
- 24. Различные теории кислот и основанийСВЕРХОСНОВА́НИЯ (супероснования), вещества,
- 25. Скачать презентанцию
Различные теории кислот и основанийКислоты и основания. Термины «кислоты» и «основания» вполне сформировались в 17 в. Их содержание неоднократно пересматривалось и дополнялось. Этот процесс происходил и происходит в острых столкновениях представителей разных
Слайды и текст этой презентации
Слайд 1
Различные теории кислот и оснований
Знание, информация, власть, слова… Невидимые, они
летели по воздуху…
Слайд 2Различные теории кислот и оснований
Кислоты и основания. Термины «кислоты» и
«основания» вполне сформировались в 17 в. Их содержание неоднократно пересматривалось и
дополнялось. Этот процесс происходил и происходит в острых столкновениях представителей разных взглядов на природу кислот и оснований.Развитие взглядов на кислоты и основания
А. Лавуазье (1778) объяснял свойства кислот наличием в них кислорода («кислородная теория» кислот). Однако скоро выяснилось, что очень многие кислородсодержащие вещества (оксиды металлов, соли и др.) не обладают кислотными свойствами, а ряд типичных кислот, например соляная, не содержат кислорода (Г. Дэви и Ж. Гей-Люссак 1810, 1814).
Й. Берцелиус (1802–19) устранил первое из этих противоречий, приписав оксидам знак электрического заряда. Электроотрицательные (по Берцелиусу) оксиды неметаллов образуют кислоты, электроположительные оксиды металлов – основания.
В 1814 Г. Дэви высказал мнение, что атом водорода – необходимая составная часть кислот.
Ю. Либих (1833) уточнил эту «водородную теорию» кислот, показав, что кислотные свойства обусловлены не любым атомом водорода, а лишь тем, который способен замещаться металлом.
Слайд 3Различные теории кислот и оснований
Теории кислот и оснований – совокупность
фундаментальных физико-химических представлений, описывающих природу и свойства кислот и оснований.
Все они вводят определения кислот и оснований – двух классов веществ, реагирующих между собой. Задача теории – предсказание продуктов реакции между кислотой и основанием и возможности её протекания, для чего используются количественные характеристики силы кислоты и основания. Различия между теориями лежат в определениях кислот и оснований, характеристики их силы и, как следствие – в правилах предсказания продуктов реакции между ними. Все они имеют свою область применимости, каковые области частично пересекаются.Кислотно-основные взаимодействия чрезвычайно распространены в природе и находят широкое применение в научной и производственной практике. Теоретические представления о кислотах и основаниях имеют важное значение в формировании всех концептуальных систем химии и оказывают разностороннее влияние на развитие многих теоретических концепций во всех основных химических дисциплинах.
На основе современной теории кислот и оснований разработаны такие разделы химических наук, как химия водных и неводных растворов электролитов, рН-метрия в неводных средах, гомо- и гетерогенный кислотно-основный катализ, теория функций кислотности и многие другие.
Слайд 4Различные теории кислот и оснований
Теория электролитической диссоциации С. Аррениуса (1887)
1. Электролиты при
растворении в воде распадаются (диссоциируют) на ионы – положительные и
отрицательные. Ионы находятся в более устойчивых электронных состояниях, чем атомы. Они могут состоять из одного атома – это простые ионы (Na+, Mg2+, Аl3+ и т.д.) – или из нескольких атомов – это сложные ионы (NО3⎺, SO42−, РО43− и т.д.).2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные – к аноду. Поэтому первые называются катионами, вторые – анионами. Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами.
3. Диссоциация – обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация).
После появления теории электролитической диссоциации С. Аррениуса (1887) сформировалась ионная теория кислот и оснований.
Слайд 5Различные теории кислот и оснований
Ионная теория кислот и оснований (теория
Оствальда).
Согласно данной теории, кислота – водородсодержащее соединения, при электролитической
диссоциации которого в воде образуются ионы водорода и анионы, а основание – соединение, диссоциирующее с отщеплением ионов ОН⎺ и катионов. В дальнейшем появились различные варианты обобщения ионной теории кислот и оснований применительно к неводным растворителям. Эти варианты не противоречат, а дополняют друг друга, большинство их используется и разрабатывается в настоящее время.Определения. Кислоты – это вещества, образующие в водном растворе гидратированные катионы водорода Н+ (ионы гидроксония) и анионы кислотного остатка.
Основания – вещества, диссоциирующие в водном растворе с образованием катионов металла или аммония и гидроксид-анионов ОН⎺.
Соли – вещества, диссоциирующие с образованием катиона металла или аммония и аниона кислотного остатка.
Продукты реакции. В реакции кислоты с основанием (реакция нейтрализации) образуется соль и вода.
Слайд 6Различные теории кислот и оснований
Примеры. Кислота – HCl (кислотный остаток
Cl⎺): HCl + H2O ⇄ H3O+ + Cl⎺
Основание –
NaOH: NaOH ⇄ Na+ + OH⎺ Реакция нейтрализации (соль – NaCl): HCl + NaOH NaCl + H2O
Критерии протекания реакции. Сильные кислоты реагируют с сильными основаниями. Чем слабее кислота, тем более сильное основание нужно для реакции.
Количественные характеристики. Сила кислоты и основания характеризуются их константами диссоциации Ka и Kb.
Для кислоты HA
HA ⇄ H+ + A⎺ Ka = [H+][A⎺]/[HA]
Для основания BOH
BOH ⇄ B+ + OH⎺
Kb = [B+][OH⎺]/[BOH]
Чтобы прошла реакция между кислотой и основанием, произведение их констант диссоциации должно быть больше, чем 10−14 (ионное произведение воды).
Слайд 7Различные теории кислот и оснований
Область применимости.
Ионная теория вполне удовлетворительно
описывает реакции достаточно сильных кислот и оснований друг с другом
и свойства их водных растворов. На основе представлений о степени и константе диссоциации было закреплено деление электролитов на сильные и слабые, введено понятие водородного показателя, распространение которого на щелочные среды требует, однако, дополнительных допущений (введения ионного произведения воды).Теорию можно применять для описания гидролиза солей и реакции кислот и оснований с солями, однако при этом требуется весьма громоздкий аппарат – протонная теория гораздо удобнее.
Теории Аррениуса и Оствальда объединили в теорию Аррениуса-Оствальда
Применимость теории Аррениуса-Оствальда ограничивается водными растворами. Кроме того, она не позволяет объяснить наличие основных свойств аммиака, фосфина и других соединений, не содержащих гидроксогрупп.
Слайд 8Различные теории кислот и оснований
Сольвентная теория (теория сольвосистем) (1924)
Э. Франклином в
1924 г. создана сольвентная теория. По этой теории, кислоты и
основания – вещества, при растворении которых увеличивается концентрация соответствующих катионов и анионов, образующихся при диссоциации растворителя. В этом случае кислотно-основное взаимодействий выражается схемой:кислота + основание соль + растворитель
Сольвентная теория способствовала исследованию кислот и оснований в неводных растворах.
Теория сольвосистем – расширение теории Аррениуса-Оствальда на другие ионные (в частности, протонные растворители). Предложена американскими химиками Г. Кэди, Э. Франклин и Ч. Краусом.
Определения. Ионный растворитель – растворитель, самодиссоциирующий на катион и анион. Катион при этом называется ионом лиония, а анион – ионом лиата. Протонный растворитель – растворитель, способный к автопротолизу, то есть передаче иона H+ от одной молекулы к другой:
2HL ⇄ H2L+ + L⎺
Это растворители, содержащие достаточно полярную связь с участием водорода и неподеленную электронную пару на каком-либо другом неметалле (чаще всего, азоте, кислороде или фторе).
Слайд 9Различные теории кислот и оснований
Сольвентная теория (теория сольвосистем) (1924)
Примечание: в
данном определении «зашита» протонная теория, ибо автопротолиз есть кислотно-основная реакция
по Брёнстеду-Лоури. В нём также «зашита» теория Льюиса, поскольку именно она объясняет причины образования ионов лиония.Ион H2L+ при этом называется ионом лиония, а L⎺ – ионом лиата.
Кислоты – это вещества, образующие в данном растворителе ион лиония.
Основания – вещества, образующие в данном растворителе ион лиата.
Соли – вещества, диссоциирующие в данном растворителе с образованием катиона и аниона, не являющихся лионием и лиатом.
Продукты реакции. В реакции кислоты с основанием (реакция нейтрализации образуется соль и растворитель.
Слайд 11Различные теории кислот и оснований
Количественные характеристики и критерии протекания реакции.
Силы кислот и оснований характеризуются их константой диссоциации. Константы диссоциации
зависят от растворителя. Протонные растворители с высоким константами автодиссоциации («кислотные растворители», например HF) дифференцируют кислоты (в них кислоты становятся слабыми и различающимися по силе), но нивелируют основания (все основания становятся сильными, правращаясь в ион лиата). Протонные растворители с низкими константами автодиссоциации («основные растворители», например NH3) дифференцируют основания, но нивелируют кислоты (которые становятся сильными, превращаясь в лионий).Реакция идёт от сильных кислот к слабым.
Область применимости. Позволяет предсказывать кислотно-основные реакции в любых растворителях. Управление кислотно-основными процессами при помощи растворителя. Расширяет на неводные растворы понятие водородного показателя (pH) как концентрацию ионов лиония. Описывает основные свойства веществ, не содержащих групп ОН.
Однако для многих задач теория слишком громоздкая.
Специфические черты Некоторые кислотно-основные реакции в этой теории могут встать «с ног на голову», например, в расплавленном KCl:
KOH (кислота) + HCl (основание) = KCl (растворитель) + H2O (соль)
Слайд 12Различные теории кислот и оснований
Протолитическая (протонная) теория Й.Брёнстеда и Т.Лоури
(1923)
Была предложена в 1923 году независимо друг от друга датским
учёным Й. Брёнстедом и английским учёным Т. Лоури. В ней понятие о кислотах и основаниях было объединено в единое целое, проявляющееся в кислотно-основном взаимодействии (А – кислота, В – основание): A B + H+ (кислота основание + Н+)
По Брёнстеду, кислота – донор протона, а основание – акцептор его. По этой теории, кислота и основание составляют сопряженную пару и связаны уравнением:
Слайд 13Различные теории кислот и оснований
Например, вода при взаимодействии с протоном
H2O + H+ = H3О+ является основанием, а реагируя с
аммиаком NH3 + H2O = NH4+ + OH⎺ – является кислотой.Согласно этой теории кислотами являются молекулы или ионы, способные быть в данной реакции донорами протонов, а основаниями являются молекулы или ионы, присоединяющие протоны (акцепторы). Кислоты и основания получили общее название протолитов.
Сущностью кислотно-основного взаимодействия является передача протона от кислоты к основанию. При этом кислота, передав протон основанию, сама становится основанием, так как может снова присоединять протон, а основание, образуя протонированную частицу, становится кислотой. Таким образом, в любом кислотно-основном взаимодействии участвуют две пары кислот и оснований, названные Брёнстедом сопряженными: A1 + B2 A2 + B1
Одно и то же вещество в зависимости от условий взаимодействия может быть как кислотой, так и основанием (амфотерность). Например, вода при взаимодействии с сильными кислотами выступает в роли основания: H+ + H2O H3O+, а реагируя с аммиаком – в роли кислоты: NH3 + H2O NH4+ + OH⎺
Слайд 14Различные теории кислот и оснований
Электронная теория Г.Льюиса (1923)
По Льюису, кислота
– вещество, которое может использовать неподеленную электронную пару электронов атома
другой молекулы для образования устойчивой электронной группировки одного из своих атомов, основание – вещество, обладающее неподеленной парой электронов, которая может быть использована для образования устойчивой электронной группировки другого атома. Часто такой группировкой является октет электронов.Катионы, анионы или нейтральные молекулы, способные принять одну или несколько пар электронов, называют кислотами Льюиса.
Слайд 15Различные теории кислот и оснований
Кислота Льюиса – молекула или ион,
имеющие вакантные электронные орбитали, вследствие чего они способны принимать электронные
пары. Это, например, ионы водорода – протоны, ионы металлов (Ag+, Fe3+), оксиды некоторых неметаллов (например, SO3, SiO2), ряд солей (AlCl3), а также такие вещества как BF3, Al2O3. Кислоты Льюиса, не содержащие ионов водорода, называются апротонными. Протонные кислоты рассматриваются как частный случай класса кислот.Катионы, анионы или нейтральные молекулы, способные отдавать электронные пары, называют основаниями Льюиса. Например, основания Льюиса – все анионы, аммиак и амины, вода, спирты, галогены.
Основание Льюиса – это молекула или ион, способные быть донором электронных пар: все анионы, аммиак и амины, вода, спирты, галогены.
Слайд 16Различные теории кислот и оснований
Примеры химических реакций между кислотами и
основаниями Льюиса:
AlCl3 + Cl⎺ [AlCl4]⎺
BF3 + F⎺
[BF4]⎺ PCl5 + Cl⎺ [PCl6]⎺
Г. Льюис предположил, что кислотно-основные взаимодействия совсем необязательно происходят с переносом протона. В определении кислот и оснований по Льюису основная роль отводится участию электронных пар в химическом взаимодействии.
Отличительным признаком кислоты и основания в теории Льюиса является то, что они взаимодействуют друг с другом с образованием донорно-акцепторной (координационной) связи: А + В А:В, где А – кислота, В – основание, А:В – кислотно-основный комплекс (продукт нейтрализации). В результате приобретенной пары электронов атомом, ответственным за кислотные свойства рассматриваемого соединения, часто возникает завершенная электронная конфигурация, например:
Слайд 17Различные теории кислот и оснований
В случае взаимодействия нейтральных молекул продукт
реакции [напр., BF3·NH3, SbCl5·O(C2H5)2] часто называют аддуктом.
Понятие основания в теориях
Льюиса и Брёнстеда совпадают, однако понятие кислоты в первой теории охватывает кроме протона также электроноакцепторные вещества, в обратимых реакциях которых с основаниями не участвует водород, например BF3, SO3, Ag+. К кислотам Льюиса относится протон, как частица, легко присоединяющая пару электронов. Протонные кислоты рассматриваются в теории Льюиса как продукты нейтрализации протона основаниями (напр., соляная кислота – продукт нейтрализации Н+ основанием Сl⎺).Определение Г. Льюиса охватывает все кислотно-основные процессы, рассмотренные ранее предложенными теориями.
Слайд 18Различные теории кислот и оснований
Общая теория М.И. Усановича (1939–53)
Теория, предложенная М.И. Усановичем
(1939–53), объединяет электронную и протонную теории. По этой теории, кислота
– вещество, способное отдавать катионы или присоединять анионы; основание – вещество, способное отщеплять анионы или присоединять катионы, например:Fe(CN)3 (к-та) + 3KCN (основание) K3[Fe(CN)6]
СН3I (к-та) + N(CH3)3 (основание) (CH3)4NI
Для всех обсуждаемых теорий характерно, что в них определения кислоты и оснований зависят от определения понятия кислотно-основного процесса, в котором реагирующие между собой Кислоты и основания являются таковыми лишь по отношению друг к другу. Единой теории кислотно-основного взаимодействия и, следовательно, понятий кислоты и основания пока нет. В настоящее время наиболее широко используются две теории кислоты и оснований: электронная и протонная.
В основе теории лежит представление о том, что всякое кислотно-основное взаимодействие – это реакция солеобразования. Согласно этой теории «кислота – это частица, которая может отщеплять катионы, включая протон, или присоединять анионы, включая электрон. Основание – частица, которая может присоединять протон и другие катионы или отдавать электрон и другие анионы» (формулировка 1964 г.).
Слайд 19Различные теории кислот и оснований
Общая теория М.И. Усановича (1939–53)
В отличие от
Льюиса Усанович в основе понятий «кислота» и «основание» использует знак
заряда частицы, а не строение электронной оболочки.По Усановичу, в реакции гидролиза SO3 + 2H2O H3O+ + HSO4⎺ вода, отдавая анион OH⎺, является основанием, а триоксид серы, присоединяя этот анион – кислотой.
Аналогично в реакции: SnCl4 + 2KCl K2[SnCl6] тетрахлорид олова, присоединяющий анионы хлора, выступает в роли кислоты.
Таким образом, данная формулировка кислот и оснований позволяет отнести к кислотно-основным взаимодействиям и все окислительно-восстановительные реакции.
Теория Усановича фактически отменяет один из основополагающих принципов классической химии – представления о классах кислот и оснований: «кислоты и основания – это не классы соединений; кислотность и основность – это функции вещества. Будет ли вещество кислотой или основанием, зависит от партнера».
К недостаткам теории Усановича относят её слишком общий характер и недостаточно чёткую определённость формулировки понятий «кислота» и «основание». К недостаткам относят также то обстоятельство, что она не описывает неионогенные кислотно-основные превращения. Наконец, она не позволяет делать количественные предсказания.
Слайд 21Различные теории кислот и оснований
Суперкислота (или сверхкислота) – вещество или
смесь веществ, параметр кислотности которых превышает кислотность 100%-ой серной кислоты.
В данном случае параметр кислотности принимается как способность кислоты протонировать произвольное основание и фактически совпадает с функцией кислотности. Для 100% серной кислоты параметр кислотности составляет H0 = −12,2. Наличие воды снижает кислотность сверхкислот, так как в присутствии воды сила кислоты ограничивается кислотностью иона гидроксония H3O+.Протонные суперкислоты
К простым суперкислотам относят трифторметансульфоновую (CF3SO3H), хлорную, хлорсульфоновую, пентафторэтансульфоновую, фторсульфоновую (FSO3H) кислоты. Во многих случаях суперкислота является не одиночным соединением, а смесью соединений, совмещаемых для достижения высокой кислотности.
Слайд 22Различные теории кислот и оснований
Карборановая кислота – самая сильная кислота
(суперкислота) из тех, которые можно хранить в бутылках. 2,3,4,5,6,7,8,9,10,11,12-Ундекахлор-1-карба-клозо-додекаборан(12) (журналистское
название Карборановая кислота) – одна из самых сильных кислот (суперкислота) полученных в начале 21 века. Химическая формула – H(CB11Cl11).Карборановая кислота приблизительно в миллион раз сильнее концентрированной серной кислоты. В обычных шкалах измерить силу кислоты не удается, так как кислота протонирует все известные слабые основания и все растворители в которых она растворяется. На момент получения была сильнейшей известной кислотой. В настоящий момент получены более сильные сверхкислоты, например карфторановая кислота H(CB11F11).
Протонирует бензол, давая стабильную соль бензолия. Протонирует фуллерен-60, диоксид серы.
Создана в университете Калифорнии (США) при участии сотрудников Института катализа СО РАН (Новосибирск).
Сверхкислоты Льюиса
К сверхкислотам Льюиса относятся большинство пентафторидов металлов и трифторид бора.
Слайд 23Различные теории кислот и оснований
Магические кислоты (Magic Acids) – самые
кислые из известных кислот, представляют собой смеси чистых фтороводорода или
фторсульфоновой кислоты с пентафторидом сурьмы (FSO3H·SbF5). Соответственные значения функции Гаммета –31,3 и –23.Название магических они получили после того, как на новогодней вечеринке в начале 1960-х в научной группе Дьёрдя Ола один из сотрудников растворил праздничную свечу в одной из этих смесей. ЯМР-спектр полученного раствора показал наличие чистого трет-бутильного катиона, после чего за кислотами закрепилась слава «магических».
Последующее исследование показало, что при этом происходят расщепление и изомеризация молекул длинноцепочечных парафинов, из которых состоит свеча.
Слайд 24Различные теории кислот и оснований
СВЕРХОСНОВА́НИЯ (супероснования), вещества, проявляющие очень сильное
сродство к протону.
К супероснованиям относятся, в частности, неорганические солеобразные
соединения, в которых анион имеет малый радиус и высокий заряд (нитрид лития, гидрид калия и т.п.), азотсодержащие органические соединения (фосфазены, амидины и др.), литийорганические соединения, а также системы, состоящие из сильного ионного основания и вещества, способного специфически связывать катион щелочного металла или ониевый (напр., NaOH в среде диметилсульфоксида). Некоторые супероснования (напр., диизопропиламид Li) относятся к т.н. протонным губкам – веществам, обладающим способностью ионизировать слабые кислоты по связям С─Н, не затрагивая другие лабильные группы.
Супероснования используют в органическом синтезе, например в реакциях конденсации.














![Различные теории кислот и оснований Различные теории кислот и основанийПримеры химических реакций между кислотами и основаниями Различные теории кислот и основанийПримеры химических реакций между кислотами и основаниями Льюиса: AlCl3 + Cl⎺ [AlCl4]⎺](/img/thumbs/da680cabb1cbdbbde7376b809442452f-800x.jpg)
![Различные теории кислот и оснований Различные теории кислот и основанийВ случае взаимодействия нейтральных молекул продукт реакции Различные теории кислот и основанийВ случае взаимодействия нейтральных молекул продукт реакции [напр., BF3·NH3, SbCl5·O(C2H5)2] часто называют аддуктом.Понятие](/img/thumbs/97266098a9259f3baad67c8e05c79f42-800x.jpg)