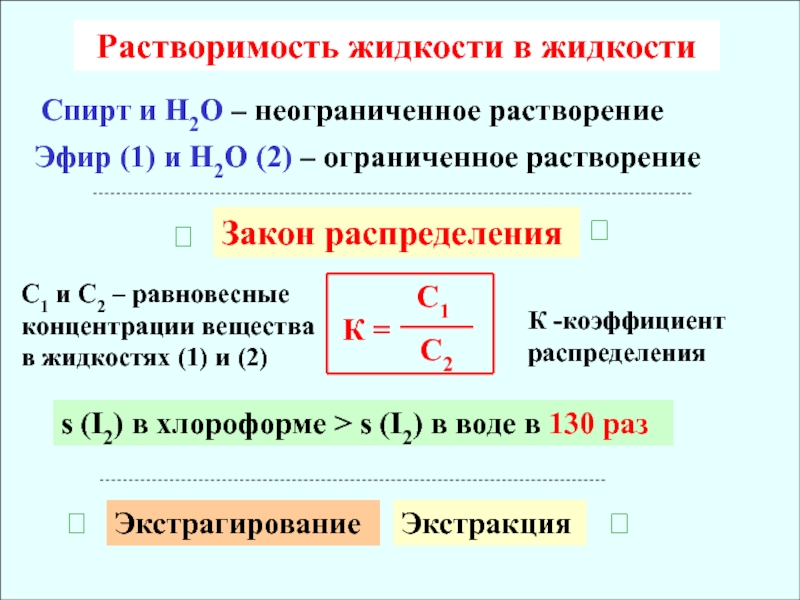
в металлургии. В частности, в гидропроцессах металлургии редких металлов экстракция
применяется для разделения Ta и Nb, Zr и Hf, РЗЭ, получения из водных растворов таких элементов как Re, In, Tl, Sc, U и др.
Разделение продуктов экстракции (экстракта и рафината) производят в отстойниках. Реэкстракцию органической фазы (после промывки в воде) осуществляют горячей водой, растворами кислот, щелочей солей
Примеры процессов экстракции.
1. Экстракция рения из водных растворов. Экстракция из растворов с H2SO4 протекает по механизму межфазного анионного обмена. Экстрагент – ТОА тироктиламин [(R3NH)+]
(R3NH)HSO4 + ReO4- (R3NH)ReO4 + HSO4-