Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Реакция нуклеофильного замещения
Содержание
- 1. Реакция нуклеофильного замещения
- 2. ПЛАН9.1 Классификация и номенклатура карбоновых кислот9.2. Электронное
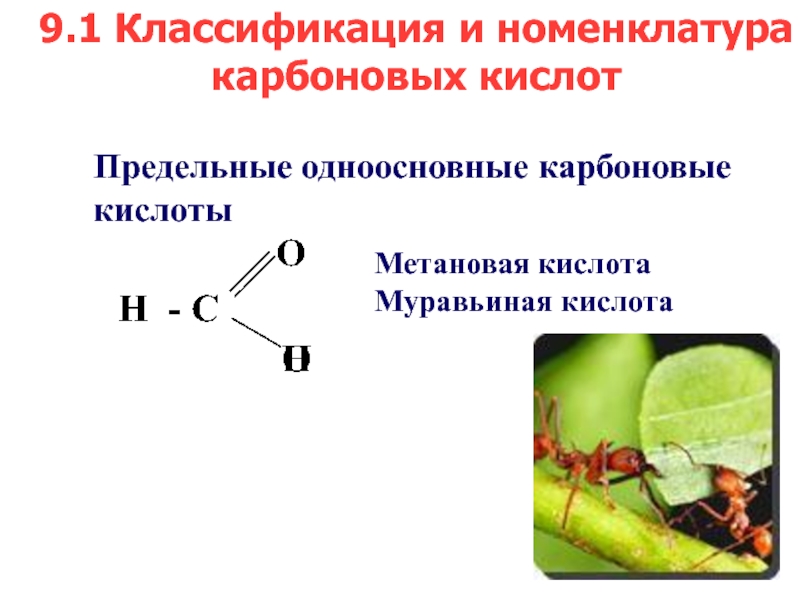
- 3. Предельные одноосновные карбоновые кислотыМетановая кислота Муравьиная кислота 9.1 Классификация и номенклатура карбоновых кислот
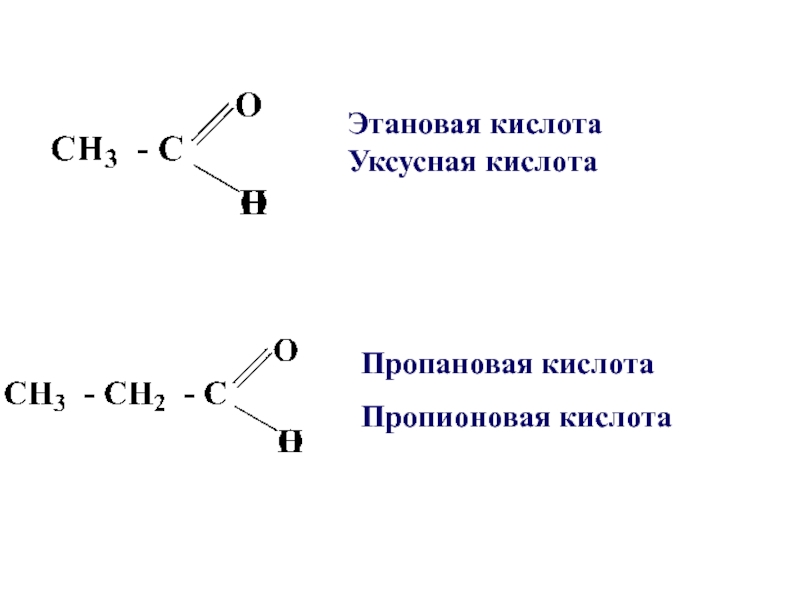
- 4. Пропановая кислотаПропионовая кислотаЭтановая кислота Уксусная кислота
- 5. Бутановая кислотаМасляная кислотаПентановая кислотаВалериановая кислота
- 6. Гексановая кислотаКапроновая кислотаКозы являются источником капроновой, каприловой и каприновой кислот: CH3(CH2)nCOOH n = 4, 6, 8
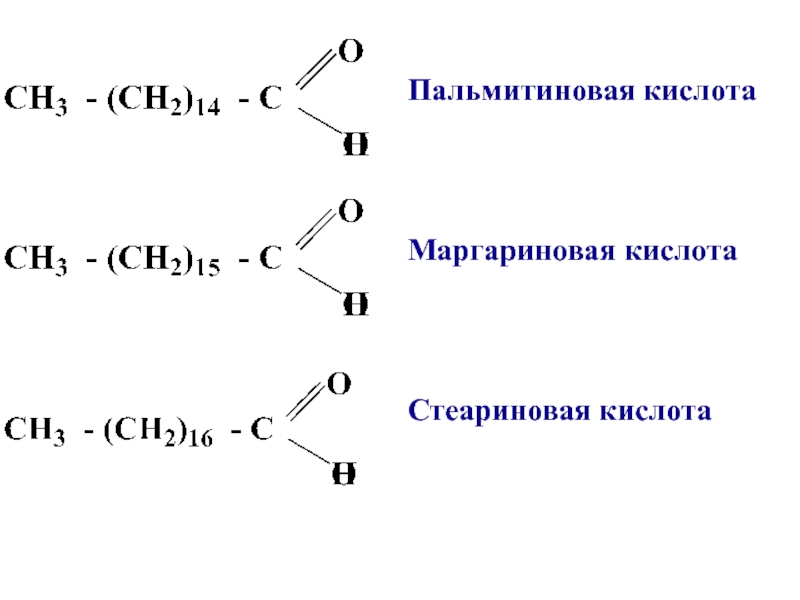
- 7. Пальмитиновая кислотаМаргариновая кислотаСтеариновая кислота
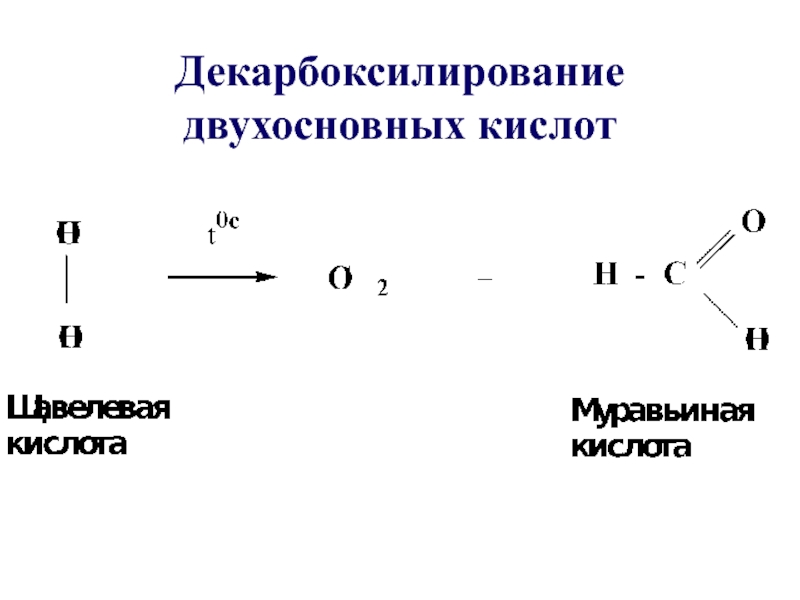
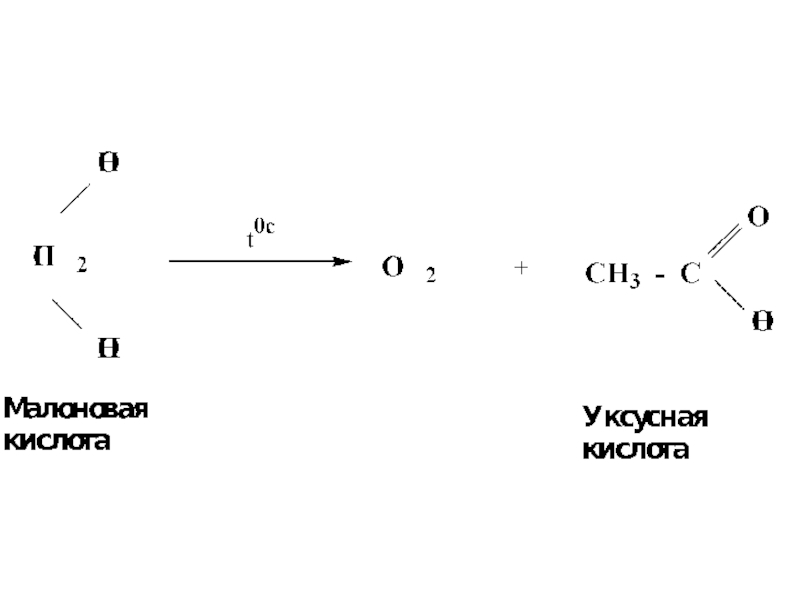
- 8. ДВУХОСНОВНЫЕ ПРЕДЕЛЬНЫЕ КИСЛОТЫЭтандиовая кислотаЩавелевая кислотаПропандиовая кислотаМалоновая кислота
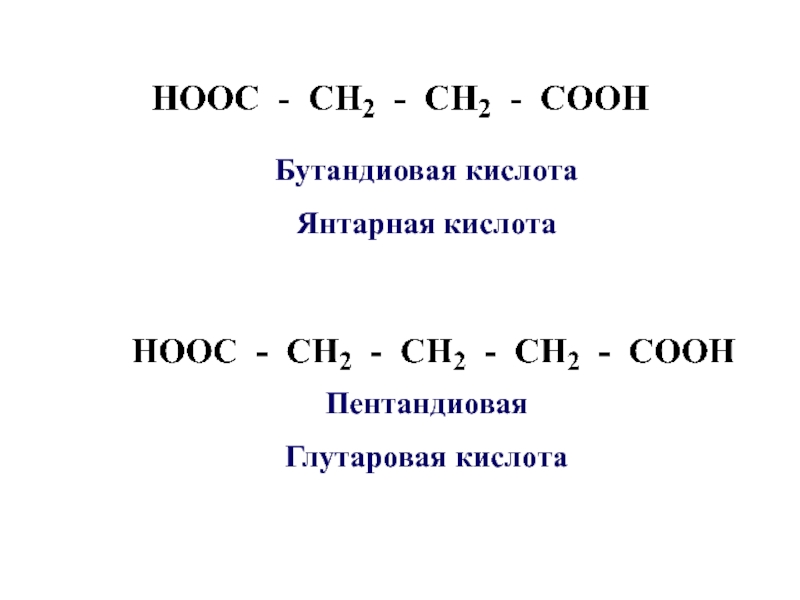
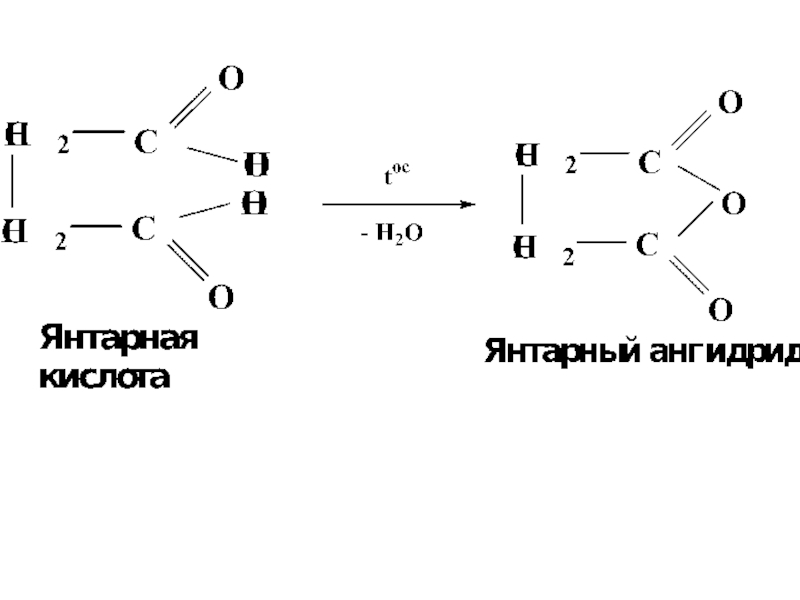
- 9. ПентандиоваяГлутаровая кислотаБутандиовая кислотаЯнтарная кислота
- 10. Непредельные одноосновные кислоты
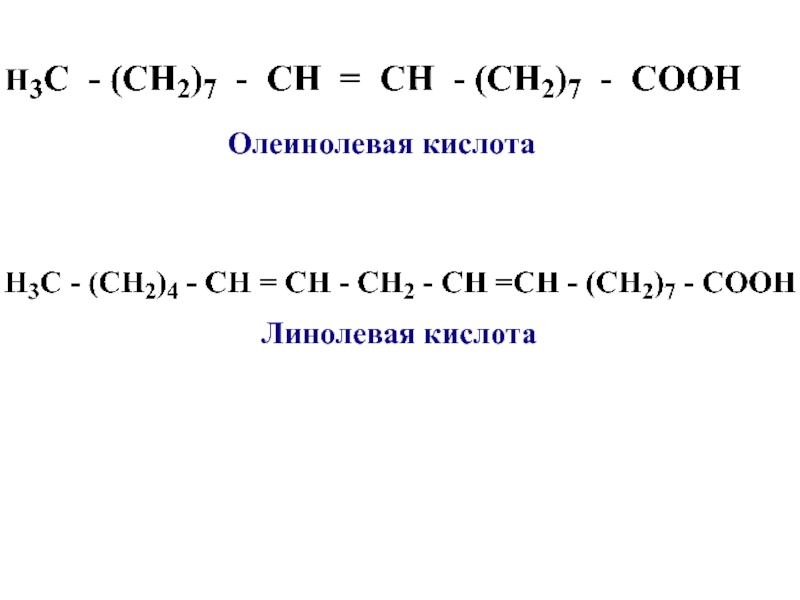
- 11. Линолевая кислотаОлеинолевая кислота
- 12. Линоленовая кислотаАрахидоновая кислота
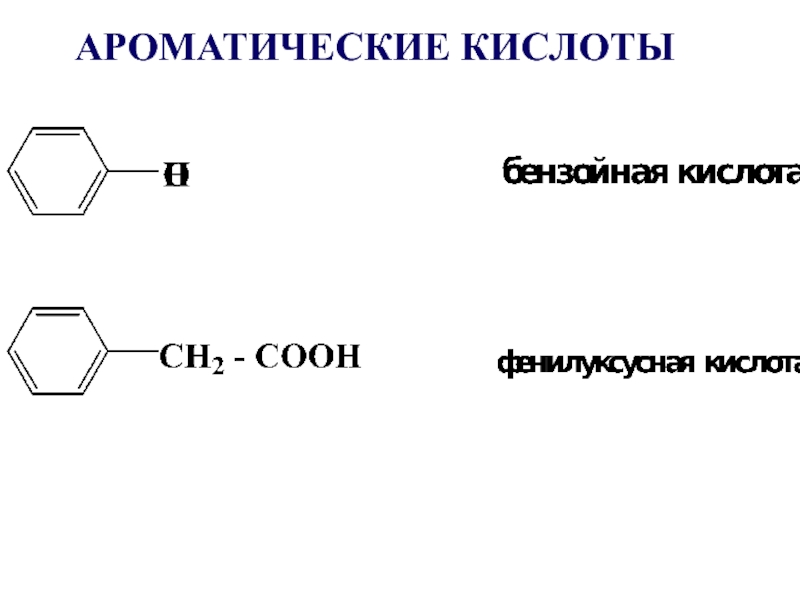
- 13. АРОМАТИЧЕСКИЕ КИСЛОТЫ
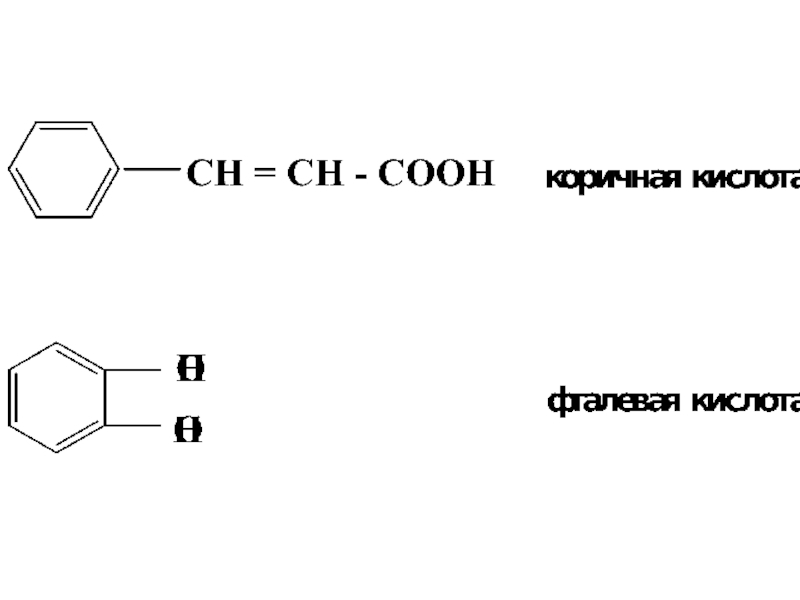
- 14. Слайд 14
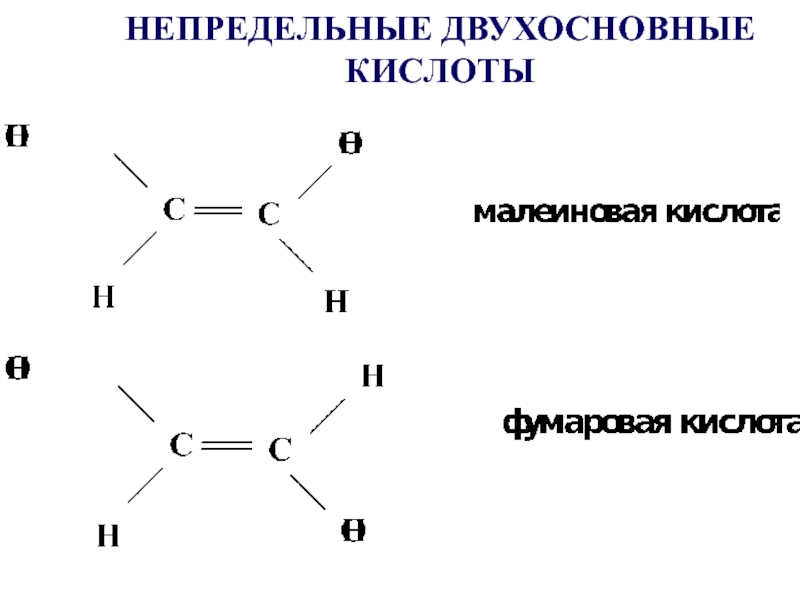
- 15. НЕПРЕДЕЛЬНЫЕ ДВУХОСНОВНЫЕ КИСЛОТЫ
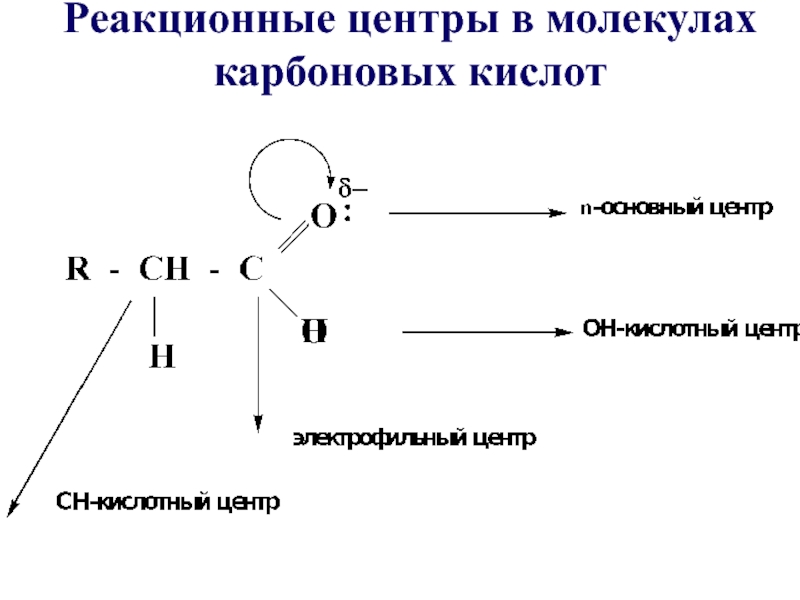
- 16. Карбоксильная группа состоит из карбонильной и
- 17. Реакционные центры в молекулах карбоновых кислот
- 18. Характеристика реакционной способности карбоновых кислот:•У карбоновых кислот
- 19. •У карбоновых кислот частичный положительный
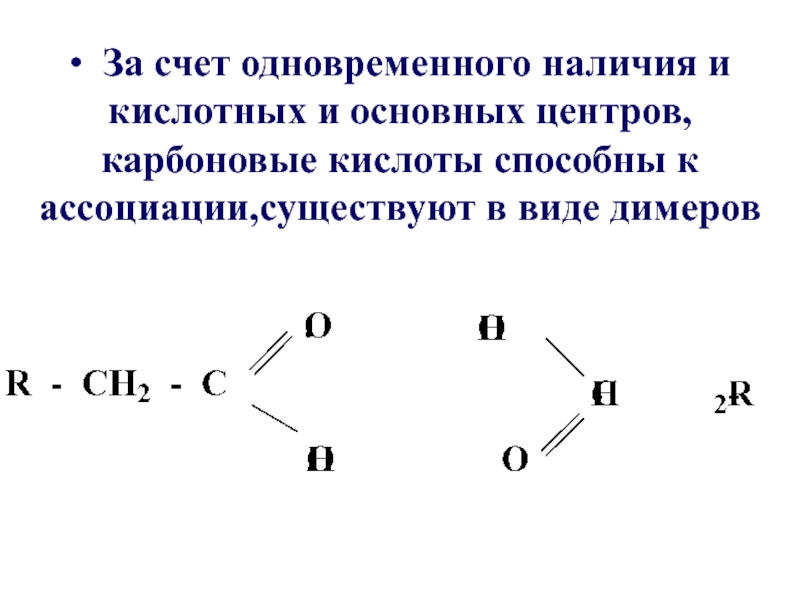
- 20. • За счет одновременного наличия и кислотных
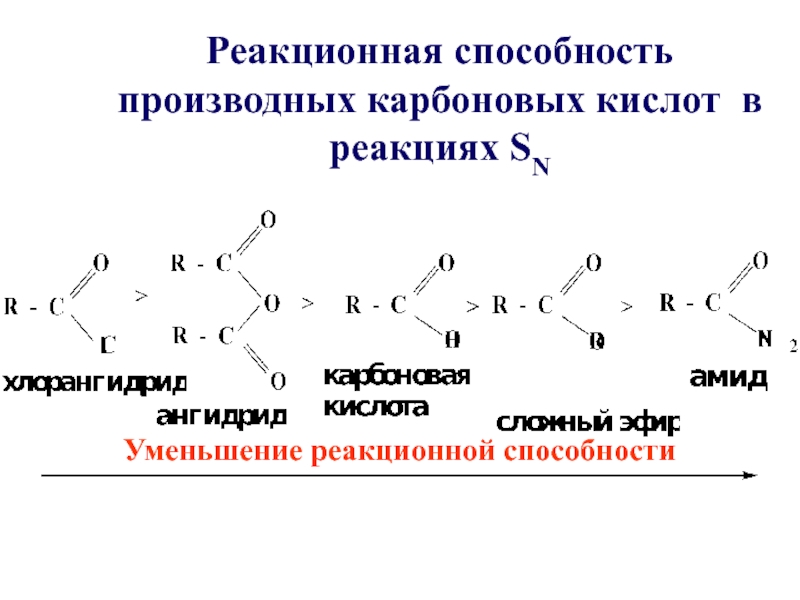
- 21. Реакционная способность производных карбоновых кислот в реакциях SNУменьшение реакционной способности
- 22. 9.3 Реакции нуклеофильного замещения (SN), их рольРеакции
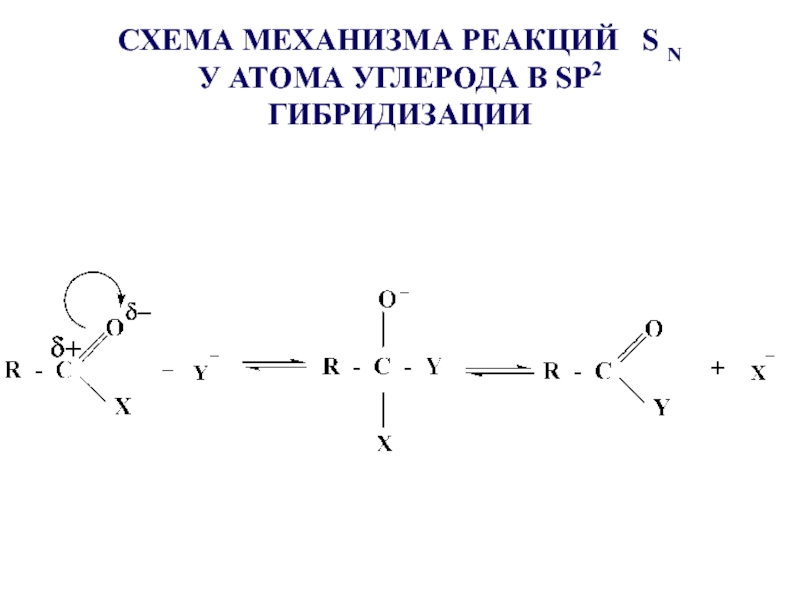
- 23. СХЕМА МЕХАНИЗМА РЕАКЦИЙ S N
- 24. Реакция протекает при наличии сильного нуклеофила
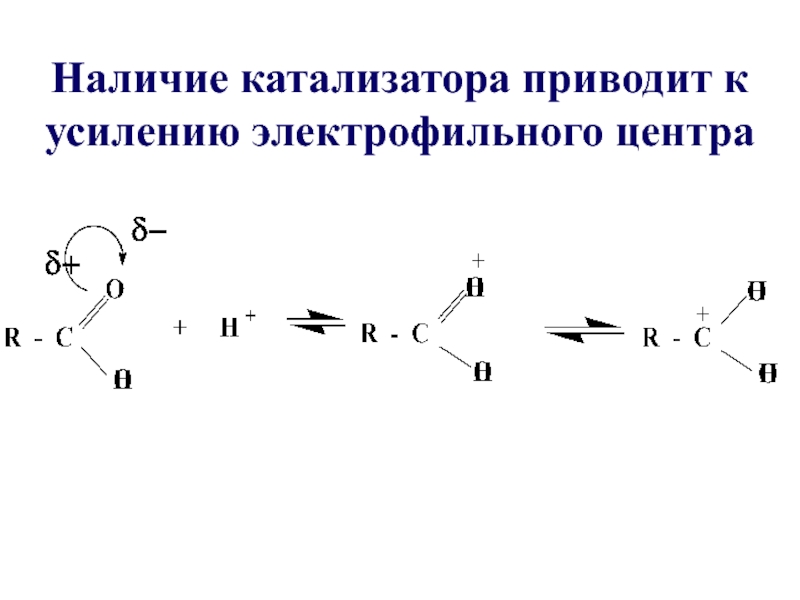
- 25. Наличие катализатора приводит к усилению электрофильного центра
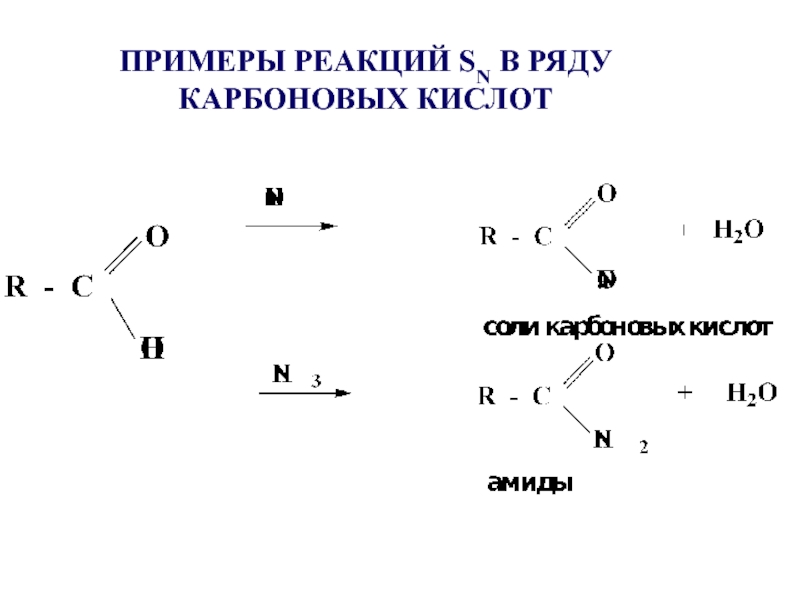
- 26. ПРИМЕРЫ РЕАКЦИЙ SN В РЯДУ КАРБОНОВЫХ КИСЛОТ
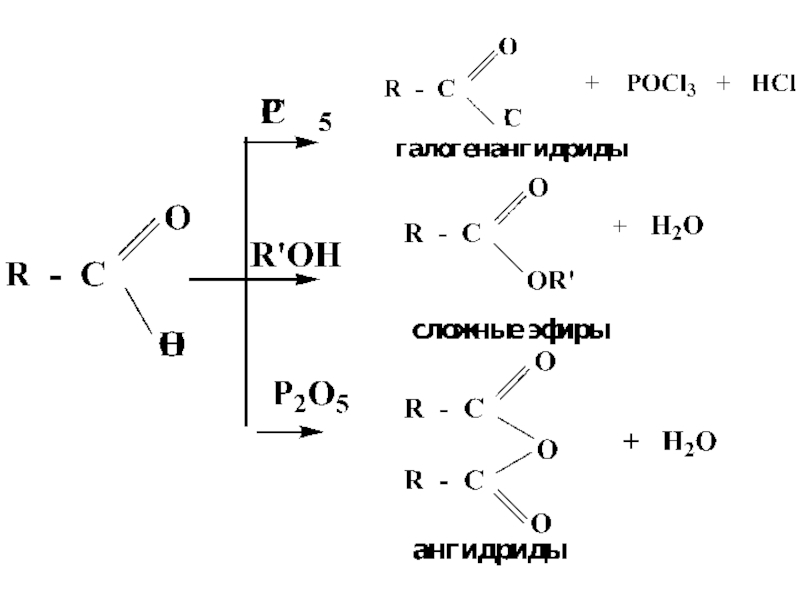
- 27. Слайд 27
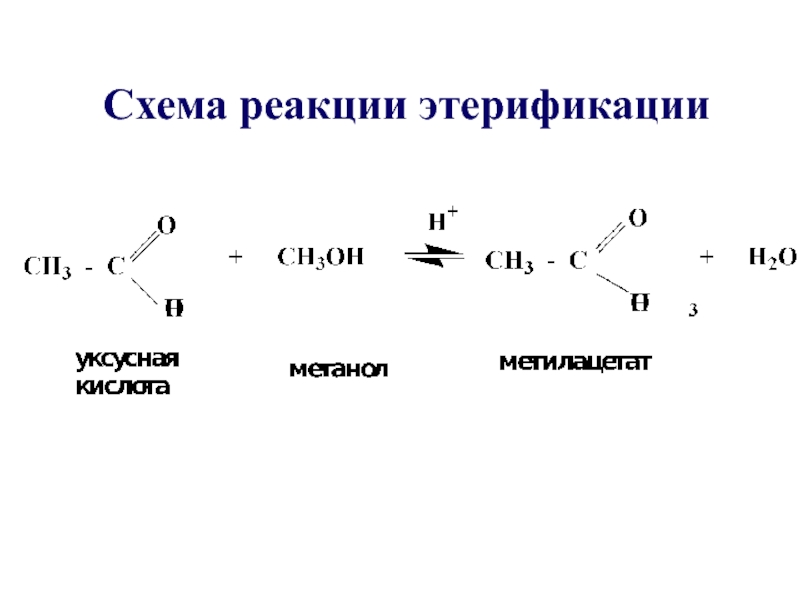
- 28. Схема реакции этерификации
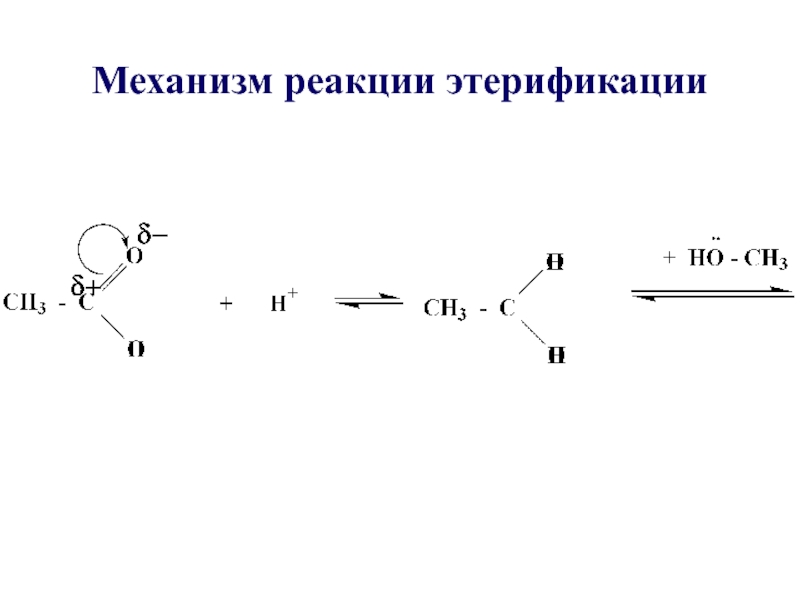
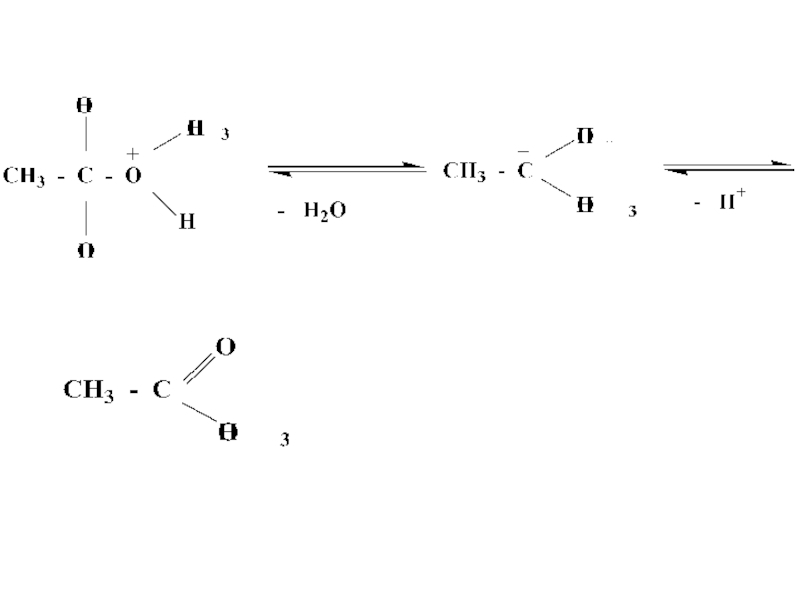
- 29. Механизм реакции этерификации
- 30. Слайд 30
- 31. Реакция этерификации протекает в присутствии минеральных кислот,
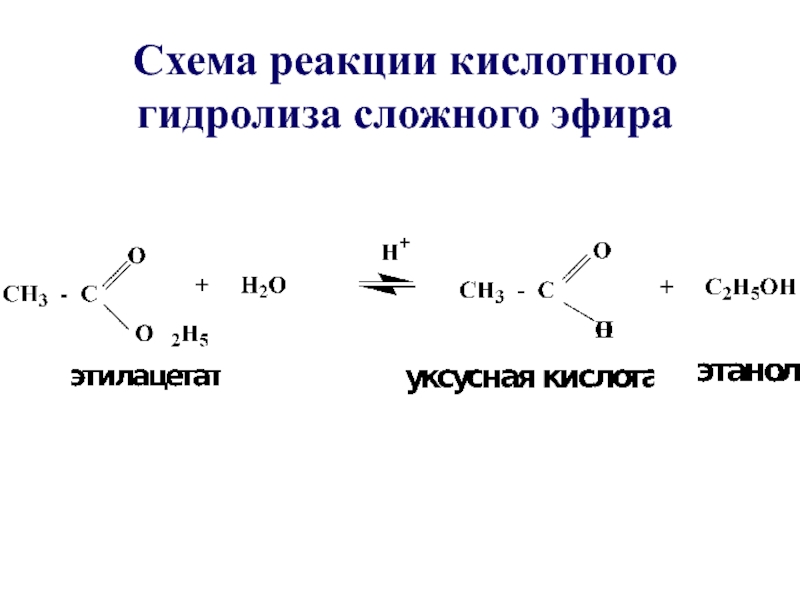
- 32. Схема реакции кислотного гидролиза сложного эфира
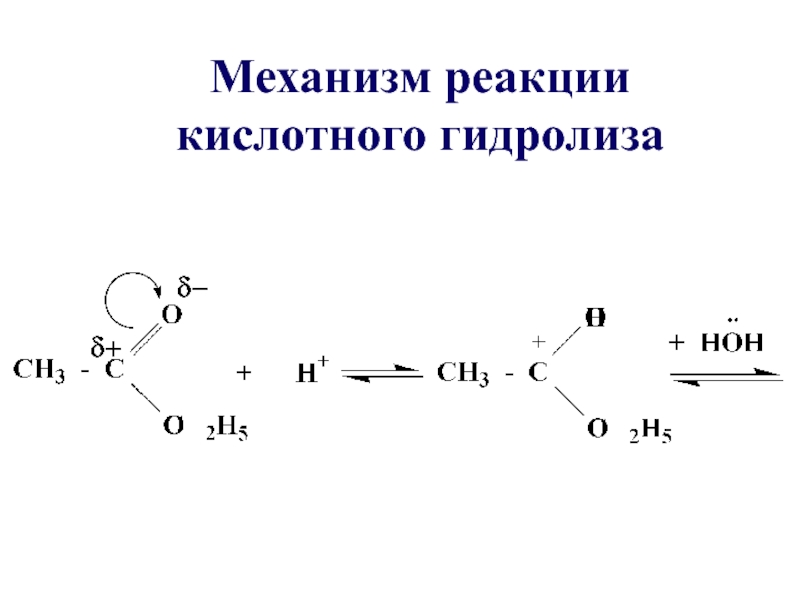
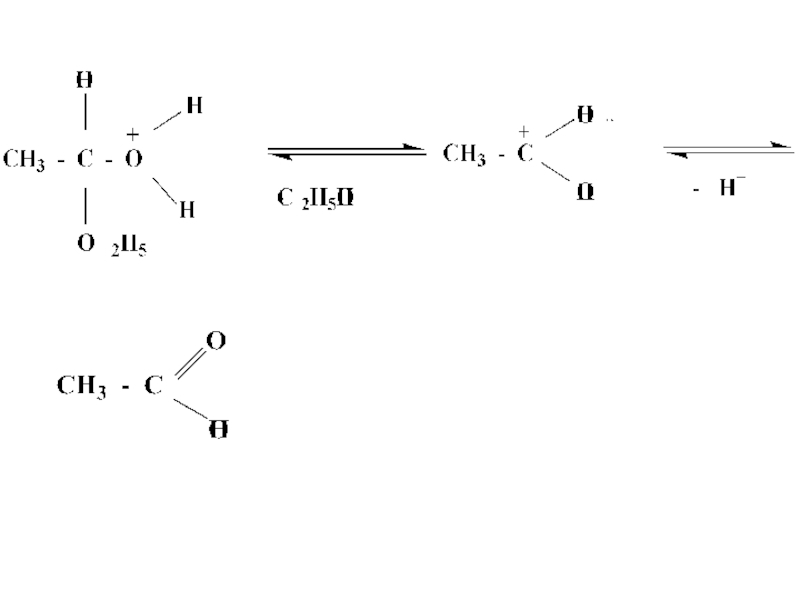
- 33. Механизм реакции кислотного гидролиза
- 34. Слайд 34
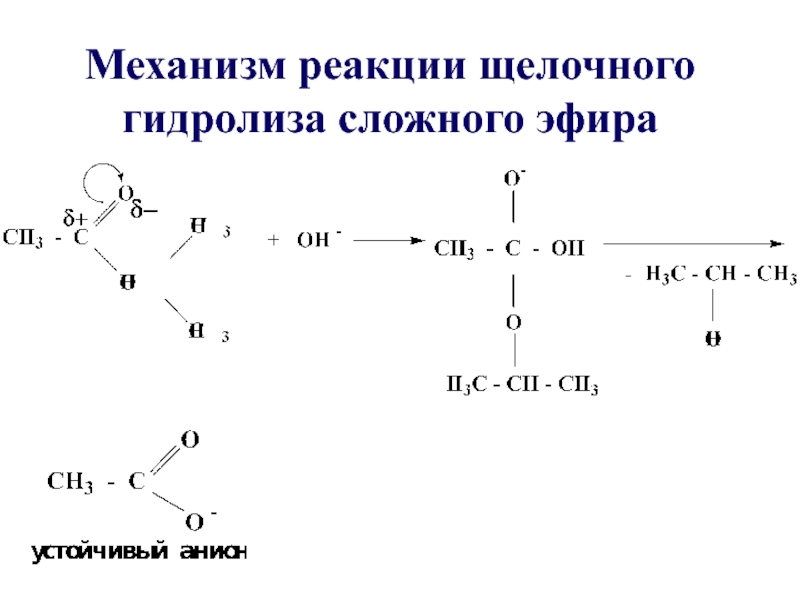
- 35. В щелочной среде гидролиз необратим, причиной этого является образование в щелочной среде стабильного ацилат-иона
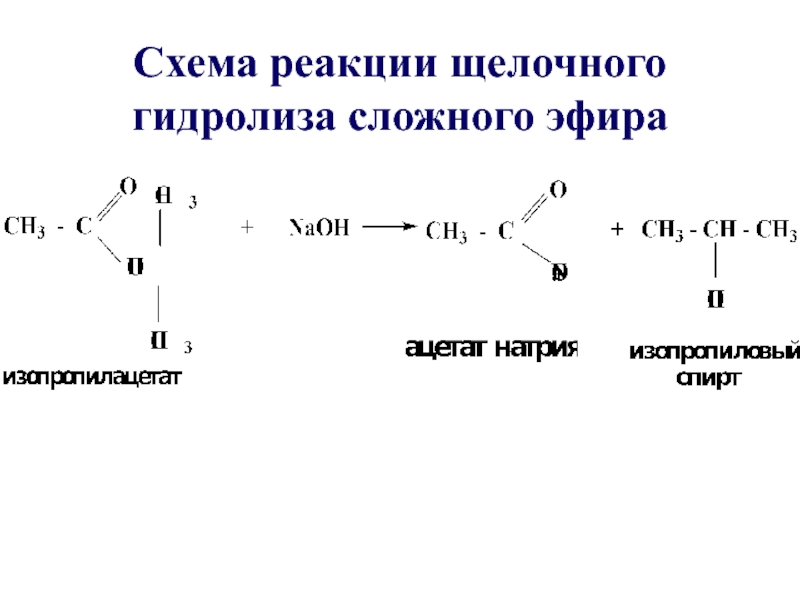
- 36. Схема реакции щелочного гидролиза сложного эфира
- 37. Механизм реакции щелочного гидролиза сложного эфира
- 38. Для практического получения сложных эфиров обычно
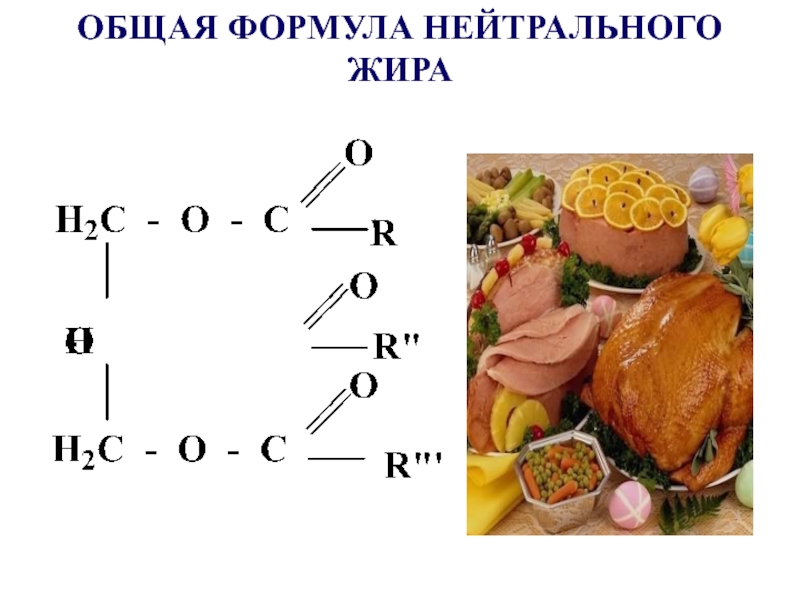
- 39. Сложными эфирами являются жиры и липиды, в образовании которых принимают участие многоатомные спирты иВЖК
- 40. ОБЩАЯ ФОРМУЛА НЕЙТРАЛЬНОГО ЖИРА
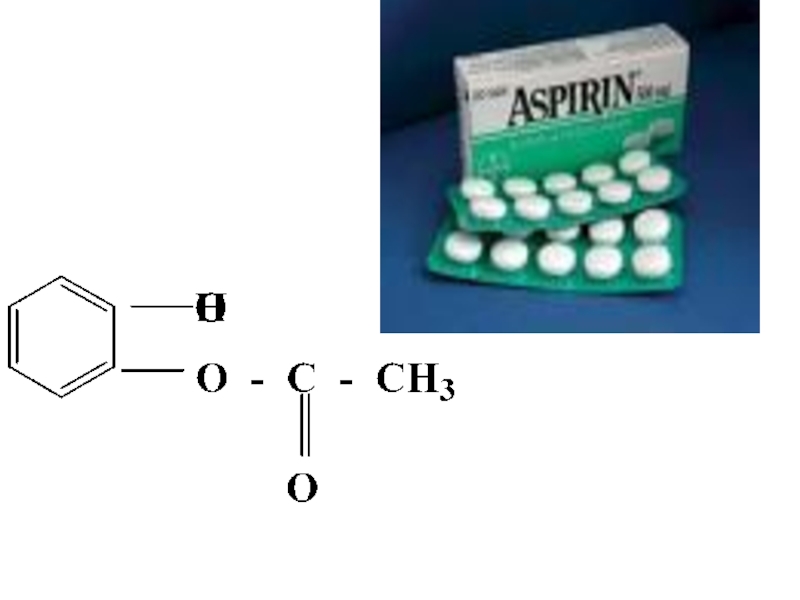
- 41. Многие лекарственные препараты являются сложными эфирами.
- 42. Слайд 42
- 43. Аспирин использовали при лечении зубной, головной боли
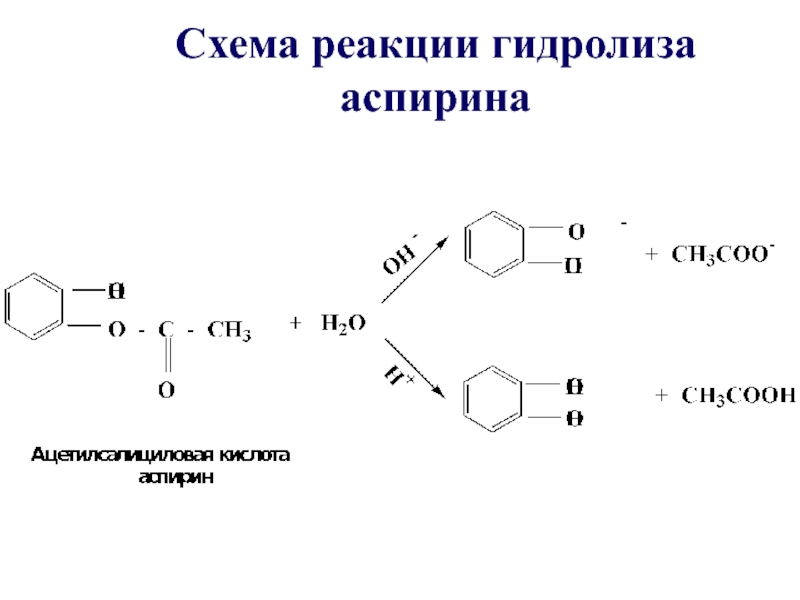
- 44. Схема реакции гидролиза аспирина
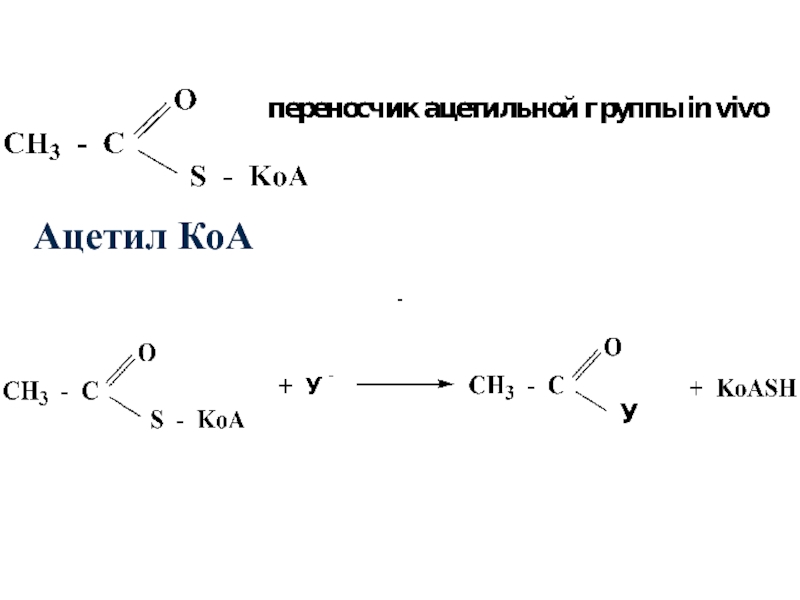
- 45. Сложные тиоэфиры наряду со сложными эфирами
- 46. Ацетил КоА
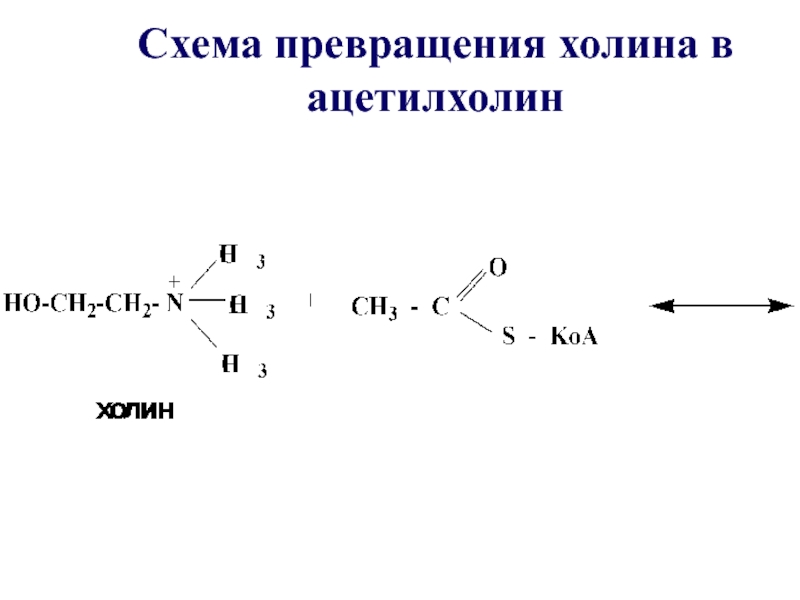
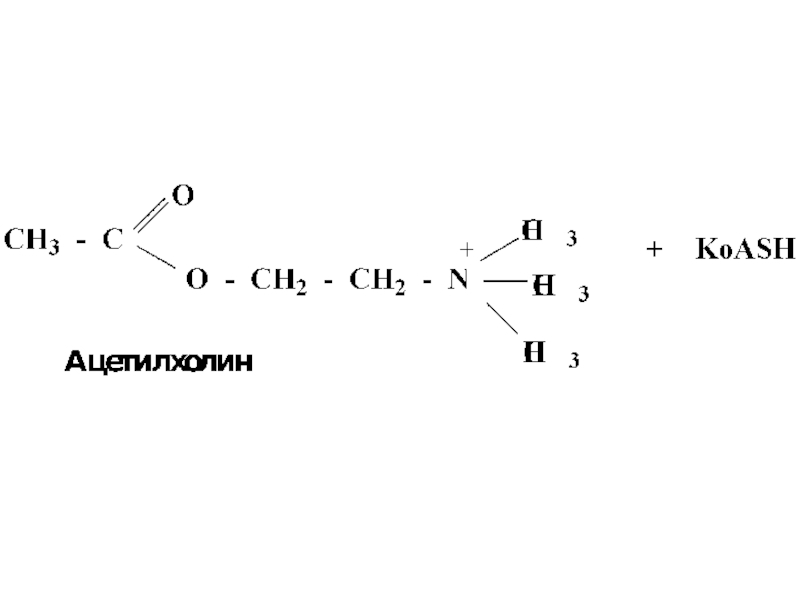
- 47. Таким образом осуществляется превращение холина в ацетилхолин – нейромедиатор, посредник при передаче нервного импульса
- 48. Схема превращения холина в ацетилхолин
- 49. Слайд 49
- 50. При передаче нервного импульса ацетилхолин синтезируется в
- 51. Схемы реакций декарбоксилированияРеакции декарбоксилирования карбоновых кислот –
- 52. Декарбоксилирование двухосновных кислот
- 53. Слайд 53
- 54. При декарбоксилировании янтарной и глутаровой кислот происходит
- 55. Слайд 55
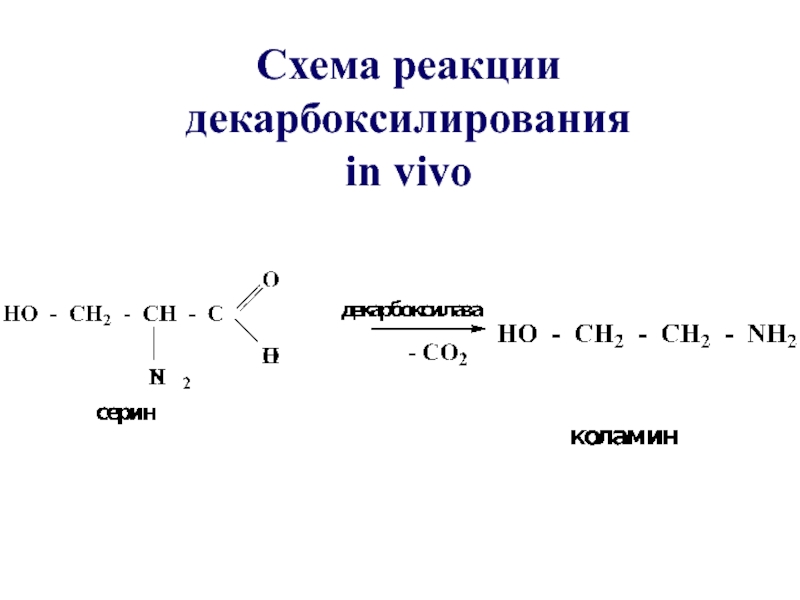
- 56. В биологических системах реакции декарбоксилирования протекают с
- 57. Схема реакции декарбоксилирования in vivo
- 58. В насыщенных алифатических кислотах в результате
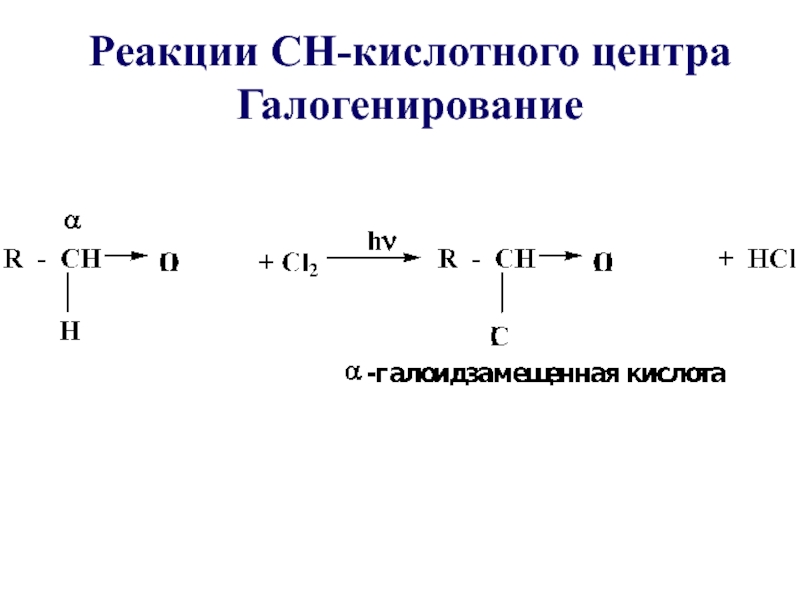
- 59. Реакции СН-кислотного центра Галогенирование
- 60. Спасибо за внимание !
- 61. Скачать презентанцию
ПЛАН9.1 Классификация и номенклатура карбоновых кислот9.2. Электронное и пространственное строение карбоксильной группы9.3 Реакции нуклеофильного замещения (SN), их роль