Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Рецепты и механизмы их действия
Содержание
- 1. Рецепты и механизмы их действия
- 2. РЕЦЕПТОР –СПЕЦИФИЧЕСКИЙ БЕЛОК, КОТОРЫЙ СВЯЗЫВАЕТ СИГНАЛЬНОЕ ВЕЩЕСТВО,
- 3. ХАРАКТЕРИСТИКИ РЕЦЕПТОРОВ
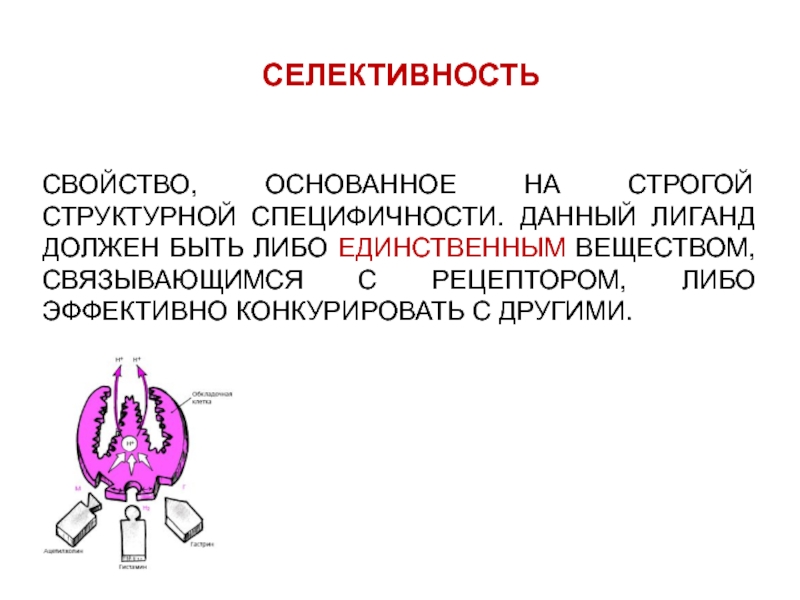
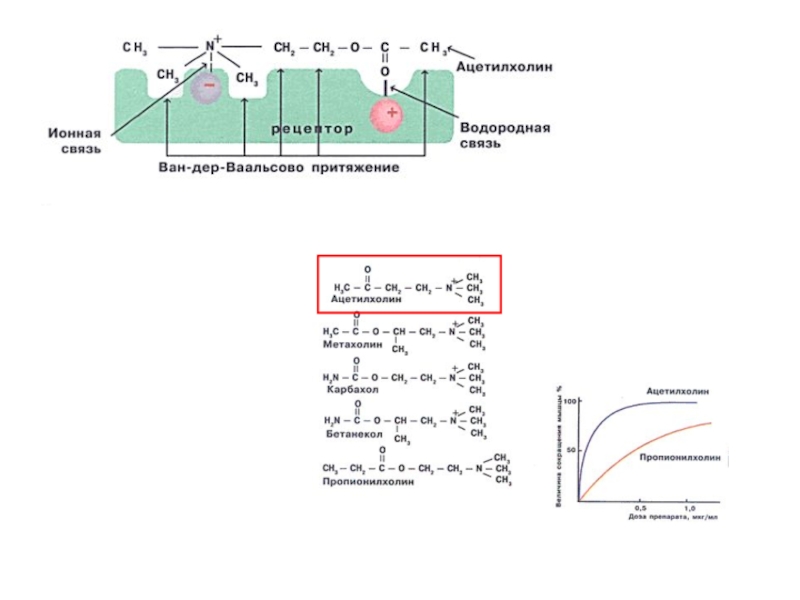
- 4. СЕЛЕКТИВНОСТЬ СВОЙСТВО, ОСНОВАННОЕ НА СТРОГОЙ СТРУКТУРНОЙ СПЕЦИФИЧНОСТИ.
- 5. Слайд 5
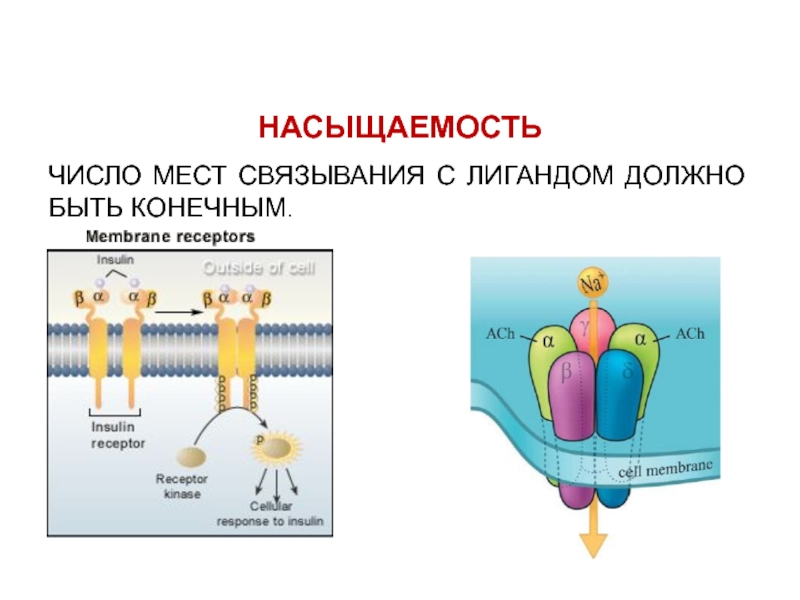
- 6. НАСЫЩАЕМОСТЬЧИСЛО МЕСТ СВЯЗЫВАНИЯ С ЛИГАНДОМ ДОЛЖНО БЫТЬ КОНЕЧНЫМ.
- 7. СРОДСТВО К ЛИГАНДУНАСЫЩЕНИЕ РЕЦЕПТОРА ПРОИСХОДИТ ПРИ ФИЗИОЛОГИЧЕСКИХ
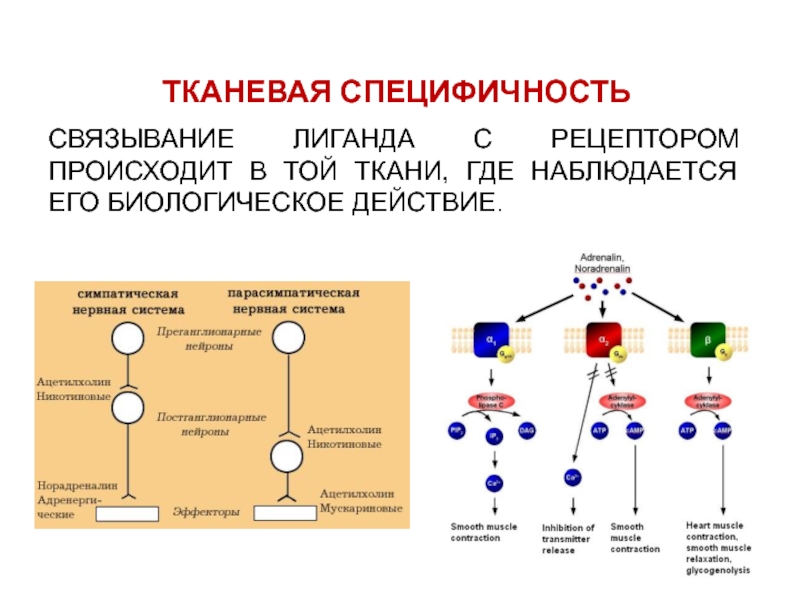
- 8. ТКАНЕВАЯ СПЕЦИФИЧНОСТЬСВЯЗЫВАНИЕ ЛИГАНДА С РЕЦЕПТОРОМ ПРОИСХОДИТ В ТОЙ ТКАНИ, ГДЕ НАБЛЮДАЕТСЯ ЕГО БИОЛОГИЧЕСКОЕ ДЕЙСТВИЕ.
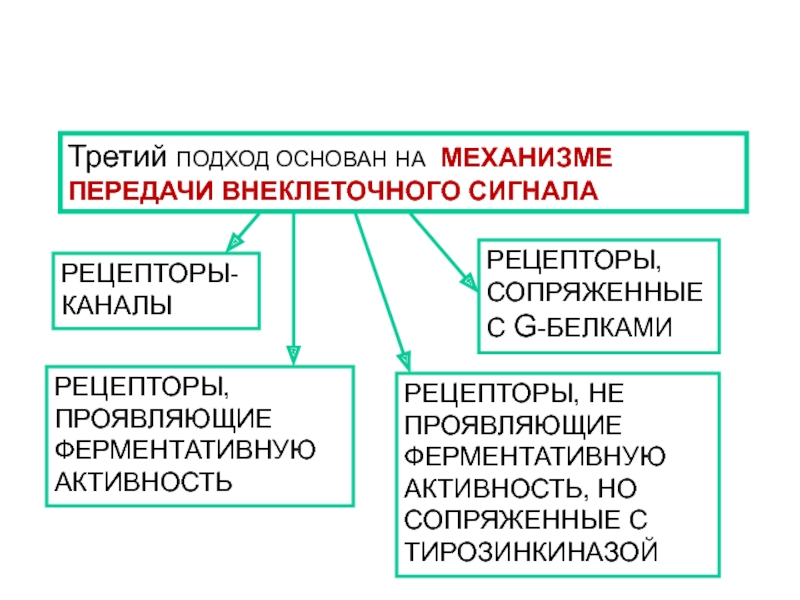
- 9. КЛАССИФИКАЦИЯ РЕЦЕПТОРОВ
- 10. Классификация, основанная на видах агонистов, с которым взаимодействует рецептор (применяют, как правило, для мембранных рецепторов).НАПРИМЕРАдренэргические ХолинэргическиеСеротонинэргические
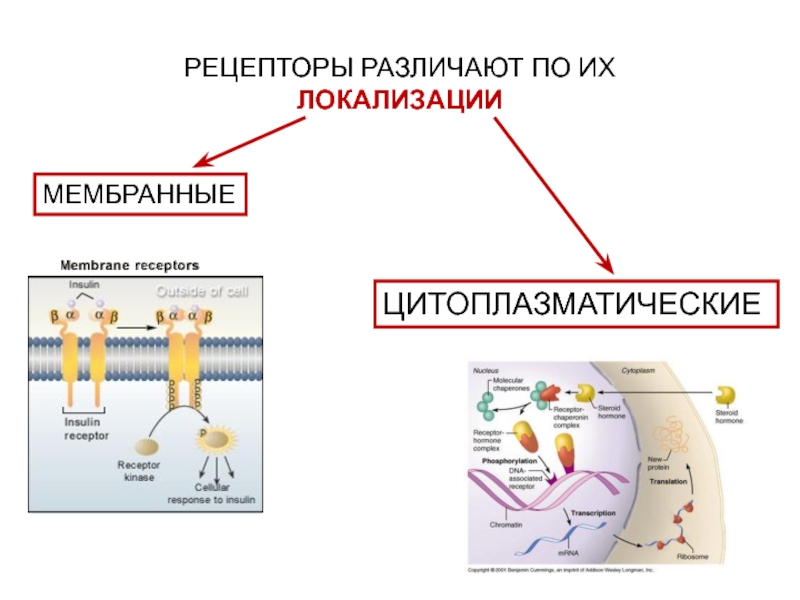
- 11. ЦИТОПЛАЗМАТИЧЕСКИЕРЕЦЕПТОРЫ РАЗЛИЧАЮТ ПО ИХ ЛОКАЛИЗАЦИИМЕМБРАННЫЕ
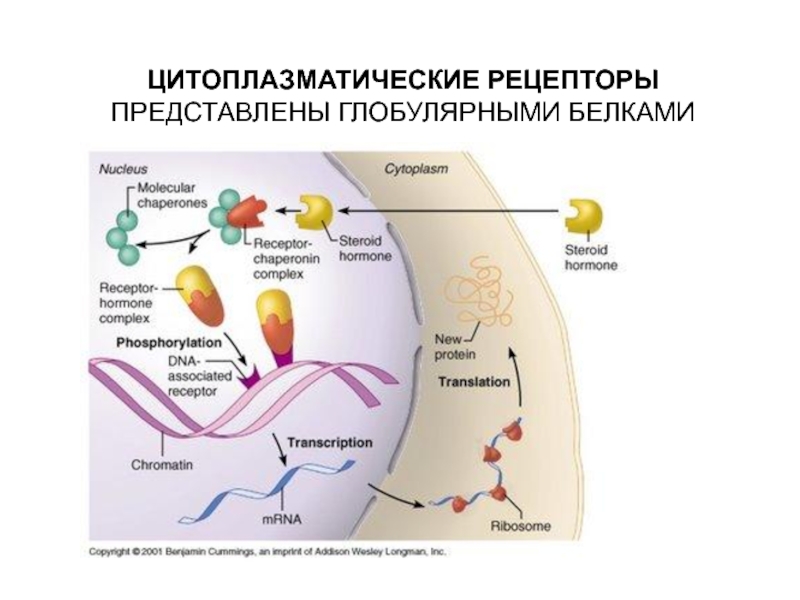
- 12. ЦИТОПЛАЗМАТИЧЕСКИЕ РЕЦЕПТОРЫ ПРЕДСТАВЛЕНЫ ГЛОБУЛЯРНЫМИ БЕЛКАМИ
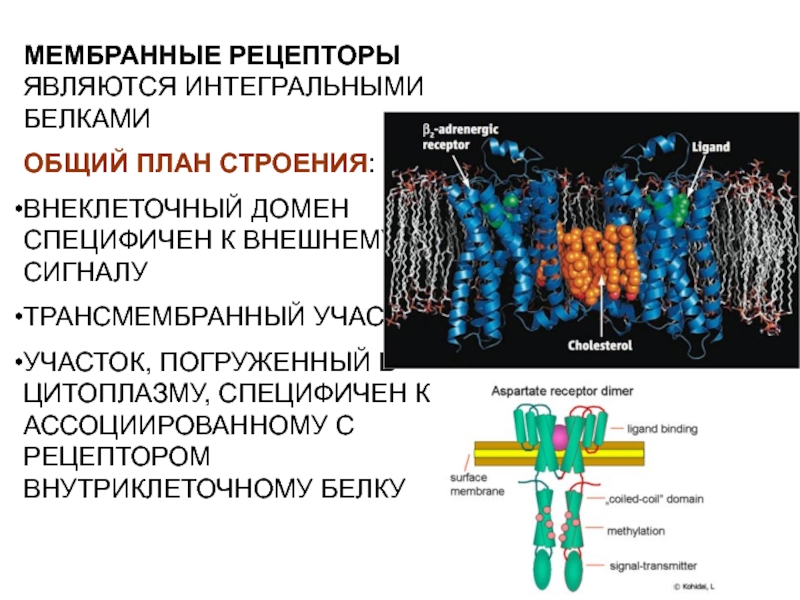
- 13. МЕМБРАННЫЕ РЕЦЕПТОРЫ ЯВЛЯЮТСЯ ИНТЕГРАЛЬНЫМИ БЕЛКАМИ ОБЩИЙ ПЛАН
- 14. РЕЦЕПТОРЫ, ПРОЯВЛЯЮЩИЕ ФЕРМЕНТАТИВНУЮ АКТИВНОСТЬ
- 15. Слайд 15
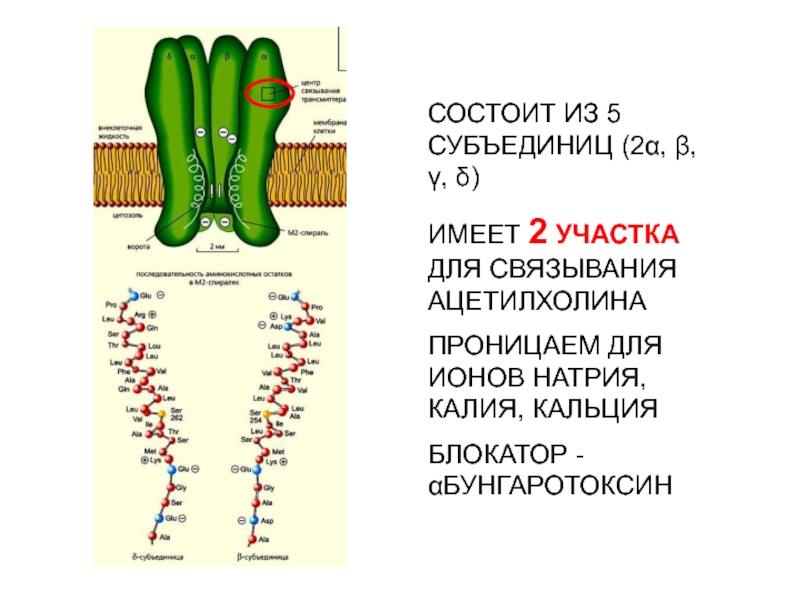
- 16. РЕЦЕПТОРЫ-КАНАЛЫ
- 17. СВЯЗЫВАНИЕ С ЛИГАНДОМ ПРИВОДИТ К КОНФОРМАЦИОННЫМ ПЕРЕСТРОЙКАМ РЕЦЕПТОРА, ЧТО ВЫЗЫВАЕТ ОТКРЫВАНИЕ ИОННОГО КАНАЛАМЕХАНИЗМ РАБОТЫ РЕЦЕПТОРА-КАНАЛА
- 18. Электрический скат, из электрического органа которого были
- 19. Слайд 19
- 20. ДРУГИЕ ПРИМЕРЫ:РЕЦЕПТОРЫ К ГЛУТАМАТУРЕЦЕПТОРЫ К АСПАРТАТУГЛИЦИНОВЫЕ РЕЦЕПТОРЫГАМК-рецепторы1,2 проницаемы для катионов3,4 проницаемы для ионов хлора
- 21. РЕЦЕПТОРЫ, СОПРЯЖЕННЫЕ С G-БЕЛКАМИ
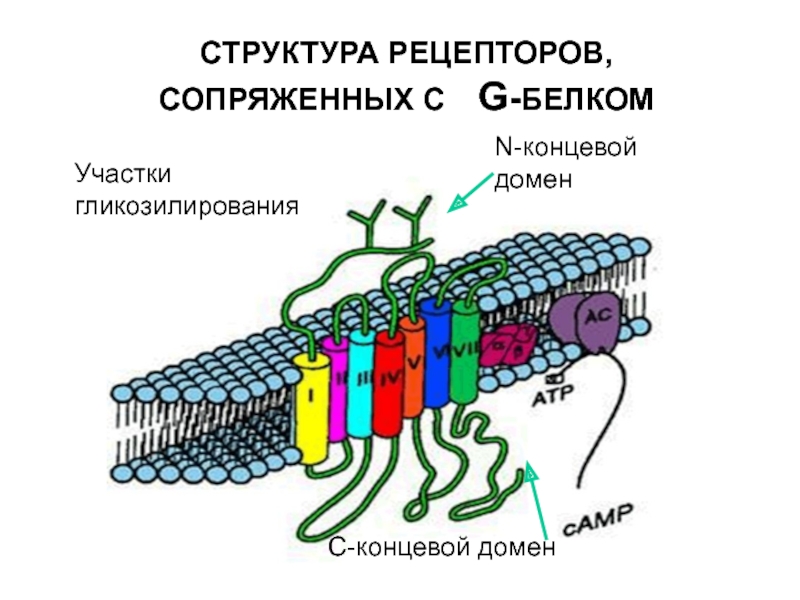
- 22. СТРУКТУРА РЕЦЕПТОРОВ,СОПРЯЖЕННЫХ С G-БЕЛКОМN-концевой доменУчастки гликозилированияС-концевой домен
- 23. ПРИМЕРЫ АГОНИСТОВ, ДЕЙСТВУЮЩИХ НА РЕЦЕПТОРЫ, СОПРЯЖЕННЫЕ С G-БЕЛКАМИАДРЕНАЛИН, НОРАДРЕНАЛИНАЦЕТИЛХОЛИНСЕРОТОНИНГИСТАМИНОПИОИДЫ, КАННАБИНОИДЫГОРМОНЫ ПЕПТИДНОЙ ПРИРОДЫ (АКТГ, ВАЗОПРЕССИН, АНГИОТЕНЗИН)
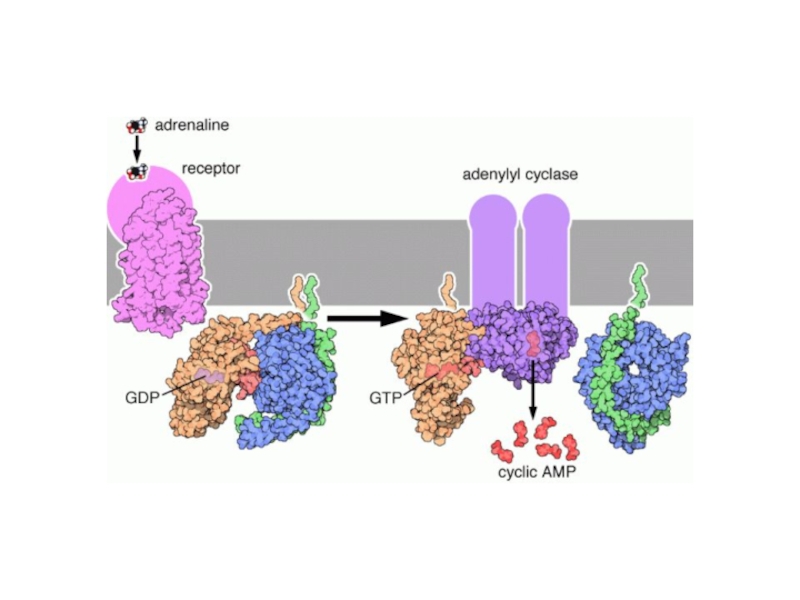
- 24. ПРИМЕРЫ РЕЦЕПТОРОВ, СОПРЯЖЕННЫХ С G-БЕЛКОМαАДРЕНОРЕЦЕПТОРβ2 АДРЕНОРЕЦЕПТОР
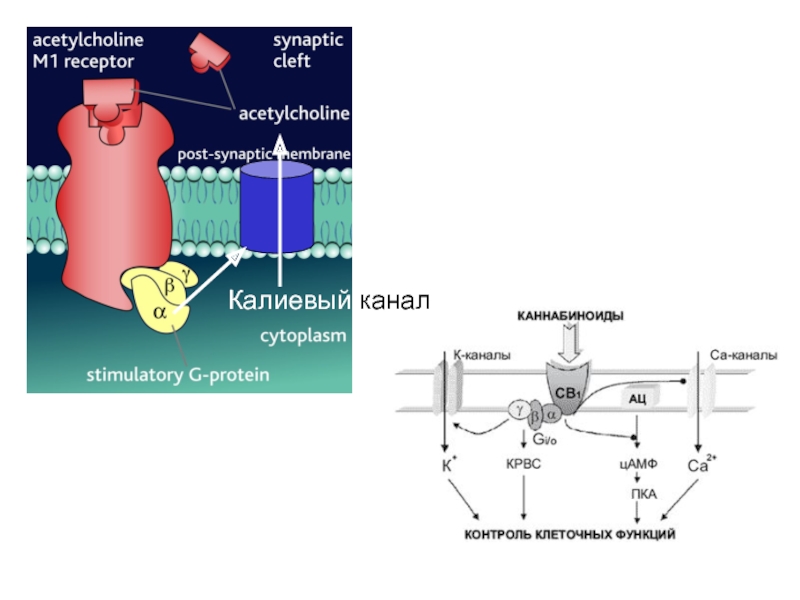
- 25. Калиевый канал
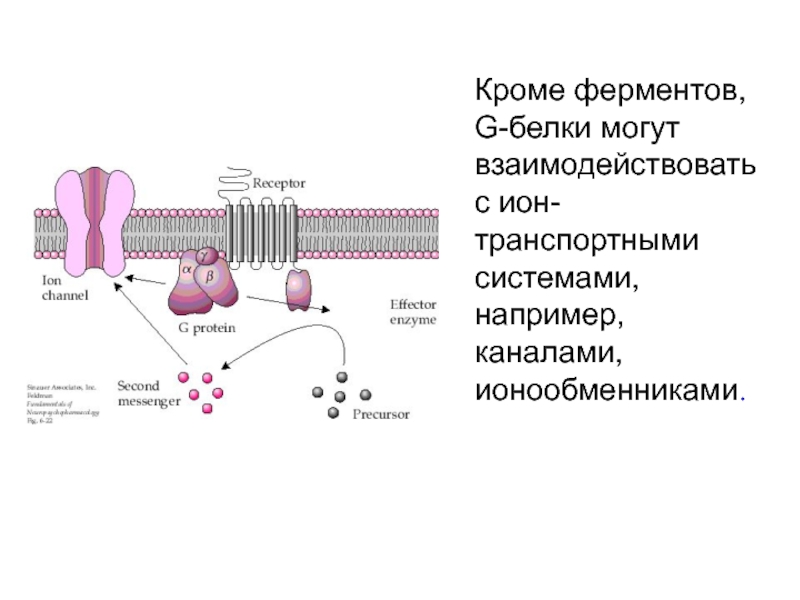
- 26. Кроме ферментов, G-белки могут взаимодействовать с ион-транспортными системами, например, каналами, ионообменниками.
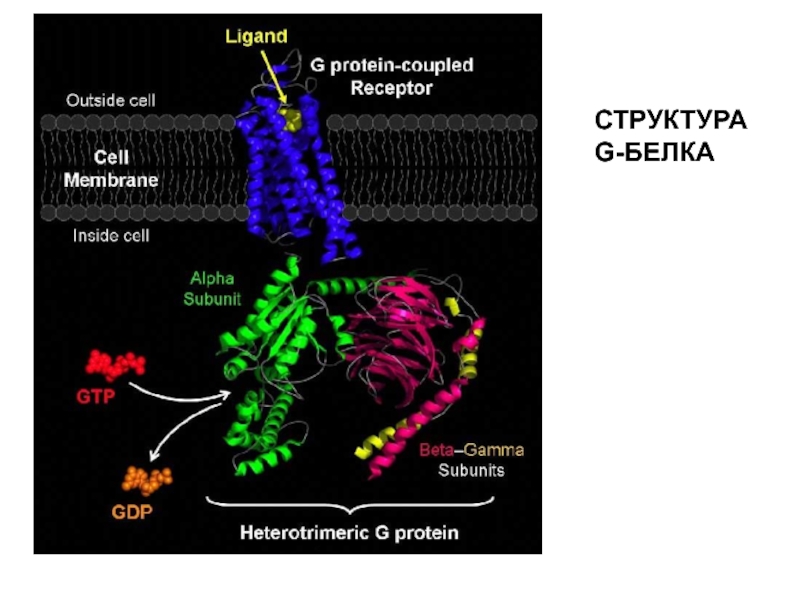
- 27. СТРУКТУРА G-БЕЛКА
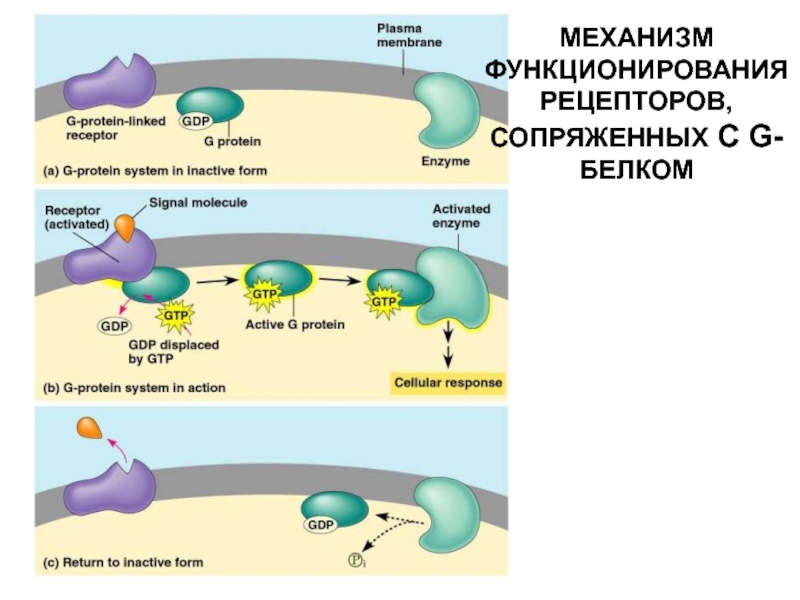
- 28. МЕХАНИЗМ ФУНКЦИОНИРОВАНИЯ РЕЦЕПТОРОВ, СОПРЯЖЕННЫХ С G-БЕЛКОМ
- 29. Слайд 29
- 30. ВИДЫ G-БЕЛКОВИДЕНТИФИЦИРОВАНО ОКОЛО 20 ВИДОВ G-БЕЛКОВGS И
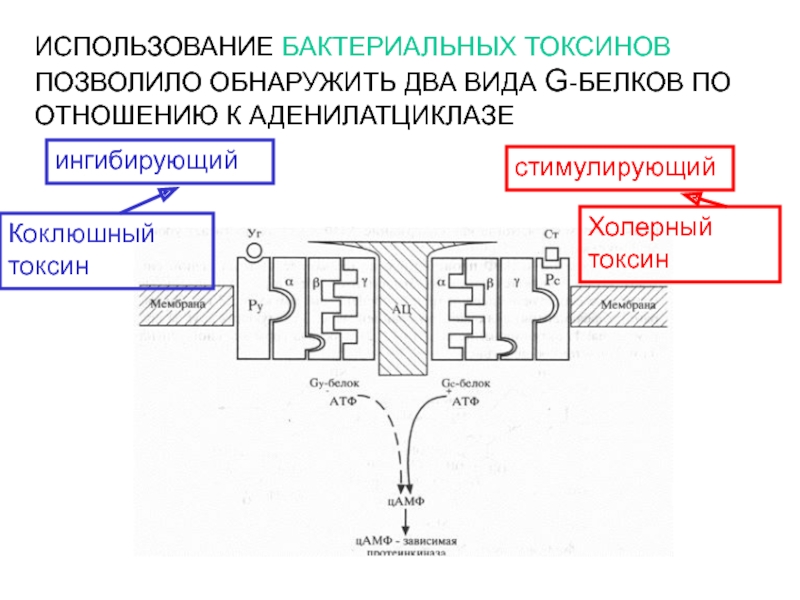
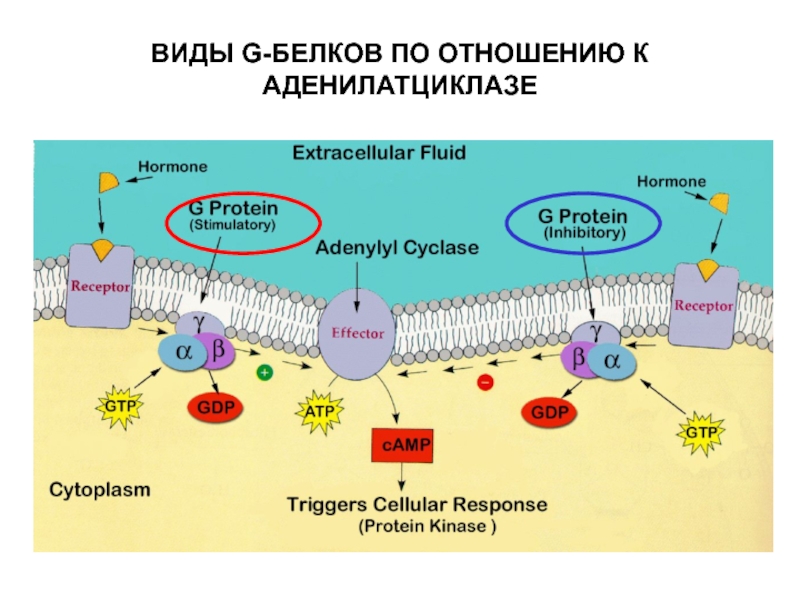
- 31. ИСПОЛЬЗОВАНИЕ БАКТЕРИАЛЬНЫХ ТОКСИНОВ ПОЗВОЛИЛО ОБНАРУЖИТЬ ДВА ВИДА G-БЕЛКОВ ПО ОТНОШЕНИЮ К АДЕНИЛАТЦИКЛАЗЕстимулирующийингибирующийХолерный токсинКоклюшный токсин
- 32. Слайд 32
- 33. Холерный токсин, также как и коклюшный, содержит
- 34. ВИДЫ G-БЕЛКОВ ПО ОТНОШЕНИЮ К АДЕНИЛАТЦИКЛАЗЕ
- 35. РЕЦЕПТОРЫ, ПРОЯВЛЯЮЩИЕ ФЕРМЕНТАТИВНУЮ АКТИВНОСТЬ
- 36. РЕЦЕПТОРНЫЕ ТИРОЗИНКИНАЗЫМЕМБРАННОСВЯЗАННАЯ ГУАНИЛАТЦИКЛАЗА
- 37. РЕЦЕПТОРНЫЕ ТИРОЗИНКИНАЗЫАгонисты: факторы ростаинсулин
- 38. Факторы роста (GF) или митогены стимулируют рост
- 39. РЕЦЕПТОРНАЯ ТИРОЗИНКИНАЗА1 – внеклеточный N-концевой участок, связывающий агонисты;2 – трансмембранный участок;3 – внутриклеточный тирозинкиназный домен123
- 40. Слайд 40
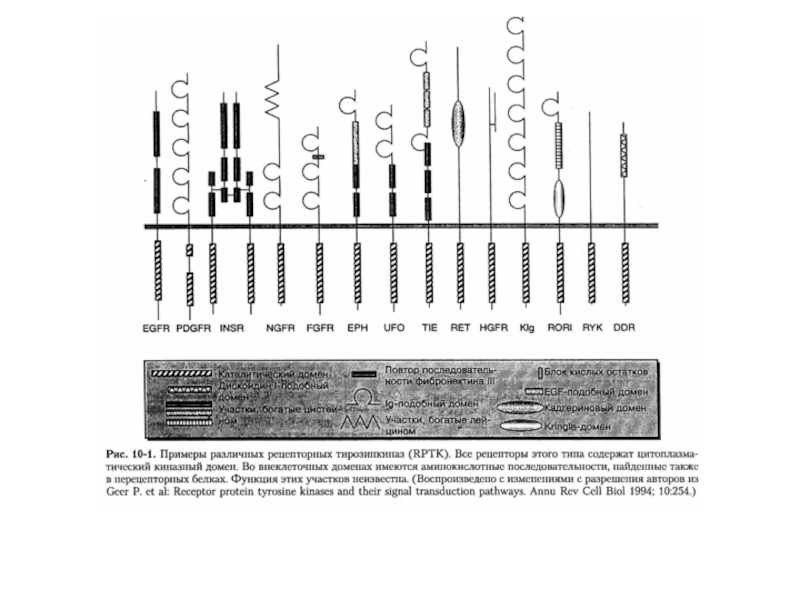
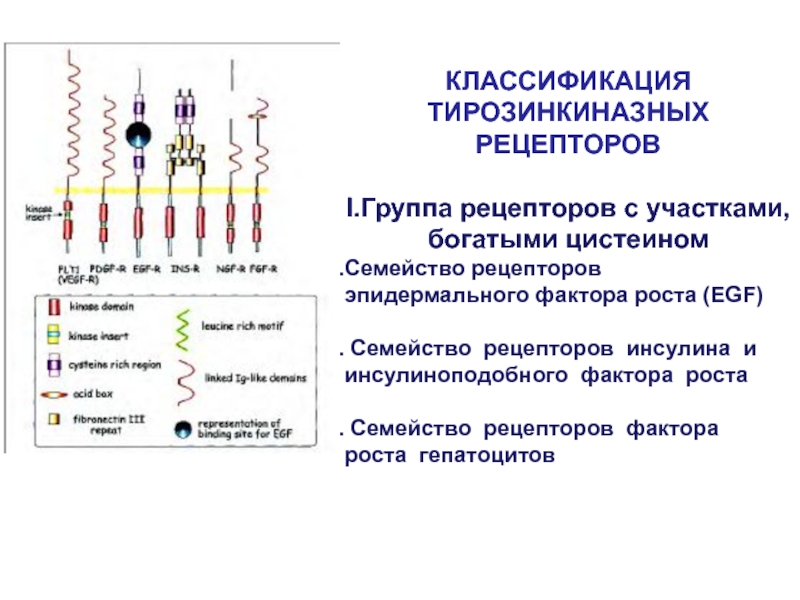
- 41. КЛАССИФИКАЦИЯ ТИРОЗИНКИНАЗНЫХ РЕЦЕПТОРОВI.Группа рецепторов с участками, богатыми
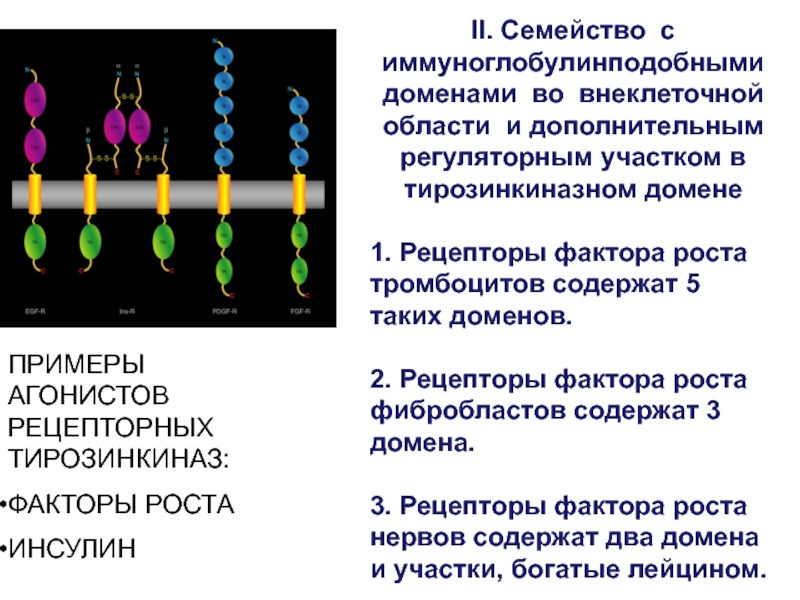
- 42. ПРИМЕРЫ АГОНИСТОВ РЕЦЕПТОРНЫХ ТИРОЗИНКИНАЗ:ФАКТОРЫ РОСТАИНСУЛИНII. Семейство с
- 43. МЕХАНИЗМ ФУНКЦИОНИРОВАНИЯ РЕЦЕПТОРНОЙ ТИРОЗИНКИНАЗЫ (РТК)ДИМЕРИЗАЦИЯ РЕЦЕПТОРОВТРАНСАВТОФОСФОРИЛИРОВАНИЕ ТИРОЗИНОВЫХ
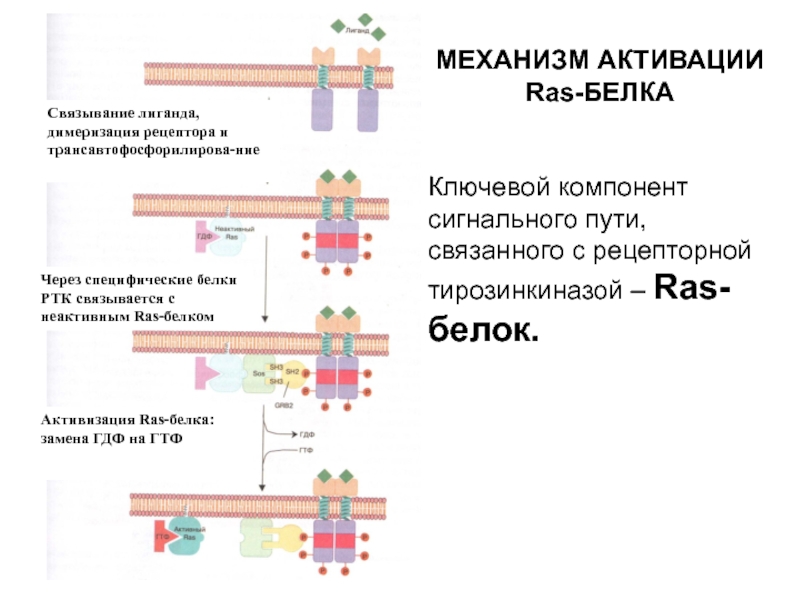
- 44. МЕХАНИЗМ АКТИВАЦИИ Ras-БЕЛКАКлючевой компонент сигнального пути, связанного
- 45. Ras-БЕЛОК – МОНОМЕРНАЯ ГТФазаВ АКТИВНОМ СОСТОЯНИИ Ras-БЕЛОК
- 46. Каскад внутриклеточных протеинкиназ, фосфорилирующих многие субстраты, в т.ч. и факторы транскрипции
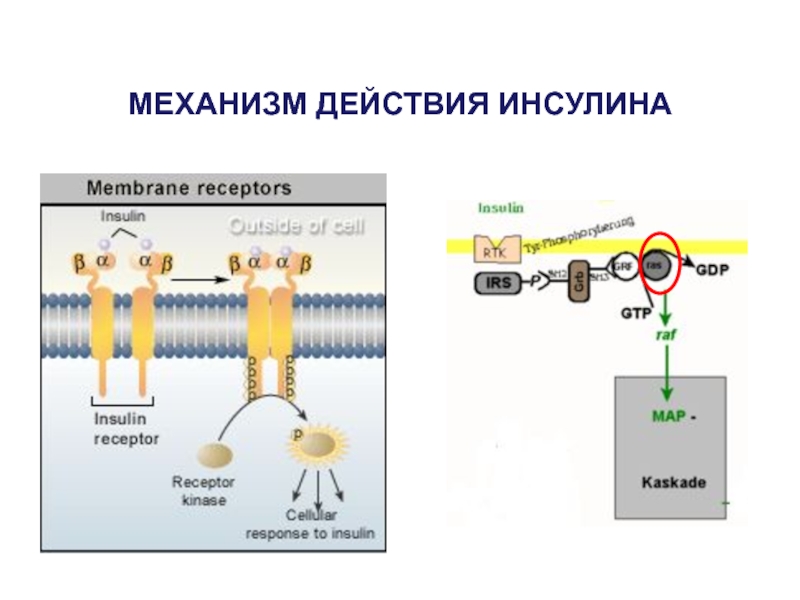
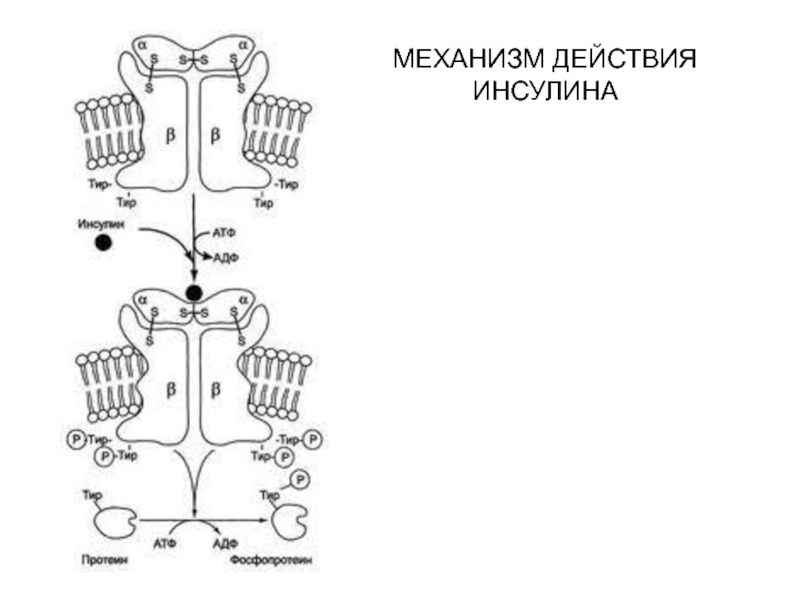
- 47. МЕХАНИЗМ ДЕЙСТВИЯ ИНСУЛИНА
- 48. МЕХАНИЗМ ДЕЙСТВИЯ ИНСУЛИНА
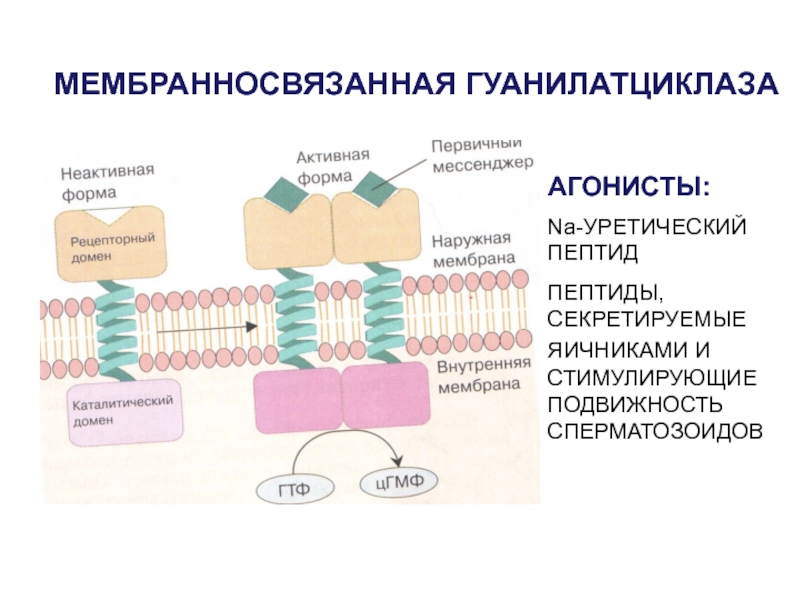
- 49. МЕМБРАННОСВЯЗАННАЯ ГУАНИЛАТЦИКЛАЗААГОНИСТЫ:Na-УРЕТИЧЕСКИЙ ПЕПТИДПЕПТИДЫ, СЕКРЕТИРУЕМЫЕ ЯИЧНИКАМИ И СТИМУЛИРУЮЩИЕ ПОДВИЖНОСТЬ СПЕРМАТОЗОИДОВ
- 50. РЕЦЕПТОРЫ, НЕ ПРОЯВЛЯЮЩИЕ ФЕРМЕНТАТИВНУЮ АКТИВНОСТЬ, НО СОПРЯЖЕННЫЕ С ТИРОЗИНКИНАЗОЙ
- 51. Эти рецепторы при активации связываются с цитоплазматическими
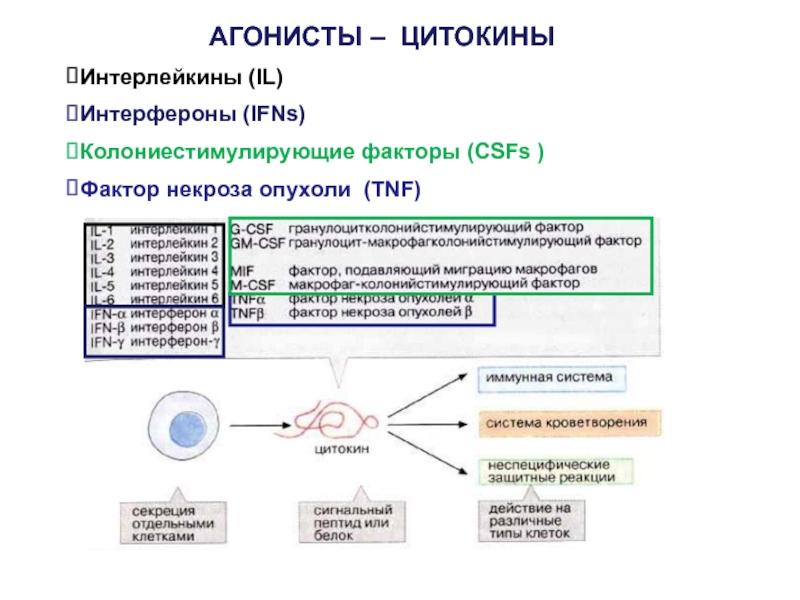
- 52. АГОНИСТЫ – ЦИТОКИНЫИнтерлейкины (IL)Интерфероны (IFNs)Колониестимулирующие факторы (CSFs )Фактор некроза опухоли (TNF)
- 53. Цитокины — группа гормоноподобных белков и пептидов
- 54. Слайд 54
- 55. ОСНОВНЫЕ ИСТОЧНИКИ И ЭФФЕКТЫ НЕКОТОРЫХ ЦИТОКИНОВ
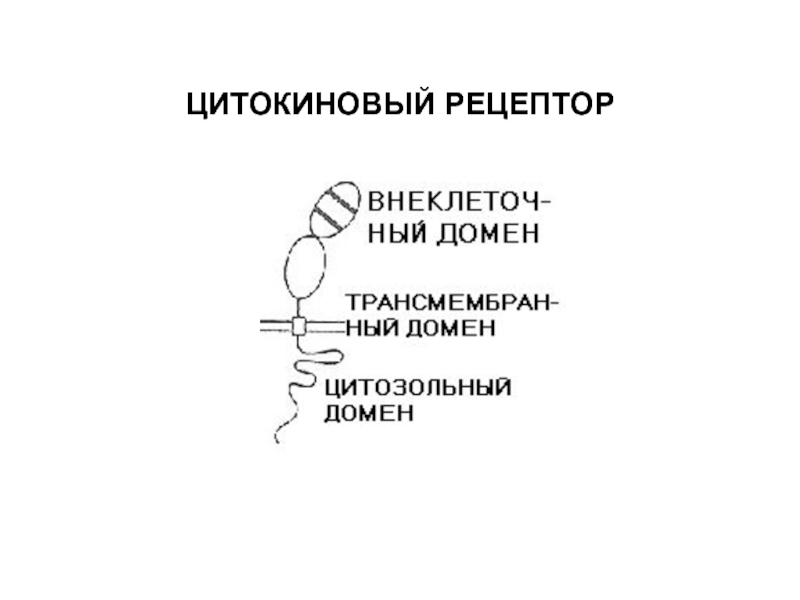
- 56. ЦИТОКИНОВЫЙ РЕЦЕПТОР
- 57. Эти рецепторы не имеют киназного участка в
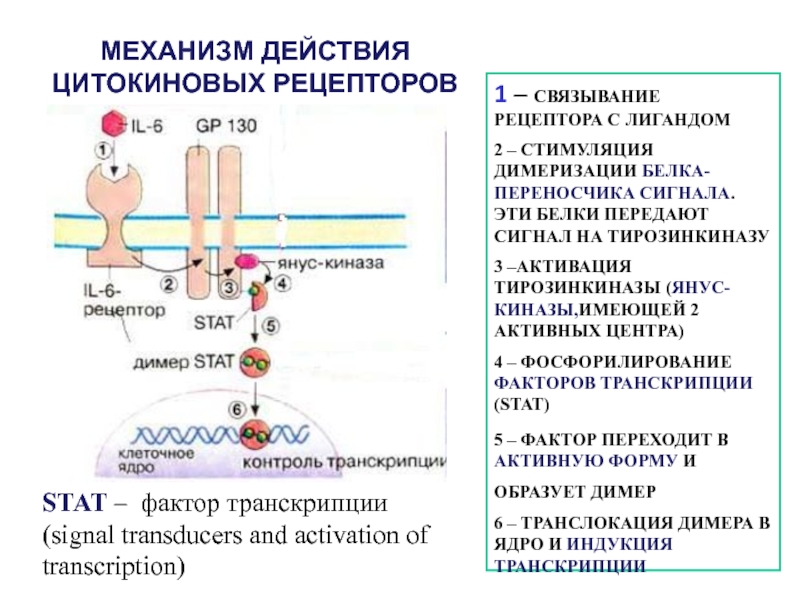
- 58. МЕХАНИЗМ ДЕЙСТВИЯ ЦИТОКИНОВЫХ РЕЦЕПТОРОВ1 – СВЯЗЫВАНИЕ РЕЦЕПТОРА
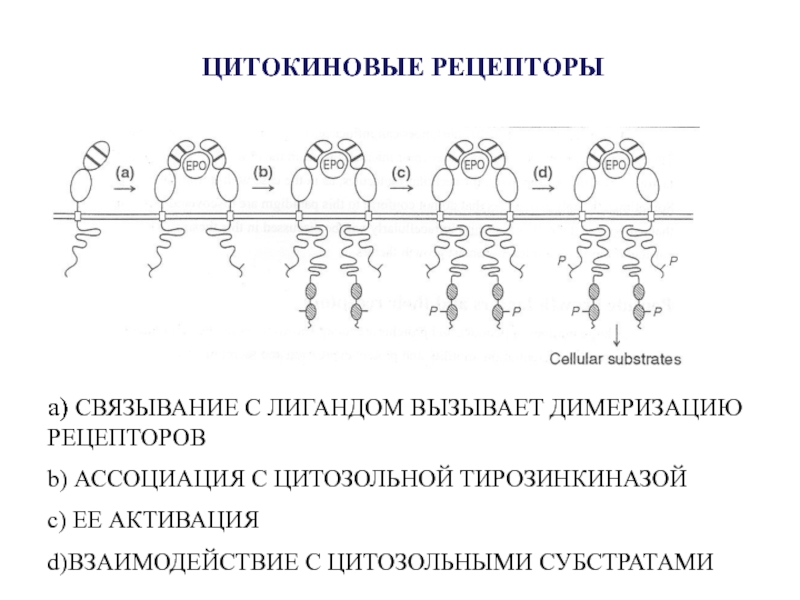
- 59. ЦИТОКИНОВЫЕ РЕЦЕПТОРЫа) СВЯЗЫВАНИЕ С ЛИГАНДОМ ВЫЗЫВАЕТ ДИМЕРИЗАЦИЮ
- 60. Слайд 60
- 61. Скачать презентанцию
РЕЦЕПТОР –СПЕЦИФИЧЕСКИЙ БЕЛОК, КОТОРЫЙ СВЯЗЫВАЕТ СИГНАЛЬНОЕ ВЕЩЕСТВО, ЧТО ПРИВОДИТ В КОНЕЧНОМ ИТОГЕ К РАЗВИТИЮ КЛЕТОЧНОЙ РЕАКЦИИ. АГОНИСТ ПЕРЕВОДИТ РЕЦЕПТОР В АКТИВНОЕ СОСТОЯНИЕ, АНТАГОНИСТ – В НЕАКТИВНОЕ.
Слайды и текст этой презентации
Слайд 2РЕЦЕПТОР –СПЕЦИФИЧЕСКИЙ БЕЛОК, КОТОРЫЙ СВЯЗЫВАЕТ СИГНАЛЬНОЕ ВЕЩЕСТВО, ЧТО ПРИВОДИТ В
КОНЕЧНОМ ИТОГЕ К РАЗВИТИЮ КЛЕТОЧНОЙ РЕАКЦИИ.
АКТИВНОЕ СОСТОЯНИЕ, АНТАГОНИСТ – В НЕАКТИВНОЕ.Слайд 4СЕЛЕКТИВНОСТЬ
СВОЙСТВО, ОСНОВАННОЕ НА СТРОГОЙ СТРУКТУРНОЙ СПЕЦИФИЧНОСТИ. ДАННЫЙ ЛИГАНД ДОЛЖЕН
БЫТЬ ЛИБО ЕДИНСТВЕННЫМ ВЕЩЕСТВОМ, СВЯЗЫВАЮЩИМСЯ С РЕЦЕПТОРОМ, ЛИБО ЭФФЕКТИВНО КОНКУРИРОВАТЬ
С ДРУГИМИ.Слайд 7СРОДСТВО К ЛИГАНДУ
НАСЫЩЕНИЕ РЕЦЕПТОРА ПРОИСХОДИТ ПРИ ФИЗИОЛОГИЧЕСКИХ КОНЦЕНТРАЦИЯХ ЛИГАНДА
АКТГ
— 0-50 пг/мл
Тироксин общий (Т4) —62-141 нмоль/л
Кальцитонин — 5,5-28 пмоль/л.
Данные приведены для плазмы крови
Слайд 8ТКАНЕВАЯ СПЕЦИФИЧНОСТЬ
СВЯЗЫВАНИЕ ЛИГАНДА С РЕЦЕПТОРОМ ПРОИСХОДИТ В ТОЙ ТКАНИ, ГДЕ
НАБЛЮДАЕТСЯ ЕГО БИОЛОГИЧЕСКОЕ ДЕЙСТВИЕ.
Слайд 10Классификация, основанная на видах агонистов, с которым взаимодействует рецептор (применяют,
как правило, для мембранных рецепторов).
НАПРИМЕР
Адренэргические
Холинэргические
Серотонинэргические
Слайд 13МЕМБРАННЫЕ РЕЦЕПТОРЫ ЯВЛЯЮТСЯ ИНТЕГРАЛЬНЫМИ БЕЛКАМИ
ОБЩИЙ ПЛАН СТРОЕНИЯ:
ВНЕКЛЕТОЧНЫЙ ДОМЕН СПЕЦИФИЧЕН
К ВНЕШНЕМУ СИГНАЛУ
ТРАНСМЕМБРАННЫЙ УЧАСТОК
УЧАСТОК, ПОГРУЖЕННЫЙ В ЦИТОПЛАЗМУ, СПЕЦИФИЧЕН К АССОЦИИРОВАННОМУ
С РЕЦЕПТОРОМ ВНУТРИКЛЕТОЧНОМУ БЕЛКУСлайд 17СВЯЗЫВАНИЕ С ЛИГАНДОМ ПРИВОДИТ К КОНФОРМАЦИОННЫМ ПЕРЕСТРОЙКАМ РЕЦЕПТОРА, ЧТО ВЫЗЫВАЕТ
ОТКРЫВАНИЕ ИОННОГО КАНАЛА
МЕХАНИЗМ РАБОТЫ РЕЦЕПТОРА-КАНАЛА
Слайд 18Электрический скат, из электрического органа которого были выделены и очищены
никотиновые холинэргические рецепторы, расшифрована их аминокислотная последовательность
Слайд 20ДРУГИЕ ПРИМЕРЫ:
РЕЦЕПТОРЫ К ГЛУТАМАТУ
РЕЦЕПТОРЫ К АСПАРТАТУ
ГЛИЦИНОВЫЕ РЕЦЕПТОРЫ
ГАМК-рецепторы
1,2 проницаемы для катионов
3,4
проницаемы для ионов хлора
Слайд 22СТРУКТУРА РЕЦЕПТОРОВ,СОПРЯЖЕННЫХ С G-БЕЛКОМ
N-концевой домен
Участки гликозилирования
С-концевой домен
Слайд 23ПРИМЕРЫ АГОНИСТОВ, ДЕЙСТВУЮЩИХ НА РЕЦЕПТОРЫ, СОПРЯЖЕННЫЕ С G-БЕЛКАМИ
АДРЕНАЛИН, НОРАДРЕНАЛИН
АЦЕТИЛХОЛИН
СЕРОТОНИН
ГИСТАМИН
ОПИОИДЫ, КАННАБИНОИДЫ
ГОРМОНЫ
ПЕПТИДНОЙ ПРИРОДЫ (АКТГ, ВАЗОПРЕССИН, АНГИОТЕНЗИН)
Слайд 26Кроме ферментов, G-белки могут взаимодействовать с ион-транспортными системами, например, каналами,
ионообменниками.
Слайд 30ВИДЫ G-БЕЛКОВ
ИДЕНТИФИЦИРОВАНО ОКОЛО 20 ВИДОВ G-БЕЛКОВ
GS И GI БЕЛКИ ДЕЙСТВУЮТ
НА АДЕНИЛАТЦИКЛАЗУ
GO ИНГИБИРУЕТ Са-КАНАЛЫ В НЕЙРОНАХ
Gq АКТИВИРУЕТ ФОСФОЛИПАЗУ C
Gk ОТКРЫВАЕТ
КАЛИЕВЫЕ КАНАЛЫ В СЕРДЕЧНЫХ И ДРУГИХ КЛЕТКАХG-БЕЛКИ СЕНСОРНЫХ КЛЕТОК (ТРАНСДУЦИН ИЛИ Gt В ПАЛОЧКАХ И ДР.)
G-белки, отмеченные цветом, выделены и очищены
Слайд 31ИСПОЛЬЗОВАНИЕ БАКТЕРИАЛЬНЫХ ТОКСИНОВ ПОЗВОЛИЛО ОБНАРУЖИТЬ ДВА ВИДА G-БЕЛКОВ ПО ОТНОШЕНИЮ
К АДЕНИЛАТЦИКЛАЗЕ
стимулирующий
ингибирующий
Холерный токсин
Коклюшный токсин
Слайд 33Холерный токсин, также как и коклюшный, содержит фермент АДФ-рибозилазу.
АДФрибозилирование
α-субъединицы GS белка приводит к ее необратимому активированию, т.е. препятствует
гидролизу ГТФ. Итог – активация аденилатциклазы и непрекращающаяся наработка цАМФ.АДФрибозилирование α-субъединицы GI белка препятствует его диссоциации на субъединицы. Результат – устранение ингибирующего действия на аденилатциклазу, и она остается активной.
Слайд 38Факторы роста (GF) или митогены
стимулируют рост клетки и ее
прохождение через митоз.
GF - полипептиды, состоящие из 50-100 аминокислот.
Слайд 39РЕЦЕПТОРНАЯ ТИРОЗИНКИНАЗА
1 – внеклеточный N-концевой участок, связывающий агонисты;
2 – трансмембранный
участок;
3 – внутриклеточный тирозинкиназный домен
1
2
3
Слайд 41КЛАССИФИКАЦИЯ ТИРОЗИНКИНАЗНЫХ РЕЦЕПТОРОВ
I.Группа рецепторов с участками, богатыми цистеином
Семейство рецепторов эпидермального
фактора роста (EGF)
Семейство рецепторов инсулина и инсулиноподобного фактора
роста Семейство рецепторов фактора роста гепатоцитов
Слайд 42ПРИМЕРЫ АГОНИСТОВ РЕЦЕПТОРНЫХ ТИРОЗИНКИНАЗ:
ФАКТОРЫ РОСТА
ИНСУЛИН
II. Семейство с иммуноглобулинподобными доменами во
внеклеточной области и дополнительным регуляторным участком в тирозинкиназном домене
1. Рецепторы
фактора роста тромбоцитов содержат 5 таких доменов. 2. Рецепторы фактора роста фибробластов содержат 3 домена.
3. Рецепторы фактора роста нервов содержат два домена и участки, богатые лейцином.
Слайд 43МЕХАНИЗМ ФУНКЦИОНИРОВАНИЯ РЕЦЕПТОРНОЙ ТИРОЗИНКИНАЗЫ (РТК)
ДИМЕРИЗАЦИЯ РЕЦЕПТОРОВ
ТРАНСАВТОФОСФОРИЛИРОВАНИЕ ТИРОЗИНОВЫХ ОСТАТКОВ
ФОРМИРОВАНИЕ УЧАСТКОВ ДЛЯ
СВЯЗЫВАНИЯ БЕЛКОВ-СУБСТРАТОВ, СОДЕРЖАЩИХ SH2 и SH3 ДОМЕНЫ
ФОСФОРИЛИРОВАНИЕ СВЯЗЫВАЮЩИХСЯ С РТК
БЕЛКОВСлайд 44МЕХАНИЗМ АКТИВАЦИИ Ras-БЕЛКА
Ключевой компонент сигнального пути, связанного с рецепторной тирозинкиназой
– Ras-белок.
Через специфические белки РТК связывается с неактивным Ras-белком
Активизация Ras-белка:
замена ГДФ на ГТФСвязывание лиганда, димеризация рецептора и трансавтофосфорилирова-ние
Слайд 45Ras-БЕЛОК – МОНОМЕРНАЯ ГТФаза
В АКТИВНОМ СОСТОЯНИИ Ras-БЕЛОК КОНТАКТИРУЕТ С ГТФ,
В НЕАКТИВНОМ – С ГДФ
АКТИВАЦИЯ И ИНАКТИВАЦИЯ Rаs-БЕЛКА ОСУЩЕСТВЛЯЕТСЯ ДВУМЯ
СПЕЦИФИЧЕСКИМИ БЕЛКАМИ (GEF и GAP)ПОСЛЕ АКТИВАЦИИ Ras-БЕЛКА В ПРОЦЕСС ВКЛЮЧАЕТСЯ НЕСКОЛЬКО ВНУТРИКЛЕТОЧНЫХ КИНАЗ (КИНАЗНЫЙ КАСКАД)
ЭФФЕКТ – ДЕЛЕНИЕ КЛЕТОК
Слайд 46
Каскад внутриклеточных протеинкиназ, фосфорилирующих многие субстраты, в т.ч. и факторы
транскрипции
Слайд 49МЕМБРАННОСВЯЗАННАЯ ГУАНИЛАТЦИКЛАЗА
АГОНИСТЫ:
Na-УРЕТИЧЕСКИЙ ПЕПТИД
ПЕПТИДЫ, СЕКРЕТИРУЕМЫЕ ЯИЧНИКАМИ И СТИМУЛИРУЮЩИЕ ПОДВИЖНОСТЬ СПЕРМАТОЗОИДОВ
Слайд 51Эти рецепторы при активации связываются с цитоплазматическими тирозинкиназами и
образуют
сигнальный комплекс.
Рецепторы цитокинов
Рецепторы антигенов на Т-
и В-лимфоцитахFc – рецепторы
Слайд 52АГОНИСТЫ – ЦИТОКИНЫ
Интерлейкины (IL)
Интерфероны (IFNs)
Колониестимулирующие факторы (CSFs )
Фактор некроза опухоли
(TNF)
Слайд 53Цитокины — группа гормоноподобных белков и пептидов
синтезируются и секретируются
клетками иммунной системы и другими типами клеток.
ФУНКЦИИ цитокинов:
управляют
развитием и гомеостазом иммунной системыосуществляют контроль за ростом и дифференцировкой клеток крови (системой гемопоэза)
принимают участие в неспецифических защитных реакциях организма, оказывая влияние на воспалительные процессы, свертывание крови, кровяное давление
принимают участие в регуляции роста, дифференцировки и продолжительности жизни клеток, а также в управлении апоптозом
Слайд 57Эти рецепторы не имеют киназного участка в своем составе и
фосфорилируются особыми цитоплазматическими киназами (JANUS KINASES - JAKs).
Расположены на внутренней
поверхности мембраны вблизи рецептора.JAKs фосфорилируют остатки тирозина как на рецепторах, так и на сигнальных белках, связывающихся с рецепторами.
Слайд 58МЕХАНИЗМ ДЕЙСТВИЯ ЦИТОКИНОВЫХ РЕЦЕПТОРОВ
1 – СВЯЗЫВАНИЕ РЕЦЕПТОРА С ЛИГАНДОМ
2 –
СТИМУЛЯЦИЯ ДИМЕРИЗАЦИИ БЕЛКА-ПЕРЕНОСЧИКА СИГНАЛА. ЭТИ БЕЛКИ ПЕРЕДАЮТ СИГНАЛ НА ТИРОЗИНКИНАЗУ
3
–АКТИВАЦИЯ ТИРОЗИНКИНАЗЫ (ЯНУС-КИНАЗЫ,ИМЕЮЩЕЙ 2 АКТИВНЫХ ЦЕНТРА)4 – ФОСФОРИЛИРОВАНИЕ ФАКТОРОВ ТРАНСКРИПЦИИ (STAT)
5 – ФАКТОР ПЕРЕХОДИТ В АКТИВНУЮ ФОРМУ И ОБРАЗУЕТ ДИМЕР
6 – ТРАНСЛОКАЦИЯ ДИМЕРА В ЯДРО И ИНДУКЦИЯ ТРАНСКРИПЦИИ
STAT – фактор транскрипции (signal transducers and activation of transcription)