Слайд 1Регуляція ферментативної активності шляхом просторового роз’єднання
Дисоціативна регуляція
Адсорбційна регуляція
Слайд 2Дисоціативна регуляція
1. Типи структур, що утворюються при асоціації білкових
молекул.
2. Характер розподілу ферментативної активності серед олігомерних форм ферменту.
3. Вплив специфічних лігандів на положення рівноваги між олігомерними формами ферментів.
4. Динамічна мікрокомпартменталізація метаболітів.
Слайд 3Типи структур, що утворюються при асоціації білкових молекул
Ізологічна асоціація -
асоціація, елементарною стадією якої є взаємодія 2-х ідентичних центрів асоціації,
розташованих на білкових субодиницях;
асоціація білкових субодиниць веде до утворення "замкнених" олігомерних структур.
Гетерологічна асоціація - тобто асоціація, елементарною стадією якої є взаємодія 2-х різнорідних центрів асоціації;
асоціація молекул ферменту супроводжується утворенням асоціатів необмеженої довжини.
Мi+ Mj <=> Mi+j (K = [Mi+j]/ [Mi][Mj]) – ідентичні при
утворенні контактів одного типу
Слайд 4Ізологічна асоціація
NADP-залежна ізоцитратдегідрогеназа
система типу
мономер димер з молекулярною
масою 115 кД
глікогенфосфорилаза b з скелетних м'язів кроля
димер
тетрамер, молекулярна маса димеру 194,8 кД
Слайд 5Гетерологічна асоціація
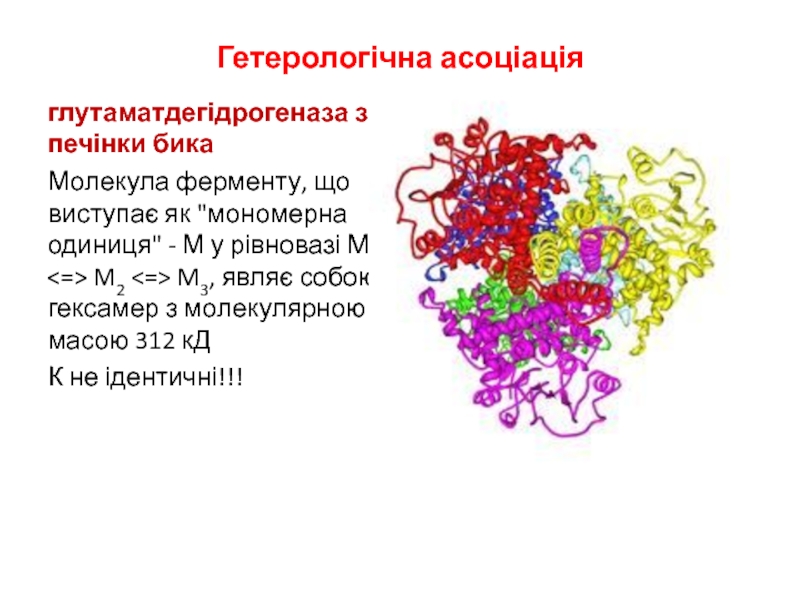
глутаматдегідрогеназа з печінки бика
Молекула ферменту, що виступає як
"мономерна одиниця" - М у рівновазі М M2
M3, являє собою гексамер з молекулярною масою 312 кД
К не ідентичні!!!
Слайд 6Характер розподілу ферментативної активності серед олігомерних форм ферменту
неактивний мономер
активний димер
а=v/ [E] – не є сталою при
зміні концентрації ферменту!!!
А- залежність питомої ферментативної активності NADP-залежної ізоцитратдегідрогенази із серця свині від концентрації ферменту, розрахованої на мономер [E]0; 0,1 мМ NADP; рН 7,4; 25 °С; [ Dl-ізоцитрат]: 1- 5мкм, 2- 10 мкм.
Б- лінійна анаморфоза
Слайд 7Характер розподілу ферментативної активності серед олігомерних форм ферменту
активний димер
неактивний тетрамер
Н:глікогенфосфорилаза b з скелетних м'язів кроля
Слайд 8Характер розподілу ферментативної активності серед олігомерних форм ферменту
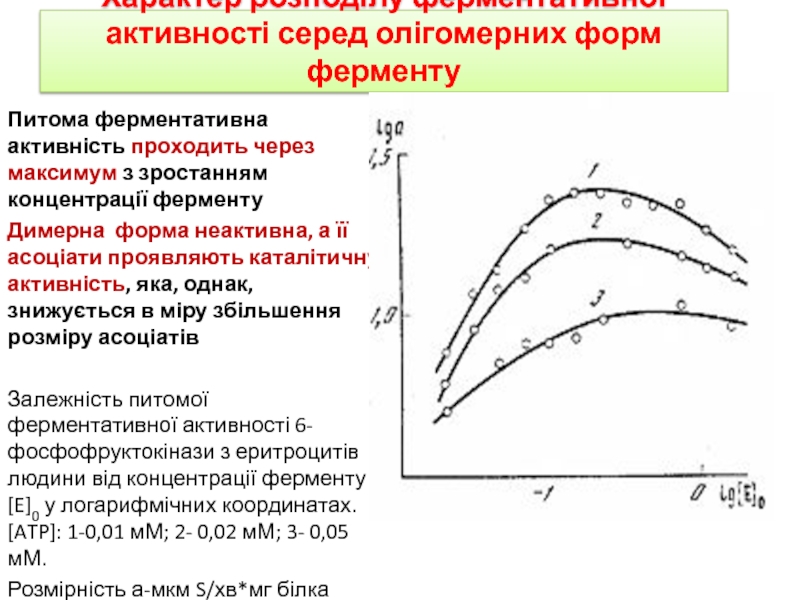
Питома ферментативна активність
проходить через максимум з зростанням концентрації ферменту
Димерна форма неактивна,
а її асоціати проявляють каталітичну активність, яка, однак, знижується в міру збільшення розміру асоціатів
Залежність питомої ферментативної активності 6-фосфофруктокінази з еритроцитів людини від концентрації ферменту [E]0 у логарифмічних координатах. [ATP]: 1-0,01 мМ; 2- 0,02 мМ; 3- 0,05 мМ.
Розмірність а-мкм S/хв*мг білка
Слайд 9Вплив специфічних лігандів на положення рівноваги між олігомерними формами ферментів
зв'язування
специфічних лігандів приводить до конформаційних змін білкової молекули, що стосуються
центрів асоціації, відповідальних за білок-білкові взаємодії.
Н: асоціація димерів глікогенфосфорилази b у тетрамери під дією АМР
центри зв'язування специфічних лігандів розташовуються в зонах, що беруть участь у білок-білкових взаємодіях, і стерично екрануються при утворенні білкових асоціатів
Н: глікогенфосфорилаза b: амінокислотні залишки, що входять у центр запасання глікогену, залучаються в димер-димерні контакти в тетрамері. Тому тетрамер не здатний зв'язувати глікоген. В умовах існуючої рухомої рівноваги димер <=> тетрамер глікоген проявляє дисоціюючу дію.
Слайд 10Динамічна мікрокомпартменталізація метаболітів
Модель регуляції гліколізу, що враховує утворення динамічних комплексів
ферментів.
А й Б - високий і низький рівні фруктозо-1,
6-біфосфату (Fru-1,6-P2). FBPаза - фруктозо-1, 6-біфосфатаза; PFK - 6-фосфофруктокіназа; ALD - фруктозобіфосфатальдолаза; GAPD - гліцеральдегідфосфатдегідрогеназа; Fru-6-P - фруктозо-6-фосфат; G-3-P - гліцеральдегід-3-фосфат; DHAP - діоксиацетонфосфат; GPD - d-гліцероілфосфат. .
Слайд 11Адсорбційний механізм регуляції активності ферментів
Фізіологічна важливість оборотного зв'язування ферментів субклітинними
структурами.
Адсорбційний механізм регуляції. Зміна властивостей ферменту.
Фізіологічні наслідки адсорбції
ферментів. Компартменталізація метаболітів.
Слайд 12Фізіологічна важливість оборотного зв'язування ферментів субклітинними структурами
а) оборотна адсорбція ферментів
може приводити до зміни їх каталітичних і регуляторних властивостей і,
отже, бути чинником, що регулює активність ферментів;
б) адсорбція ферментів може забезпечувати компартменталізацію метаболітів у поверхні, на якій адсорбовані ці ферменти;
в) адсорбовані ферменти можуть утворювати впорядковані мультиферментні структури (метаболони), завдяки чому з'являється можливість регулювати метаболічний процес як єдине ціле;
г) ферменти, адсорбовані на білкових порах мембран, можуть брати участь в активному транспорті метаболітів через мембрану;
д) адсорбовані ферменти більш стабільні, чим вільні ферменти й таким чином, адсорбція може служити фактором, що знижує швидкість деградації ферментів у клітині.
Слайд 13Адсорбційний механізм регуляції
Передумови існування
1) існування оборотної рівноваги між вільною
формою ферменту й адсорбованим ферментом;
2) зміна каталітичних характеристик ферменту
при адсорбції;
3) чутливість рухомої рівноваги між вільною й зв'язаною формами ферменту до присутності клітинних метаболітів
Слайд 14Адсорбційний механізм регуляції
Зміна активності 6-фосфофруктокінази при адсорбції на еритроцитах людини:
а-
залежності швидкості ферментативної реакції, що каталізується вільною 6-фосфофруктокіназою (1) і
мембраноз’вязаним ферментом (2), від концентрації фруктозо-6-фосфату (1 мМ АТР);
б- залежності швидкості ферментативної реакції, що каталізується вільною 6-фосфофруктокіназою (1) і мембрано-зв'язаним ферментом (2), від концентрації АТР (0,2 мМ фруктозо-6-фосфат)
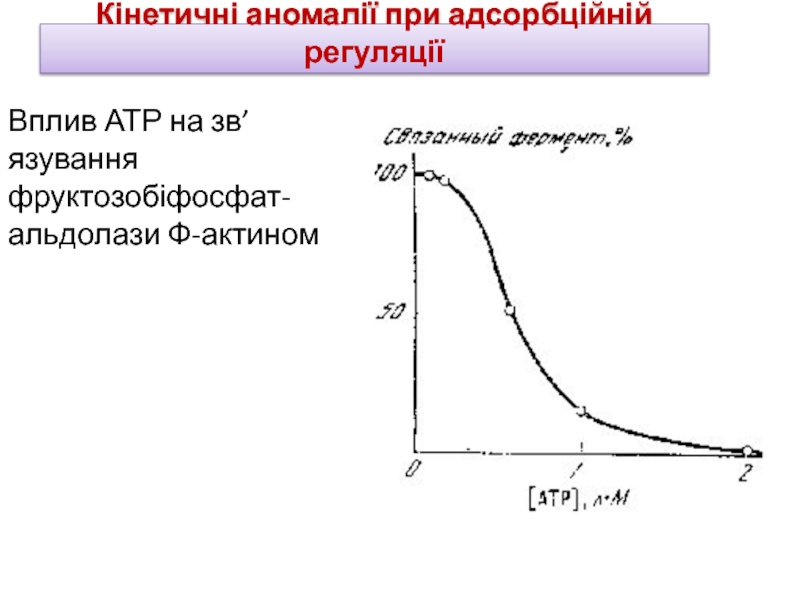
Слайд 15Кінетичні аномалії при адсорбційній регуляції
Вплив АТР на зв’язування фруктозобіфосфат-альдолази Ф-актином
Слайд 16Аллотопія
Зміна фізико-хімічних властивостей ферменту під впливом мембранного оточення
Слайд 17Причини зміни каталітичних і регуляторних властивостей ферменту при адсорбції на
субклітинних структурах
зміна конформації білкової молекули
стеричне екранування активних або алостеричних центрів
зміна
мікрооточення молекули ферменту, що супроводжує перехід ферменту з вільного стану в адсорбований.
Слайд 18Кінетична поведінка адсорбційної ферментативної системи, у якій адсорбована форма ферменту
не зв'язує субстрат (n=4).
Е + А ЕА
при
оборотній адсорбції мономерного ферменту (n=1) можливе зниження чутливості швидкості ферментативної реакції до зміни концентрації субстрату
а- теоретична залежність відносної швидкості ферментативної реакції v/V від безрозмірної концентрації субстрату [S]0/Kм;
б- залежність порядку швидкості ферментативної реакції по субстрату (ns) від відношення v/V; пунктирна лінія відповідає випадку, коли виконується міхаелісова кінетика; K0[A]0 = 100; значення безрозмірної концентрації ферменту К0[E]0: 1- К0[E]0 → 0; 2- 40; 3- 80 і 4- 100
Слайд 19Фізіологічні наслідки адсорбції ферментів. Компартменталізація метаболітів
“естафета біля поверхні"
Слайд 20Регуляція ковалентним зв’язуванням
Слайд 22Участь у активному транспорті
Периферические мембрано-связанные ферменты могут участвовать в активном
транспорте метаболитов через мембрану за счет энергии ферментативной реакции, катализирумой
ферментом. Возможно, подобным образом функционирует гексокиназа, адсорбированная на порине, встроенном во внешнюю мембрану митохондрий. Известно, что адсорбированная гексокиназа эффективно использует синтезируемый митохондриями АТР. Не исключено, что транспорт адениновых нуклеотидов через порин сопряжен с действием гексокиназы
Слайд 23Підсумок
Аллостерический, диссоциативный и адсорбционный механизмы регуляции активности ферментов обеспечивают регуляцию
метаболических процессов на уровне ферментов. У Надмолекулярных структур появляется новый,
иерархически более высокий регуляторный механизм. Важность изучения структурных уровней, соответствующих биомакромолекулам и надмолекулярным комплексам, состоит в том, что они играют роль стандартных блоков (транспортные, ферментные, сократительные, рецепторные, энергизирующие) в построении более высоких структурных уровней (клетка, орган, ткань, системы органов, организм), выполняющих более сложные функции и регулируемые с участием иерархически более важных регуляторных механизмов. В целом эволюция осуществляется с помощью комбинации одних и тех же универсальных блоков, что приводит к возникновению функциональных блоков более высокого ранга, которые обладают новыми, уникальными функциями.




![Регуляція ферментативної активності шляхом просторового роз ’ єднання Характер розподілу ферментативної активності серед олігомерних форм ферменту неактивний мономер активний Характер розподілу ферментативної активності серед олігомерних форм ферменту неактивний мономер активний димер а=v/ [E] –](/img/thumbs/cbabd9acfe5e4cf9bfb2bf154083d013-800x.jpg)