Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Репликация ДНК и Биосинтез белка
Содержание
- 1. Репликация ДНК и Биосинтез белка
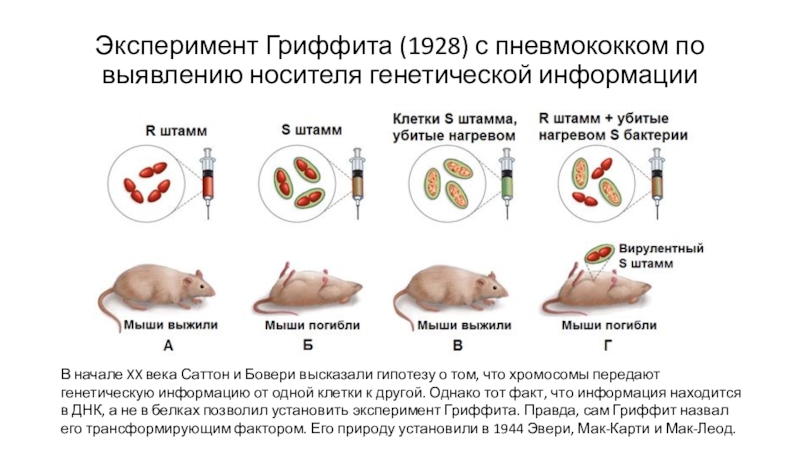
- 2. Эксперимент Гриффита (1928) с пневмококком по выявлению
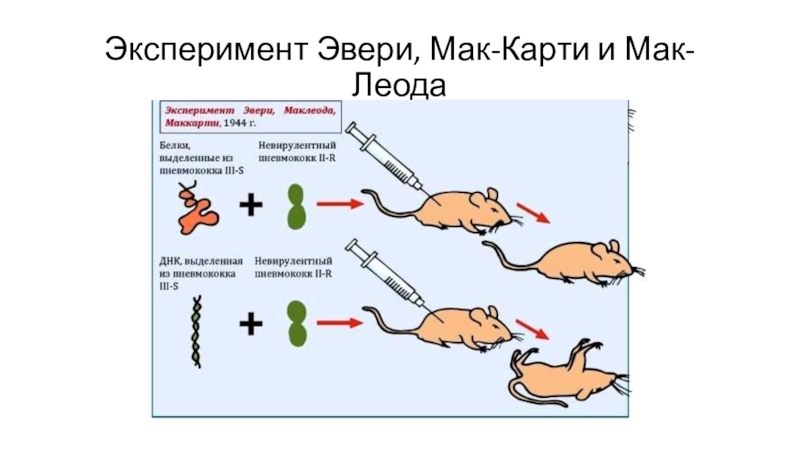
- 3. Эксперимент Эвери, Мак-Карти и Мак-Леода
- 4. Компетентность бактерий
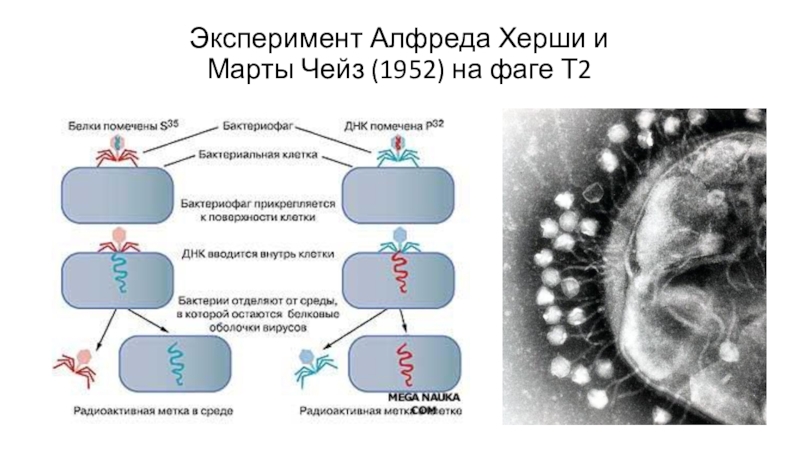
- 5. Эксперимент Алфреда Херши и Марты Чейз (1952) на фаге Т2
- 6. Предпосылки для определения структуры ДНКПравило Чарграффа (1949-1951)Снимки Розалинды Франклин
- 7. Структура ДНКОткрыли Джеймс Уотсон и Френсис Крик
- 8. Гипотезы репликации ДНКПервую гипотезу полуконсервативной репликации ДНК
- 9. Эксперимент Мезенсона и Сталя (1958)Ранее (1956), Корнберг показал возможность синтеза двуцепочечной ДНК на одной цепи.
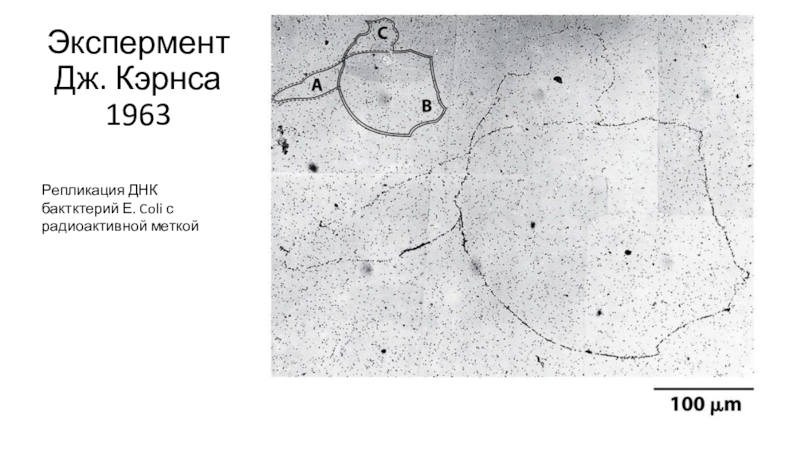
- 10. Экспермент Дж. Кэрнса 1963Репликация ДНК бактктерий Е. Coli с радиоактивной меткой
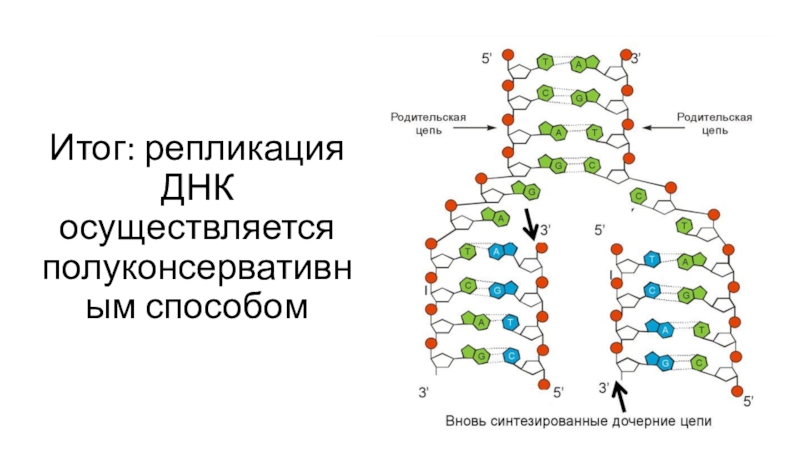
- 11. Итог: репликация ДНК осуществляется полуконсервативным способом
- 12. Репликация – двунаправленный процессБиологический смысл: передача генетической информации следующим поколениям
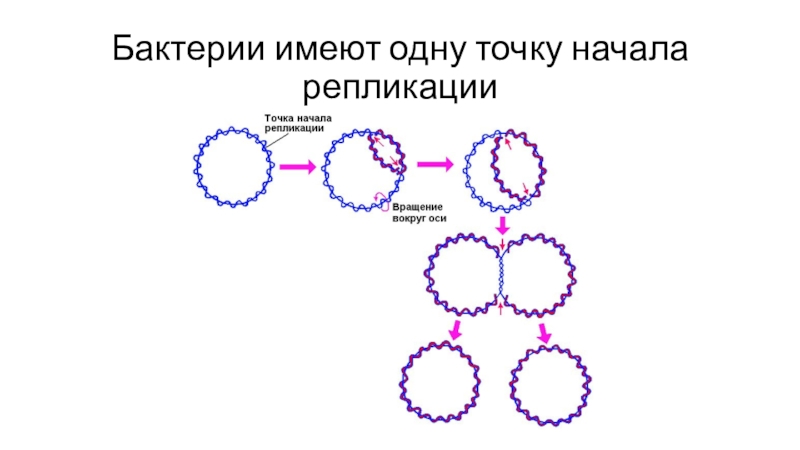
- 13. Бактерии имеют одну точку начала репликации
- 14. Инициация репликацииУ Escherichia coli в области точки
- 15. Функция ДНК-хеликазы и SSB белков (1968)
- 16. Репликация ДНК
- 17. Рейдзи Оказаки доказал прерывистость синтеза отстающей цепи
- 18. Цунеко Оказаки доказала необходимость РНК-затравки (1985)Она использовала
- 19. Функция праймазыПраймаза активируется ДНК-хеликазой и комплекс называется праймосомой
- 20. Топоизомеразы убирают супервитки с затратой АТФТопоизомераза I
- 21. Элонгация и терминация репликации ДНКДНКП обладают еще
- 22. Репликация ДНК эукариотИнициирует репликацию ДНК-полимераза α, которая
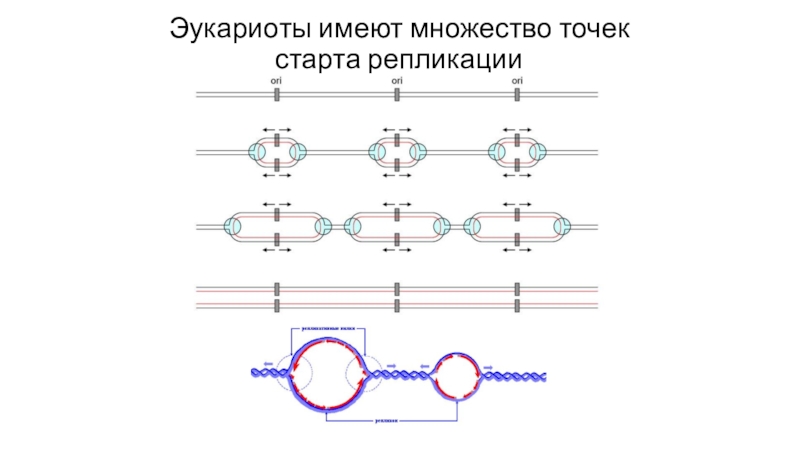
- 23. Эукариоты имеют множество точек старта репликации
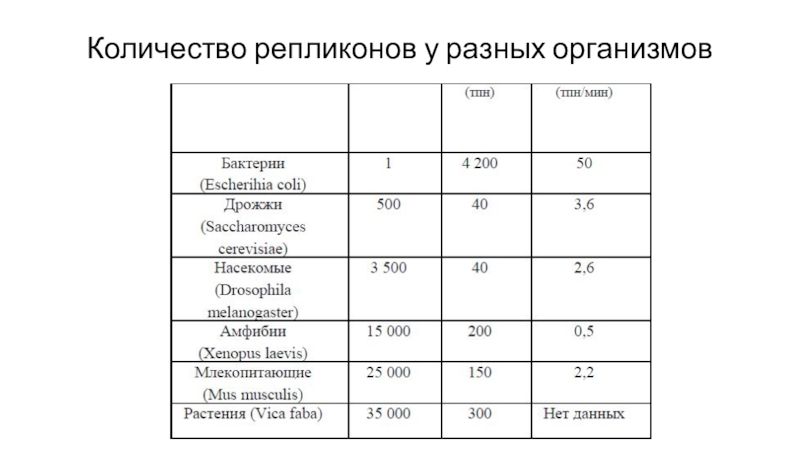
- 24. Количество репликонов у разных организмов
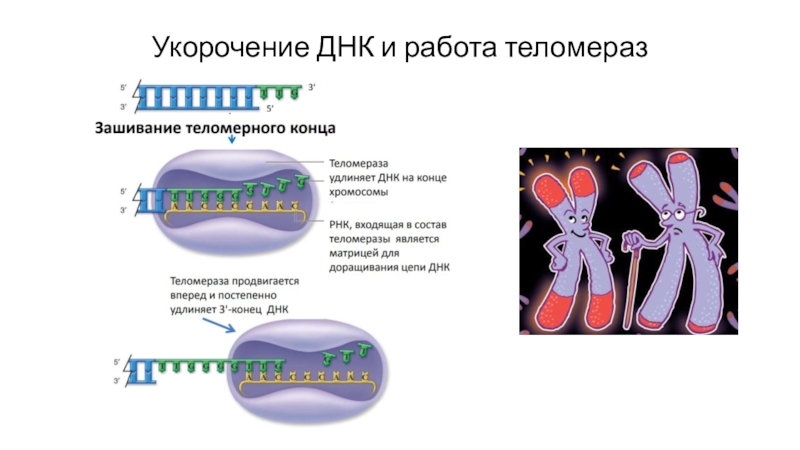
- 25. Укорочение ДНК и работа теломераз
- 26. Центральная догма молекулярной биологииобобщающее наблюдаемое в природе
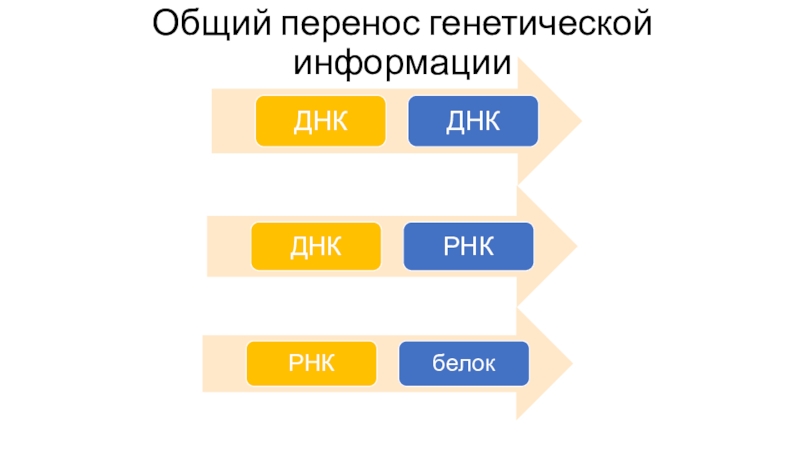
- 27. Общий перенос генетической информации
- 28. Специализированный перенос генетической информацииРНК-содержащие вирусыРетровирусыВозможно in vitro
- 29. Обратная транскриптазаА. Для синтеза первой («минусовой») цепи
- 30. Запрещенный перенос генетической информации
- 31. Свойства генетического кодаГенетический код - это система
- 32. Триплетность генетического кодаКак в последовательности из 4
- 33. Вырожденность (избыточность) и однозначность генетического кода
- 34. Знаки препинания
- 35. Универсальность генетического кода
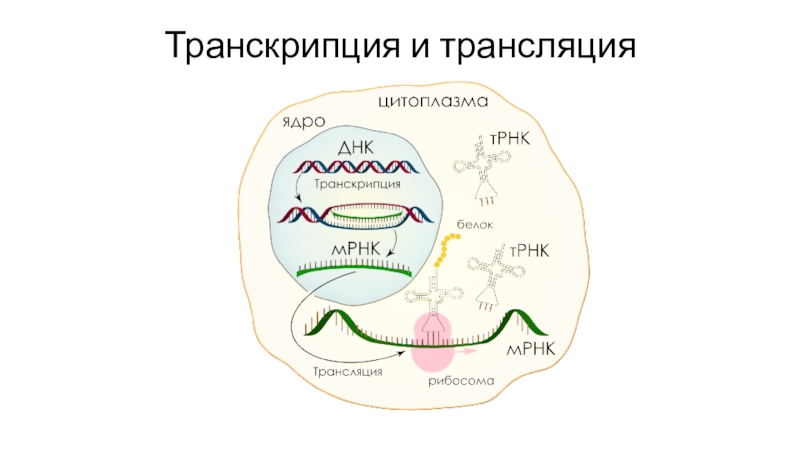
- 36. Транскрипция и трансляция
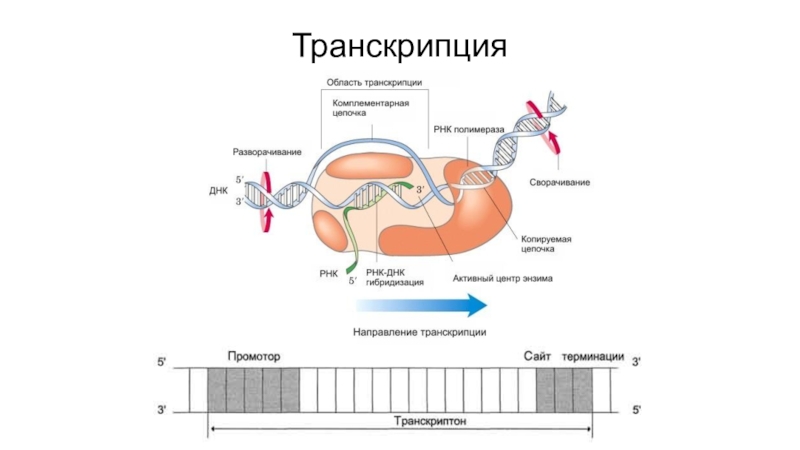
- 37. Транскрипция
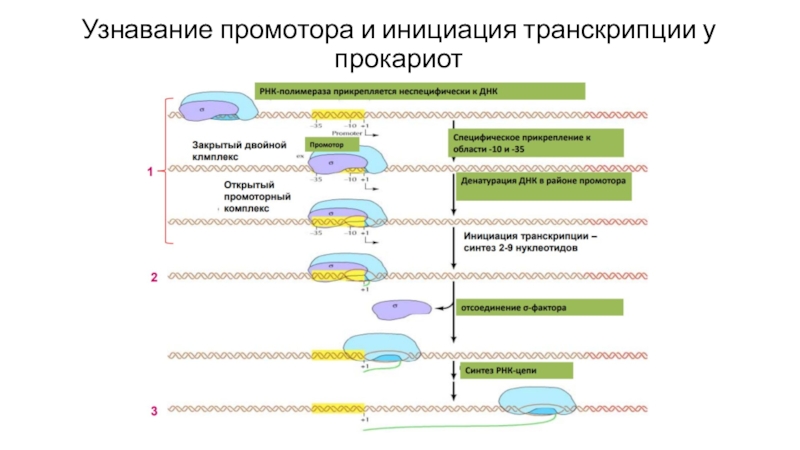
- 38. Узнавание промотора и инициация транскрипции у прокариот
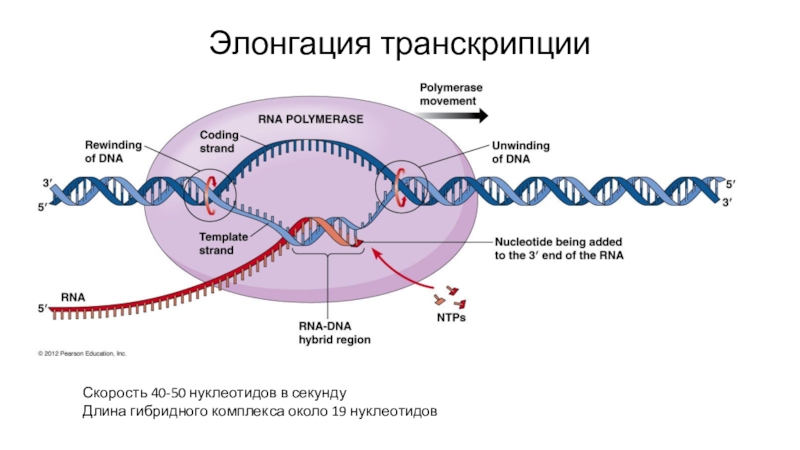
- 39. Элонгация транскрипцииСкорость 40-50 нуклеотидов в секундуДлина гибридного комплекса около 19 нуклеотидов
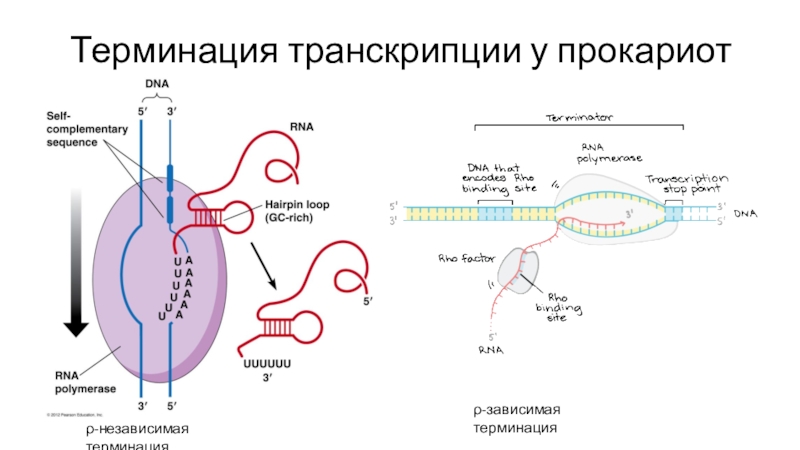
- 40. Терминация транскрипции у прокариотρ-независимая терминацияρ-зависимая терминация
- 41. Ингибиторы транскрипции прокариотРифампицин - Полусинтетический антибиотик широкого
- 42. Исследование РНК-полимеразы IIНобелевская премия по химии в
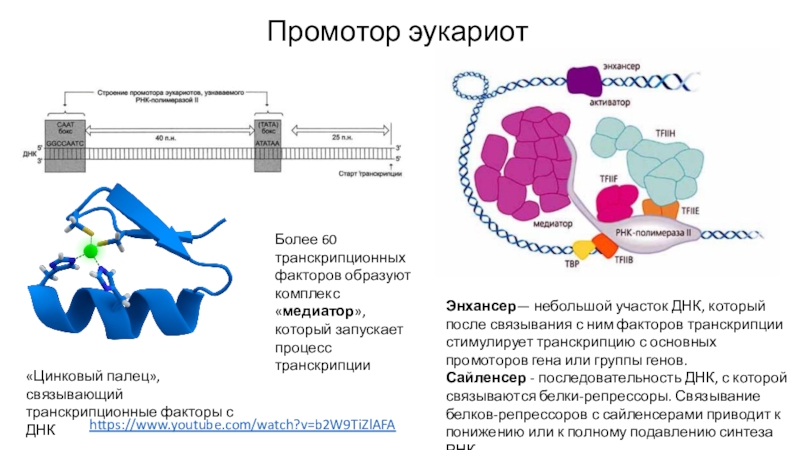
- 43. Промотор эукариот«Цинковый палец», связывающий транскрипционные факторы с
- 44. РНК-полимеразы эукариотРНК‐полимераза I – синтез рРНК (28S, 18S и 5,8S
- 45. Бледные поганки блокируют работу РНК-полимеразыАльфа-аманитинАльфа-аманитин обладает необычно
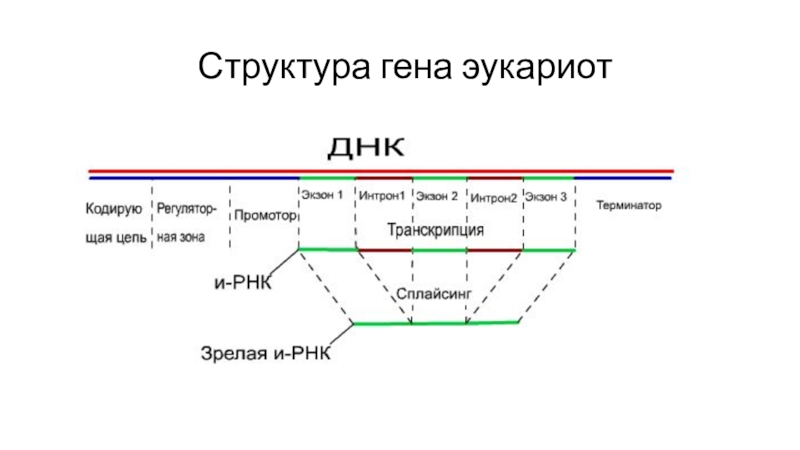
- 46. Структура гена эукариот
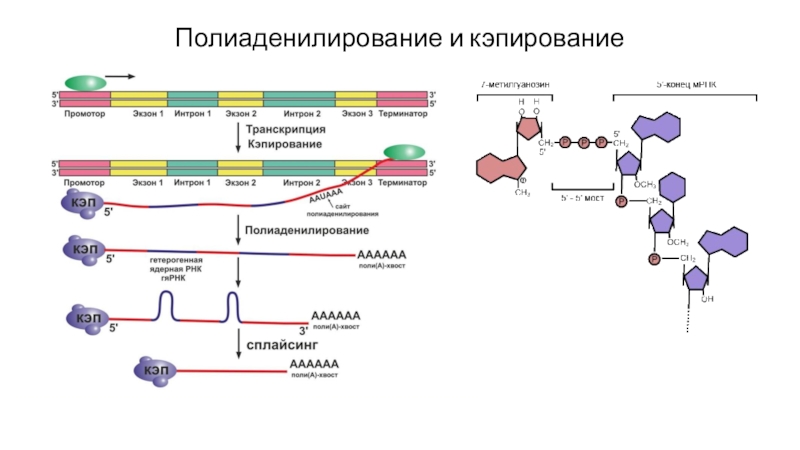
- 47. Полиаденилирование и кэпирование
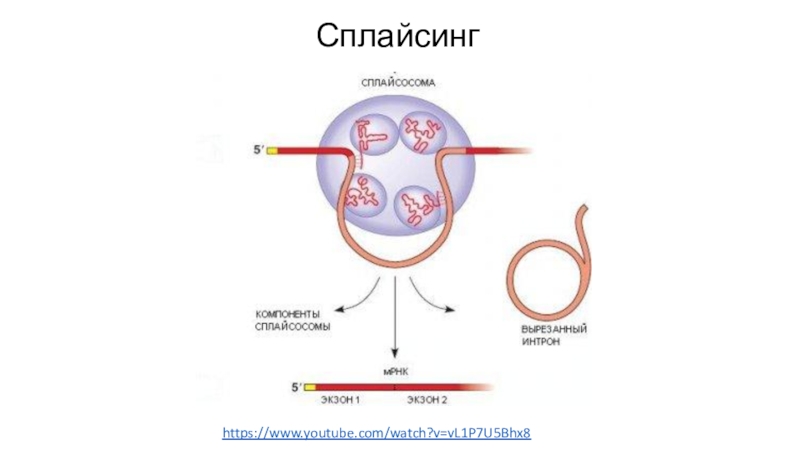
- 48. Сплайсингhttps://www.youtube.com/watch?v=vL1P7U5Bhx8
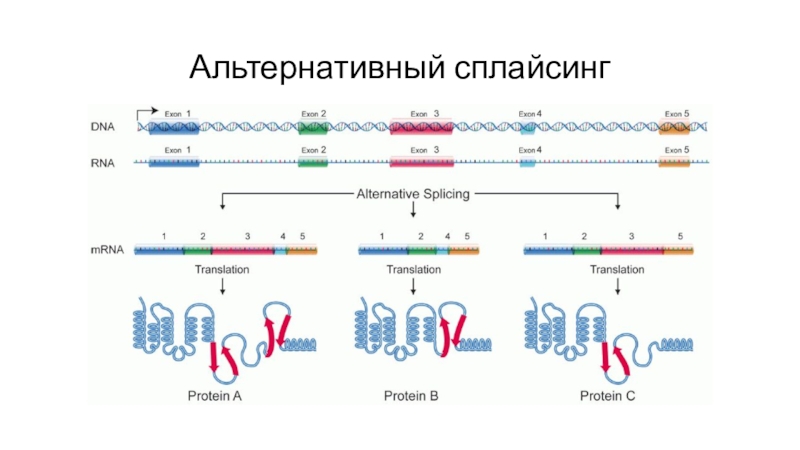
- 49. Альтернативный сплайсинг
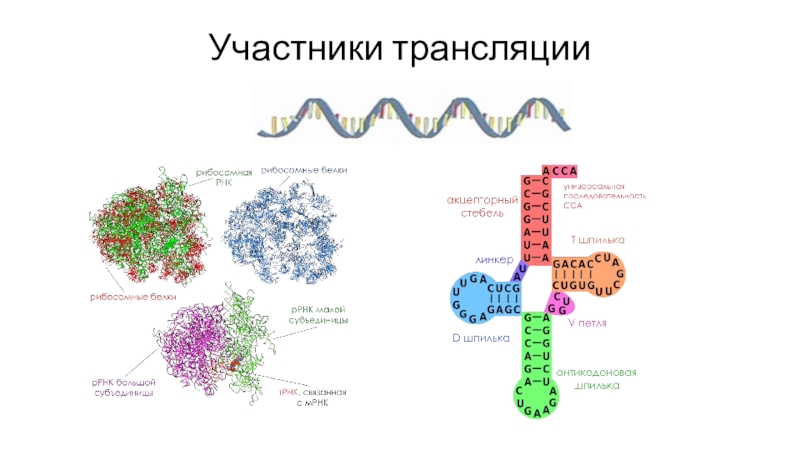
- 50. Участники трансляции
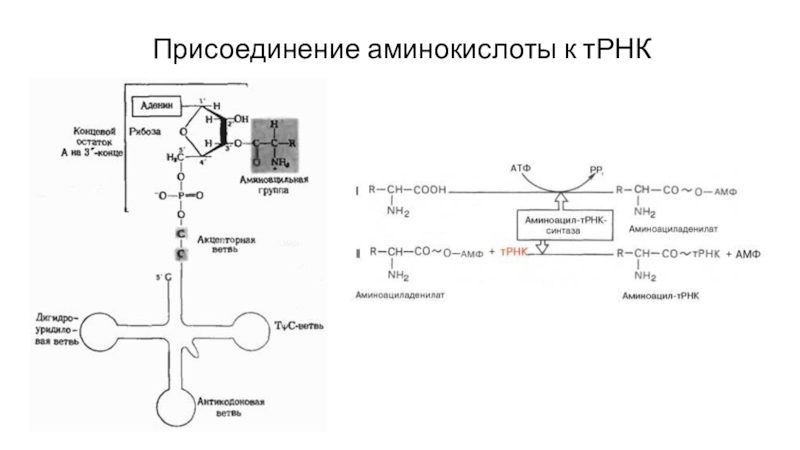
- 51. Присоединение аминокислоты к тРНК
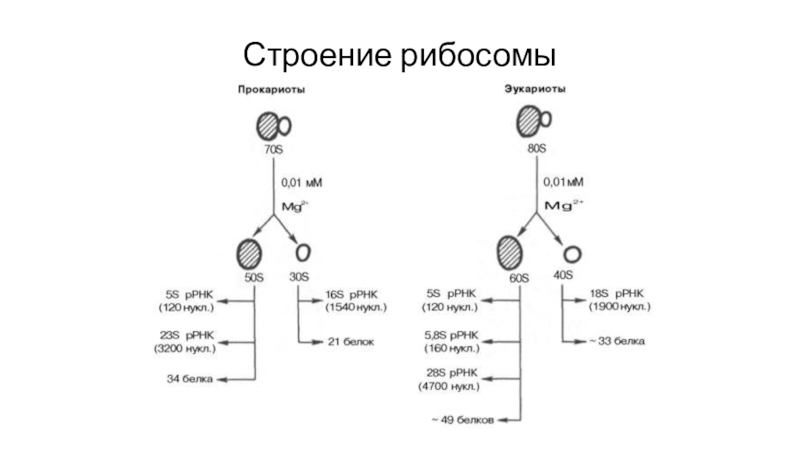
- 52. Строение рибосомы
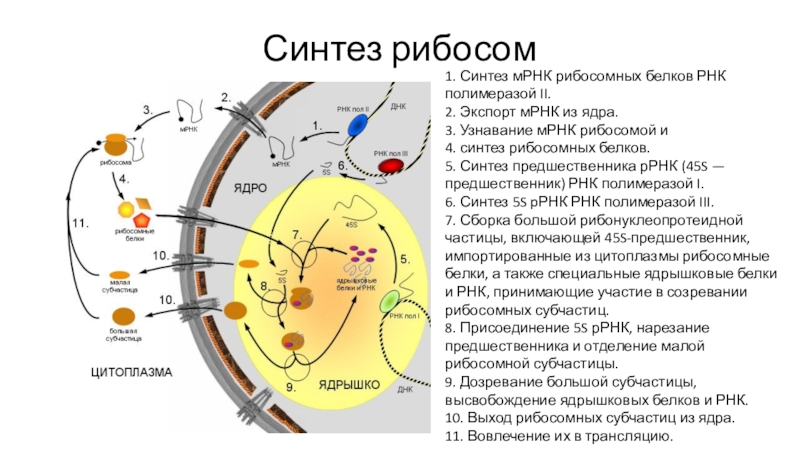
- 53. Синтез рибосом1. Синтез мРНК рибосомных белков РНК
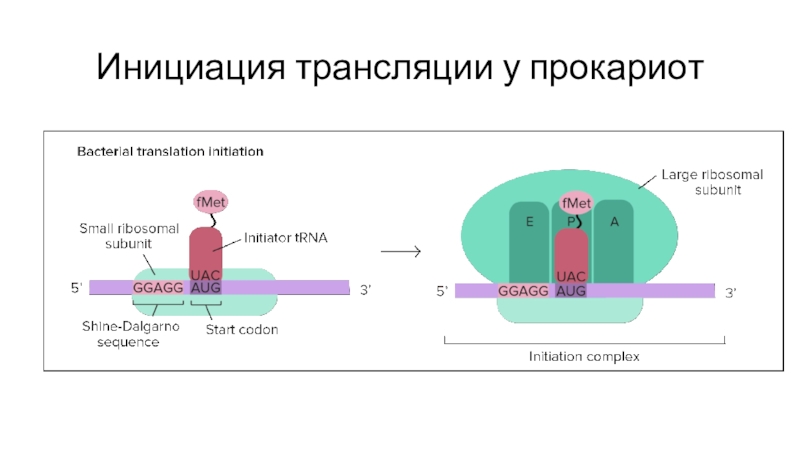
- 54. Инициация трансляции у прокариот
- 55. Инициация трансляции у эукариотПри сканирующем механизме малая
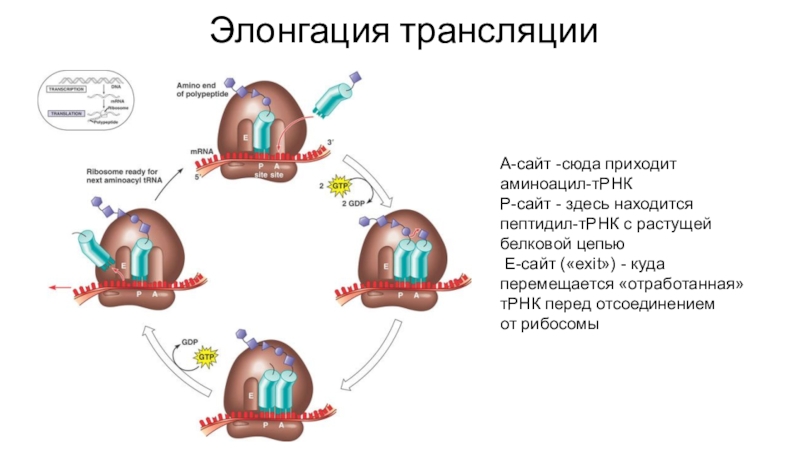
- 56. Элонгация трансляцииА-сайт -сюда приходит аминоацил-тРНКP-сайт - здесь находится
- 57. Терминация трансляцииhttps://www.youtube.com/watch?v=eik96kz5Kn4&t=37sУ эукариот вместо 3 разных RF
- 58. Антибиотики, влияющие на трансляциюТетрациклин – блокирует А-сайт
- 59. Трансляция на ЭПР
- 60. Полисома
- 61. Полисомы на ЭПР
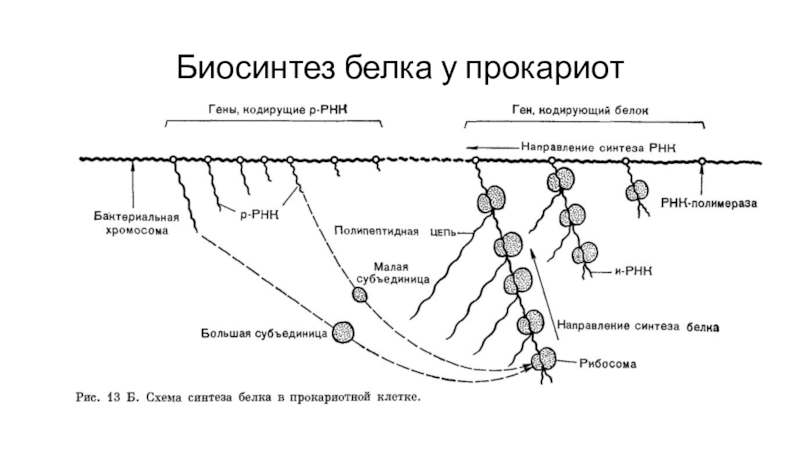
- 62. Биосинтез белка у прокариот
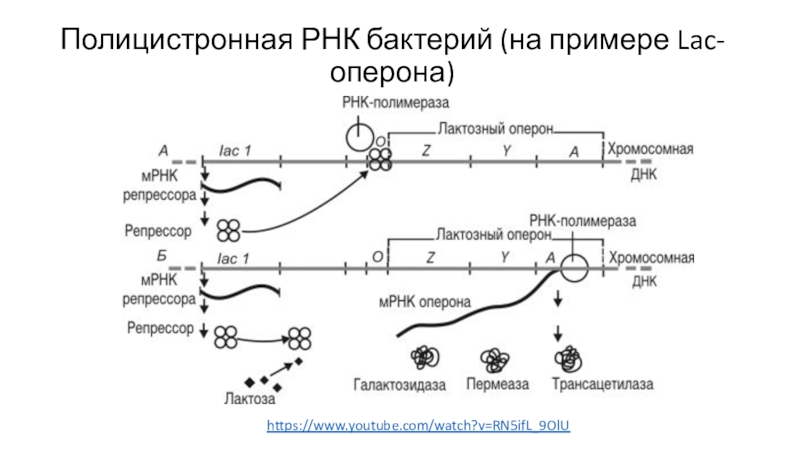
- 63. Полицистронная РНК бактерий (на примере Lac-оперона)https://www.youtube.com/watch?v=RN5ifL_9OlU
- 64. Фотосинтез
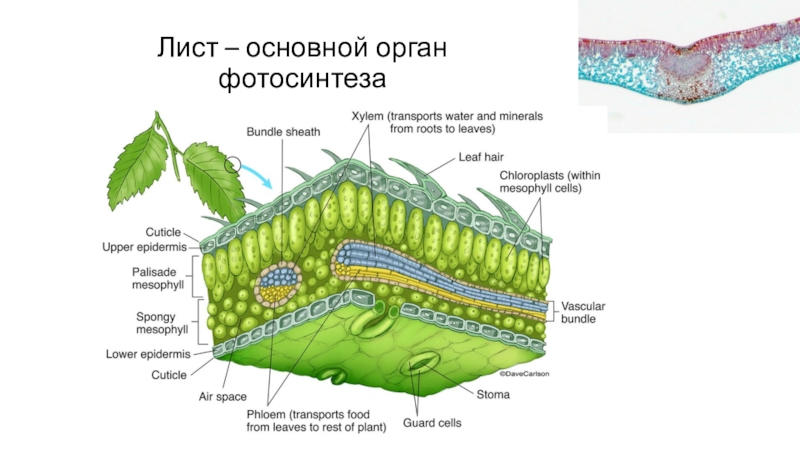
- 65. Лист – основной орган фотосинтеза
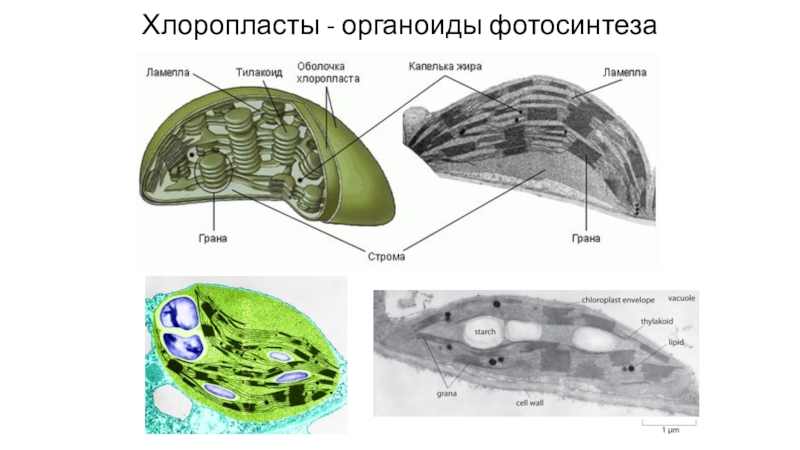
- 66. Хлоропласты - органоиды фотосинтеза
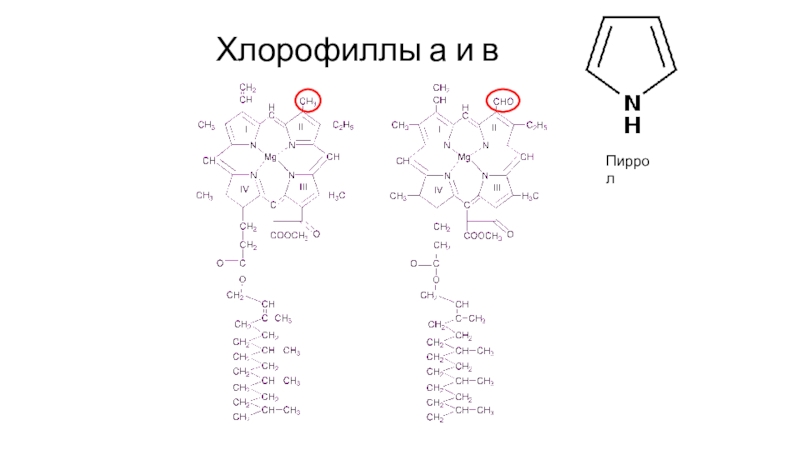
- 67. Хлорофиллы а и вПиррол
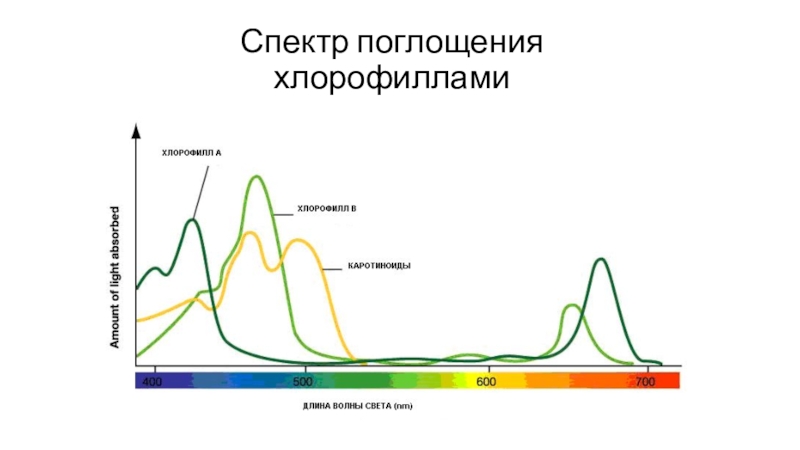
- 68. Спектр поглощения хлорофиллами
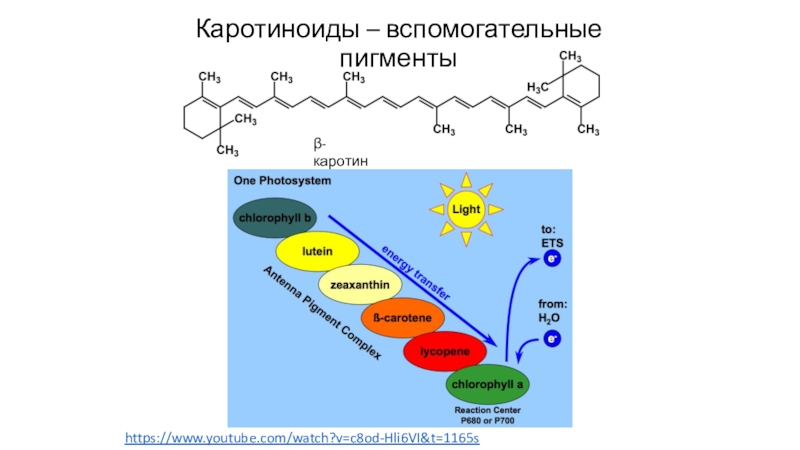
- 69. Каротиноиды – вспомогательные пигментыβ- каротинhttps://www.youtube.com/watch?v=c8od-Hli6VI&t=1165s
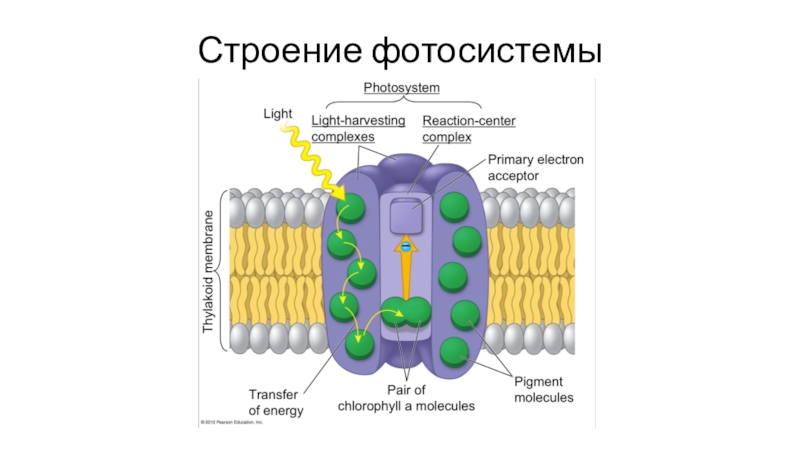
- 70. Строение фотосистемы
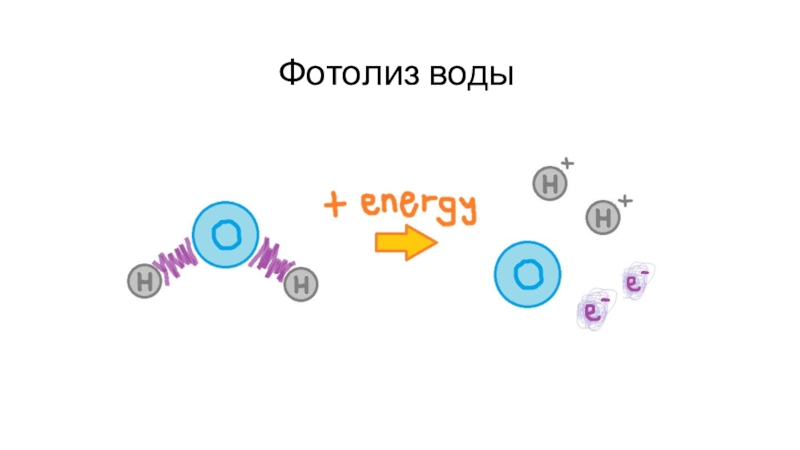
- 71. Фотолиз воды
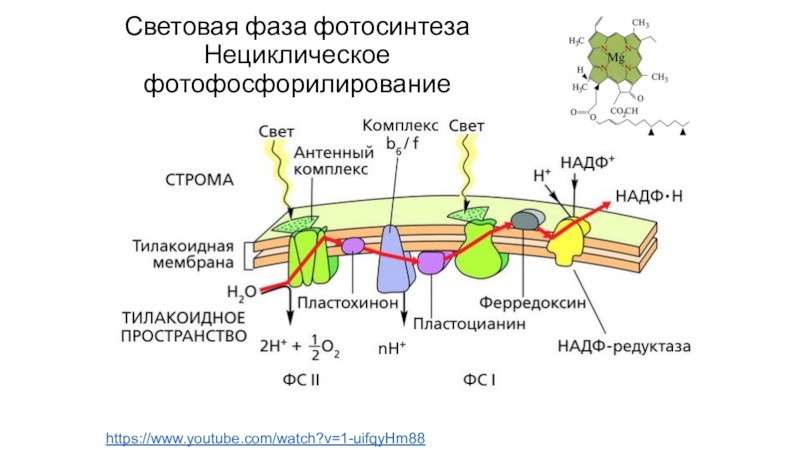
- 72. Световая фаза фотосинтеза Нециклическое фотофосфорилированиеhttps://www.youtube.com/watch?v=1-uifqyHm88
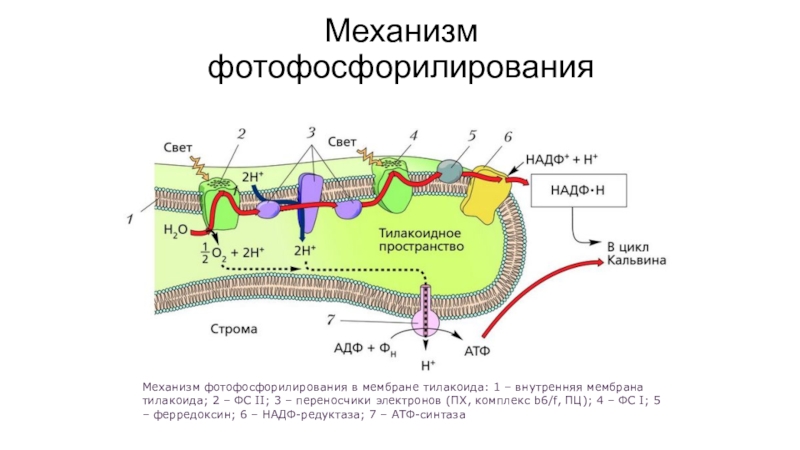
- 73. Механизм фотофосфорилированияМеханизм фотофосфорилирования в мембране тилакоида: 1
- 74. Слайд 74
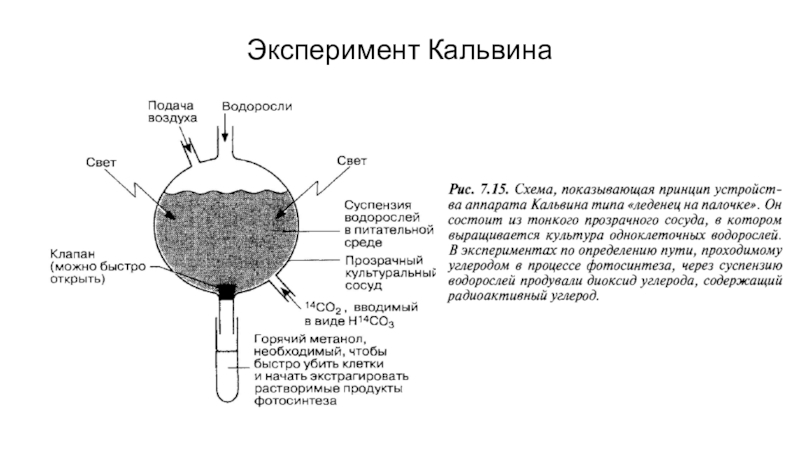
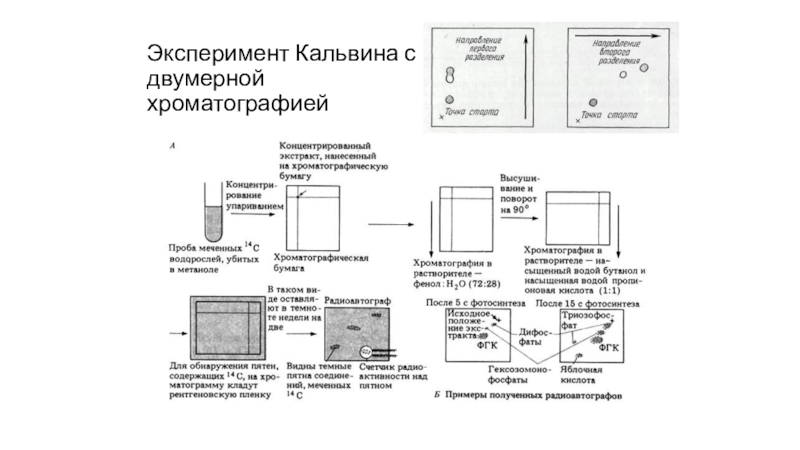
- 75. Эксперимент Кальвина
- 76. Эксперимент Кальвина с двумерной хроматографией
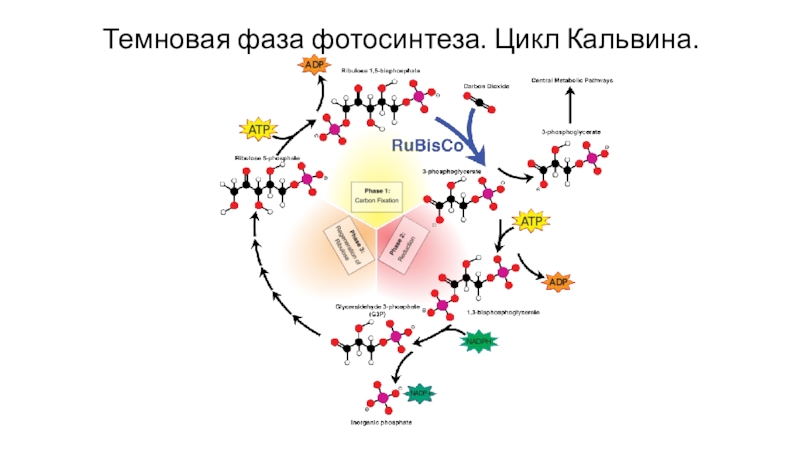
- 77. Темновая фаза фотосинтеза. Цикл Кальвина.
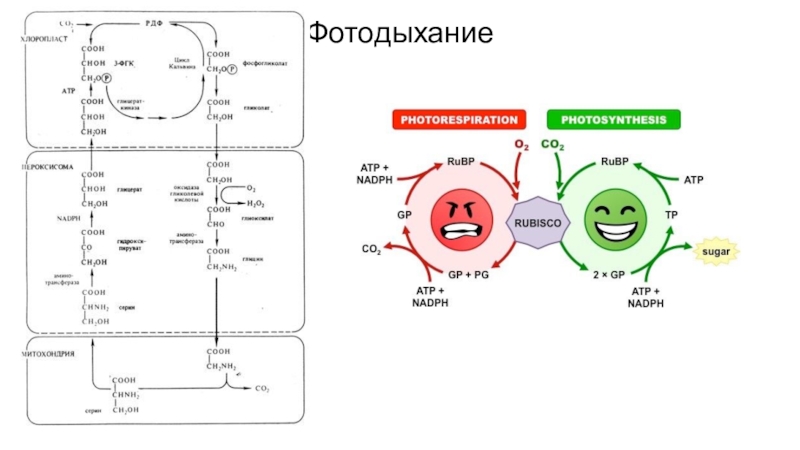
- 78. Фотодыхание
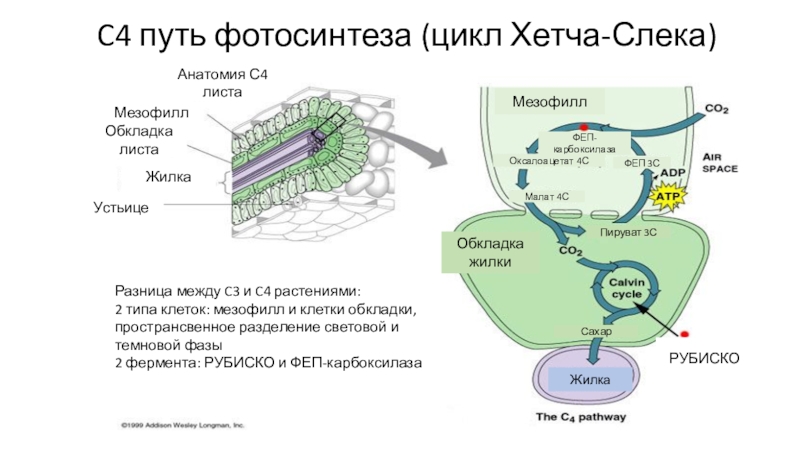
- 79. C4 путь фотосинтеза (цикл Хетча-Слека)
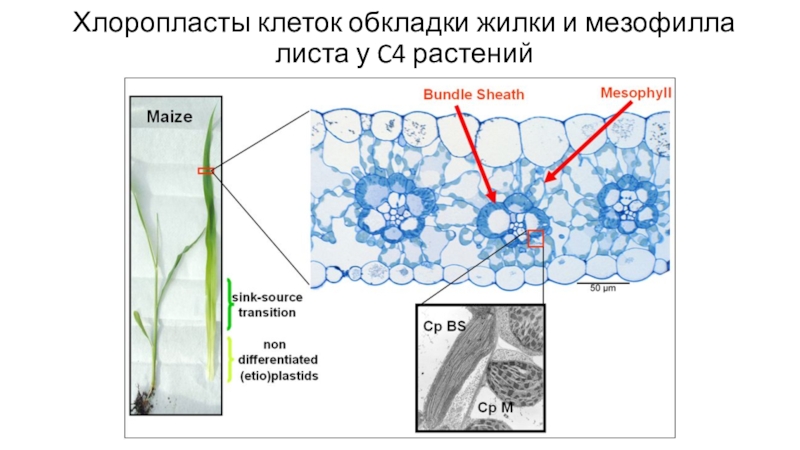
- 80. Хлоропласты клеток обкладки жилки и мезофилла листа у C4 растений
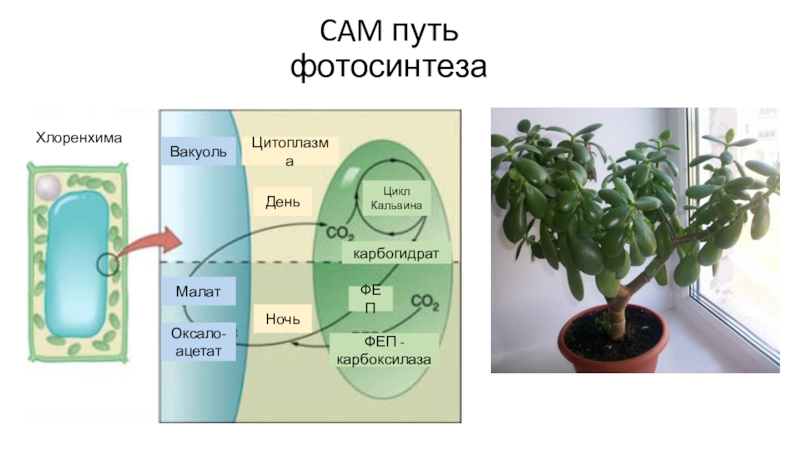
- 81. CAM путь фотосинтеза
- 82. Скачать презентанцию
Слайды и текст этой презентации
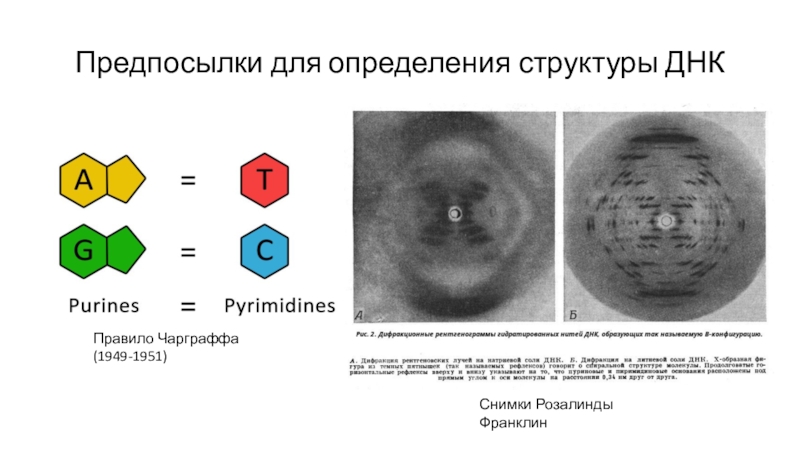
Слайд 6Предпосылки для определения структуры ДНК
Правило Чарграффа (1949-1951)
Снимки Розалинды Франклин
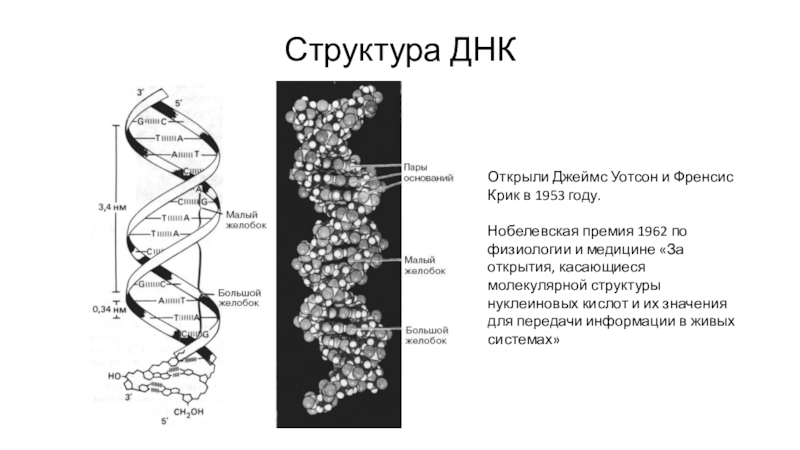
Слайд 7Структура ДНК
Открыли Джеймс Уотсон и Френсис Крик в 1953 году.
Нобелевская
премия 1962 по физиологии и медицине «За открытия, касающиеся молекулярной
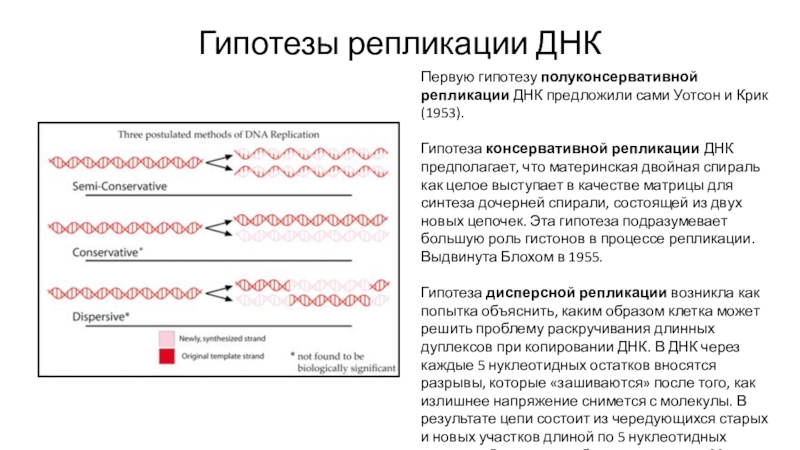
структуры нуклеиновых кислот и их значения для передачи информации в живых системах»Слайд 8Гипотезы репликации ДНК
Первую гипотезу полуконсервативной репликации ДНК предложили сами Уотсон
и Крик (1953).
Гипотеза консервативной репликации ДНК предполагает, что материнская двойная
спираль как целое выступает в качестве матрицы для синтеза дочерней спирали, состоящей из двух новых цепочек. Эта гипотеза подразумевает большую роль гистонов в процессе репликации. Выдвинута Блохом в 1955.Гипотеза дисперсной репликации возникла как попытка объяснить, каким образом клетка может решить проблему раскручивания длинных дуплексов при копировании ДНК. В ДНК через каждые 5 нуклеотидных остатков вносятся разрывы, которые «зашиваются» после того, как излишнее напряжение снимется с молекулы. В результате цепи состоит из чередующихся старых и новых участков длиной по 5 нуклеотидных остатков. Эта гипотеза была предложена Максом Дельбрюком в 1957.
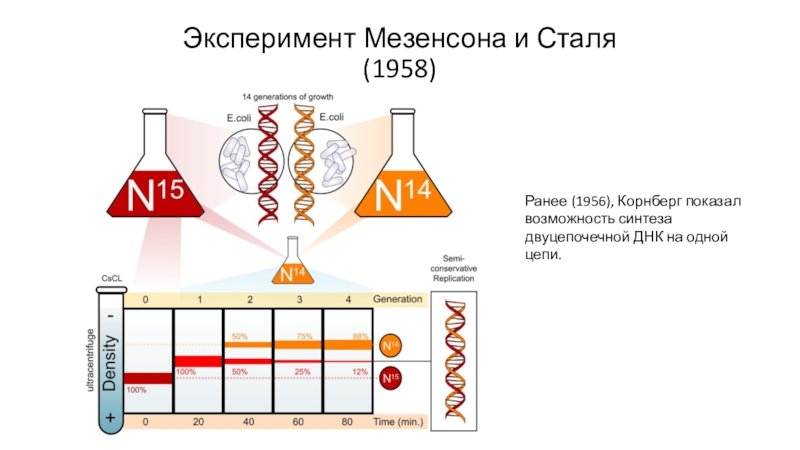
Слайд 9Эксперимент Мезенсона и Сталя (1958)
Ранее (1956), Корнберг показал возможность синтеза
двуцепочечной ДНК на одной цепи.
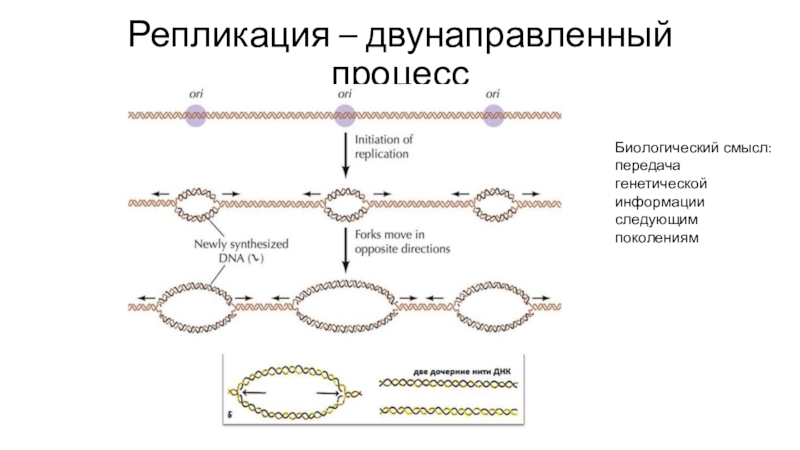
Слайд 12Репликация – двунаправленный процесс
Биологический смысл: передача генетической информации следующим поколениям
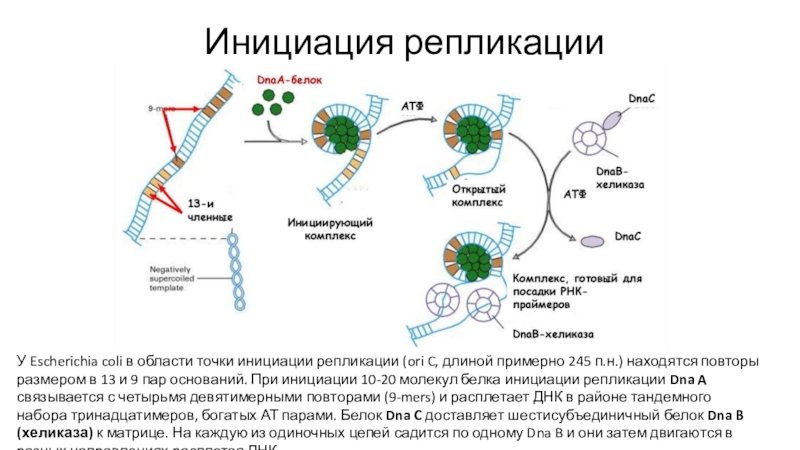
Слайд 14Инициация репликации
У Escherichia coli в области точки инициации репликации (ori
C, длиной примерно 245 п.н.) находятся повторы размером в 13
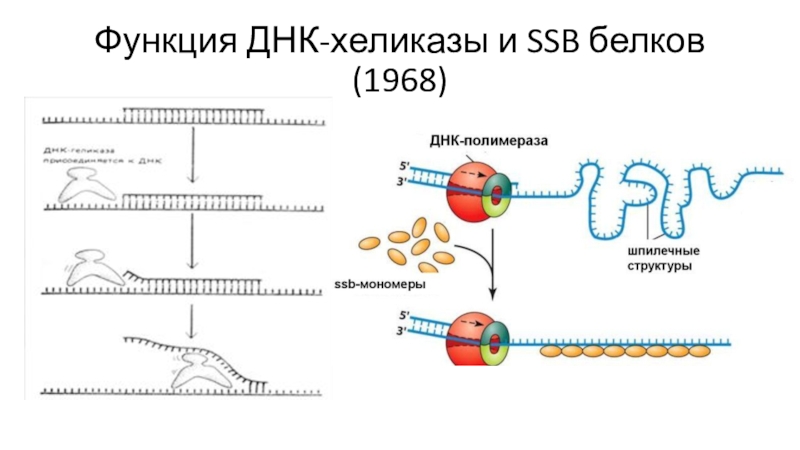
и 9 пар оснований. При инициации 10-20 молекул белка инициации репликации Dna A связывается с четырьмя девятимерными повторами (9-mers) и расплетает ДНК в районе тандемного набора тринадцатимеров, богатых АТ парами. Белок Dna C доставляет шестисубъединичный белок Dna B (хеликаза) к матрице. На каждую из одиночных цепей садится по одному Dna B и они затем двигаются в разных направлениях расплетая ДНК.Слайд 17Рейдзи Оказаки доказал прерывистость синтеза отстающей цепи ДНК (1968)
Метод импульсных
меток
В культуру E. Coli, зараженную фагом Т4 с меченым 3Н-тимидином
через короткий промежуток времени добавляют 1000-кратный избыток немеченого. Метка включалась только в течении короткого промежутка времени. Затем разрушение и центрифугирование в щелочном градиенте сахарозы. В щелочной среде ДНК денатурирует и короткие фрагменты диссоциируют от длинных. Эксперимент с термочувствительной лигазой
Оказаки провел эксперимент на E. coli, дефектными по лигазе, зараженных фагом Т4, у которого есть своя термочувствительная лигаза, которая работает при 20С и не работает при 43С.
Клетки заражали фагом Т4, давали импульсную метку и выращивали при двух температурах: 20С и 43С. Потом проводили центрифугирование в щелочном градиенте сахарозы.
Таким образом, Оказаки доказал, что ДНК на отстающей цепи не только синтезируется фрагментарно, но и сшивается ферментом лигазой.
Фрагменты Оказаки бактерий 1000-2000 нуклеотидов, у эукариот – 100-200.
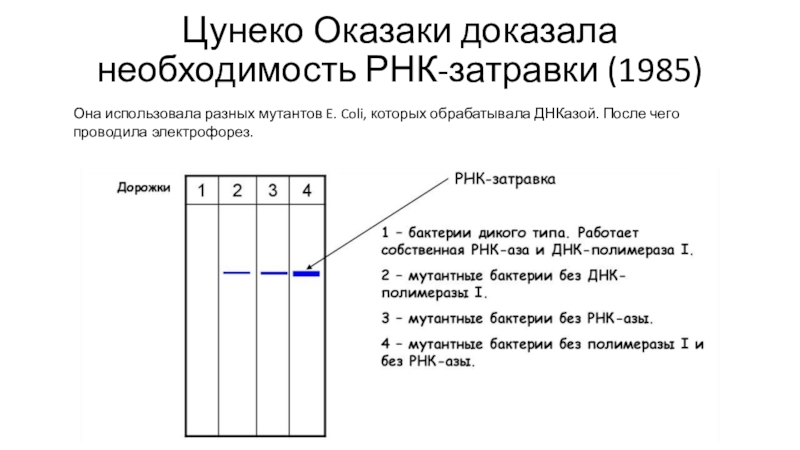
Слайд 18Цунеко Оказаки доказала необходимость РНК-затравки (1985)
Она использовала разных мутантов E.
Coli, которых обрабатывала ДНКазой. После чего проводила электрофорез.
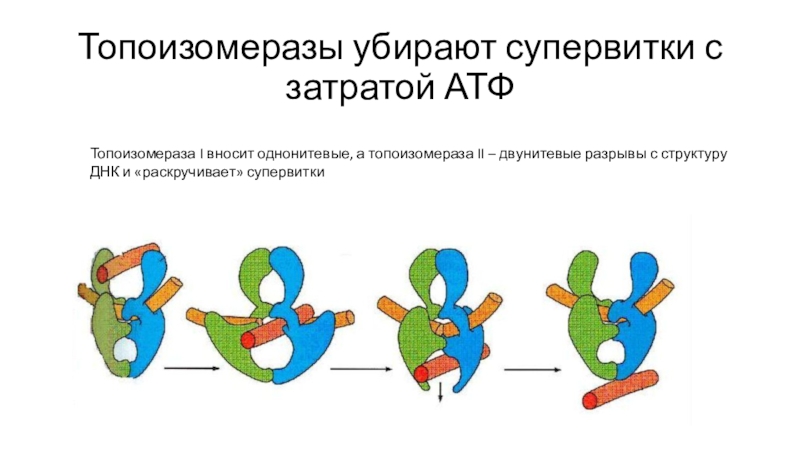
Слайд 20Топоизомеразы убирают супервитки с затратой АТФ
Топоизомераза I вносит однонитевые, а
топоизомераза II – двунитевые разрывы с структуру ДНК и «раскручивает»
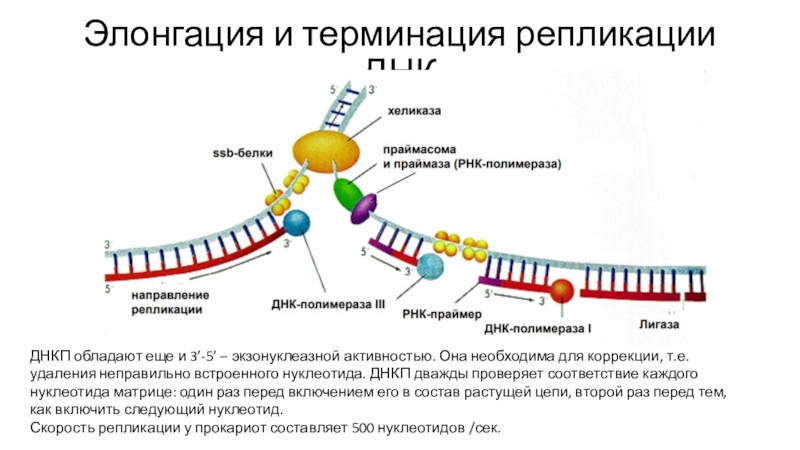
супервиткиСлайд 21Элонгация и терминация репликации ДНК
ДНКП обладают еще и 3’-5’ –
экзонуклеазной активностью. Она необходима для коррекции, т.е. удаления неправильно встроенного
нуклеотида. ДНКП дважды проверяет соответствие каждого нуклеотида матрице: один раз перед включением его в состав растущей цепи, второй раз перед тем, как включить следующий нуклеотид.Скорость репликации у прокариот составляет 500 нуклеотидов /сек.
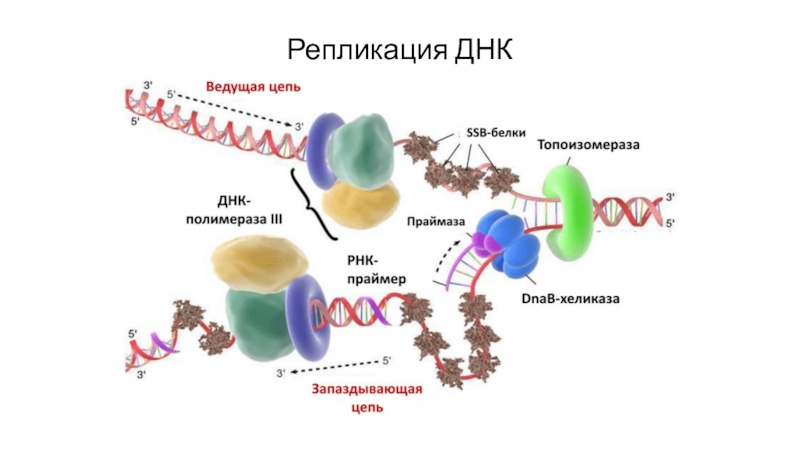
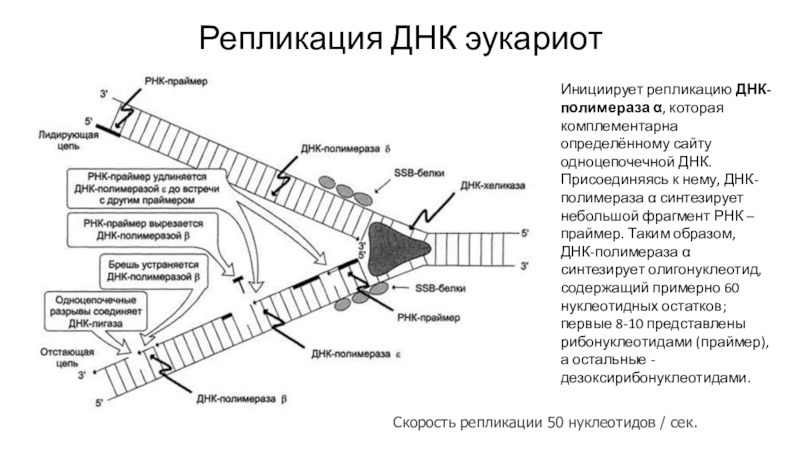
Слайд 22Репликация ДНК эукариот
Инициирует репликацию ДНК-полимераза α, которая комплементарна определённому сайту
одноцепочечной ДНК. Присоединяясь к нему, ДНК-полимераза α синтезирует небольшой фрагмент
РНК – праймер. Таким образом, ДНК-полимераза α синтезирует олигонуклеотид, содержащий примерно 60 нуклеотидных остатков; первые 8-10 представлены рибонуклеотидами (праймер), а остальные - дезоксирибонуклеотидами.Скорость репликации 50 нуклеотидов / сек.
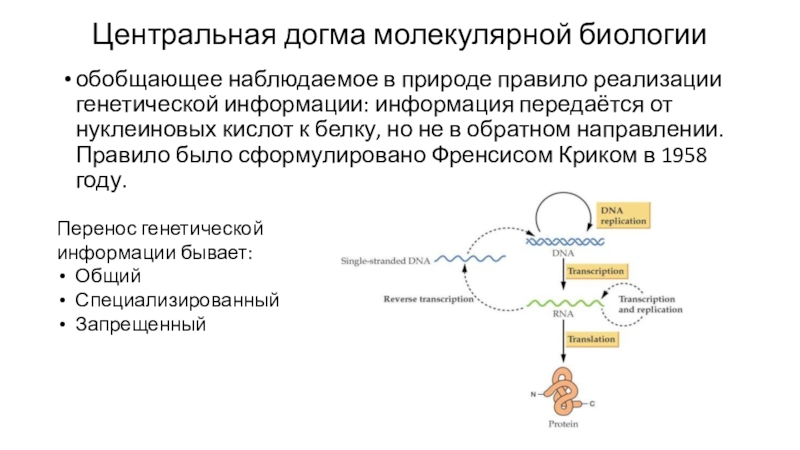
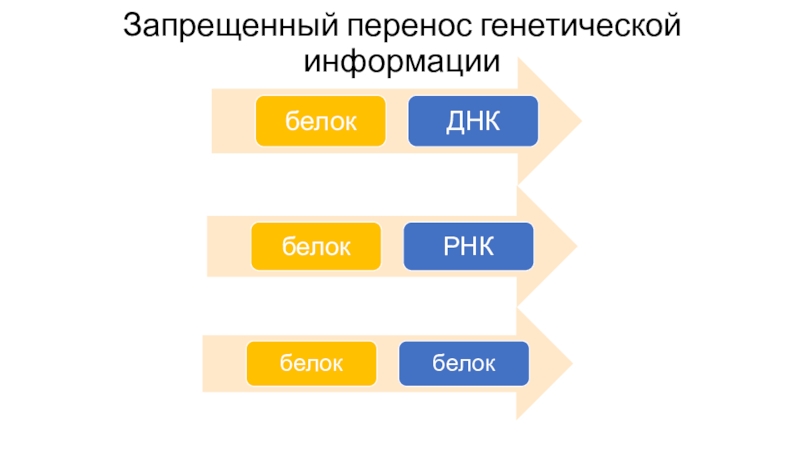
Слайд 26Центральная догма молекулярной биологии
обобщающее наблюдаемое в природе правило реализации генетической
информации: информация передаётся от нуклеиновых кислот к белку, но не
в обратном направлении. Правило было сформулировано Френсисом Криком в 1958 году.Перенос генетической информации бывает:
Общий
Специализированный
Запрещенный
Слайд 28Специализированный перенос генетической информации
РНК-содержащие вирусы
Ретровирусы
Возможно in vitro
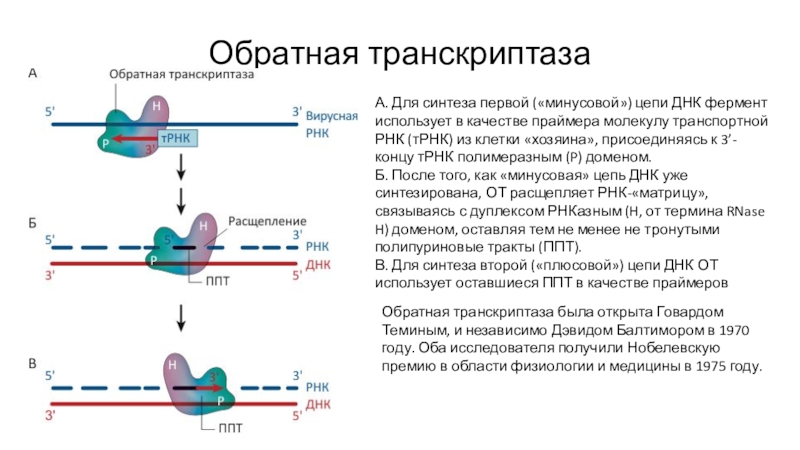
Слайд 29Обратная транскриптаза
А. Для синтеза первой («минусовой») цепи ДНК фермент использует
в качестве праймера молекулу транспортной РНК (тРНК) из клетки «хозяина»,
присоединяясь к 3’-концу тРНК полимеразным (P) доменом.Б. После того, как «минусовая» цепь ДНК уже синтезирована, ОТ расщепляет РНК-«матрицу», связываясь с дуплексом РНКазным (H, от термина RNase H) доменом, оставляя тем не менее не тронутыми полипуриновые тракты (ППТ).
В. Для синтеза второй («плюсовой») цепи ДНК ОТ использует оставшиеся ППТ в качестве праймеров
Обратная транскриптаза была открыта Говардом Теминым, и независимо Дэвидом Балтимором в 1970 году. Оба исследователя получили Нобелевскую премию в области физиологии и медицины в 1975 году.
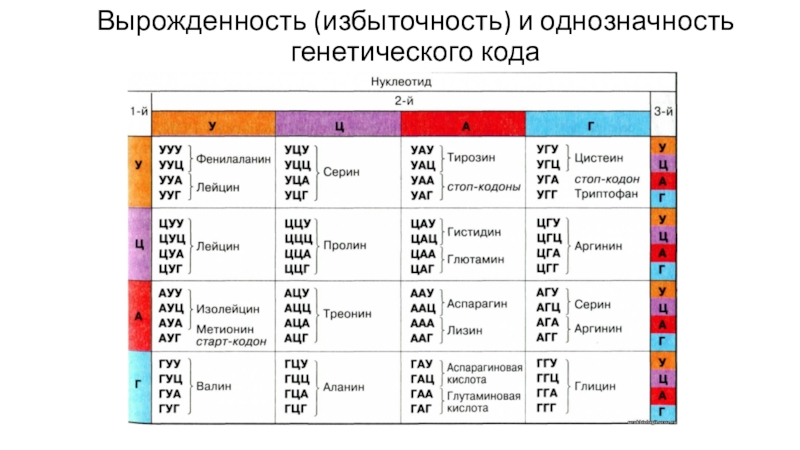
Слайд 31Свойства генетического кода
Генетический код - это система записи информации о
последовательности расположения аминокислот в белках с помощью последовательности расположения нуклеотидов
в ДНК информационной РНК1. Код триплетен
2. Код вырожден
3. Код однозначен
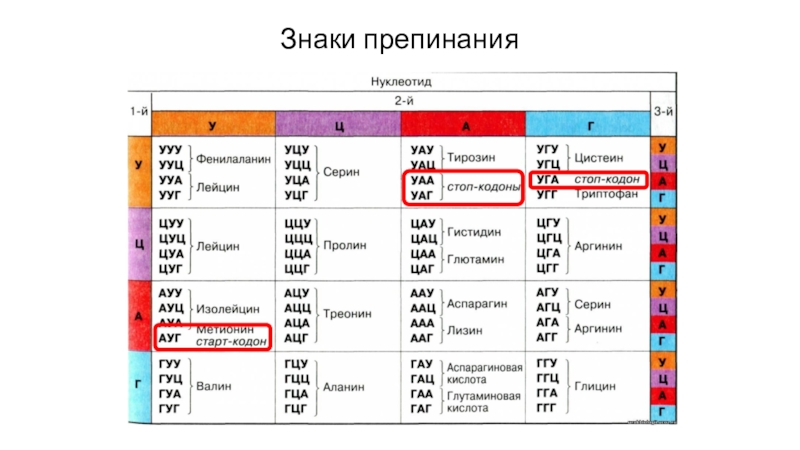
4. Между генами имеются «знаки препинания», но внутри гена нет «знаков препинания»
5. Код универсален
Слайд 32Триплетность генетического кода
Как в последовательности из 4 нуклеотидов закодировать 20
аминокислот?
1 вариант:
1 нуклеотид=1 аминокислота: можно закодировать 4 аминокислоты
2 нуклеотида=1 аминокислота:
можно закодировать 16 аминокислот3 нуклеотида=1 аминокислота: можно закодировать 64 аминокислоты
Триплетность кода была доказана Ф. Криком в 1961 году. Он исследовал мутации фага Т4.
Слайд 39Элонгация транскрипции
Скорость 40-50 нуклеотидов в секунду
Длина гибридного комплекса около 19
нуклеотидов
Слайд 41Ингибиторы транскрипции прокариот
Рифампицин - Полусинтетический антибиотик широкого спектра действия. Нарушает
синтез РНК в бактериальной клетке: связывается с бета- субъединицей ДНК-зависимой
РНК-полимеразы, препятствуя ее присоединению к ДНК, и ингибирует транскрипцию РНК. На человеческую РНК-полимеразу не действует.Стрептолидигин (Stl), производное 3-ацилтетрамовой кислоты, является специфическим ингибитором бактериальной РНК-полимеразы (РНКП) и подавляет все каталитические активности фермента. Стрептолидигин способен подавлять активность РНКП как на стадии инициации, так и на стадии элонгации транскрипции.
Слайд 42Исследование РНК-полимеразы II
Нобелевская премия по химии в 2006 году была
присуждена Роджеру Корнбергу за получение точных данных о механизме работы
РНК механизме работы РНК‐полимеразы полимеразы II в различные моменты в различные моменты процесса транскрипции.Р.Корнберг ‐ «Десять лет, 10 тысяч литров дрожжей и один аспирант» понадобились для того, чтобы выделить из дрожжей несколько выделить из дрожжей несколько граммов белков и изучить их строение»
Слайд 43Промотор эукариот
«Цинковый палец», связывающий транскрипционные факторы с ДНК
Более 60 транскрипционных
факторов образуют комплекс «медиатор», который запускает процесс транскрипции
Энхансер— небольшой участок
ДНК, который после связывания с ним факторов транскрипции стимулирует транскрипцию с основных промоторов гена или группы генов.Сайленсер - последовательность ДНК, с которой связываются белки-репрессоры. Связывание белков-репрессоров с сайленсерами приводит к понижению или к полному подавлению синтеза РНК.
https://www.youtube.com/watch?v=b2W9TiZlAFA
Слайд 44РНК-полимеразы эукариот
РНК‐полимераза I – синтез рРНК (28S, 18S и 5,8S рРНК)
РНК‐полимераза II
– синтез мРНК и мяРНК
РНК‐полимераза полимераза III – синтез тРНК, 5S рРНК,
некоторых мяРНК РНК‐полимераза митохондрий – состоит из одной субъединицы одной субъединицы, ген которой которой находится в ядерной ДНК
https://www.youtube.com/watch?v=N_84YIAlrcs
Слайд 45Бледные поганки блокируют работу РНК-полимеразы
Альфа-аманитин
Альфа-аманитин обладает необычно сильным сродством к
ферменту РНК-полимеразе II. РНК-полимераза I нечувствительна к нему, а РНК-полимераза
III чувствительна слабо. Попадая в клетку, аманитин связывает этот фермент, блокируя его работу, что, в свою очередь, приводит к прекращению синтеза белков и к разрушению клетки (цитолизу).Слайд 53Синтез рибосом
1. Синтез мРНК рибосомных белков РНК полимеразой II.
2.
Экспорт мРНК из ядра.
3. Узнавание мРНК рибосомой и
4.
синтез рибосомных белков. 5. Синтез предшественника рРНК (45S — предшественник) РНК полимеразой I.
6. Синтез 5S pРНК РНК полимеразой III.
7. Сборка большой рибонуклеопротеидной частицы, включающей 45S-предшественник, импортированные из цитоплазмы рибосомные белки, а также специальные ядрышковые белки и РНК, принимающие участие в созревании рибосомных субчастиц.
8. Присоединение 5S рРНК, нарезание предшественника и отделение малой рибосомной субчастицы.
9. Дозревание большой субчастицы, высвобождение ядрышковых белков и РНК.
10. Выход рибосомных субчастиц из ядра.
11. Вовлечение их в трансляцию.
Слайд 55Инициация трансляции у эукариот
При сканирующем механизме малая субъединица рибосомы садится
на 5'-конец мРНК в области кэпа и двигается вдоль молекулы
мРНК, «сканируя» один кодон за другим, пока не наткнётся на инициаторный AUG. Для привлечения рибосомы к 5'-концу мРНК требуется специальная структура, кэп — 7-метилгуанин, прикреплённый к 5'-концевому нуклеотиду мРНК.При механизме внутренней инициации, называемом у эукариот также IRES-зависимым механизмом, рибосома садится на внутренний участок мРНК, называемый IRES (англ. Internal Ribosomal Entry Site, участок внутренней посадки рибосомы) — участок мРНК, обладающий выраженной вторичной структурой, позволяющей ему направлять рибосомы на стартовый AUG. По IRES-зависимому механизму инициируется синтез лишь на небольшой части клеточных мРНК, а также на РНК некоторых вирусов.
Слайд 56Элонгация трансляции
А-сайт -сюда приходит аминоацил-тРНК
P-сайт - здесь находится пептидил-тРНК с растущей белковой
цепью
E-сайт («exit») - куда перемещается «отработанная» тРНК перед отсоединением от рибосомы
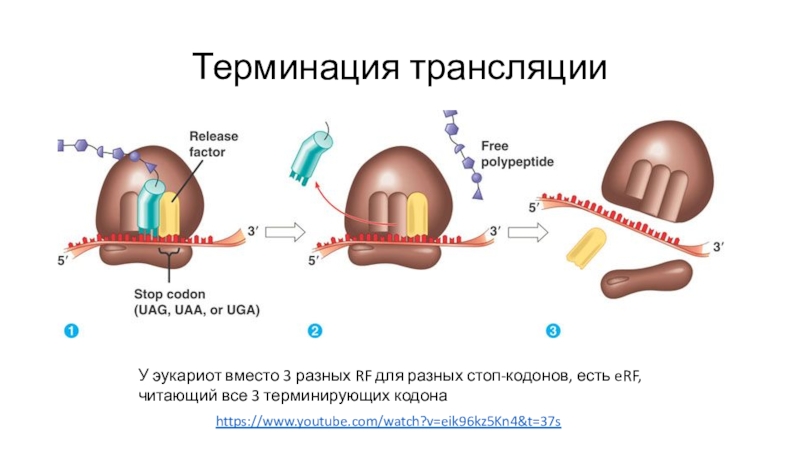
Слайд 57Терминация трансляции
https://www.youtube.com/watch?v=eik96kz5Kn4&t=37s
У эукариот вместо 3 разных RF для разных стоп-кодонов,
есть eRF, читающий все 3 терминирующих кодона
Слайд 58Антибиотики, влияющие на трансляцию
Тетрациклин – блокирует А-сайт рибосомы, блокирует связывание
аминоацил-тРНК
Левомицетин – связывается с большой субъединицей и ингибирует пептидилтрансферазу
Эритромицин -
связывается с большой субъединицей и ингибирует транслоказуПуромицин – входит в А-сайт и связывает пептид, так как по структуре схож с тРНК.