Слайд 1Ретротранспозоны и ДНК транспозоны
Слайд 5Мобильные генетические элементы
В 40-х годах Барбара Мак-Клинток, американский генетик,
обнаружила мозаичность окраски зерен у кукурузы, небъяснимую законами Менделя и
мутационной теорией.
Она предположила, что некоторые гены могут менять свое место в геноме. В 70-х годах это предположение получило экспериментальное подтверждение.
Слайд 6Первое описание элементов геномной ДНК, характеризующихся наследуемой способностью передвигаться внутри
и между геномами, было сделано в 1951 г. прошлого века
Барбарой Мак-Клинток для кукурузы. Благодаря развитию технологий геномного секвенирования, к настоящему времени эти мобильные генетические элементы (МГЭ) обнаружены в геномах самых разных видов, часто получая названия, отражающие их способность к передвижению (hobo – бродяга, gypsy – цыган, flea – блоха и т.д.). Содержание МГЭ варьирует и может достигать 85% (Zea mays) генома, причем максимальное разнообразие МГЭ демонстрируют беспозвоночные. В малых геномах число копий МГЭ на семейство низкое, но в больших геномах оно значительно варьирует.
Слайд 7Все МГЭ по способу перемещения могут быть сгруппированы в два
основных класса:
1 - ретротранспозоны, перемещающиеся с помощью РНК-посредника («copy
and paste»), и
2 - ДНК транспозоны (перемещается непосредственно ДНК).
Ретротранспозоны обнаружены у всех эукариот, от грибов до млекопитающих и, по-видимому, эти МГЭ связаны с половым размножением.
ДНК транспозоны – самая древняя группа МГЭ, распространенная среди про- и эукариот.
Интересно, что МГЭ первого класса были обнаружены как у плоских, так и круглых червей, а МГЭ второго класса оказались типичными для паразитических нематод, но не для трематод и ленточных червей. К настоящему времени только у гельминтов млекопитающих описано более 30 видов МГЭ.
Слайд 8Оба класса делятся последовательно на подклассы, суперсемейства и семейства, согласно
механизму их интеграции.
Ретротранспозоны обнаружены у всех эукариот от грибов
до млекопитающих; они включают
- LTR-ретротранспозоны,
- non-LTR ретротранспозоны и
- тирозин-рекомбинантные ретротранспозоны.
LTR ретротранспозоны объединяют пять групп: Copia, BEL, Gypsy, эндогенные ретровирусы (ERV) и DIRS.
non-LTR ретротранспозоны включают автономные LINES (перемещающиеся самостоятельно) и неавтономные SINES (требующие для своего перемещения наличия автономных МГЭ) элементы.
Ретротранспозоны, по-видимому, связаны с половым размножением, поскольку среди представителей 24 типов животных они не были обнаружены только у размножающихся бесполым путем коловраток.
Для своей экспансии ретротранспозоны вначале транскрибируются РНК полимеразой хозяина, а затем копируются собственной обратной транскриптазой. Поскольку оба фермента не обладают редактирующей способностью, эти копии имеют тенденцию приобретения случайных замен оснований. Такие замены часто инактивируют последовательности-потомки и приводят к утрате их мобильности (“dead-on-arrival”).
ДНК транспозоны – самая древняя группа МГЭ, распространенная среди про- и эукариот; по механизмам транспозиции подразделяется на «cut-and-paste» транспозоны, самореплицирующиеся транспозоны и транспозоны «катящегося кольца» (полурепликативная транспозиция).

Слайд 9Мутации, создаваемые инсерцией ретротранспозонов, более стабильны, чем мутации, вызванные ДНК
транспозонами, поскольку в отличие от последних, ретротранспозоны, встроившись в геном
уже никогда не исчезают.
Передвигаясь по геному и интегрируя в новые сайты, МГЭ могут обеспечить потенциально вредную генетическую изменчивость, от полиморфизма простой последовательности, до кардинальных изменений в структуре хромосом, их целостности и инактивации соседних генов. Показано, например, что все non-LTR ретротранспозоны или ретротранспозон-подобные последовательности трипаносом T. brucei и T. cruzi, а также лейшмании Leishmania major имеют тенденцию локализации в местах хромосомных инверсий, «strand-switch» регионов и хромосомных концов.
Слайд 10
Вырезание и встраивание МГЭ индуцирует мутагенез, уровень которого может в
тысячу раз превышать скорость спонтанных мутаций. Поэтому для подавления неконтролируемой
пролиферации МГЭ сформировались специальные защитные механизмы против их транспозиции, включающие эпигенетические процессы, такие как система транскрипционного и посттранскрипционного сайленсинга генов. Однако различные виды физиологического стресса, например, температурные изменения или колонизация новых мест обитания хозяевами, могут активировать МГЭ и привести к их пролиферации, разрушив эпигенетический сайленсинг.
С другой стороны, есть данные, предполагающие коэволюцию МГЭ и геномов хозяев, положительное влияние и важную роль этих элементов в формировании и поддержании хромосом хозяина, модификации генной экспрессии и участии в разделении генома на хромосомные домены с эпигенетическими метками.
Слайд 11МГЭ и трансгенные технологии
Накопление знаний о структуре и активности МГЭ
может пролить свет на эволюционную историю и филогенетические отношения самих
элементов и генома хозяина (в частности, дать информацию об эволюции генов в сайтах интеграции МГЭ), а также будет способствовать развитию трансгенных технологий, полезных для изучения структуры, функции и контроля генов паразитических видов.
Виды Platyhelminthes рассматриваются в настоящее время как объекты трансфекции для изучения тканевой регенерации, дизайна новых и более эффективных антигельминтных препаратов и исследования молекулярных связей между паразитом и хозяином. Недавно, при изучении регенеративных процессов и МГЭ у саламандры Ambyostoma mexicanum и голотурии Holothuria glaberrima, была высказана гипотеза, что транскрипционная активность ретротранспозонов может специфически контролироваться хозяином и играть определенную роль в регенерации органов животных.
Слайд 12Способность свободноживущих плоских червей к регенерации значительных участков тела (подразумевающая
присутствие зародышевых клеток) привлекает внимание исследователей на протяжении нескольких последних
десятилетий. Понимание основ регенирации у животных, в том числе плоских червей, может внести важный вклад в регенеративную медицину человека. Планарии, свободноживущие филогенетические родственники трематод, способны регенирировать целых червей из небольшого фрагмента их тела. Клетки, ответственные за эти регенеративные свойства, были названы «необластами».
Однако для изучения данного феномена необходимы новые более эффективные методы для интродукции чужеродных генов и векторы для стабильной трансфекции. Методом электропарации в геном необластов планарии Dugesia japonica были эффективно интродуцированы три транспозона: mariner, Herms и Piggybac, два из которых хорошо экспрессировались через восемь месяцев после трансфекции. Содержание паразитических видов червей в лабораторных условиях, а также генетические манипуляции с ними осуществлять сложнее. Тем не менее, уже известны успешные эксперименты по получению генетически модифицированных гельминтов - трематод, цестод и нематод. Практическое применение данных исследований лежит в сфере сайленсинга генов, вовлеченных в жизненно важные физиологические процессы, посредством РНК интерференции.

Слайд 13Помимо фундаментального значения, практический интерес может иметь способность ретроэлементов выполнять
важные функции в эмбриогенезе, в частности, влиять на плюрипотентность клеток.
Ретротранспозоны часто видо- или родоспецифичны, что открывает перспективу разработки чувствительных и специфичных молекулярных диагностикумов, особенно необходимых для паразитических видов.
Кроме того, изучение МГЭ представляет определенный интерес для эпидемиологических и медицинских исследований, поскольку они могут генерировать специфические генетические паттерны, ассоциированные с клиническими проявлениями заболеваний.
Слайд 14Как членов фракции повторов, МГЭ вначале считали «мусорной», «эгоистичной» ДНК,
или «геномными паразитами». Однако накопление весомых свидетельств о важной роли
МГЭ в эволюции генов и геномов приводит к пониманию того обстоятельства, что помимо вредных эффектов эти геномные элементы вносят позитивный вклад в эволюцию генома их хозяев и поэтому могут быть переименованы в «потенциально полезные доместицированные элементы».
Слайд 15Геномная доместикация может приводить к существенной функциональной эволюции МГЭ.
-
Яркий пример – влияние этих элементов на эволюцию адаптивной иммунной
системы челюстных позвоночных. Домен Rag1, участвующий в обеспечении образования огромного разнообразия антител, высоко гомологичен транспозазе ДНК транспозонов transib, которые были обнаружены в геномах беспозвоночных, но не идентифицированы у позвоночных.
- Предполагают, что ретротранспозон LITc генома трипаносомы Trypanosoma cruzi может участвовать в репарации ДНК, а
- ген SETMAR, участвующий в каскаде репараций двойных разрывов ДНК, произошел от транспозазы mariner.
- Есть основания полагать, что теломераза, по-видимому, произошла от обратной транскриптазы ретротранспозонов.
- Считается, что доместицированные гены ретроэлементов PNMA, SIRH и SYNCYTIN, необходимые для нормального развития плаценты, значительно повлияли на радиацию млекопитающих.
- Наконец, описано большое число генов, произошедших от транспозонов, которые приобрели функцию регуляторов транскрипции.
Слайд 16МГЭ и горизонтальный перенос генов
Мобильные элементы генома являются основными кандидатами
на роль переносчиков в рамках гипотезы горизонтального переноса ДНК (Horizontal
Gene Transfer, HGT) между репродуктивно изолированными видами. События HGT рассматриваются сейчас, как важная движущая сила эволюции эукариотического генома. Причем считается, что система паразит-хозяин является оптимальной моделью для изучения данного феномена. Приобретение МГЭ de novo считается доказанным, если гомология первичных последовательностей в геномах неродственных организмов составляет более 90%.
Слайд 17В геноме F. hepatica среди ретротранспозонов обнаружен повтор BovB (67
тыс. полных или частичных копий). Ранее для него был описан
горизонтальный перенос между змеями и жвачными, а наличие данного элемента у F. hepatica предполагает, что перенос BovB между различными таксонами позвоночных может усиливаться трематодной инфекцией.
В геноме анкилостомы Ancylostoma caninum содержится ДНК транспозон bandit. Его ближайшим филогенетическим родственником является ДНК транспозон человека Hsmar, что предполагает возможность горизонтального переноса между анкилостомами и их хозяевами-млекопитающими.
Слайд 18Имеющийся объем знаний по изучению HGT позволяет сделать ряд важных
заключений:
(1) для HGT не требуется долговременной физической ассоциации между
видами, но физический контакт может увеличить вероятность HGT;
(2) смена хозяев может затруднить идентификацию HGT, ассоциированную с паразитизмом;
(3) обнаружение МГЭ часто идентифицируется как HGT, однако следует проверять, нет ли первичного механизма, обусловившего его распространение;
(4) HGT часто подвергается сомнению из-за потенциально возможной контаминации, и эта проблема не должна оставаться без внимания.
Дальнейшие исследования HGT могут в значительной мере пополнить наши представления о геномной коэволюции и дать эволюционое понимание эпидемиологии паразитарных инфекций.
Слайд 21Ретроэлементы
Ретроэлементы (RE) составляют значительную часть (до 50%) генома человека. RE несут в себе большое
количество различных регуляторных элементов и способны перемещаться по геному при помощи
ретротранспозиции. Ретроэлементы способны оказывать влияние как на экспрессию близлежащих генов, так и на функционирование генома в целом. В геноме человека обнаружено большое количество интеграций RE, полиморфных в различных человеческих популяциях.
Слайд 22Полиморфные интеграции ретроэлементов все шире используются в качестве молекулярно-генетических маркеров (МГМ)
в популяционно- и медико-генетических исследованиях, например для определения генетических взаимоотношений между
отдельными популяциями или ассоциативного анализа интеграционного полиморфизма с развитием некоторых заболеваний. МГМ на основе RE обладают рядом преимуществ:
1) присутствие инсерции ретроэлемента в данном геномном локусе всегда говорит об общем происхождении, так как вероятность независимой интеграции RE в точно такое же место генома исчезающе мала;
2) инсерции RE, как правило, достаточно стабильны, так как в геноме не существует специального механизма для бесследного удаления интеграций;
3) из всех известных типов полиморфизмов инсерционная вариабельность ретроэлементов наиболее легко детектируется экспериментально.
Слайд 23
LINE
Полноразмерные LINE элементы (Long Interspersed Nuclear Elements) имеют длину 4-6
тыс. п. о. и содержат две открытые рамки считывания (ORF
- Open Reading Frame) и поли А последовательность на 3' конце. Нуклеотидная последовательность полноразмерного LINE кодирует ферменты, необходимые для их размножения, таким образом, этот класс элементов считается автономным. По краям LINE элементов имеется короткий прямой повтор длиной 7-20 п. о., представляющий собой дупликацию сайта мишени.
Слайд 24
SINE
В отличие от LINE нуклеотидная последовательность SINE (Short Interspersed Nuclear
Elements) элементов лишена каких-либо ORF. В ее состав входит внутренний
промотор для РНК-полимеразы III, поли А последовательность на 3' конце и короткий прямой повтор такой же длины как у LINE по краям. Для размножения они используют ретротранспозиционный аппарат LINE элементов.
В геноме приматов обнаружена немногочисленная группа ретроэлементов SINE-R/SVA, имеющих смешанное происхождение, но размножающиеся при помощи ретротранспозиционного аппарата LINE.
Слайд 25
SINE
составляют около 13-14% человеческого генома.
Этот класс ретроэлементов включает
в себя неавтономные ретротранспозоны длиной менее 500 п. о., имеющие
в своем составе промотор и поли А последовательность, и лишенные каких-либо открытых рамок считывания.
В человеческом геноме, как и в геноме других приматов, SINE представлены в основном двумя семействами:
MIR (Mammalian-wide Interspersed Repeats) и
Alu.
Семейство MIR представлено в геноме человека 300 - 400 тыс. копий, что составляет около 2,5% генома. Как и многие другие SINE элементы, обнаруженные в геномах многих эукариотических организмов, MIR произошли от тРНК. Считается, что представители семейства MIR активно размножались в геноме еще до расхождения основных эволюционных ветвей млекопитающих.
Слайд 26
Alu
Семейство Alu представлено более чем миллионом копий в человеческом геноме,
что составляет порядка 10 % всех геномных последовательностей. Полноразмерный Alu
элемент имеет длину около 300 п. о. и представляет собой гомодимер. В 5' концевой части Alu элемента находится расщепленный промотор, узнаваемый РНК полимеразой III и состоящий из боксов А и В. В средней части ретроэлемента содержится короткая А/Т богатая последовательность, а в 3' концевой части поли А последовательность различной длины. В отличии от большинства других семейств SINE, ведущих свое начало преимущественно от тРНК, Alu элементы произошли от 7SL РНК, входящей в состав рибонуклеопротеиновых частиц SRP (Signal Recognition Particles).
Слайд 27
Наиболее известными повторами семейства SINE в геноме грызунов являются B1
и B2 семейства.
Слайд 28Схема строения Alu элемента.
А и В - бокс А
и бокс В - части расщепленного промотора для РНК полимеразы
III;
А5ТАСА6 последовательность, разделяющая две половины элемента;
(А)n - поли А последовательность на 3' конце. Белые треугольники обозначают дупликации сайта мишени в результате интеграции.
Слайд 29Все Alu-повторы разделяются на три основных семейства, различающиеся по времени
возникновения, и обозначающиеся заглавными латинскими буквами в алфавитном порядке:
старое
(junk, J),
среднее (standard, S) и
молодое (young, Y).
Каждое семейство подразделяется
на ряд подсемейств. AluJ разделяют на два подсемейства AluJo и AluJb. Последовательность AluJo наиболее близка к 7SL RNA. S подсемейства Sx, Sp, Sq, Sg и Sc - средние по возрасту подсемейства Alu возникли от 31 до 48 миллионов лет назад.
Слайд 30Время возникновения и представленность основных семейств Alu.
Ряд молодых подсемейств
AluY, например, Yb9,
Ya5a2, Yc1 и др., является человек специфическим.
Некоторые интеграции представителей
молодых подсемейств Alu остаются полиморфными в популяциях человека.
Слайд 31LINE
В геноме встречаются в основном 3 класса LINE:
L1 (LINE1)
L2 (LINE2)
L3 (LINE3)
Полноразмерные представители LINE имеют длину несколько
тысяч п. о. и включают в свой состав две ORF, однако большинство содержащихся в геноме копий укорочены со стороны 5' конца. К LINE элементам можно отнести также HAL1 элементы, имеющие только одну ORF, сходную по структуре с ORF1. Считается, что LINE элементы возникли еще в докембрии и являются ровесниками эукариот, так как встречаются в геномах практически всех эукариотических организмов. L2 и L3 очень "старые" группы, которые были активны еще до возникновения млекопитающих. Считается, что последние представители L2 были активны 80-100 млн. лет назад и принимали участие в размножении MIR элементов.
Слайд 32LINE-последовательности заключают в себе гены обратных транскриптаз, что является признаком
ретротранспозонов (мобильных генетических элементов животных, обладающих структурным сходством с геномом
ретровирусов ), но для них характерно отсутствие последовательностей длинных концевых повторов ( LTR - long terminal repeats), типичных для ретротранспозонов.
В качестве примера LINE-последовательности можно упомянуть LINE1 повтор мыши и L1-повтор человека.
Длинные повторы изначально были описаны как последовательности ДНК длиной более 5 kb и представленные более чем 104 копиями на геном. В геноме человека было обнаружено только одно семейство повторов LINE - L1. Консенсусная последовательность этих повторов имеет длину около 6 kb, так называемый poly-A "хвост" на одном конце и фланкирована короткими прямыми повторами обычно менее 20 н.п. длиной. Число копий - примерно 100,000 на гаплоидный геном. Большинство этих повторов усечены на 5'-конце.
Слайд 33
Семейство L1 ретротранспозонов является наиболее молодой и широко распространенной группой
LINE элементов. Около полумиллиона копий представителей L1 образуют не менее
17 % человеческого генома.
Полноразмерный элемент имеет длину около 6 тысяч п. о. и включает в свой состав 5' нетранслируемую область (5' UTR - 5' Untranslated Region) длиной около 900 п. о., содержащую внутренний промотор, ORF1 (длиной около 1 т. п. о.) и ORF2 (длиной 4 т. п. о.), разделенные спейсером (63 п. о.), короткую 3' нетранслируемую область (3' UTR - 3' Untranslated Region) длиной около 200 п. о., за которой следует сигнал полиаденилирования и поли А последовательность. В геноме содержится всего лишь около 5000-7000 полноразмерных копий
L1, в то время как остальные копии укорочены со стороны 5' конца. Благодаря этому средняя длина L1 элемента в геноме составляет около 900 п. о.
Считается, что человеческий геном содержит 60-100 L1, сохранивших способность к автономной
ретротранспозиции.
Слайд 34Схема строение LINE 1 элемента
5' UTR и 3' UTR -
5' и 3' нетранслируемые области;
ORF1 и ORF2 - открытые
рамки считывания LINE;
EN – эндонуклеазный домен, RT - домен с активностью обратной транскриптазы, С - С-концевой домен белка ORF2p;
Pr - промотор;
ААТААА - сигнал полиаденилирования;
(А)n - поли А последовательность на 3' конце.
Белые треугольники обозначают дупликации сайта мишени в результате интеграции L1.
Слайд 36
Еще одной обширной группой ретроэлементов являются LTR содержащие ретротранспозоны.
Эта
достаточно разнородная группа включает в себя повторяющиеся элементы, объединяемые наличием
LTR, указывающего на ретровирусное происхождение. При этом LTR (Long Terminal Repeat) определяется как длинный концевой повтор, имеющий по краям инвертированную последовательность TG/CA и содержащий промотор и сайт полиаденилирования. Все LTR-ретропозоны составляют около 8 % человеческого генома и представлены 450 тысячами копий.
Слайд 37
Систематическое исследование и каталогизация базы данных Repbase, содержащей все обнаруженные
повторяющиеся генетические элементы многих организмов, выявило около 200 семейств ретровирусных
и LTR подобных повторяющихся элементов в геноме человека.
К этой группе также относится суперсемейство MaLR (Mammalian apparent LTR retrotransposons) с наиболее многочисленным семейством THE-1.
Последовательность MaLR, находящаяся между двумя LTR, содержит единственную ORF.
Для некоторых MaLR показана гомология их единственной ORF либо ретровирусному гену pol, либо gag, в то время как остальные лишены такого структурного сходства с HERV, что затрудняет объяснение их происхождения. По-видимому, MaLR возникли 80-100 млн. лет
назад, о чем свидетельствует их наличие в геномах млекопитающих различных отрядов, таких как грызуны, парнокопытные и др.
Слайд 38Эндогенные ретровирусы (HERVs-Human Endogenous Retroviruses) - это повторяющиеся мобильные генетические
элементы геномов млекопитающих, сходные по структуре с интегрированной формой персистирующих
экзогенных ретровирусов.
По современным представлениям HERV являются отпечатками древних экзогенных ретровирусов, заразивших клетки линии зародышевого пути и закрепившихся в геноме.
Слайд 39Строение провируса ERV
Белыми прямоугольниками обозначены ORF, соответствующие ретровирусным генам:
gag - group specific antigen кодирует белок основного капсида (CA),
белок ядерного капсида (NC) и белок матрикса (MA);
prt - кодирует дУТФазу (DU) и протеазу (PR);
pol - полимераза кодирует обратную транскриптазу (RT), РНКазу Н (RNH) и интегразу (IN);
env - липопротеиновая оболочка кодирует трансмембранный (TM) и поверхностный (SU) белки.
Черными прямоугольниками обозначен ген corf, кодирующий вспомогательный белок
CORF. PBS - участок связывания тРНК затравки;
LTR - длинный концевой повтор.
Белые треугольники по краям обозначают дупликации сайта мишени (TSD).
Слайд 41
Мобильные генетические элементы (МГЭ) - это последовательности нуклеотидов, меняющие свою
локализацию и копийность в геноме.
Выделяют следущие классы МГЭ:
1. IS -
вставочные элементы у прокариот.
2. Tn - транспозоны у прокариот.
3. Эписомы у прокариот.
4. Некоторые умеренные фаги.
5. Контролирующие элементы кукурузы.
6. Мобильные диспергированные гены у дрозофилы, мыши, человека.
7. Провирусы.
В литературе "транспозоны" - все мобильные генетические элементы. Это элементы генома, которые меняют свое положение и копийность в геноме.
Слайд 42Major Types of Mobile DNA Elements
Слайд 43Major Types of Mobile DNA Elements
Слайд 44IS-элементы
Это самые простые транспозоны. Другое название – инсертосомы.
Размер IS-элементов
~1000 п.н. На концах они содержат инвертированные повторы (~20 п.н.).
IS- элементы содержат только один ген - ген транспозазы, фермента, обеспечивающего перемещение IS-элемента по геному.
Транспозаза - это обобщеный термин.
Разные транспозазы работают по-разному, но смысл общий:
транспозаза вырезает ДНК в одном месте и вставляет в другое место генома.
Перед геном в IS-элементе имеется промотор, за геном - слабый терминатор транскрипции. Не всегда РНК-полимераза останавливается на нем, она может продолжать транскрибировать и рядом стоящий участок генома до сильного терминатора.
Слайд 45Tn-транспозоны
Помимо гена транспозазы Tn-транспозоны содержат один или несколько генов
лекарственной устойчивости. Копийность транспозона возрастает при наличии провокационного фона (например,
наличие в среде антибиотика, ген устойчивости к которому кодируется в транспозоне).
Есть транспозоны, не содержащие гена транспозазы. Такие транспозоны содержат по краям IS-элементы. Размер транспозонов - 2.5-10 тыс. п. н.
Всем транспозонам свойственно наличие прямых повторов, LTR (long terminal repeats - длинные концевые повторы)
После перехода из основной ДНК в плазмиду транспозон может попасть с ней в другую бактерию, придавая новому хозяину ранее отсутствующую лекарственную устойчивость. Кроме того, при вырезании транспозона из геномной бактериальной ДНК захватываются участки генома одной бактерии, которые вместе с транспозоном переносятся в другую бактерию. Захват ДНК происходит, если эта ДНК находится между двумя транспозонами.
Слайд 46Умеренные фаги
Фаги – бактериальные вирусы, осуществляющие инфекционный процесс. Фаг может
захватывать часть генетической информации одной бактерии и переносить ее в
другую. Поэтому сегодня говорят о едином генофонде прокариот.
Вирусы
Некоторые вирусы - на самом деле тоже мобильные элементы. В форме провируса они находятся в геноме клетки хозяина, а потом могут начать перемещаться. Это, например, онкорнавирусы, являющиеся ретровирусами.
С открытием ретровирусов стал вопрос о возможности переноса генетического материала от одного организма к другому без полового процесса. При заражении вирусом генетический материал может переходить от вида к виду, минуя барьеры межвидовой изоляции. Такой перенос был назван горизонтальным.
Его могли осуществлять клещи, паразитирующие на разных видах дрозофилы (работа наподобие иглы со шприцом). Такой перенос может осуществляться, когда хищник поедает жертву (показано, что ДНК переваривается не до конца, отдельные молекулы могут попадать из кишечника в клетку и ядро, а затем интегрироваться в хромосому).
Эписомы прокариот
Эписома – плазмида, способная интегрировать в бактериальную ДНК. Плазмиды способствуют конъюгации бактерий.

Слайд 48Контролирующие элементы кукурузы
Геном кукурузы содержит несколько семейств, члены каждого семейства
могут быть подразделены на два класса:
автономные – способны вырезаться
и транспозироваться и
не автономные – передвигаются, если в определенной области генома есть автономный член того же семейства
Элементы Ty дрожжей
Напоминают бактериальные транспозоны. Способны вырезаться при участии гомологичной рекомбинации; траскрибируются.
Слайд 50P-elements are transposable elements that carry genes for transposase activity
that cause the elements to move, and repressor activity that
prevents expression of transposase.
In a cross between a P-element-carrying female and a laboratory male [left], repressors in the maternally - derived cytoplasm repress expression of the maternally - inherited P elements. The resulting offspring show the wild-type phenotype.
гибридизация при 290С: ♀ норма х ♂ с активным р элементом → все потомство стерильное; ♀ с активным р элементом х ♂ норма → все потомство нормальное
Слайд 51Contribution of mobile genetic elements to the evolution of pathogenic
E. coli.
Слайд 52The Tn916/Tn1545 Family of Conjugative Transposons
http://www.landesbioscience.com/curie/chapter/5268/
Слайд 53Haploid Pokey number inside and outside of rDNA in D.
pulex and D. pulicaria. L isolates are from lakes (D.
pulicaria) and P isolates are from ponds (D. pulex). (a) gPokey and rPokey number in each isolate. rPokey is inserted in 28S genes. gPokey was calculated as (total
Pokey- rPokey). (b) Correlation between gPokey and rPokey. D. pulicaria (-3) refers to the analysis done after excluding the three isolates with high Pokey load
Слайд 54Mobile Genetic Elements in Metazoan Parasites http://www.landesbioscience.com/curie/chapter/3124/
It has become apparent
that the schistosome genome is replete with numerous copies of
diverse repetitive sequences. Mobile genetic elements constitute much of this repetitive component of the schistosome genome. Of these mobile elements, an expanding number of discrete schistosome retrotransposons—long terminal repeat (LTR) retrotransposons, non-LTR retrotransposons and SINEs—have been identified in recent years. The identity, structure, phylogenetic relationships, and size contributions of the schistosome non-LTR retrotransposons reported to date are reviewed here. (Other chapters in this book focus on LTR retrotransposons of schistosomes [Copeland, Laha, Brindley] and schistosome SINES [Ferbeyre].) These elements include members of the CR1, RTE and R2 clades, including elements termed SR1, SR2, SR3, pido and Perere-3 and Perere-9 from Schistosoma mansoni, S. japonicum and S. haematobium. An enhanced understanding of these elements will increase\r\nour understanding on the evolutionary and phylogenetic relationships of schistosomes and Platyhelminths at large, will facilitate the annotation of the soon-to-be-reported draft genome sequences of S. mansoni and S. japonicum, and can be expected to have practical implications including the development of transgenesis vectors.

Слайд 55The impact of retrotransposons on human genome evolution
http://www.nature.com/nrg/journal/v10/n10/full/nrg2640.html
Слайд 56This visualiztion provides an overview of the composition of LTR
retrotransposons across the entire genome, and quickly allows the user
to see that LTR retrotransposons have preferentially accumlated in pericentromeric heterochromatin.
This image illustrates an overview of 1) the distribution of the LTR retrotransposons coverage for the 10 chromosomes in the maize genome, 2) the histogram of the percent coverage of all 1 MB bins in the genome, 3) the empiriculative cumulative distirbution coverage for these data, and 4) color assignment of these data into ten color classes using an euqal interval clustering approach. The above visualization was generated by hand in the R statistical programming language, and providing a tool for quick generation of intuitive visualizations such as these could facilitate exploratory spatial data analysis. Author: James Estill
http://gencart.sourceforge.net/
Слайд 57Distribution of different clades of non-LTR retrotransposons among nematode Caenorhabditis
elegans, fruit fly Drosophila melanogaster, malaria mosquito Anopheles gambiae, sea
squirt Ciona intestinalis, fungi, and vertebrata.
http://retrotransposons.org/index_research_other.html
Слайд 58Age and Number of Mobile elements
Humans contain a higher percentage
of mobile elements (active and incactive) relative to three other
fully-sequenced genes (Fly, worm, mustard):
However, human elements are older.
Even when compared to mice, again human elements are older.
Hence, relative to certain "model" organisms, humans have a higher percentage of their genome from mobile elements, but the vast majority of these are old, no longer functional, elements.
Слайд 59Evolutionary Implications of Mobile Elements
Слайд 60Структура,
механизмы перемещения и
роль подвижных элементов в поддержании целостности хромосом
Слайд 61http://www-old.agr.unipi.it/typo3temp/pics/a46cedf7ff.jpg
http://sete.nichd.nih.gov/current_research.htm
Слайд 62Перемещение транспозона
Концы транспозона (инвертированные повторы) показаны направленными навстречу стрелками.
Дочерние
нити ДНК после репликаии изображены разным цветом
Внизу на схеме направленные
навстречу стрелки указывают положение транспозона в районе «красной»двойной спирали.
Синими стрелками изображен синтез комплементарных нитей.
Слайд 64Сохранение концов хромосомы в процессе повторных актов репликации
Слайд 65Устранение повреждений в одной из комплементарных цепей ДНК и залечивание
двухнитиевого разрыва ДНК с помощью ретротранспозона
Слайд 66Роль МГЭ в регуляции активности генов и эволюции генома
Слайд 67Нарушение работы гена в результате внедрения подвижного элемента
Слайд 68След, оставляемый транспозоном в районе промотора
Слайд 69Variegation in sectors of wildflower petals. A wildflower blooms all
over the middle Atlantic states in the USA in late
May and June. My neighbors call this wild flox. It is an invasive plant, but it is pretty when it blooms. It has two predominant flower colors, purple (A) and white (B). However, a casual examination of the plants reveals sectored petals at a moderate frequency (C-E). This is a variegating phenotype of unknown origin. It can produce white sectors on purple petals (C) or purple sectors on white petals (D, E).
Слайд 70Three-dimensional structure of the Tn5 transposase in complex with Tn5
transposon DNA. A. The dimer of the Tn5 transposase is
shown bound to a fragment of duplex DNA from the end of the transposon. Alpha helices are green cylinders, beta sheets are yellow-brown, flat arrows and protein loops are blue wires. The DNA is a duplex of two red wires, one for each strand. B. The DNA is shown without the protein and with the nucleotides labeled. The end of the DNA at the top of this panel is oriented into the active site in the middle of the protein in panel A. The structure was determined by Davies DR, Goryshin IY, Reznikoff WS, Rayment I. (2000) �Three-dimensional structure of the Tn5 synaptic complex transposition intermediate.� Science 289:77-85. These images was obtained by downloading the atomic coordinates from the Molecular Modeling Database at NCBI, viewing them with CN3D 3.0 and saving static views as screen shots. The file for observing a virtual three-dimensional image is available at the course website.
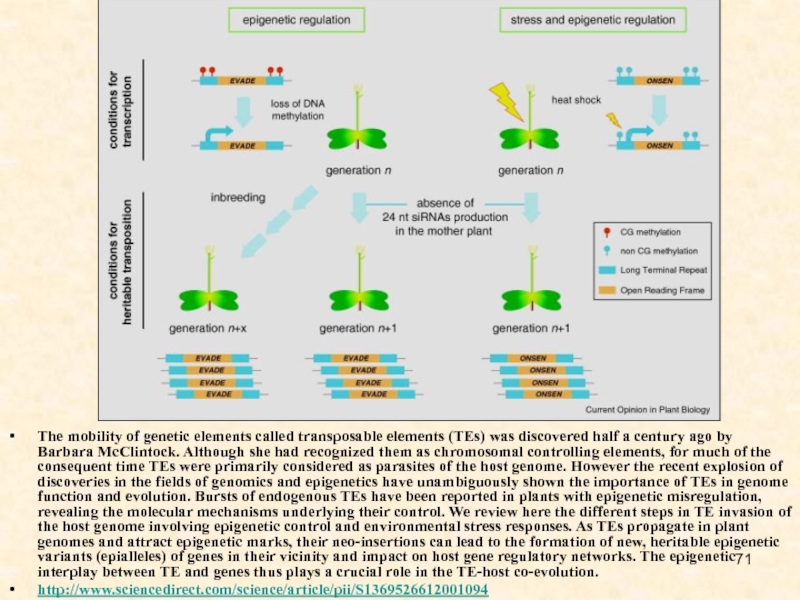
Слайд 71The mobility of genetic elements called transposable elements (TEs) was
discovered half a century ago by Barbara McClintock. Although she
had recognized them as chromosomal controlling elements, for much of the consequent time TEs were primarily considered as parasites of the host genome. However the recent explosion of discoveries in the fields of genomics and epigenetics have unambiguously shown the importance of TEs in genome function and evolution. Bursts of endogenous TEs have been reported in plants with epigenetic misregulation, revealing the molecular mechanisms underlying their control. We review here the different steps in TE invasion of the host genome involving epigenetic control and environmental stress responses. As TEs propagate in plant genomes and attract epigenetic marks, their neo-insertions can lead to the formation of new, heritable epigenetic variants (epialleles) of genes in their vicinity and impact on host gene regulatory networks. The epigenetic interplay between TE and genes thus plays a crucial role in the TE-host co-evolution.
http://www.sciencedirect.com/science/article/pii/S1369526612001094
Слайд 73Перестройки хромосом, обусловленные присутствием в хромосомах одинаковых повторяющихся последовательностей, представленных
подвижными элементами
Слайд 74Эффекты, вызываемые мобильными элементами
- Внедрение мобильных элементов внутрь гена
приводит к выключению гена.
- Может нарушаться регуляция гена, если
мобильный элемент внедряется между оператором и цистроном (у мобильного элемента есть свой промотор).
- Вставка мобильного элемента может привести к экспрессии генов, которые не должны в данное время работать.
Наличие мобильных элементов является фактором, способствующим незаконной рекомбинации.
При незаконной рекомбинации перетасовываются гены, не имеющие отношения друг к другу.
Мобильные элементы провоцируют образование делеций, инверсий, дупликаций. Все это - хромосомные мутации.
Слайд 75Обратная транскрипция
Обратная транскрипция - это синтез ДНК по матрице РНК.
Обратную транскрипцию обнаружили в 1970 г. Темин, Балтимор, Дульбеко, работавшие
с вирусом саркомы Рауса (ВСР). Этот вирус вызывает саркому у кур. Это онкорнавирус (oncoRNA) - относится к ретровирусам.
Ретровирусы - это РНК-содержащие вирусы, в жизненный цикл которых входит стадия образования ДНК обратной транскриптазой и внедрение ее в геном клетки хозяина в форме провируса.
Предпочтительного места внедрения провируса в геном нет. Это позволяет отнести его к мобильным генетическим элементам.
В состав ретровируса входят две идентичные молекулы РНК. На 5'-конце имеется Сap, на 3'-конце - поли А-хвост. Фермент обратную транскриптазу вирус "носит" c собой.
Геном ретровируса содержит 4 гена: gag - белок нуклеоида,
pol - обратная транскриптаза,
env - белок капсида (оболочки),
onc - онкоген, ответственный за злокачественную трансформацию клетки.
str5 = str3 - (short terminal repeat) короткий концевой повтор;
U5, U3 - уникальные последовательности (U5 - 80 н., U3 - 200 н.);
PB (primer binding site) - участок связывания затравки.

Слайд 77Ретровирусные РНК кончаются прямыми повторами (R), а свободные линейные ДНК-последовательностями
LTR; концы провирусов представляют собой LTR-последовательности, укороченные на два основания.
Слайд 78Последовательности LTR образуются при переключении матриц во время обратной транскрипции.
Новая матрица может быть другим концом той же молекулы (как
показано на рисунке) или другой молекулой.
Слайд 79у дефектных в отношении репликации трансформирующих вирусов часть вирусной последовательности
замещена последовательностью клетки. Длина замещенной последовательности характерна для каждого вируса
Интеграция ретровируса сопровождается образованием двух типов кольцевых молекул ДНК
Слайд 80В отдельных случаях последовательность РНК служит предшественником геномной последовательности (ДНК).
Вероятно, РНК должна была превратиться в двухцепочечную ДНК, которая затем
внедрялась в геном с помощью события, напоминающего транспозицию. Прямое указание на существование такого пути получено при изучении ретровирусов, у которых такой путь представляет собой часть обычного инфекционного цикла. Структура некоторых псевдогенов и других последовательностей (включая членов семейства Alu) свидетельствует, что аналогичный путь может быть пройден клеточной последовательностью (достаточно редко). В обоих случаях внехромосомный элемент дает начало геномной последовательности.
По всей вероятности, транспозоны не способны к существованию вне генома. Независимо от того, являются ли они компонентами, играющими важную роль в жизни клетки, или ее паразитами, занятыми только своим собственным воспроизведением, свободных молекул ДНК они не образуют.
Изменения в относительном соотношении компонентов генома иногда происходят во время соматического развития. Хорошо известно, например, увеличение числа копий определенных генов у личинок насекомых. Благодаря возможности отбирать варианты клеток с увеличенным числом копий определенного гена показана случайная амплификация генов в культуре клеток млекопитающих. Инициируемое внутри генома событие амплификации способствует созданию дополнительных копий гена, которые существуют либо в составе хромосомы, либо в форме внехромосомных элементов.
Открытию транспозиции и других перестроек в ДНК в какой-то мере способствовали наши знания об удивительной способности последовательностей ДНК приспосабливаться.
Льюин

Слайд 82ЛОКАЛИЗАЦИЯ МОБИЛЬНЫХ ЭЛЕМЕНТОВ В ЛОКУСАХ рДНК
A small region of
the 28S gene, which contains many insertion classes, is magnified
above this repeat. Arrows indicate the insertion site of the various elements based on their 3' junction with the gene. The current known distribution of each element is also shown.
ЛОКУСЫ рДНК СЛУЖАТ НИШАМИ ДЛЯ МОБИЛЬНЫХ ЭЛЕМЕНТОВ (Eickbush & Eickbush, 2007)
R – недлинные терминальные повторы ретротраннспозоны, в то время как Pokey являются ДНК опосредованным элементом.
R2, R4, R5 и R8 найдены во многих линиях животных, а R1, R6, R7 и RT представляют независимые линии элементов у артропод; они перемещаются иногда за пределы локусов рРНК.
R1 и R2 обнаружены в большом количестве у разных таксонов, т.е. они видимо являются просто успешными «паразитами».
Так как конверсии обычно ингибируются большими вставками (R1 и R2 элементы имеют длину 3.5-5.5 тпн) большая часть элиминации новых инсерций из локусов рДНК (что происходит быстро) осуществляется через неравный кроссинговер между сестринскими хроматидами. Таким образом, «оборот» R1 и R2 является мерой объема неравного кроссинговера в модели согласованной эволюции (Eickbush & Eickbush, 2007)

Слайд 83
Длина этих элементов варьирует от 2000 до 12 000 нуклеотидных
пар. В состав каждого семейства входит много различных элементов, в
таблице приведены лишь немногие из них.
Слайд 84Ба́рбара Мак-Кли́нток (1902-1992) – американский ученый-цитогенетик, лауреат Нобелевской премии по
физиологии и медицине
Барбара Мак-Клинток на чтении Нобелевской лекции 8 декабря
1983 года
Слайд 85
Барбара Мак-Клинток разработала метод визуализации хромосом, сделала множество фундаментальных открытий
в цитогенетике, в их числе
рекомбинация наследственной информации в результате кроссинговера
(«перекреста» и обмена участками хромосом) во время мейоза.
Она составила первую генетическую карту кукурузы, описав физические свойства участков хромосом, показала роль теломер и центромер (участков хромосом, задействованных в сохранении генетической информации),
провела обширные исследования по цитогенетике и этноботанике южноамериканских видов кукурузы, разработала теорию, объясняющую репрессию и экспрессию генетической информации при передаче от одного поколения к другому на примере кукурузы.
В 1951 г. Мак-Клинток открыла транспозоны.
Её работы получили признание в 1960-1970 годы, когда был изучен механизм регуляции генов, открытой Мак-Клинток в 1940-е годы. В 1983 г. Мак-Клинток была удостоена Нобелевской премии по физиологии и медицине с формулировкой «За открытие мобильных генетических элементов».
Слайд 86Стереомикроскоп Мак-Клинток и кукурузные початки на выставке в Национальном музее
естествознания.
Слайд 87Влияние пропорции Ac/Ds на окраску зёрен. Зерно 10 бесцветно: в
нём отсутствуют элементы Ac, и элементы Ds полностью ингибируют синтез
пигментов антоцианов. В клетках зёрен с 11 по 13 присутствует по одному типу Ac, Ds могут перемещаться, что позволяет синтезировать некоторое количество антоцианов и приводит к мозаицизму зёрен. В клетках зёрен 14 и 15 присутствует по два и по три Ac соответственно.
Слайд 88“mobile genetic elements”
comprise 45% of human chromosomal DNA “middle repetitive
DNA”
contribute to spontaneous mutation, genetic rearrangements, horizontal transfer of
genetic material
aid speciation and genomic change (in bacteria transposons are often associated with antibiotic resistance genes)
cells must depress transposition to insure genetic stability
Слайд 89Transposable element: mobile genetic elements of a chromosome that have
the capacity to move from one location to another in
the genome.
Normal and ubiquitous components of prokaryote and eukaryote genomes.
Prokaryotes-transpose to/from cell’s chromosome, plasmid, or a phage chromosome.
Eukaryotes-transpose to/from same or a different chromosome.
Nonhomologous recombination: transposable elements insert into DNA that has no sequence homology with the transposon.
Transposable elements cause genetics changes and make important contributions to the evolution of genomes:
Insert into genes.
Insert into regulatory sequences; modify gene expression.
Produce chromosomal mutations.
Слайд 90Transposable elements:
Two classes of transposable elements/mechanisms of movement:
Encode proteins that
(1) move DNA directly to a new position or (2)
replicate DNA and integrate replicated DNA elsewhere in the genome (prokaryotes and eukaryotes).
Retrotransposons encode reverse transcriptase and make DNA copies of RNA transcripts; new DNA copies integrate at different sites (eukaryotes only).
Слайд 91Transposable elements in prokaryotes:
Two examples:
Insertion sequence (IS) elements
Transposons (Tn)
Слайд 92Insertion sequence (IS) elements:
Simplest type of transposable element found in
bacterial chromosomes and plasmids.
Encode gene (transposase) for mobilization and insertion.
Range
in size from 768 bp to 5 kb.
IS1 first identified in E. coli’s glactose operon is 768 bp long and is present with 4-19 copies in the E. coli chromosome.
Ends of all known IS elements show inverted terminal repeats (ITRs).
Fig. 7.19
Слайд 93Insertion sequence (IS) elements:
Integration of an IS element may:
Disrupt coding
sequences or regulatory regions.
Alter expression of nearby genes.
Cause deletions and
inversions in adjacent DNA.
Result in crossing-over.
Слайд 94Transposition of insertion sequence (IS) elements:
Original copy remains in place;
new copy inserts randomly.
Transposition requires transposase, coded by the IS
element.
IS element otherwise uses host enzymes for replication.
Transposition initiates when transposase recognizes ITRs.
Site of integration = target site.
Staggered cuts are made in DNA at target site by transposase, IS element inserts, DNA polymerase and ligase fill the gaps (note---transposase behaves like a restriction enzyme).
Small direct repeats (~5 bp) flanking the target site are created.
Слайд 95Fig. 7.20, Integration of IS element in chromosomal DNA.
Слайд 96Transposons (Tn):
Similar to IS elements but are more complex structurally
and carry additional genes
2 types of transposons:
Composite transposons
Noncomposite transposons
Слайд 97Composite transposons (Tn):
Carry genes (example might be a gene for
antibiotic resistance) flanked on both sides by IS elements.
Tn10 is
9.3 kb and includes 6.5 kb of central DNA (includes a gene for tetracycline resistance) and 1.4 kb inverted IS elements.
IS elements supply transposase and ITR recognition signals.
Fig. 7.21a
Слайд 98Noncomposite transposons (Tn):
Carry genes (example might be a gene for
antibiotic resistance) but do not terminate with IS elements.
Ends are
non-IS element repeated sequences.
Tn3 is 5 kb with 38-bp ITRs and includes 3 genes; bla (-lactamase), tnpA (transposase), and tnpB (resolvase, which functions in recombination).
Fig. 7.21b
Слайд 99Models of transposition:
Similar to that of IS elements; duplication at
target sites occurs.
Cointegration = movement of a transposon from one
genome (e.g., plasmid) to another (e.g., chromosome) integrates transposon to both genomes (duplication).
Transposition may be replicative (duplication), but it can also be non-replicative (transposon lost from original site).
Result in same types of mutations as IS elements: insertions, deletions, changes in gene expression, or duplication.
Слайд 100Fig. 7.22, Recombination, crossing-over, and duplication of a transposable element.
Слайд 101Transposable elements in eukaryotes:
Barbara McClintock (1902-1992)
Cold Spring Harbor Laboratory, NY
Nobel
Prize in Physiology and Medicine 1983
“for her discovery of mobile
genetic elements”
Studied transposable elements in corn (Zea mays) 1940s-1950s
(formerly identified as mutator genes by Marcus Rhoades 1930s)
Also known for work demonstrating crossing over as part of the chromosomal basis of inheritance.
Biographical sketch, pp. 155-156
Слайд 102General properties of plant transposons:
Possess ITR sequences and generate short
repeats at target sites.
May activate or repress target genes, cause
chromosome mutations, and disrupt genes.
Two types:
Autonomous elements transpose themselves; possess transposition gene.
Nonautonomous elements do not transpose themselves; lack transposition gene and rely on presence of another Tn
McClintock demonstrated purple spots in otherwise white corn (Zea mays) kernels are results of transposable elements.
Слайд 104
McClintock’s discovery of transposons in corn:
c/c = white kernels and
C/- = purple kernels
Kernal color alleles/traits are “unstable”.
If reversion of
c to C occurs in a cell, cell will produce purple pigment and a spot.
Earlier in development reversion occurs, the larger the spot.
McClintock concluded “c” allele results from a non-autonomous transposon called “Ds” inserted into the “C” gene (Ds = dissassociation).
Autonomous transposon “Ac” controls “Ds” transposon (Ac = activator).
Слайд 105Fig. 7.24, Transposon effects on corn kernel color.
Слайд 106McClintock’s discovery of transposons in corn (cont.):
Ac element is autonomous/Ds
element is nonautonomous.
Ac is 4,563 bp with 11 bp ITRs
and 1 transcription unit encoding an 807 amino acid transposase.
Ac activates Ds; Ds varies in length and sequence, but possesses same ITRs as Ac.
Many Ds elements are deleted or rearranged version of Ac; Ds element derived from Ac.
Ac/Ds are developmentally regulated; Ac/Ds transpose only during chromosome replication and do not leave copies behind.
Слайд 107Fig. 20.12 2nd edition, Structure of Ac autonomous and Ds
non-autonomous transposable elements in corn.
Слайд 108Fig. 7.25, Ac transposition mechanism during chromosome replication.
Слайд 109Ty elements in yeast:
Similar to bacterial transposons; terminal repeated sequences,
integrate at non-homologous sites, with target site duplication.
Ty elements share
properties with retroviruses, retrotransposons:
Synthesize RNA copy and make DNA using reverse transcriptase.
cDNA integrates at a new chromosomal site.
Fig. 7.26
Слайд 110Drosophila transposons:
~15% of Drosophila genome thought to be mobile.
P elements
Hybrid
dysgenesis, defects arise from crossing of specific Drosophila strains.
Occurs when
haploid genome of male (P strain) possesses ~40 P elements/genome.
P elements vary in length from 500-2,900 bp.
P elements code a repressor present in the cytoplasm, which makes them stable in the P strain (but unstable when crossed to the wild type female; female lacks repressor in cytoplasm).
Used experimentally as transformation vectors.
Fig. 7.27
Слайд 111http://www.mun.ca/biology/scarr/P-element_hybrid_dysgenesis.htm
Слайд 112Female
P elements
DNA + cytoplasm
Repressor
Stable
Male
No P elements
DNA only
Female
No P elements
DNA +
cytoplasm
No repressor
Male
P elements
DNA only
Offspring
P elements
No repressor
Unstable germ line
Слайд 113Fig. 7.28 Illustration of the use of P elements to
introduce genes into the Drosophila genome
Слайд 114Human retrotransposons:
Alu1 SINEs (short-interspersed sequences)
~300 bp long, repeated 300,000-500,000X.
Flanked
by 7-20 bp direct repeats.
Some are transcribed, thought to move
by RNA intermediate.
AluI SINEs detected in neurofibromatosis (OMIM1622200) intron; results in loss of an exon and non-functional protein.
L-1 LINEs (long-interspersed sequences)
6.5 kb element, repeated 50,000-100,000X (~5% of genome).
Contain ORFs with homology to reverse transcriptases; lacks LTRs.
Some cases of hemophilia (OMIM-306700) known to result from newly transposed L1 insertions.
Слайд 116The role of genes domesticated from LTR retrotransposons and retroviruses
in mammals
Theacquisitionofmultiplegenesfromlongterminalrepeat(LTR)retrotransposonsoccurredinmammals.Genesbelongingtoasushi-ichi-relatedretrotransposonhomologs(SIRH)fam-ilyemergedaroundthetimeoftheestablishmentoftwoviviparousmammaliangroups,marsupialsandeutherians.Thesegenesencodeproteinsthatarehomologoustoaretro-transposonGagcapsidproteinandsometimesalsohaveaPol-likeregion.WepreviouslydemonstratedthatPEG10(SIRH1)andPEG11/RTL1(SIRH2)playessentialbutdifferentrolesinplacentaldevelopment.PEG10isconservedinboththemarsupialsandtheeutherians,whilePEG11/RTL1isaeutherian-specificgene,suggestingthatthesetwodomesticatedgenesweredeeplyinvolvedintheevolutionofmammalsviatheestab-lishmentoftheviviparousreproductionsystem.Inthisreview,weintroducetherolesofPEG10andPEG11/RTL1inmammaliandevelopmentandevolution,andsummarizetheothergenesdomesticatedfromLTRretrotransposonsandendogenousretroviruses(ERVs)inmammals.WealsopointouttheimportanceofDNAmethylationininactivatingandneutralizingtheintegratedretrotransposonsandERVsintheprocessofdomestication. TomokoKaneko-Ishino1* andFumitoshiIshino2 1 SchoolofHealthSciences,TokaiUniversity,Isehara,Kanagawa,Japan 2 Medical ResearchInstitute,TokyoMedicalandDentalUniversity,Tokyo,Japan
Editedby: YukihitoIshizaka,NationalCenterfor Global HealthandMedicine,Japan Reviewedby: MatthewLorincz,UniversityofBritish Columbia, Canada KenjiIchiyanagi,KyushuUniversity, Japan *Correspondence: TomokoKaneko-Ishino,Schoolof Health Sciences,TokaiUniversity, Bohseidai,Isehara,Kanagawa 259-1193,Japan. e-mail: tkanekoi@is.icc.u-tokai.ac.jp

Слайд 117«Прыжки» транспозонов придают причудливую окраску кукурузным початкам. Фото PIXFOLIO/ALAMY из
статьи: Christian Biémont and Cristina Vieira. Genetics: Junk DNA as an
evolutionary force // Nature. V. 443. P. 521–524 (5 October 2006 )
Арабидопсис, любимое растение молекулярных биологов, внимательно следит за колебаниями освещенности при помощи сложной системы светочувствительных белков. Как выяснилось, важнейшую роль в этой системе играют гены прирученных транспозонов. (Фото с сайта www.utoronto.ca)
Слайд 118Благодаря развитию техники геномного секвенирования, мобильные генетические элементы (МГЭ) обнаружены
в геномах самых разных видов, причем наибольшее их разнообразие демонстрируют
беспозвоночные [32]. Все МГЭ по способу перемещения могут быть сгруппированы в два основных класса:
1 - ретротранспозоны, перемещающиеся с помощью РНК-посредника («copy and paste»), и
2 - ДНК транспозоны (перемещается непосредственно ДНК).
Оба класса делятся последовательно на подклассы, суперсемейства и семейства, согласно механизму их интеграции и структурным особенностям.
Ретротранспозоны (LTR, non-LTR и тирозин-рекомбинантные) обнаружены у всех эукариот, от грибов до млекопитающих [33, 34] и, по-видимому, эти МГЭ связаны с половым размножением [35].
ДНК транспозоны (самореплицирующиеся, «cut and paste» и «катящегося кольца») – самая древняя группа МГЭ, распространенная среди про- и эукариот [33, 34].
Интересно, что МГЭ первого класса были обнаружены как у плоских, так и круглых червей, тогда как МГЭ второго класса оказались типичными для паразитических нематод, но не для трематод и ленточных червей [36]. К настоящему времени только у гельминтов млекопитающих описано более 30 различных МГЭ [34].

Слайд 119Как членов фракции повторов, МГЭ вначале считали «мусорной», «эгоистичной» ДНК,
или «геномными паразитами». С накоплением знаний стало очевидным, что помимо
вредных эффектов эти геномные элементы вносят позитивный вклад в эволюцию генома их хозяев и поэтому могут быть переименованы в «потенциально полезные доместицированные элементы» [34], причем геномная доместикация может приводить к существенной функциональной эволюции МГЭ [34, 37-39]. Имеющиеся данные предполагают коэволюцию МГЭ и геномов их хозяев, важную роль этих элементов в формировании и поддержании хромосом хозяина, модификации генной экспрессии и участии в разделении генома на хромосомные домены с эпигенетическими метками [34, 36, 40-43]. Предполагается, что транскрипционная активность ретротранспозонов может специфически контролироваться хозяином и играть определенную роль в регенерации органов животных [41]. Понимание основ регенирации у животных, в том числе плоских червей (привлекающих в последнее время особое внимание), может внести важный вклад в регенеративную медицину человека [3, 6]. Фундаментальное значение и большой практический интерес имеет способность ретроэлементов выполнять важные функции в эмбриогенезе, в частности, влиять на плюрипотентность клеток [41]. Ретротранспозоны часто видо- или родоспецифичны, что открывает перспективу разработки чувствительных и специфичных молекулярных диагностикумов, особенно необходимых для паразитических видов [44]. Изучение этих элементов представляет определенный интерес для эпидемиологических и медицинских исследований, поскольку они могут генерировать специфические генетические паттерны, ассоциированные с клиническими проявлениями заболеваний [36]. МГЭ являются основными кандидатами на роль переносчиков в рамках гипотезы горизонтального переноса ДНК (Horizontal Gene Transfer, HGT) между репродуктивно изолированными видами. События HGT рассматриваются сейчас, как важная движущая сила эволюции эукариотического генома [45, 46], а система паразит-хозяин является оптимальной моделью для изучения данного феномена [47-51].

Слайд 120Передвигаясь по геному и интегрируя в новые сайты, МГЭ могут
обеспечить потенциально вредную генетическую изменчивость, от полиморфизма простой последовательности, до
кардинальных изменений в структуре хромосом, их целостности и инактивации соседних генов [34]. Вырезание и встраивание МГЭ индуцирует мутагенез, уровень которого может в тысячу раз превышать скорость спонтанных мутаций [52]. При этом мутации, создаваемые инсерцией ретротранспозонов, более стабильны, чем мутации, вызванные ДНК транспозонами [53]. Для подавления неконтролируемой пролиферации МГЭ сформировались специальные защитные механизмы против их транспозиции, включающие эпигенетические процессы, такие как система транскрипционного и посттранскрипционного сайленсинга генов. Однако различные виды физиологического стресса, например, температурные изменения или колонизация новых мест обитания хозяевами, могут активировать МГЭ и привести к их пролиферации, разрушив эпигенетический сайленсинг [51]. Основываясь на огромном потенциале для создания генетической изменчивости, ретротранспозоны признаны как основные средства в эволюции, которые приводят к фенотипической изменчивости, экологической адаптации, ремоделированию генома хозяина, а в долгосрочной перспективе – к видообразованию [34, 36, 40, 54-58]. Накопление знаний о структуре и активности МГЭ может пролить свет на эволюционную историю и филогенетические отношения самих элементов и генома хозяина, а также будет способствовать развитию трансгенных технологий, полезных для изучения структуры, функции и контроля генов паразитических видов [36].

Слайд 121Геномная доместикация может приводить к существенной функциональной эволюции МГЭ. В
качестве примера можно отметить влияние этих элементов на эволюцию адаптивной
иммунной системы челюстных позвоночных [37] и нормального развития плаценты у млекопитающих [39], участие в репарации ДНК [27, 38]. Описано большое число генов, произошедших от транспозонов, которые приобрели функцию регуляторов транскрипции, и получены данные, предполагающие происхождение теломеразаы от обратной транскриптазы ретротранспозонов [27].
Слайд 122МГЭ являются основными кандидатами на роль переносчиков в рамках гипотезы
горизонтального переноса ДНК (Horizontal Gene Transfer, HGT) между репродуктивно изолированными
видами. События HGT рассматриваются сейчас, как важная движущая сила эволюции эукариотического генома [49, 50]. Причем считается, что система паразит-хозяин является оптимальной моделью для изучения данного феномена [51-55]. Приобретение МГЭ de novo считается доказанным, если гомология первичных последовательностей в геномах неродственных организмов составляет более 90%. В геномах шистосом известно около 200 различных комбинаций последовательностей хозяина, среди которых ретровирусы мышей. Некоторые последовательности имеют вертикальную трансмиссию, тогда как другие не обладают такой способностью; характер их присутствия/отсутствия в течение жизненного цикла паразита сильно отличается (одни обнаруживаются у марит, другие – в мирацидиях или церкариях и т.п.) [34, 54]. В геноме F. hepatica среди ретротранспозонов обнаружен повтор BovB (67 тыс. полных или частичных копий). Ранее для него был описан горизонтальный перенос между змеями и жвачными [56], а наличие данного элемента у F. hepatica предполагает, что перенос BovB между различными таксонами позвоночных может усиливаться трематодной инфекцией [5]. В геноме анкилостомы Ancylostoma caninum содержится ДНК транспозон bandit. Его ближайшим филогенетическим родственником является ДНК транспозон человека Hsmar, что предполагает возможность горизонтального переноса между анкилостомами и их хозяевами-млекопитающими [27].

Слайд 123Вместе с тем, в отличие от прокариот, у которых HGT
считается признанным и одним из важнейших механизмов достижения генетического разнообразия,
HGT между эукариотами, за исключением переноса фрагментов ДНК вирусными носителями, не является столь же бесспорным. Поводом для критического скептицизма относительно HGT между эукариотическими организмами являются неизвестные механизмы HGT между хозяином и паразитом, а также некоторые методологические особенности, не позволяющие надежно подтвердить наличие данного феномена [55]. Тем не менее, имеющийся объем знаний по изучению HGT позволяет сделать ряд важных заключений:
(1) для HGT не требуется долговременной физической ассоциации между видами, но физический контакт может увеличить вероятность HGT;
(2) смена хозяев может затруднить идентификацию HGT, ассоциированную с паразитизмом;
(3) обнаружение МГЭ часто идентифицируется как HGT, однако следует проверять, нет ли первичного механизма, обусловившего его распространение;
(4) HGT часто подвергается сомнению из-за потенциально возможной контаминации, и эта проблема не должна оставаться без внимания.
Дальнейшие исследования HGT могут в значительной мере пополнить наши представления о геномной коэволюции и дать эволюционое понимание эпидемиологии паразитарных инфекций [55].
