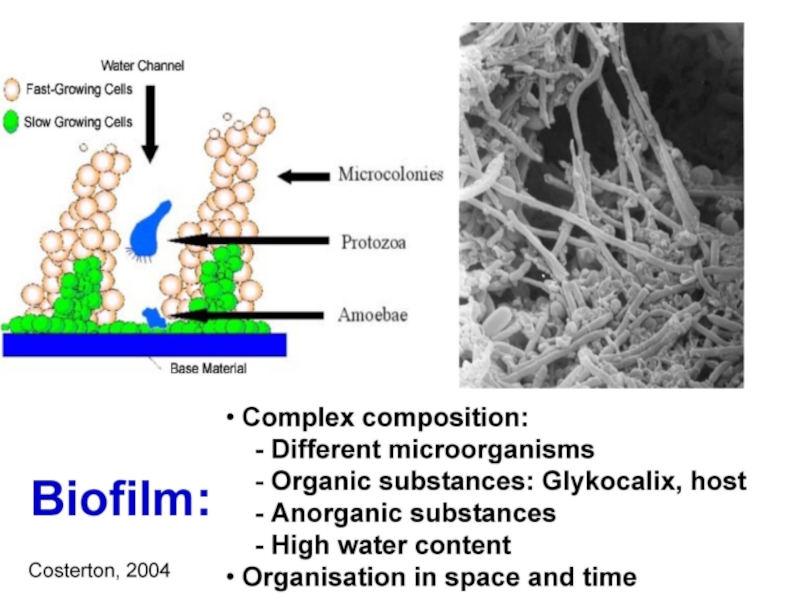
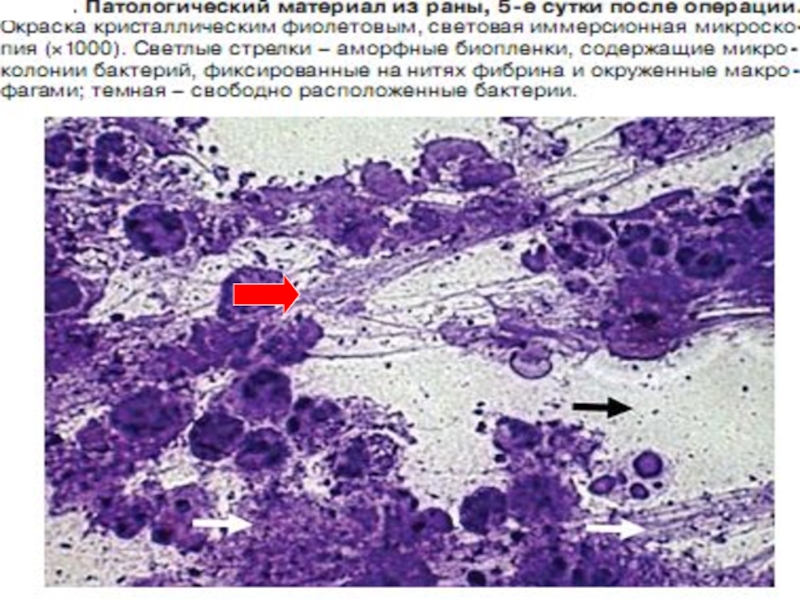
Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ШКОЛА АНТИМИКРОБНАЯ ТЕРАПИЯ В СТАЦИОНАРЕ В СОВРЕМЕННЫХ УСЛОВИЯХ
Содержание
- 1. ШКОЛА АНТИМИКРОБНАЯ ТЕРАПИЯ В СТАЦИОНАРЕ В СОВРЕМЕННЫХ УСЛОВИЯХ
- 2. Слайд 2
- 3. www.escmid.org ESCMIDhttp://jac.oxfordjournals.org/Journal of Antimicrobial Chemotherapyhttp://aac.asm.org/Antimicrobial Agents and Chemotherapyhttp://cid.oxfordjournals.org/Clinical Infectious Diseases
- 4. http://www.elsevier.com/journals/subjects/medicinehttp://www.ijidonline.com/homeInternational Journal of Infectious Diseaseshttp://onlinelibrary.wiley.com/New microbes and new infections
- 5. Часть 1 Проблемы резистентности микроорганизмов к АБ
- 6. Микроорганизмы – возбудители инфекций в хирургии Грам
- 7. Особенности формирования антибиотикорезистентности в РФ (1)Избыточное потребление
- 8. Особенности формирования антибиотикорезистентности в РФ (2)Назначение АБ
- 9. Факторы риска наличия проблемных/ резистентных возбудителейГоспитализация в
- 10. Новые антибиотики vs. рост резистентностиBad Bugs, No
- 11. Проблема: инфекционный контроль в стационаре
- 12. Слайд 12
- 13. Слайд 13
- 14. Слайд 14
- 15. ТерминологияМПК90Механизмы резистентностиАссоциированная резистентностьПерекрестная R Инокулюм – эффект
- 16. Механизмы устойчивости бактерий к АБФерментативная инактивация антибиотикаБета-лактамазыАминогликозид-модифицирующие
- 17. S. aureus – эволюция резистентностиУстойчивость к бета-лактамам50-е
- 18. Устойчивость грамположительных бактерий к бензилпенициллину Пневмококки (модификация ПСБ)1960-е
- 19. Бензилпенициллин (2008 г.)Стрептококковые инфекции КиМТРожаКлостридиальная инфекцияГазовая гангренаМенингит (N.meningitidis)
- 20. Пенициллины
- 21. К этим терминам придется привыкатьMRSA Methicillin-Resistant Staphylococcus Aureus Метициллин-резистентный
- 22. Распространенность БЛРС среди Enterobacteriaceae * S.K. Bouchillon
- 23. Как часто Вы получаете подобный результат для
- 24. Что надо знать о БЛРС ?Возможны ошибки
- 25. Слайд 25
- 26. Контроль возникновения и распространения устойчивых штаммов в
- 27. Часть 2 Классификация АМП и АБ
- 28. Классификация антимикробных препаратовАнтибактериальные препараты (АБ)Противогрибковые препаратыПротивопротозойные препаратыПротивотуберкулезные препаратыПротивопаразитарные препараты
- 29. Классификация антибиотиков (1)1. Бета-лактамные АБПенициллиныЦефалоспорины (ЦС)Монобактамы Карбапенемы 2. Аминогликозиды3. Макролиды4. Фторхинолоны5. Гликопептиды
- 30. Классификация антибиотиков (2)6. Линкозамиды 7. Тетрациклины8. Оксазолидиноны
- 31. Отличительные особенности антибиотиков как лекарственных средствМишень действия – микроорганизмСнижение активности и эффективности со временем
- 32. Антистафилококковые пенициллиныОксациллин Эталон определения чувствительности стафилококков к
- 33. Пенициллины расширенного спектраАмпициллин и амоксициллинСпектр активности –
- 34. Ампициллин
- 35. Ингибитор-защищенные бета-лактамыАмоксициллин/клавуланатАмоксициллин/сульбактамВнебольничные инфекцииАбдоминальныеКожи и мягких тканейРеспираторныеТикарциллин/ клавуланат Пиперациллин/ тазобактамЦефоперазон/сульбактамНозокомиальные инфекцииАбдоминальные Пневмония
- 36. АМО/КК
- 37. Аугментин
- 38. Амоксиклав (амоксициллин + клавулановая кислота)
- 39. Антимикробная активность цефалоспориновI поколениецефазолинII поколение
- 40. Цефалоспорины I-II поколенияЦефалоспорины I: цефазолинStaphylococci (MSSA)StreptococciЦефалоспорины II:
- 41. Цефазолин, применениеПериоперационная антибиотикопрофилактикаДокументированные MSSA – инфекции (S.aureus, чувствительный к оксациллину): ИКМТ, сепсис
- 42. Цефокситин (Анаэроцеф)ЦС II с антианаэробной активностьюСтабилен к
- 43. Цефокситин (Анаэроцеф)Показания:Периоперационная АБ-профилактика в акушерстве, гинекологии, хирургии
- 44. Цефалоспорины III поколенияГруппа IIIа Группа IIIb«Базовые»
- 45. Цефалоспорины IV поколения Цефепим Спектр активности сходен с
- 46. Проблема: БЛРС (ESBL) РФ занимает 1-е место
- 47. Цефоперазон/сульбактам (Сульперазон, Сульперацеф) Клиническое значение комбинацииРасширение клинической активности
- 48. Сульперазон
- 49. Активность ЦС в отношении Ps.aeruginosaЦефпиром > цефепим = цефтазидим > цефоперазон = ЦП/СБ
- 50. Проникновение цефалоспоринов в желчьМакс. концентрации цефоперазона (2 г ) в желчи - >3000 мг/л
- 51. Классификация карбапенемовГруппа 1 – антипсевдомонадныеИмипенем (1986)Меропенем (1995)Дорипенем (2008)Группа 2 – без антипсевдомонадной активностиЭртапенем (2002)
- 52. Тиенам (имипенем)
- 53. Эртапенем (ИНВАНЗ)Карбапенем без антисинегнойной активностиТяжелые внебольничные/ ранние госпитальные инфекции1г х 1 р/сут в/в, в/м
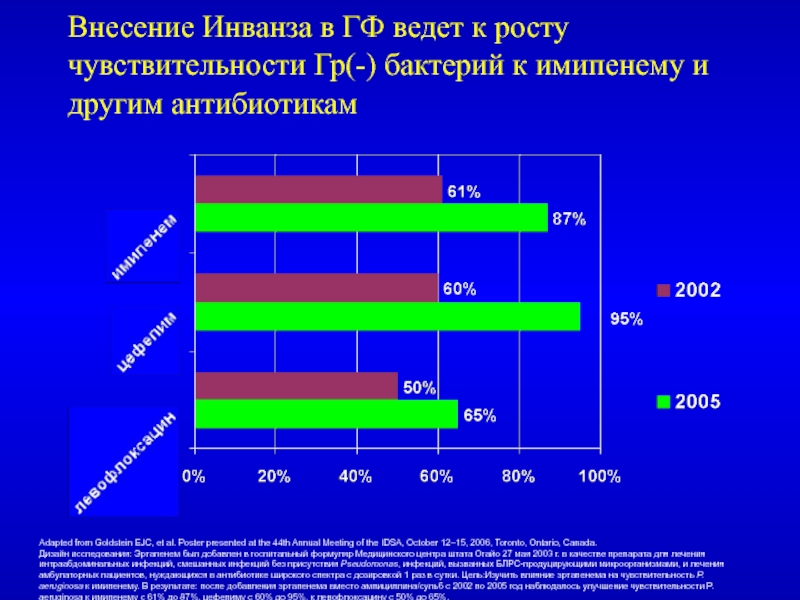
- 54. Внесение Инванза в ГФ ведет к росту
- 55. Карбапенемы: имипенем, меропенем, дорипенем Наиболее
- 56. Устойчивость к карбапенемам Грам(+)S.aureus: перекрестнаяStreptococci: не документирована Грам(-)E.coli, P.mirabilis,
- 57. Имипенем (тиенам)Утрата OprD (пориновый белок -
- 58. Влияние типа мутации на развитие резистентности P.
- 59. Современное значение антисинегнойных карбапенемовЭмпирическая терапияГоспитальный перитонитХолангит, билиарный
- 60. Фармакодинамически эквивалентные режимы дозирования меропенема и имипенемаМеропенем
- 61. Оптимизация фармакодинамических параметров карбапенемовУвеличение дозы при сохранении
- 62. Оптимизация применения меронемапри МПК = 4 мкг/мл
- 63. Обоснование продолжительной инфузии меропенема: стабильность в разных
- 64. Оптимизация применения бета-лактамных антибиотиковВ отношении P.aeruginosa с
- 65. Оптимизация применения меронемаВ отношении P.aeruginosa с МПК
- 66. Болюс 2гДлительная инфузияОптимизация применения меронема064416320481262Концентрация (мкг/мл)Часы
- 67. Объективные причины повышения потребности в карбапенемах (1)По
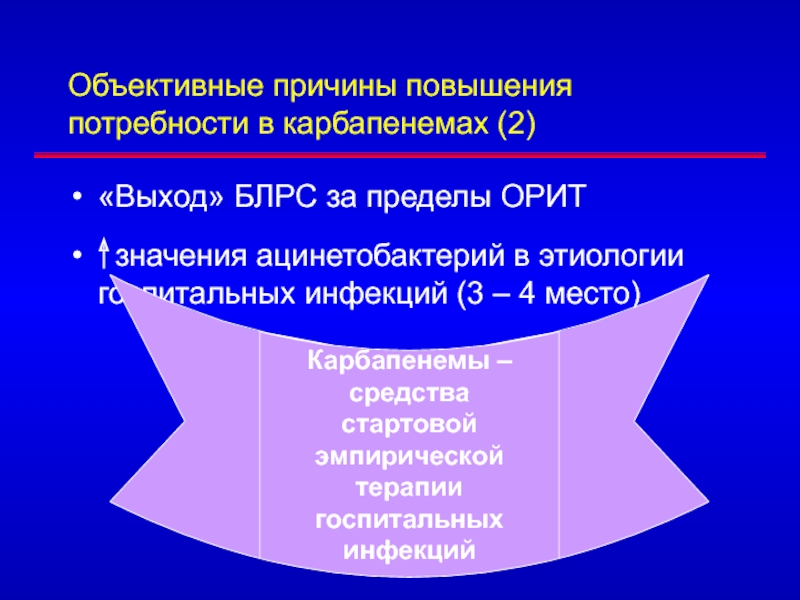
- 68. Объективные причины повышения потребности в карбапенемах (2)«Выход»
- 69. БЛРС: возможности леченияНаиболее надежны карбапенемыФармакодинамически обоснован режим
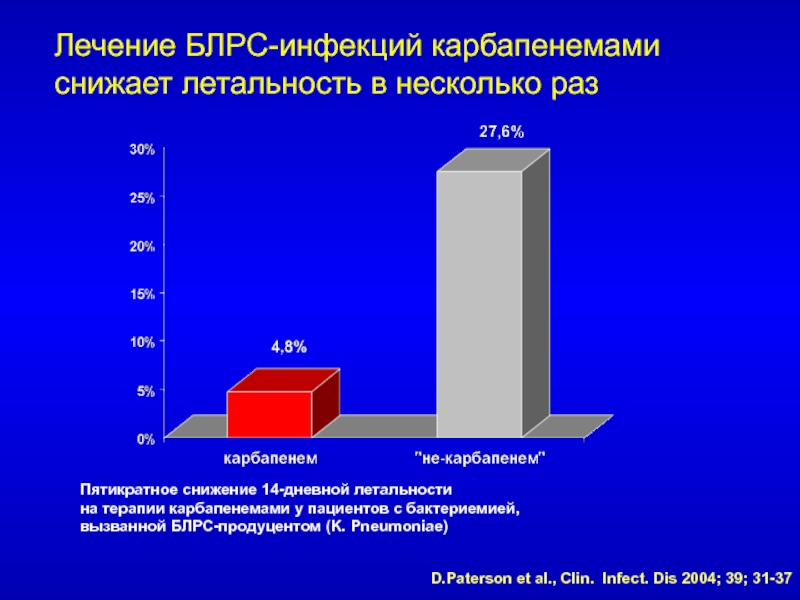
- 70. Лечение БЛРС-инфекций карбапенемами снижает летальность в несколько
- 71. Резюме по антибактериальной активности карбапенемовЭнтеробактерии: E.coli, Klebsiella
- 72. Сравнительные исследования оригинальных и воспроизведенных антибиотиков Фармакодинамическая/терапевтическая эквивалентностьИмипенем:
- 73. Антибиотики генерики – фактор риска летальности в
- 74. Монобактамы /Азтреонам, Азтреабол/ Узкий спектр – грам(-)
- 75. Азтреабол, азактам (азтреонам)
- 76. Монобактамы /Азтреабол/, показания Госпитальная пневмонияИнтраабдоминальные инфекцииИнфекции органов
- 77. Аминогликозиды Природная активностьВысокая: грам(-) бактерииУмеренная:
- 78. однократноетрехкратноеNicolau et al. Antimicrob Agents Chemother 1995;39:650–6551-кратное и 3-кратное введение аминогликозидов0814461012012242048162Концентрация (мкг/мл)Часы
- 79. Современное значение аминогликозидов в стационареВысокий уровень устойчивости
- 80. Повышение безопасности – ключ к успеху новых
- 81. Повышение безопасности – ключ к успеху новых
- 82. ФторхинолоныРанние: ципрофлоксацин Преим. Грам(-) офлоксацин Ципро
- 83. Место новых фторхинолонов в стационареЛевофлоксацин, моксифлоксациннБолее выраженная
- 84. Левофлоксацин vs моксифлоксацинМоксифлоксацин – выше активность против
- 85. Авелокс (моксифлоксацин) Возможности использования в стационаре
- 86. Гликопептиды Ванкомицин Природная активность – Грамположительные бактерииСтафилококки, включая
- 87. Эдицин (ванкомицин)
- 88. 65%
- 89. Доля MRSA штаммов в Европе, 2011Antimicrobial resistance
- 90. Проблема MRSA в России Доля MRSA штаммов
- 91. Распространенность MRSA в стационарах РФ Проблема MRSA-инфекций
- 92. ВанкомицинПоказания к применениюMRSA инфекцииЭнтерококковые инфекции (Амп, Пен
- 93. Ванкомицин«Проблемные» для ванкомицина локализации инфекций –
- 94. ВанкомицинПри использовании в теч. 14 дней появляются
- 95. Условия безопасного применения ванкомицинаИспользовать хроматографически очищенные препараты
- 96. ОксазолидиноныПервый представитель класса – линезолид (зивокс)Антимикробная активность
- 97. Линезолид (Зивокс)Препарат выбора при НПивл, вызванной MRSA
- 98. Линезолид (Зивокс)Другие клинические ситуации, при которых назначение
- 99. Зивокс (линезолид)
- 100. Даптомицин (Кубицин)Новый класс антибиотиков – липопептидНовый механизм
- 101. Антимикробные свойства даптомицина (Кубицина)Быстрое бактерицидное действиеВ
- 102. Новые анти-MRSA препараты: Тигециклин (Тигацил, Wyeth)Производное миноциклинаС
- 103. Тигециклин: первый анти-MRSA антибиотик с широким спектром:
- 104. Отличительные свойства тицециклинаШирокий спектр: Грам(+), Грам(-), анаэробыВозможность
- 105. ЗинфороTM – цефалоспорин с расширенной Грам+ активностьюЦефтаролин
- 106. Фосфомицин натрия (Урофосфабол)Бактерицидный АБМедленное развитие резистентностиШирокий спектр,
- 107. Фосфомицин натрия (УРОФОСФАБОЛ)Активен против БЛРС-продуцентов, ФХ-резистентных уропатогенов,
- 108. Урофосфабол, показанияИнфекции любой локализации, вкл.СепсисMRSA-инфекции (+ ванкомицин)Инфекционный эндокардитБактериальный менингитНейтропенияПолирезистентные штаммы синегнойной палочки
- 109. Урофосфабол, неантибактериальные свойстваСпособность проникать в биопленкиСтимуляция фагоцитозаИммуномодулирующий эффектПредупреждение ото- и нефротоксичности (АГ, ванкомицин, амфотерицин В)
- 110. МетронидазолСпектр активности – только анаэробыНе применять вместе
- 111. Проблема резистентности анаэробовКарбапенемы 1 – 2%Амоксиклав
- 112. Полимиксин В (Вилимиксин)Эффективен в отношении грам(-) бактерий
- 113. Полимиксин В (Вилимиксин), лекарственные взаимодействияПолимиксин +Имипенем +Рифампицин
- 114. МакролидыБактериостатикиПри аллергии на β-лактамыПостантибиотический, иммуномодулирующий эффекты (14- и 15-членные макролиды)Разрушение биопленок
- 115. Рекомендуется ограничить использованиеЭритромицин - эффективная доза 2
- 116. Слайд 116
- 117. Слайд 117
- 118. Слайд 118
- 119. Слайд 119
- 120. Слайд 120
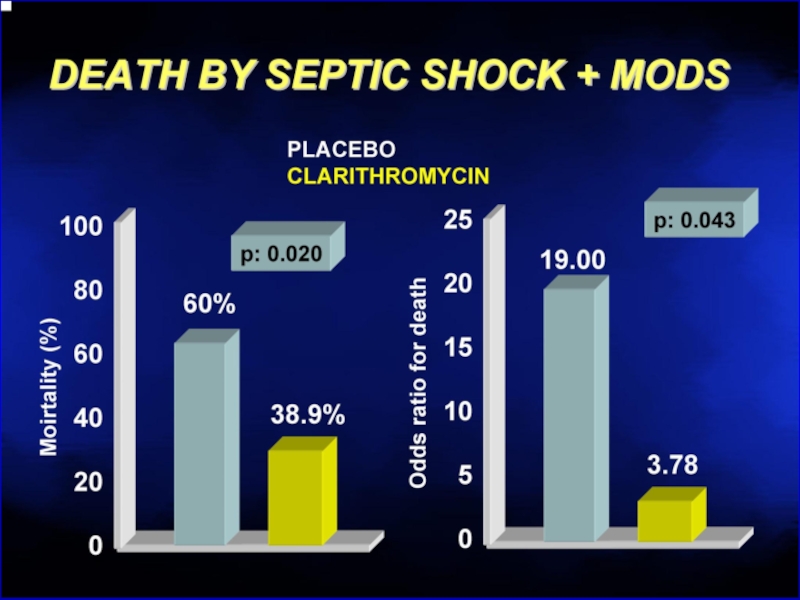
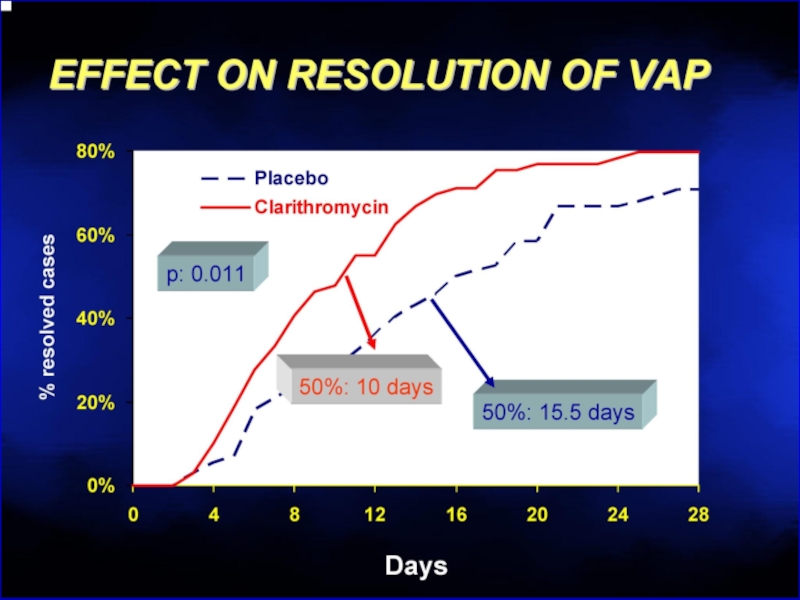
- 121. Клацид проникает в биопленки
- 122. Слайд 122
- 123. Слайд 123
- 124. Слайд 124
- 125. Слайд 125
- 126. Слайд 126
- 127. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1ШКОЛА
«АНТИМИКРОБНАЯ ТЕРАПИЯ В СТАЦИОНАРЕ В СОВРЕМЕННЫХ УСЛОВИЯХ»
Шаповалова Ю.С.,
к.м.н.,
главный клинический фармаколог ЮУЖД
Слайд 3www.escmid.org ESCMID
http://jac.oxfordjournals.org/
Journal of Antimicrobial Chemotherapy
http://aac.asm.org/
Antimicrobial Agents and Chemotherapy
http://cid.oxfordjournals.org/
Clinical Infectious Diseases
Слайд 4http://www.elsevier.com/journals/subjects/medicine
http://www.ijidonline.com/home
International Journal of Infectious Diseases
http://onlinelibrary.wiley.com/
New microbes and new infections
Слайд 6Микроорганизмы – возбудители инфекций в хирургии
Грам (+) аэробы
Staphylococcus
Streptococcus
Enterococcus
Анаэробы
Bacteroides
Clostridium
Грам (–) аэробы
Enterobacteriaceae
Escherichia Enterobacter
Klebsiella Citrobacter
Proteus Morganella Serracia
Неферментирующие грам (-)
энтеробактерииPseudomonas
Acinetobacter
Burkholderia
Stenotrophomonas
Слайд 7Особенности формирования антибиотикорезистентности в РФ (1)
Избыточное потребление АМП в ОРИТ
–
США – 0,8 доз на 1 чел. в сутки
– РФ
– 1,5 - 2,5 дозы на 1 чел. в сутки Слайд 8Особенности формирования антибиотикорезистентности в РФ (2)
Назначение АБ без учета спектра
природной активности (АГ при внебольничной пневмонии)
Назначение АБ без учета данных
о приобретенной резистентностиНедостаточные дозы
Недостаточный курс (клиническое/ бактериологическое выздоровление)
Режим дозирования (цефотаксим 2 р/сут)
Слайд 9Факторы риска наличия проблемных/ резистентных возбудителей
Госпитализация в предшествующие 90 дней
Перевод
из другого стационара
АБТ в предшествующие 90 дней
Релапаротомии
Иммуносупрессия
Слайд 10Новые антибиотики vs. рост резистентности
Bad Bugs, No Drugs: No ESCAPE?
Количество
новых молекул антибиотиков,
одобренных в США 1983–2007
Boucher at al. Clinical
Infectious Diseases 2009; 48:1–12Количество новых антибиотиков, шт.
Слайд 15Терминология
МПК90
Механизмы резистентности
Ассоциированная резистентность
Перекрестная R
Инокулюм – эффект
Слайд 16Механизмы устойчивости бактерий к АБ
Ферментативная инактивация антибиотика
Бета-лактамазы
Аминогликозид-модифицирующие ферменты
Модификация мишени действия
Пенициллинсвязывающие
белки (ПСБ)
Устойчивость стафилококков к оксациллину
Устойчивость пневмококков к пенициллину
Нарушение проницаемости внешних
структур микробной клетки Активное выведение антибиотика из микробной клетки (эффлюкс)
Слайд 17S. aureus – эволюция резистентности
Устойчивость к бета-лактамам
50-е - продукция плазмидных
бета-лактамаз класса А
60-е – MRSA (ORSA – oxacillin resistant S.
aureus) модифицированный пенициллинсвязывающий белок ПСБ2а1941 – нет
1945 – первый штамм, продуцирующий БЛ
1955 – 50% штаммов устойчивы
2000 – 95% штаммов устойчивы
Слайд 18Устойчивость грамположительных бактерий к бензилпенициллину
Пневмококки (модификация ПСБ)
1960-е годы – первый
штамм
1990 – около 1%
2003 – 20-60%
Пиогенный стрептококк
Устойчивость не документирована
Слайд 19Бензилпенициллин (2008 г.)
Стрептококковые инфекции КиМТ
Рожа
Клостридиальная инфекция
Газовая гангрена
Менингит (N.meningitidis)
Слайд 21К этим терминам придется привыкать
MRSA Methicillin-Resistant Staphylococcus Aureus
Метициллин-резистентный стафилококк
VRE Vancomycin-Resistant Enterococcus
Ванкомицин-резистентный энтерококк
ESBL
(БЛРС) Extended-Spectrum Beta-Lactamases
Бета-лактамазы расширенного спектра
AmpC Хромосомные бета-лактамазы класса С
MBL Metallo-Beta-Lactamases
Металло-бета-лактамазы
Pan-Resistant Панрезистентность
Слайд 22Распространенность БЛРС среди Enterobacteriaceae
* S.K. Bouchillon et al., Int
J Antimicrob Agents 2004 (24): 119–24
**M.Edelstein et al., ICAAC, 2004,
Washington, P: C2-1331; ***Исследование РЕВАНШ, 2006-08 Россия
2002-04**:
52.4%
2006-08***:
70.1%
Слайд 23Как часто Вы получаете подобный результат для E. coli или
K. pneumoniae из микробиологической лаборатории?
Цефотаксим: Р
Цефтазидим: Ч
Цефепим: Ч
Может ли Ваша микробиологическая лаборатория
выявлять ESBL?ЛОЖНАЯ ЧУВСТВИТЕЛЬНОСТЬ ESBL+ ШТАММОВ К ЦС III-IV IN VITRO
ESBL+ штаммы
(n=720, РЕВАНШ 2006-07)
Критерии CLSI-2007 (Ч 8 мг/л)
Слайд 24Что надо знать о БЛРС ?
Возможны ошибки в детекции БЛРС
(в т.ч. автомати-ческими анализаторами) в присутствии AmpC
Правило 1: При устойчивости
энтеробактерий хотя бы к одному из цефалоспоринов III-IV поколения, считать вероятной продукцию БЛРС и трактовать как устойчивость ко всем цефалоспоринамЧасто выявляется устойчивость к другим классам АБП
Правило 2: Считать вероятными продуцентами БЛРС, наряду с нозокомиальными штаммами E.coli, Klebsiella spp., P.mirabilis, другие энтеробактерии – Enterobacter spp., P.vulgaris, Serratia spp
Слайд 26Контроль возникновения и распространения устойчивых штаммов в стационаре
Ограничение использования антибиотиков
без обоснованных показаний
Профилактическое назначение антибиотиков оправдано только в качестве предоперационной
профилактики (1-2 дозы)Не доказана эффективность антибиотикопрофилактики:
У пациентов в ОРИТ, на ИВЛ
После хирургических вмешательств
При бессимптомной бактериурии
Антифунгальная профилактика при применении антибиотиков широкого спектра
Слайд 28Классификация антимикробных препаратов
Антибактериальные препараты (АБ)
Противогрибковые препараты
Противопротозойные препараты
Противотуберкулезные препараты
Противопаразитарные препараты
Слайд 29Классификация антибиотиков (1)
1. Бета-лактамные АБ
Пенициллины
Цефалоспорины (ЦС)
Монобактамы
Карбапенемы
2. Аминогликозиды
3. Макролиды
4.
Фторхинолоны
5. Гликопептиды
Слайд 30Классификация антибиотиков (2)
6. Линкозамиды
7. Тетрациклины
8. Оксазолидиноны (линезолид)
9. Липопептиды (даптомицин)
10.
Глицилциклины (тигециклин)
11. Сульфаниламиды (ко-тримоксазол)
12. Прочие (фосфомицин)
Слайд 31Отличительные особенности антибиотиков как лекарственных средств
Мишень действия – микроорганизм
Снижение активности
и эффективности со временем
Слайд 32Антистафилококковые пенициллины
Оксациллин
Эталон определения чувствительности стафилококков к бета-лактамам
Эффективен только
против MSSA
MSSE – умеренная активность
Показание – подтвержденные MSSA-инфекции
Дозировка – 8
– 12 г/сут в 4-6 введенийВсасывание в жкт 20 - 30%, пища биодоступность
Слайд 33Пенициллины расширенного спектра
Ампициллин и амоксициллин
Спектр активности – E.coli, P.mirabilis, H.influenzae
Enterococcus faecalis, листерии
Показания -бак.менингит, бак.эндокардит, инфекции ЖВП, ? интраабоминальные послеоперационные
Дозировка:
в/в, в/м 8 – 12 г/сут в 4 введенияВсасывание ампициллина в жкт 30 - 40%, пища биодоступность ампициллина в 2 раза
Слайд 35Ингибитор-защищенные бета-лактамы
Амоксициллин/клавуланат
Амоксициллин/сульбактам
Внебольничные инфекции
Абдоминальные
Кожи и мягких тканей
Респираторные
Тикарциллин/ клавуланат
Пиперациллин/ тазобактам
Цефоперазон/сульбактам
Нозокомиальные инфекции
Абдоминальные
Пневмония
Слайд 36АМО/КК
АМО/СБ
Сильный ингибитор и сильный индуктор БЛРС
Только
в/в и per os1,2 г х 3 – 4 р/сут
Слабый ингибитор и слабый индуктор БЛРС
В/в, в/м и per os
1,5 г х 3 р/сут
Acinetobacter spp.++
Слайд 39Антимикробная активность цефалоспоринов
I поколение
цефазолин
II поколение ограниченный
цефуроксим,
цефокситин
спектр
преим. Грам(+)
III поколение
цефотаксим, цефтриаксон,
цефтазидим, цефоперазонширокий спектр Грам(-) и Грам(+)
IV поколение
Цефепим, Цефпиром
V поколение - цефтаролин
Слайд 40Цефалоспорины I-II поколения
Цефалоспорины I: цефазолин
Staphylococci (MSSA)
Streptococci
Цефалоспорины II: цефуроксим
Haemophilus influenzae
Staphylococci: ЦС
I = ЦС II
Streptococci: ЦС I ≤ ЦС II
(< Ампициллин)E.coli, Proteus: ЦС I < ЦС II (< ЦС III-IV)
Слайд 41Цефазолин, применение
Периоперационная антибиотикопрофилактика
Документированные MSSA – инфекции (S.aureus, чувствительный к оксациллину):
ИКМТ, сепсис
Слайд 42Цефокситин (Анаэроцеф)
ЦС II с антианаэробной активностью
Стабилен к бета-лактамазам класса А
и D (ТЕМ-1, ТЕМ-2, SHV-1)
Активен в гное
Дети с 0 дней
Слайд 43Цефокситин (Анаэроцеф)
Показания:
Периоперационная АБ-профилактика в акушерстве, гинекологии, хирургии органов брюшной и
грудной полостей
Внебольничные интраабдоминальные и гинекологические инфекции
Монотерапия внебольничных инфекций НДП, плевры,
МВП, ИКМП (диабетическая стопа, ишемия)Слайд 44Цефалоспорины III поколения
Группа IIIа Группа IIIb
«Базовые»
«Антисинегнойные»
Цефотаксим Цефтазидим
Цефтриаксон Цефоперазон
Enterobacteriaceae
+ Streptococci
(= Амп) + P.aeruginosa+/- S.aureus (< Окс, ЦСI-II) +/- Acinetobacter
Цефалоспорины III гидролизуются бета-лактамазами Грам(-) бактерий:
Класса А – БЛРС
Класса С – АмрС
Слайд 45Цефалоспорины IV поколения
Цефепим
Спектр активности сходен с цефалоспоринами III
= цефотаксим,
цефтриаксон против стрептококков
= цефтазидим против P.aeruginosa
В меньшей степени вызывает селекцию
БЛРСЦефпиром
эффективен при сниженной чувствительности к цефепиму
Слайд 46Проблема: БЛРС (ESBL)
РФ занимает 1-е место в мире по
продукции БЛРС
2008 год: устойчивость м/о – продуцентов БЛРС
– к цефепиму 60%– к цефтазидиму 70%
Слайд 47Цефоперазон/сульбактам (Сульперазон, Сульперацеф)
Клиническое значение комбинации
Расширение клинической активности цефоперазона на штаммы
Грам(-) бактерий, продуцирующих БЛРС и устойчивых к незащищенным цефалоспоринам III-IV
Возможность применения при госпитальных инфекциях, вызванных не только P.aeruginosa
Появление клинической активности против анаэробов – возможность применения в режиме монотерапии при смешанных инфекциях (интраабдоминальные, раневые инфекции)
в современных условиях
часто – неуспех при госпитальных инфекциях
Слайд 49Активность ЦС в отношении Ps.aeruginosa
Цефпиром > цефепим = цефтазидим >
цефоперазон = ЦП/СБ
Слайд 50Проникновение цефалоспоринов в желчь
Макс. концентрации цефоперазона (2 г ) в
желчи - >3000 мг/л
Слайд 51Классификация карбапенемов
Группа 1 – антипсевдомонадные
Имипенем (1986)
Меропенем (1995)
Дорипенем (2008)
Группа 2 –
без антипсевдомонадной активности
Эртапенем (2002)
Слайд 53Эртапенем (ИНВАНЗ)
Карбапенем без антисинегнойной активности
Тяжелые внебольничные/ ранние госпитальные инфекции
1г х
1 р/сут в/в, в/м
Слайд 54Внесение Инванза в ГФ ведет к росту чувствительности Гр(-) бактерий
к имипенему и другим антибиотикам
Adapted from Goldstein EJC, et
al. Poster presented at the 44th Annual Meeting of the IDSA, October 12–15, 2006, Toronto, Ontario, Canada.Дизайн исследования: Эртапенем был добавлен в госпитальный формуляр Медицинского центра штата Огайо 27 мая 2003 г. в качестве препарата для лечения интраабдоминальных инфекций, смешанных инфекций без присутствия Pseudomonas, инфекций, вызванных БЛРС-продуцирующими микроорганизмами, и лечения амбулаторных пациентов, нуждающихся в антибиотике широкого спектра с дозировкой 1 раз в сутки. Цель:Изучить влияние эртапенема на чувствительность P. aeruginosa к имипенему. В результате: после добавления эртапенема вместо ампициллина/сульб с 2002 по 2005 год наблюдалось улучшение чувствительности P. aeruginosa к имипенему с 61% до 87%, цефепиму с 60% до 95%, к левофлоксацину с 50% до 65%.
Слайд 55
Карбапенемы:
имипенем, меропенем, дорипенем
Наиболее широкий спектр антимикробной активности
Практически 100% чувствительность
Enterobacteriaceae
Чувствительность P.aeruginosa и Acinetobacter варьирует
Увеличение использования приводит к:
Элиминации резистентных штаммов
Enterobacteriaceae (прежде всего, продуцентов БЛРС и АмрС бета-лактамаз)Возможна селекция полирезистентных штаммов P.aeruginosa
Сильные индукторы бета-лактамаз
В РФ зарегистрированы штаммы Klebsiella и P.aeruginosa, продуцирующие металло-энзимы класса В и группы 2f (VIM) – устойчивость к карбапенемам
Слайд 56Устойчивость к карбапенемам
Грам(+)
S.aureus: перекрестная
Streptococci: не документирована
Грам(-)
E.coli, P.mirabilis, анаэробы – нет
Acinetobacter
- перекрестная
P.aeruginosa: разные механизмы – разный уровень
В среднем к МЕРО
и ДОРИ на 5-10% ниже [Turner P., 2006]У дорипенема наиболее высокая природная активность
Слайд 57
Имипенем (тиенам)
Утрата OprD (пориновый белок - проникновение)
Частота мутаций 10-7
МПК увеличивается
с 1-2 до 8-32 мкг/мл и выше
Клиническая неэффективность
Меропенем (меронем), Дорипенем
(дорипрекс)Активация систем активного выведения (эффлюкс)
МПК увеличивается с 0,12-0,5 до 2-4 мкг/мл
Клиническая эффективность сохраняется
Потеря OprD + активное выведение (эффлюкс)
Вероятность одновременной мутации 10-14
[Livermore DM. JAC 2001; 47:247]
Развитие резистентности P.aeruginosa к карбапенемам
Слайд 58Влияние типа мутации на развитие резистентности P. aeruginosa
- Для развития
устойчивости к Меронему необходимо сочетание двух механизмов мутации
(более
редкое и сложнодостижимое событие)-Для развития устойчивости к имипинему достаточно только одного механизма (наиболее часто индуцируемое событие)
Яковлев С.В. «Фарматека» № 8/9 (2007)
P. Turner, Diagnostic Microbilolgy and Inf. Dis 2004; 39;31-37
Вывод: Меронем обладает наибольшим потенциалом
в преодолении резистентности проблемных патогенов
Слайд 59Современное значение антисинегнойных карбапенемов
Эмпирическая терапия
Госпитальный перитонит
Холангит, билиарный сепсис
Инфекции pancreas
Пациенты с
высоким риском смерти
Этиотропная терапия
Инфекции, вызванные БЛРС-продуцентами
– Acinetobacter spp., P.aeruginosa
Слайд 60Фармакодинамически эквивалентные режимы дозирования меропенема и имипенема
Меропенем 1,5 г/сут =
имипенем 2 г/сут
Меропенем 3 г/сут = имипенем 4 г/сут
Слайд 61Оптимизация фармакодинамических параметров карбапенемов
Увеличение дозы при сохранении интервалов введения
Сокращение интервалов
между введениями (более частое введение) при сохранении суточной дозы
Применение продолжительной
внутривенной инфузииСлайд 62Оптимизация применения меронема
при МПК = 4 мкг/мл :
30-минутная инфузия:
500
мг - %T>МПК ~ 30%
2000 мг - %T>МПК ~ 58%
3-часовая
инфузия:500 мг - %T>МПК ~ 43%
2000 мг - %T>МПК ~ 73%
при МПК = 16 мкг/мл:
30-минутная инфузия 2000 мг %T>МПК ~ 32%
3-часовая инфузия 2000 мг %T>МПК ~ 48%
Вывод: При 3 часовой инфузии 2000 мг препарата бактерицидный эффект достигается в отношении возбудителей, которые рассматриваются как резистентные к меропенему!!!
Слайд 63Обоснование продолжительной инфузии меропенема: стабильность в разных растворителях
Физиологический (0,9%) раствор
при комнатной температуре – 4-10 часов
Раствор Рингер-лактат - 4-8 часов
Раствор
глюкозы 5% - 1-3 часа Термостатирующая система (+4оС) – 24 часа
Слайд 64Оптимизация применения бета-лактамных антибиотиков
В отношении P.aeruginosa с МПК 0.25-64 мкг/мл
высокая доза в сочетании с продолжительной инфузией меропенема приводит к
возрастанию вероятности подавления флоры (данных о достоверности нет).Dandekar PK, Maglio D, Sutherland CA, et al. Pharmacokinetics of meropenem 0.5 and 2 g every 8 hours as a 3-hour infusion. Pharmacotherapy. 2003;23:988-991.
Слайд 65Оптимизация применения меронема
В отношении P.aeruginosa с МПК 64 мкг/мл высокая
доза (2 грамма) болюсом в сочетании с продолжительной инфузией меропенема
6г/сут приводит к возрастанию вероятности подавления флоры (данных о достоверности нет).Dandekar PK, Maglio D, Sutherland CA, et al. Pharmacokinetics of meropenem 0.5 and 2 g every 8 hours as a 3-hour infusion. Pharmacotherapy. 2003;23:988-991.
Слайд 66Болюс 2г
Длительная инфузия
Оптимизация применения меронема
0
64
4
16
32
0
4
8
1
2
6
2
Концентрация (мкг/мл)
Часы
Слайд 67Объективные причины повышения потребности в карбапенемах (1)
По распространенности БЛРС в
ОРИТ РФ на 1-м месте
Увеличение доли СТХ-М БЛРС и снижение
чувствительности БЛРС-продуцентов к альтернативным АББЛРС R к ЦС + к АГ и ФХ
СТХ-М БЛРС R ко всем альтернативным группам АБ
Слайд 68Объективные причины повышения потребности в карбапенемах (2)
«Выход» БЛРС за пределы
ОРИТ
значения ацинетобактерий в этиологии госпитальных инфекций (3 – 4
место)Карбапенемы – средства
стартовой эмпирической терапии
госпитальных инфекций
Слайд 69БЛРС: возможности лечения
Наиболее надежны карбапенемы
Фармакодинамически обоснован режим дозирования 1.5 г
в сутки
меропенем = дорипенем > имипенем > эртапенем
Альтернатива: ингибиторзащищенные бета-лактамы
Цефоперазон/сульбактам
> пиперациллин/тазобактамАдекватный режим дозирования:
Сульперазон 2 г 3 р/сут или 4 г 2 р/сут
Тазоцин 4,5 г 3-4 р/сут
Альтернатива: Тигециклин
Слайд 70Лечение БЛРС-инфекций карбапенемами снижает летальность в несколько раз
Пятикратное снижение 14-дневной
летальности
на терапии карбапенемами у пациентов с бактериемией,
вызванной БЛРС-продуцентом
(K. Pneumoniae)D.Paterson et al., Clin. Infect. Dis 2004; 39; 31-37
Слайд 71Резюме по антибактериальной активности карбапенемов
Энтеробактерии: E.coli, Klebsiella spp., Proteus и
др.
Меропенем = дорипенем > имипенем = эртапенем
Acinetobacter baumannii
Меропенем = дорипенем* = имипенем*НО! Для штаммов с МПК > 2 мкг/мл доза дори- 1,5 г/сут может оказаться недостаточной
P.aeruginosa
Меропенем = дорипенем* >> имипенем
Слайд 72Сравнительные исследования оригинальных и воспроизведенных антибиотиков
Фармакодинамическая/терапевтическая эквивалентность
Имипенем: Тиенам vs генерик
Тиенам
= генерик по фармацевтическим показателям
Тиенам = генерик по значениям МПК
и МБКТиенам достоверно превосходил генерик (P<0.0001) в эффективности в ДС экспериментальной модели инфекции [Agudelo M, 48th ICAAC, 2008, Abstr A-031]
Меропенем: Меронем vs генерик
Меронем = генерик по фармацевтическим, микробиологическим и фармацевтическим показателям (биоэквивалентность)
Меронем достоверно (P<0001) превосходил генерик по отношению доза – эффект в экспериментальной модели инфекции
Различия связаны с разной стабильностью к DHP-1
[Agudelo M, 49th ICAAC, 2009, Poster 3279]
Слайд 73Антибиотики генерики – фактор риска летальности в ОРИТ при инфекциях,
вызванных ацинетобактериями [Torres J, 49th ICAAC, 2009, Poster K-312]
Проспективное, многоцентровое
исследование10 больниц, 114 пациентов с НИ, вызванной Acinetobacter baumanii
>90% штаммов из крови и/или дыхательных путей
APACHE II > 15 баллов
Факторы риска летальности: RR 95% CI
Лечение в государственной больнице 9.4 2.6-33
Лечение генерическими антибиотиками 5.2 2.1-12.9
Лечение генериками меропенема 7.3 1.9-27.5
Слайд 74Монобактамы /Азтреонам, Азтреабол/
Узкий спектр – грам(-) аэробы, вкл. Ps.aeruginosa,
продуцирующую металло-беталактамазы
Бактерицидный эф-т (нарушает образование клеточной стенки бактерий)
R – Acinetobacter,
Stenotrophomonas maltophilia, Burkholderia cepacia, грам(+) кокки, анаэробыУстойчив ко многим бета-лактамазам грам(-) флоры
Нет перекрестной аллергии с пенициллинами и ЦС
Слайд 76Монобактамы /Азтреабол/, показания
Госпитальная пневмония
Интраабдоминальные инфекции
Инфекции органов малого таза
Инфекции МВП
ИКМТ,
костей и суставов
Сепсис
В/м и в/в 1 – 2 г х
3 – 4 р/сутСлайд 77Аминогликозиды
Природная активность
Высокая: грам(-) бактерии
Умеренная: стафилококки
Слабая:
энтерококки
Природно устойчивы:
Стрептококки, пневмококки, анаэробы
НЕ ПРОНИКАЮТ В ГНОЙ!!!
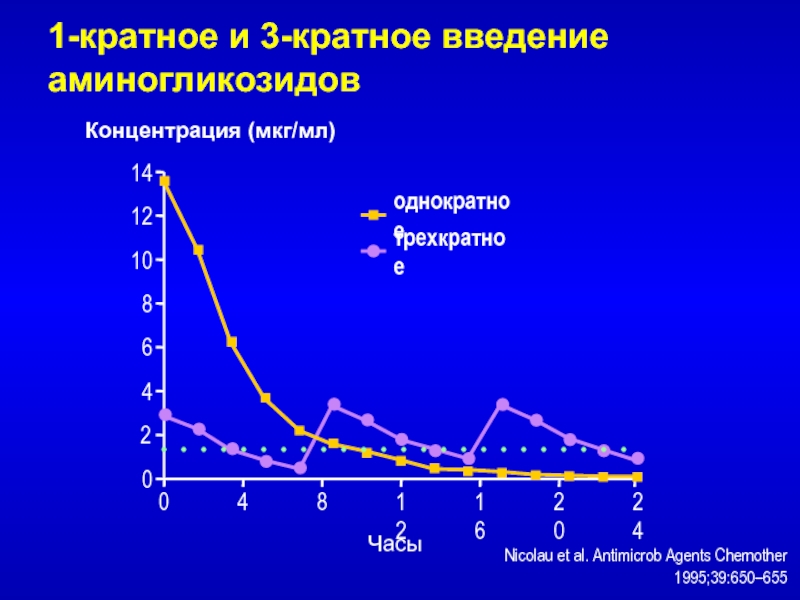
Слайд 78однократное
трехкратное
Nicolau et al. Antimicrob Agents Chemother 1995;39:650–655
1-кратное и 3-кратное введение
аминогликозидов
0
8
14
4
6
10
12
0
12
24
20
4
8
16
2
Концентрация (мкг/мл)
Часы
Слайд 79Современное значение аминогликозидов в стационаре
Высокий уровень устойчивости Грам(-) возбудителей и
низкая тканевая пенетрация лимитируют применение аминогликозидов в монотерапии (кроме инфекций
мочевыводящих путей)Данные клинических исследований и мета-анализов не подтверждают клинический синергизм между АГ и бета-лактамами/фторхинолонами
Комбинация амикацина и бета-лактамов тормозит формирование устойчивости Pseudomonas aeruginosa
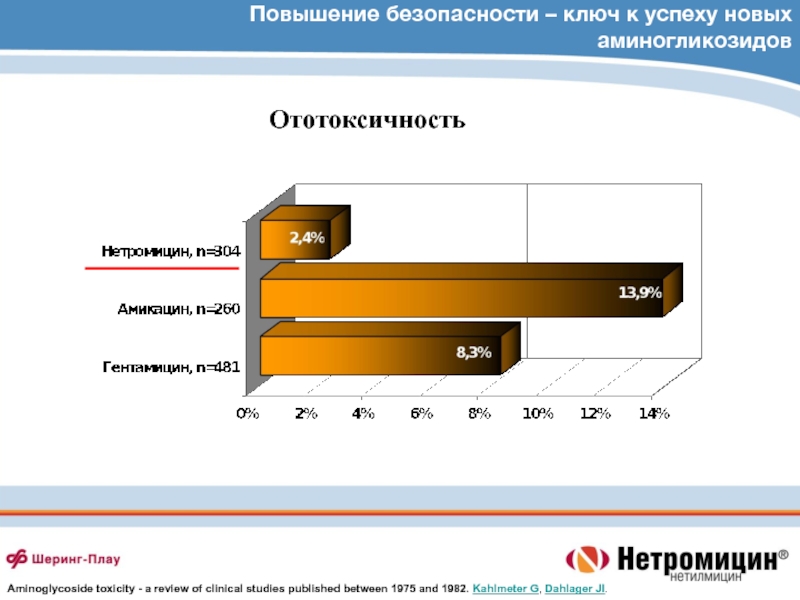
Слайд 80Повышение безопасности – ключ к успеху новых аминогликозидов
Ототоксичность
Aminoglycoside toxicity -
a review of clinical studies published between 1975 and 1982.
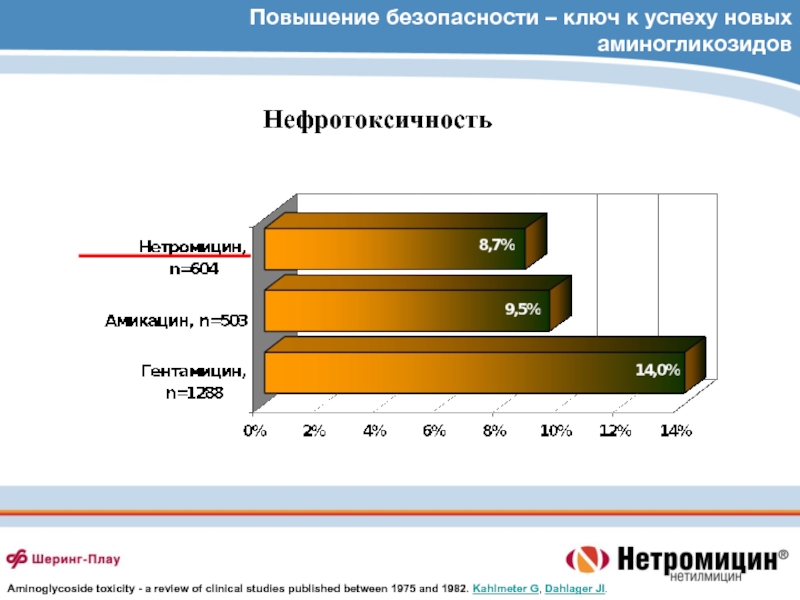
Kahlmeter G, Dahlager JI.Слайд 81Повышение безопасности – ключ к успеху новых аминогликозидов
Нефротоксичность
Aminoglycoside toxicity -
a review of clinical studies published between 1975 and 1982.
Kahlmeter G, Dahlager JI.Слайд 82Фторхинолоны
Ранние: ципрофлоксацин Преим. Грам(-)
офлоксацин Ципро > Офло=Пефло
пефлоксацин
Новые: левофлоксацин Более высокая против
моксифлоксацин Грам(+)
гемифлоксацин
Клиническое применение
Ранние госпитальные инфекции, осложненные обострения ХОБЛ
инфекции МВП
- устойчивость E.coli 10-15%
кишечные инфекции
Слайд 83Место новых фторхинолонов в стационаре
Левофлоксацин, моксифлоксацинн
Более выраженная активность против пневмококков/стрептококков,
стафилококков, энтерококков
Мокси >Лево
Резистентность Грам(+) минимальная
Более высокая эффективность по сравнению
с ранними ФХ при инфекциях внебольничного происхожденияОдни из наиболее эффективных средств
Тяжелая внебольничная пневмония
Препараты выбора при потребности ИВЛ
Осложненные инфекции кожи и мягких тканей
Внебольничный перитонит
Неполная перекрестная резистентность Грам(-) возбудителей к ранним и новым фторхинолонам
Значение при госпитальных инфекциях дискутабельно
Слайд 84Левофлоксацин vs моксифлоксацин
Моксифлоксацин – выше активность против Streptococcus pneumoniae
Мокси -
клинически эффективнее, чем лево - при инфекции Str.pneumoniae с высоким
уровнем МПКМокси - может быть эффективен при неуспехе терапии левофлоксацином
Слайд 85Авелокс (моксифлоксацин)
Возможности использования в стационаре в современных условиях:
Внебольничные инфекции
Тяжелая внебольничная пневмония
Внебольничный перитонит
Диабетическая стопа
Инфекционный эндокардит
Госпитальные инфекции
Ранний послеоперационный
перитонитГоспитальная пневмония в отделениях
Ранняя ВАП
Медиастенит
Слайд 86Гликопептиды
Ванкомицин
Природная активность – Грамположительные бактерии
Стафилококки, включая MRSA
Энтерококки, включая резистентные
к пенициллинам
Резистентность
Энтерококки – VRE
В ОРИТ США 20-30%
В Европе 2-5%
В России
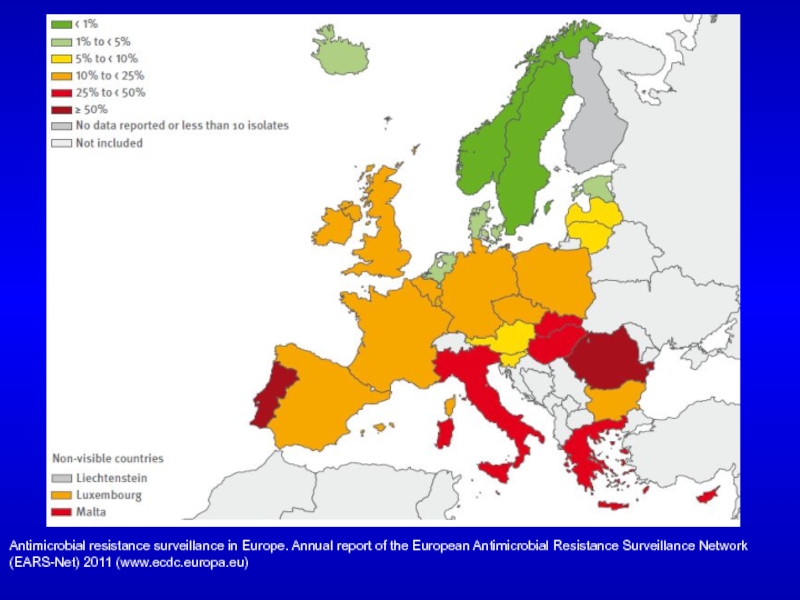
– данные отсутствуютСлайд 89Доля MRSA штаммов в Европе, 2011
Antimicrobial resistance surveillance in Europe.
Annual report of the European Antimicrobial Resistance Surveillance Network (EARS-Net)
2011 (www.ecdc.europa.eu)Слайд 90Проблема MRSA в России
Доля MRSA штаммов среди S.aureus в
последние годы постоянно увеличивается и в среднем составляет 65% (от
5 до 90%).Инфекции, вызванные MRSA, имеют большое медицинское и социальное значение, так как сопровождаются более высокой летальностью и требуют больших материальных затрат на лечение.
MRSA помимо бета-лактамов, часто характеризуются устойчивостью к другим классам антибактериальных препаратов, в частности к аминогликозидам, макролидам, линкозамидам, фторхинолонам.
Хирургические инфекции кожи и мягких тканей. Российские национальные рекомендации. Под редакцией академика РАН и РАМН В.С. Савельева. Российское общество хирургов. Российская ассоциация специалистов по хирургическим инфекциям. Альянс клинических химиотерапевтов и микробиологов. Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии. Ассоциация флебологов России. 2009г.-89с
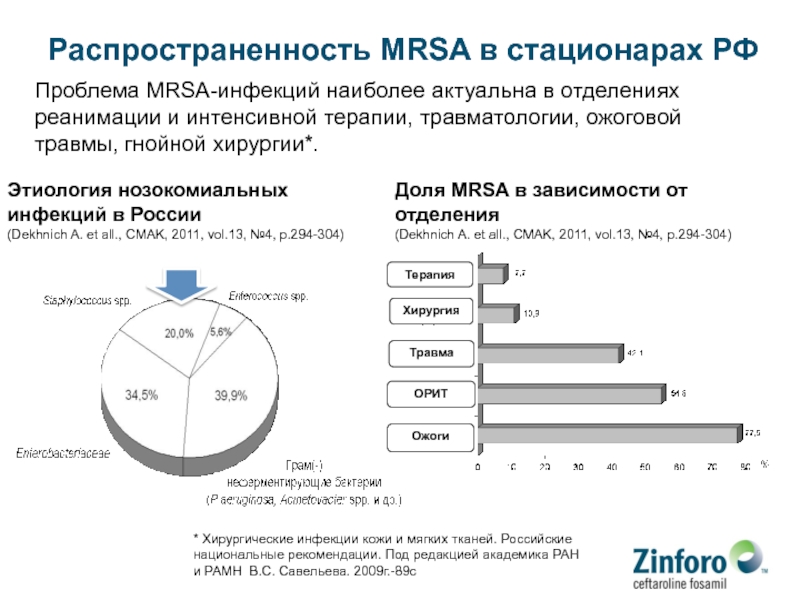
Слайд 91Распространенность MRSA в стационарах РФ
Проблема MRSA-инфекций наиболее актуальна в
отделениях реанимации и интенсивной терапии, травматологии, ожоговой травмы, гнойной хирургии*.
Доля
MRSA в зависимости от отделения (Dekhnich A. et all., CMAK, 2011, vol.13, №4, p.294-304)
Этиология нозокомиальных инфекций в России
(Dekhnich A. et all., CMAK, 2011, vol.13, №4, p.294-304)
* Хирургические инфекции кожи и мягких тканей. Российские национальные рекомендации. Под редакцией академика РАН и РАМН В.С. Савельева. 2009г.-89с
Слайд 92Ванкомицин
Показания к применению
MRSA инфекции
Энтерококковые инфекции (Амп, Пен – R)
Режим дозирования:
в/в
(60-90 мин инфузия) по 1 г каждые 12 часов
«Проблемные» для
ванкомицина локализации инфекцийДыхательные пути, клапаны сердца, ЦНС
Снижение чувствительности MRSA (VISA)
15 – 20 мг/кг х 2 р/сут
Слайд 93Ванкомицин
«Проблемные» для ванкомицина локализации инфекций
– Дыхательные пути, клапаны
сердца, ЦНС
Концентрации ванкомицина в % от сывороточных:
- легкие 11 –
17%- ликвор 0 – 18%
- мышцы, кости 7 – 13%
Слайд 94Ванкомицин
При использовании в теч. 14 дней появляются штаммы со сниженной
чувствительностью клинической эффективности в виде замедления улучшения
или рецидива симптоматики– при сохранении симптоматики изменить режим дозирования: 500мг каждые 6 ч
Слайд 95Условия безопасного применения ванкомицина
Использовать хроматографически очищенные препараты
–
эдицин, ванкомабол, ванкомицин-Тева
Медленная в/в инфузия (не менее 1 часа)
Коррекция гиповолемии,
СННе комбинировать с ото- и нефротоксичными ЛС
Коррекция режима дозирования по клиренсу креатинина
Слайд 96Оксазолидиноны
Первый представитель класса – линезолид (зивокс)
Антимикробная активность - Грам(+), вкл.
MRSA
Сохраняет активность в отношении ванкомицин-резистентных энтерококков (VRE) и стафилококков со
сниженной чувствительность к ванкомицину (VISA)Резистентных к линезолиду штаммов в РФ не выявлено
Возможность парентерального и перорального применения
Режим дозирования: 600 мг с интервалом 12 часов
Слайд 97Линезолид (Зивокс)
Препарат выбора при НПивл, вызванной MRSA
Превосходит ванкомицин по
клинической эффективности в 3 раза
Летальность на фоне линезолида в 2,2
раза ниже по сравнению с ванкомицином [M.Kollef e.a. ICM 2004;30:388-94]
Препарат выбора при MRSA инфекциях кожи и мягких тканей
Клиническая эффективность выше ванкомицина на 10%
Эрадикация MRSA на 22% выше ванкомицина (Р<0.0001)
[Weigelt e.a., 2003]
Слайд 98Линезолид (Зивокс)
Другие клинические ситуации, при которых назначение линезолида целесообразно:
Инфекционный эндокардит
Всегда
сохраняется чувствительность к линезолиду
Бактериемия или тяжелый сепсис, вызванный Enterococcus faecium
Возможен
клинический неуспех ванкомицина в случае резистентных штаммовПредшествующего применения ванкомицина
Риск селекции ванкомицин-резистентных штаммов
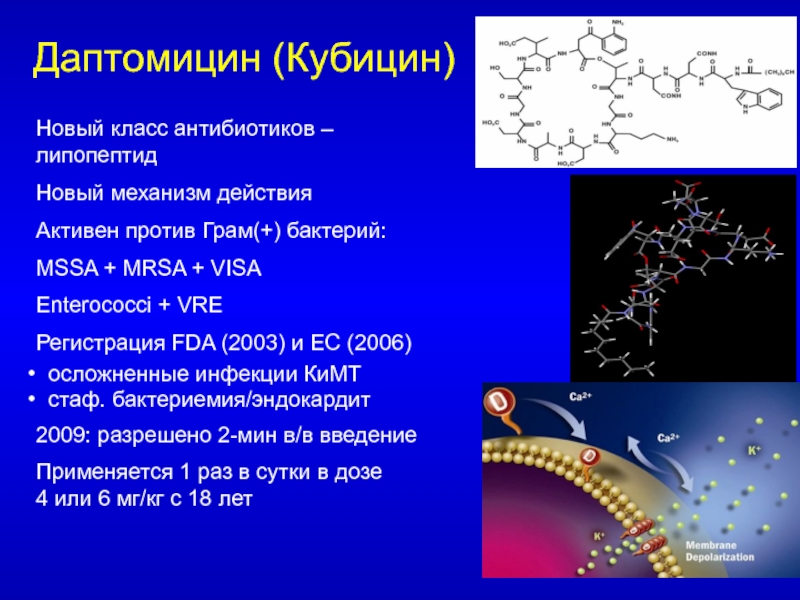
Слайд 100Даптомицин (Кубицин)
Новый класс антибиотиков – липопептид
Новый механизм действия
Активен против Грам(+)
бактерий:
MSSA + MRSA + VISA
Enterococci + VRE
Регистрация FDA (2003) и
ЕС (2006)осложненные инфекции КиМТ
стаф. бактериемия/эндокардит
2009: разрешено 2-мин в/в введение
Применяется 1 раз в сутки в дозе 4 или 6 мг/кг с 18 лет
Слайд 101 Антимикробные свойства даптомицина (Кубицина)
Быстрое бактерицидное действие
В течение 1 часа
Дозозависимое
Сохраняется
в стационарной фазе роста бактерий
Не сопровождается лизисом бактериальной клетки
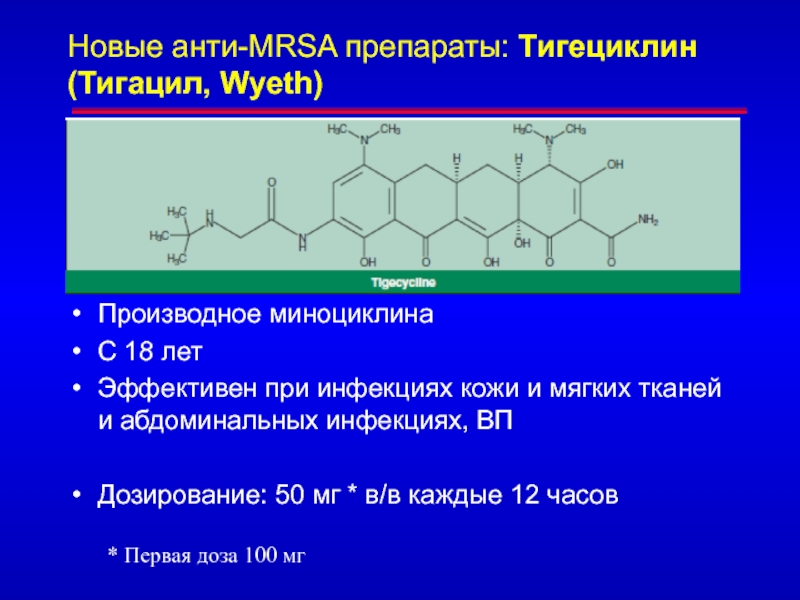
Слайд 102Новые анти-MRSA препараты: Тигециклин (Тигацил, Wyeth)
Производное миноциклина
С 18 лет
Эффективен при
инфекциях кожи и мягких тканей и абдоминальных инфекциях, ВП
Дозирование: 50
мг * в/в каждые 12 часов* Первая доза 100 мг
Слайд 103Тигециклин: первый анти-MRSA антибиотик с широким спектром: возможность монотерапии?
Анти-MRSA активность
+
Грам(+) Грам(-)
VRE Enterobacteriaceae: ESBL, KPC
PRSP Acinetobacter baumanii
Stenothrophomonas maltophilia
Анаэробы
Слайд 104Отличительные свойства тицециклина
Широкий спектр: Грам(+), Грам(-), анаэробы
Возможность эмпирической монотерапии
Активность против
резистентных возбудителей:
MRSA, БЛРС, Acinetobacter, Stenotrophomonas
Возможность эмпирической терапии нозокомиальных инфекций
Природная устойчивость
P.aeruginosaОграничение для ОРИТ?
Хорошая тканевая и в/клеточная ФК: Тк/Сыв = 5-10; Нейтрофилы >20-30; АМ > 80.
Низкие концентрации в крови
Бактериемия?
Проявляет активность против микробов в биопленках
Слайд 105ЗинфороTM – цефалоспорин с расширенной Грам+ активностью
Цефтаролин – антибиотик класса
цефалоспоринов с in vitro активностью в отношении Грам-положительных и Грам-отрицательных
микроорганизмов. Бактерицидное действие цефтаролина приводит к ингибированию биосинтеза клеточной стенки бактерий, за счет связывания с пенициллинсвязывающими белками (ПСБ).С 18 лет
Цефтаролин проявляет бактерицидную активность в отношении Staphylococcus aureus (включая MRSA) за счет высокой аффинности к ПСБ2a и в отношении Streptococcus pneumoniae (включая PNSP*) из-за высокого сродства к ПСБ2x**.
Moisan H, Pruneau M, Malouin F. Binding of ceftaroline to penicillin-binding proteins of Staphylococcus aureus and Streptococcus pneumoniae. J Antimicrob Chemother. 2010;65:713-716.
* PNSP – пенициллин нечувствительный S. pneumoniae (резистентный + промежуточный)
** ПСБ – пенициллинсвязывающие белки
Инструкция по медицинскому применению препарата Зинфоро™. Регистрационное удостоверение ЛП-001912.
Слайд 106Фосфомицин натрия (Урофосфабол)
Бактерицидный АБ
Медленное развитие резистентности
Широкий спектр, вкл. синегнойную палочку
Хорошее
проникновение в ткани, биопленки
Синергизм, кроме ципрофлоксацина и цефтазидима в отношении
P.aeruginosaАнтагонизм с рифампицином
Синергизм для MRSA и MRSE с оксациллином, ЦС, имипенемом, ванкомицином
Синергизм в отношении энтерококков с ампициллином
Слайд 107Фосфомицин натрия (УРОФОСФАБОЛ)
Активен против БЛРС-продуцентов, ФХ-резистентных уропатогенов, Ps.aeruginosa (в комбинации
с бета-лактамами, в/в)
Суточная доза 3 – 6 г/сут, при
синегнойной инфекции до 12 г/сутСлайд 108Урофосфабол, показания
Инфекции любой локализации, вкл.
Сепсис
MRSA-инфекции (+ ванкомицин)
Инфекционный эндокардит
Бактериальный менингит
Нейтропения
Полирезистентные штаммы
синегнойной палочки
Слайд 109Урофосфабол, неантибактериальные свойства
Способность проникать в биопленки
Стимуляция фагоцитоза
Иммуномодулирующий эффект
Предупреждение ото- и
нефротоксичности (АГ, ванкомицин, амфотерицин В)
Слайд 110Метронидазол
Спектр активности – только анаэробы
Не применять вместе с
ингибиторзащищенными АМП (амоксиклав, трифамокс, сульперазон, тиментин, тазоцин)
анаэроцефом карбапенемами
моксифлоксацином (авелокс) ???
Слайд 111Проблема резистентности анаэробов
Карбапенемы 1 – 2%
Амоксиклав 3
– 7%
Цефокситин (Анаэроцеф) 6%
Метронидазол 5 – 10%
Клиндамицин 10 –
30% (в РФ 25%)Моксифлоксацин > 10% (госпитальные инфекции – 25%)