Слайд 1Сутектік көрсеткіш ph. Тұздар гидролизі
Орындаған: Байбатыр.Г
Тексерген: Қанағат.Б
Слайд 2
Сутектік көрсеткіш дегеніміз теріс таңбамен алынған сутегі иондарының концентрациясының
ондық логарифмін айтады.
pH = - lg [ H+]
Сутектік көрсеткіш түсінігін 1909 жылы дат химигі Серенсен енгізді.
рН арқылы ерітінділердің реакциясы былай сипатталады:
Нейрал орта рН = 7
Қышқыл орта рН < 7
Сілтілі орта рН > 7
Слайд 3Ерітіндінің рН білу химиялық зерттеу жұмыстарында да,әр түрлі өндірістік процестерде
де,тірі органимдерде де жүретін құбылыстарды түсіндіруде өте керек.Көпшілік жағдайда рН
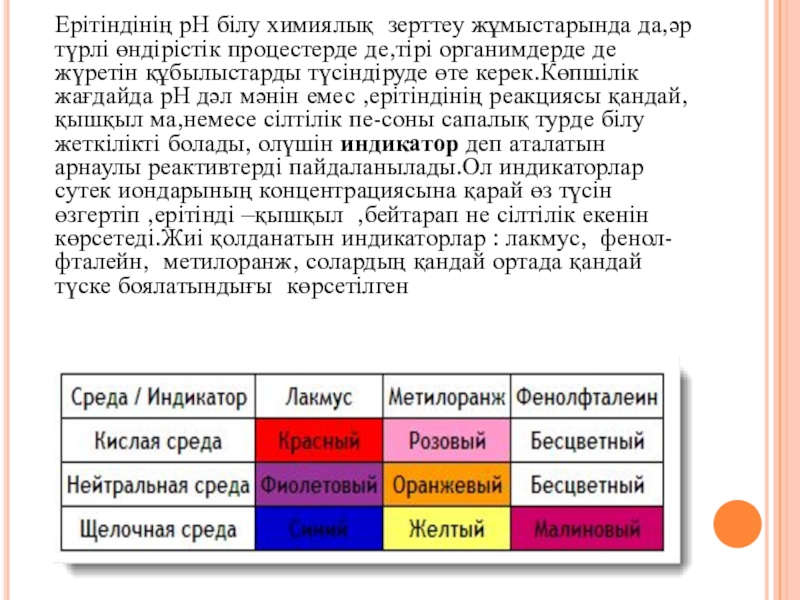
дәл мәнін емес ,ерітіндінің реакциясы қандай,қышқыл ма,немесе сілтілік пе-соны сапалық турде білу жеткілікті болады, олүшін индикатор деп аталатын арнаулы реактивтерді пайдаланылады.Ол индикаторлар сутек иондарының концентрациясына қарай өз түсін өзгертіп ,ерітінді –қышқыл ,бейтарап не сілтілік екенін көрсетеді.Жиі қолданатын индикаторлар : лакмус, фенол-фталейн, метилоранж, солардың қандай ортада қандай түске боялатындығы көрсетілген
Слайд 4 Кейбір ерітінділердің рН мәндері:
Асқазан шырыны рН=1,7 (күшті қышқылдық реакция)
Шымтезек суы рН =4 (әлсіз қышқылдық реакция)
Жаңбыр суы рН=6 (әлсіз қышқылдық реакция)
Құбыр суы рН=7,5 (әлсіз сілтілік реакция)
Қан рН=7,4 (әлсіз сілтілік)
Сілекей рН=6,9 (әлсіз қышқылдық)
Көз жасы рН =7 (бейтарап реакция)
Слайд 5Тұздар гидролизі
Тұздар гидролизі – тұз иондарының сумен әрекеттесу нәтижесінде тұз
ыдырап, әлсіз электролиттің (әлсіз қышқылдің не әлсіз негіздің) түзілу реакциясы
Сандық жағынан гидролизді гидролиздену дәрежесі (h) арқылы өрнектейді
h=гидролизденген молекулар саны
Температураны арттырып және ерітінді сұйылту арқылы гидролиздену дәрежесін өсіруге болады.
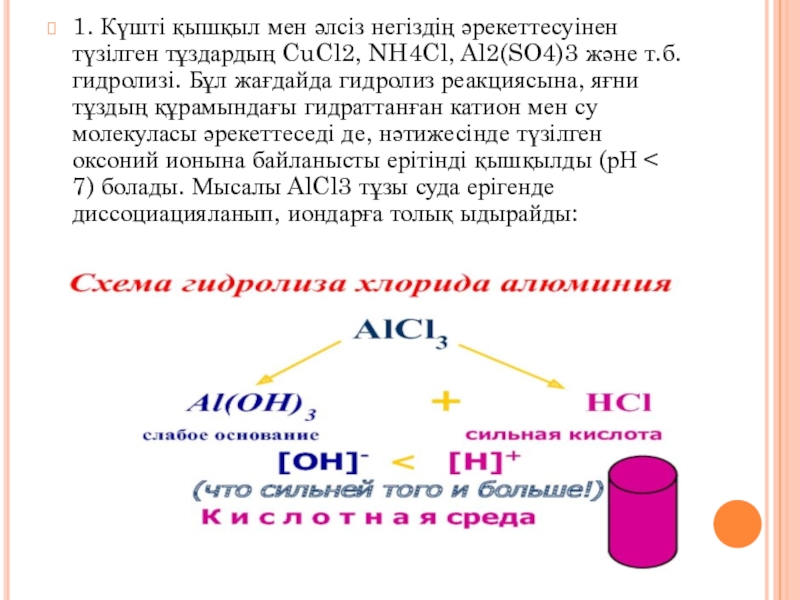
Слайд 61. Күшті қышқыл мен әлсіз негіздің әрекеттесуінен түзілген тұздардың CuCl2,
NH4Cl, Al2(SO4)3 және т.б. гидролизі. Бұл жағдайда гидролиз реакциясына, яғни
тұздың құрамындағы гидраттанған катион мен су молекуласы әрекеттеседі де, нәтижесінде түзілген оксоний ионына байланысты ерітінді қышқылды (рН < 7) болады. Мысалы AlCl3 тұзы суда ерігенде диссоциацияланып, иондарға толық ыдырайды:
Слайд 73. Әлсіз негіз бен әлсіз қышқылдан түзілген тұздар да гидролизге
ұшырайды. Бұл жағдайда гидролиздену процесі соңына дейін жүріп, қышқыл мен
негіз түзіледі. Мысалы, алюминий сульфиді Al2S3 сумен әрекеттескенде алюминий гидроксиді Al(OH)3 мен күкіртсутек H2S түзіліп, гидролиздену реакциясы қайтымсыз болады
Слайд 82. Әлсіз қышқыл мен күшті негіздердің әрекеттесуінен түзілген тұздардың CH3COONa,
Na2CO3, KCN, Na2SO3, KNO2 және т.б. гидролизі. Бұл жағдайда гидролиз
реакциясына тұздың құрамындағы әлсіз қышқылдың қалдығы болып саналатын гидраттанған анион түседі де, нәтижесінде ерітінді сілтілі (рН > 7) болады.
Слайд 9ГИДРОЛИЗГЕ ӘСЕР ЕТЕТІН ФАКТОРЛАР
Гидролиз – қайтымды процесс. Сондықтан әртүрлі
себептердің әсері Ле-Шателье принципі негізінде түсіндірілуі мүмкін:
1. температураның жоғарылауы
гидролизді ң тез жүруін (жылдамдығын) көтереді, себебі ол эндотермиялық процесс
2. сумен сұйылту (судың сіңірілуімен байланысқан) гидролиздің күшеюіне ықпал етеді
Слайд 10Гидролиздің фармация мен медицинадағы маңызы. Гидролиз адам организміндегі өтетін көптеген
процестер үшін маңызы үлкен. Мысалы, қанның құрамына енетін кейбір тұздардың,
биологиялық рөлі, Н+ тұрақты концентрациясын ұстап тұрады. Егер ерітіндіден Н+ артық пайда болса, онда ол сәттеақ ОН-иондарымен байланысады да тепе-теңдік оңға ығысады. Егер қанның құрамында ОН- иондары артық болса, онда реакция солға қарай ығысады, осыған, сол сияқты ақуыздық заттардың аралымдық-буферлік әрекетінің әсерінен, дені сау адамның қанындағы рН айтарлықтай өзгерісте бола бермейді және ол 7, 4 шамасында болады, бұл қалыпты тіршілік үшін адам өміріндегі маңызды шарттың бірі. Гидролиз буферлік аралымдық ерітінділердегі процестердің негізін құрайды.