Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Скорость химической реакции
Содержание
- 1. Скорость химической реакции
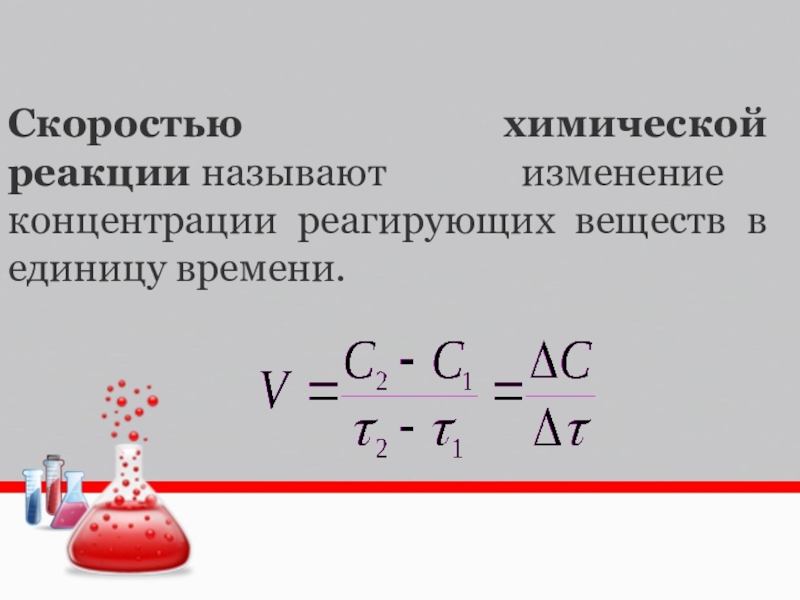
- 2. Скоростью химической реакции называют изменение концентрации реагирующих веществ в единицу времени.
- 3. Скорость реакции зависит от:- Природы взаимодействующих веществ-
- 4. 1) Природа реагентовСамые быстрые реакции – гомогенные,
- 5. Также влияет на скорость реакции активность элемента
- 6. 2) ТемператураПри увеличении температуры молекулы начинают двигаться
- 7. Зависимость скорости реакции от температуры определяется уравнением
- 8. 3) Концентрация реагентовЧем выше концентрации реагирующих веществ,
- 9. aA + bB = cC + dD
- 10. Влияние давления на скорость реакции. Жидкости и
- 11. 4) Катализаторы и ингибиторыКатализатор – вещество, увеличивающее
- 12. 5) Площадь границы раздела фазЧем сильнее измельчено
- 13. Скачать презентанцию
Скоростью химической реакции называют изменение концентрации реагирующих веществ в единицу времени.
Слайды и текст этой презентации
Слайд 2Скоростью химической реакции называют изменение концентрации реагирующих веществ в единицу времени.
Слайд 3Скорость реакции зависит от:
- Природы взаимодействующих веществ
- Температуры
- Концентрации реагирующих
веществ
соприкосновения реагентов (для гетерогенных процессов).Слайд 41) Природа реагентов
Самые быстрые реакции – гомогенные, протекающие в одной
фазе (газы или смешивающиеся жидкости). В них взаимодействие происходит во
всем объеме смеси реагентов.Гетерогенные реакции – взаимодействие не смешивающихся друг с другом веществ – протекают на границе раздела фаз. Эти процессы медленнее, и скорость определяется площадью поверхности соприкосновения.
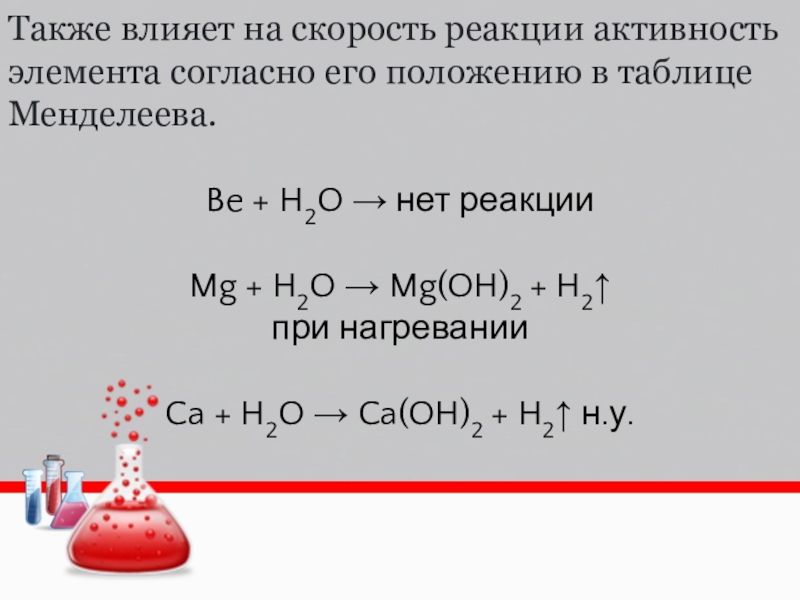
Слайд 5Также влияет на скорость реакции активность элемента согласно его положению
в таблице Менделеева.
Be + H2O → нет реакции
Mg + H2O
→ Mg(OH)2 + H2↑ при нагревании
Ca + H2O → Ca(OH)2 + H2↑ н.у.
Слайд 62) Температура
При увеличении температуры молекулы начинают двигаться быстрее, следовательно, чаще
сталкиваются друг с другом.
Таким образом, скорость реакции всегда возрастает при
повышении температуры и уменьшается – при понижении. Слайд 7Зависимость скорости реакции от температуры определяется уравнением Вант-Гоффа:
где v2 и v1 –
скорости реакции при температурах
Т2 и Т1 соответственно, γ – температурный коэффициент,
принимающий значения от 2 до 4. Слайд 83) Концентрация реагентов
Чем выше концентрации реагирующих веществ, тем чаще их
молекулы будут сталкиваться друг с другом, следовательно, тем быстрее будет протекать
взаимодействие.Зависимость скорости от концентрации реагентов выражается законом действующих масс.
Слайд 9aA + bB = cC + dD
Важно!!! скорость реакции зависит
от концентраций реагентов и не зависит от концентраций продуктов!
Слайд 10Влияние давления на скорость реакции.
Жидкости и твердые тела практически
несжимаемы и давление не влияет на их концентрации.
!!!!!Для газов увеличение
давления вызывает возрастание концентрации, следовательно, ускоряет реакцию.Слайд 114) Катализаторы и ингибиторы
Катализатор – вещество, увеличивающее скорость реакции, но
не расходующееся в ней.
Ингибитор – это «катализатор наоборот», он
замедляет реакцию.Слайд 125) Площадь границы раздела фаз
Чем сильнее измельчено твердое вещество, тем
выше скорость реакции.
Количество твердого вещества на скорость влияет намного слабее,
чем степень его измельченности и концентрация жидких или газообразных реагентов.!!!Перемешивание ускоряет гетерогенные реакции, так как увеличивается площадь соприкосновения реагентов.