Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Скорость химической реакции
Содержание
- 1. Скорость химической реакции
- 2. Задачи исследования:
- 3. Слайд 3
- 4. Идут во всём объёме2СО(г)+ О2(г)= 2СО2(г)2HBr(г)↔H2(г) +
- 5. Средняя скорость гомогенной
- 6. Средняя скорость гетерогенной реакции- определяется изменением количества
- 7. Факторы, влияющие на скорость химической реакцииПрирода реагирующих
- 8. Природа реагирующих веществРеакционная активность веществ определяется:характером химических
- 9. Якоб Вант-Гофф (1852-1911)Температура повышает количество столкновений
- 10. КонцентрацияДля взаимодействия веществ их молекулы должны столкнуться.
- 11. Площадь соприкосновенияСкорость гетерогенной реакции прямо пропорциональна площади
- 12. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2 Задачи исследования: 1. Дать определение понятию скорости
химической реакции.
2. Экспериментально выявить факторы, влияющие на скорость химической реакции.
Слайд 4Идут во всём объёме
2СО(г)+ О2(г)= 2СО2(г)
2HBr(г)↔H2(г) + Br2(г)
NaOH(р)+HCl(р)=NaCl(р)+H2O(ж)
F(тв) + S(тв)
= FeS(тв)
Идут на поверхности
раздела фаз
CaCO3(тв)↔CaO(тв) + CO2(г)
CO2(г)+С(тв) = 2СО(г)
4H2O(ж)+3Fe(тв)↔4H2(г)+Fe3O4(тв)
Классификация
реакций по фазовому составу
Слайд 5
Средняя скорость гомогенной реакции
Скорость гомогенной реакции определяется изменением концентрации одного
из веществ в единицу времени
Слайд 6Средняя скорость гетерогенной реакции
- определяется изменением количества вещества, вступившего в
реакцию или образовавшегося в результате реакции за единицу времени на
единице поверхностиВзаимодействие происходит только на поверхности раздела между веществами
S – площадь поверхности
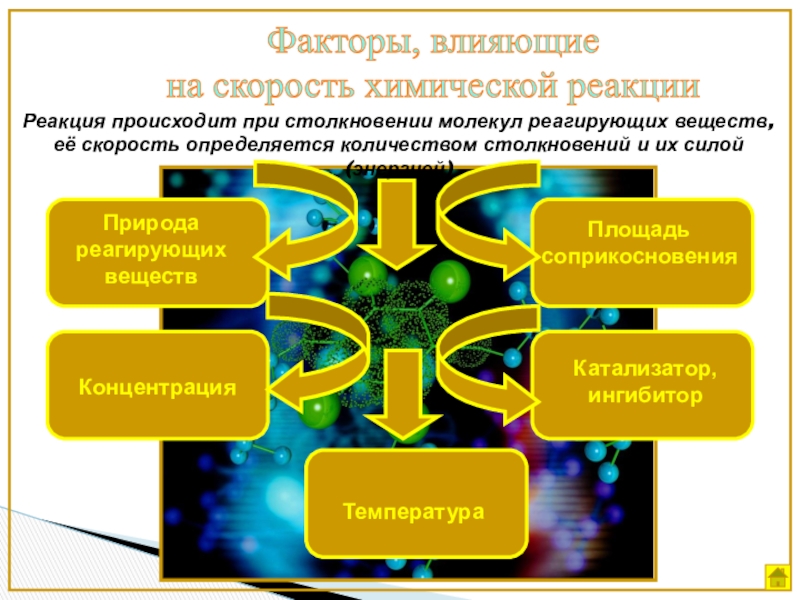
Слайд 7Факторы, влияющие
на скорость химической реакции
Природа реагирующих веществ
Концентрация
Температура
Катализатор, ингибитор
Площадь соприкосновения
Реакция
происходит при столкновении молекул реагирующих веществ, её скорость определяется количеством
столкновений и их силой (энергией)Слайд 8Природа реагирующих веществ
Реакционная активность веществ определяется:
характером химических связей
скорость больше
у веществ с ионной и ковалентной полярной связью (неорганические вещества)
скорость
меньше у веществ с ковалентной малополярной и неполярной связью (органические вещества)υ(Zn + HCl = H2 + ZnCl2) > υ(Zn + CH3COOH = H2 + Zn(CH3COO)2
их строением
скорость больше у металлов, которые легче отдают электроны (с большим радиусом атома)
скорость больше у неметаллов, которые легче принимают электроны (с меньшим радиусом атома)
υ(2K + 2H2O = H2 + 2KOH) > υ(2Na + 2H2O = H2 + 2NaOH)
Слайд 9Якоб Вант-Гофф
(1852-1911)
Температура повышает количество столкновений молекул.
Правило Вант-Гоффа
(сформулировано на основании экспериментального изучения реакций) В интервале температур от 0°С до 100°С при повышении температуры на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза:Правило Вант-Гоффа не имеет силу закона. Лабораторная техника была несовершенна, поэтому:
оказалось, что температурный коэффициент в значительном температурном интервале непостоянен
невозможно было изучать как очень быстрые реакции (протекающие за миллисекунды), так и очень медленные (для которых требуются тысячи лет)
реакции с участием больших молекул сложной формы (например, белков) не подчиняются правилу Вант-Гоффа
v = v0·∆τ/10
- температурный коэффициент Вант-Гоффа
Слайд 10Концентрация
Для взаимодействия веществ их молекулы должны столкнуться. Число столкновений пропорционально
числу частиц реагирующих веществ в единице объёма, т.е. их молярным
концентрациям.Закон действующих масс:
Скорость элементарной химической реакции пропорциональна произведению молярных концентраций реагирующих веществ, возведённых в степени равные их коэффициентам:
1867 г. К.Гульдберг и П.Вааге сформулировали закон действующих масс
Слайд 11Площадь соприкосновения
Скорость гетерогенной реакции прямо пропорциональна площади поверхности соприкосновения реагентов.
При измельчении и перемешивании увеличивается поверхность
соприкосновения реагирующих веществ, при этом
возрастает скорость реакции Скорость гетерогенной реакции зависит от:
а) скорости подвода реагентов к границе раздела фаз;
б) скорости реакции на поверхности раздела фаз, которая зависит от площади этой поверхности;
в) скорости отвода продуктов реакции от границы раздела фаз.