Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Соли и их свойства
Содержание
- 1. Соли и их свойства
- 2. Соли - это сложные вещества, состоящие из ионов металлов и кислотного остатка.
- 3. Слайд 3
- 4. Кислотный остаток образуется, если в формуле кислоты
- 5. Алгоритм (1) называния соли по формуле. 1.
- 6. Пример: Fe2(SO4)3 +3
- 7. Упражнение.Назвать: FeSO4
- 8. Алгоритм (2) построения формул солей по названию.1.
- 9. Пример: нитрат меди (II):
- 10. Упражнение. Составьте формулы: сульфит магния
- 11. Классификация солей
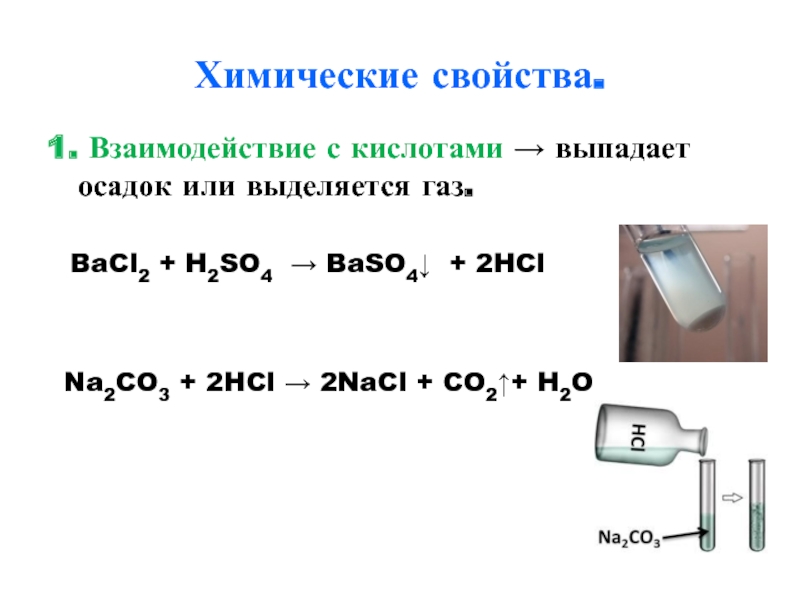
- 12. Химические свойства.1. Взаимодействие с кислотами → выпадает
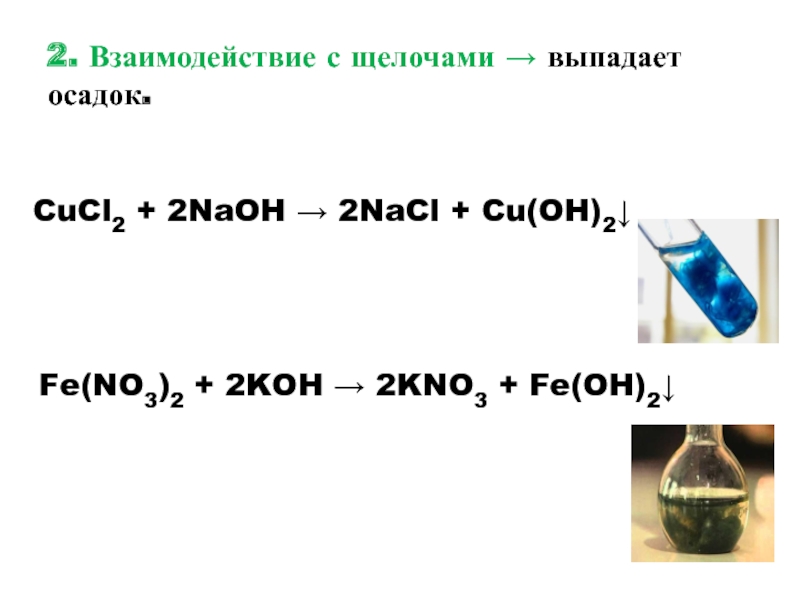
- 13. 2. Взаимодействие с щелочами → выпадает осадок.CuCl2
- 14. 3. Взаимодействие с солями - выпадает осадок.NaCl + AgNO3 NaNO3 + AgCl
- 15. Скачать презентанцию
Слайды и текст этой презентации
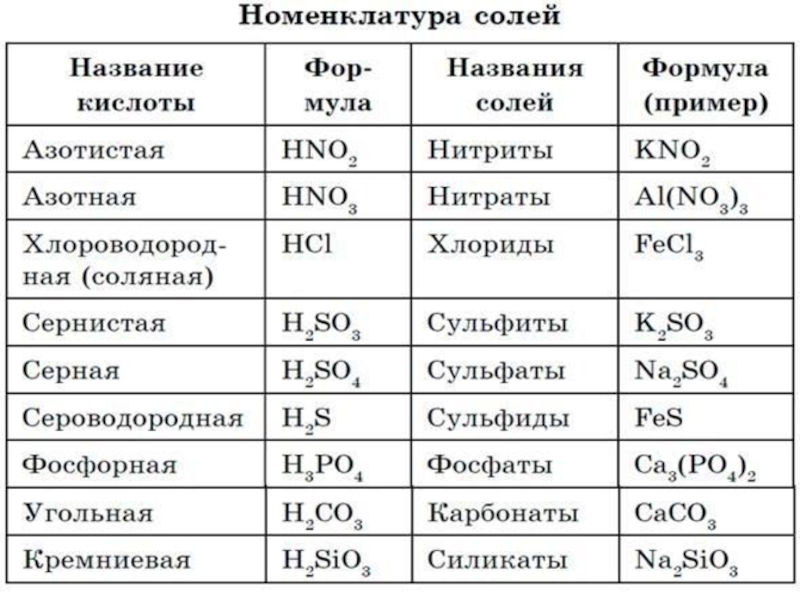
Слайд 4 Кислотный остаток образуется, если в формуле кислоты убрать атомы водорода.
Заряд кислотного остатка определяется числом атомов водорода в молекуле кислоты.
Слайд 5Алгоритм (1) называния соли по формуле.
1. Определить степени окисления металла
и кислотного остатка (по таблице растворимости, по формуле).
2. Определить по
кислотному остатку, какой кислоте соответствует соль, каково название соли.3. К названию соли добавить русское название металла в родительном падеже, указать в скобках римской цифрой степень окисления металла (если она не постоянна).
Слайд 6Пример: Fe2(SO4)3
+3 -2
1. Fe2(SO4)3
2. Сульфат - соль H2SO4 (серной кислоты)
3. Сульфат железа (III).
Слайд 8Алгоритм (2) построения формул солей по названию.
1. Слева записать металл,
указанный в названии, над ним - степень окисления (из названия,
из таблицы растворимости).2. По названию соли определить, какой кислоте она соответствует, кислотный остаток записать справа от металла, над ним написать степень окисления (из таблицы растворимости).
3. Снести степень окисления крест-накрест.
4. Если надо, индексы сократить.
! Если после кислотного остатка должен быть индекс, кислотный остаток берется в скобки.
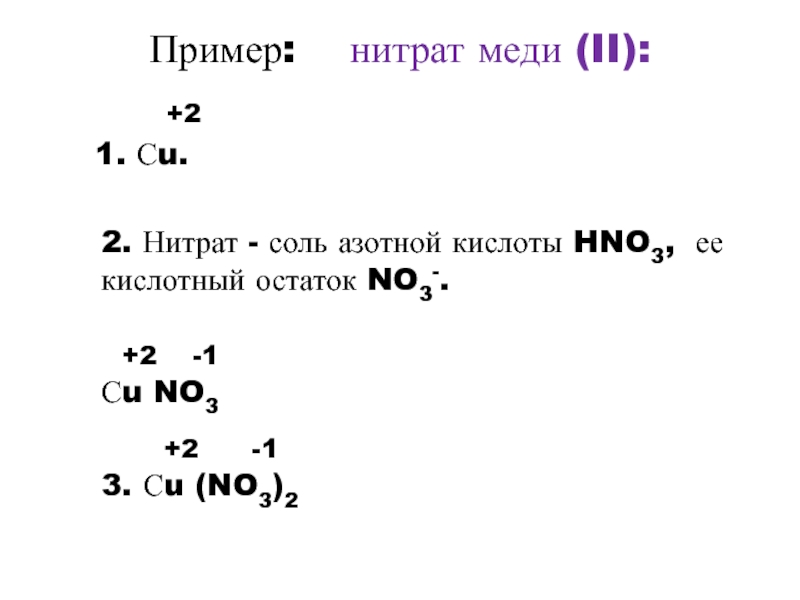
Слайд 9Пример: нитрат меди (II):
+2
1. Сu.
2.
Нитрат - соль азотной кислоты HNO3, ее кислотный остаток NO3-.
+2 -1Сu NO3
+2 -1
3. Сu (NO3)2
Слайд 10Упражнение.
Составьте формулы:
сульфит магния
бромид хрома (III)
ортофосфат бариясульфат алюминия.