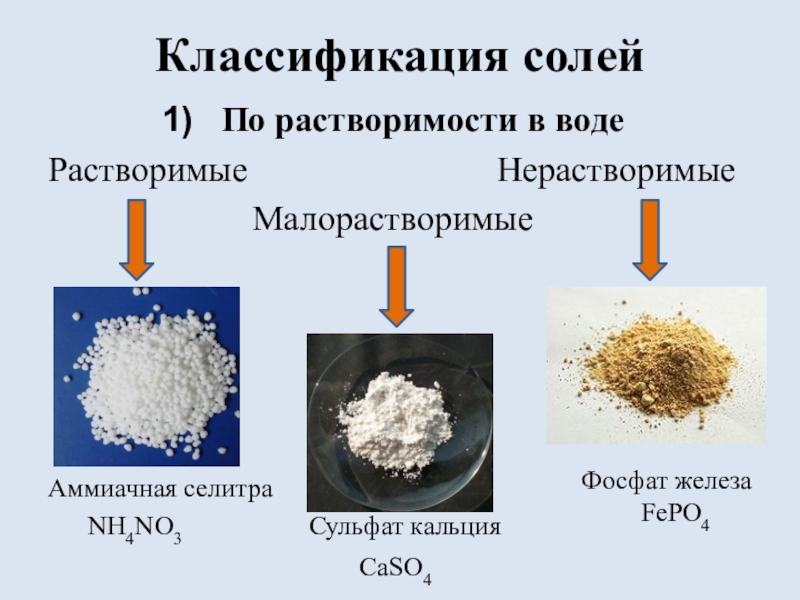
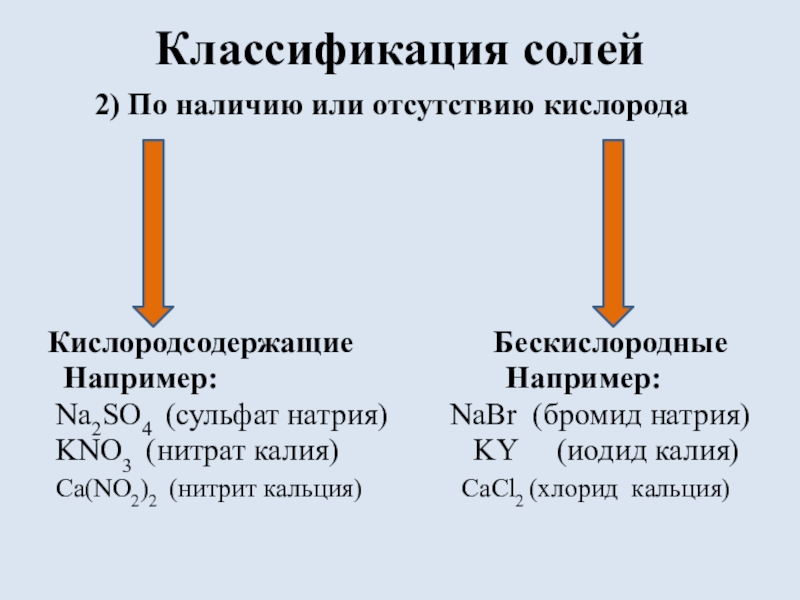
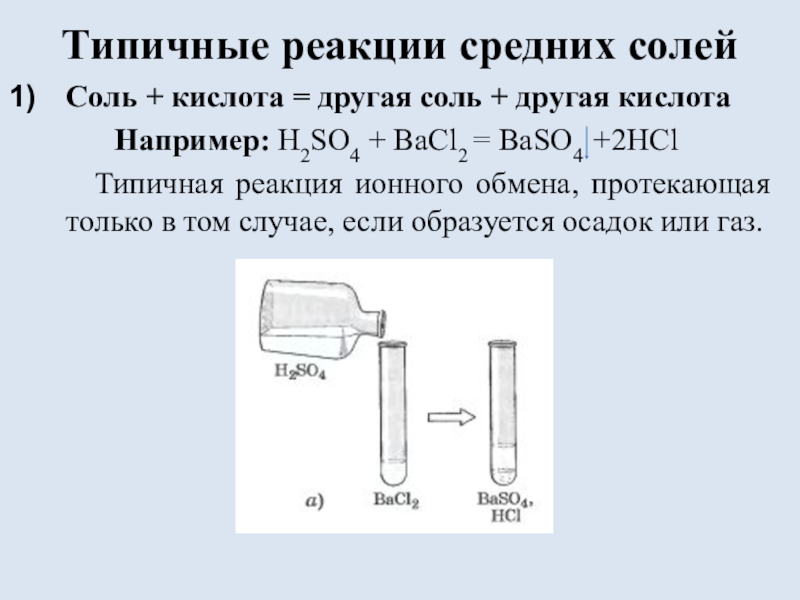
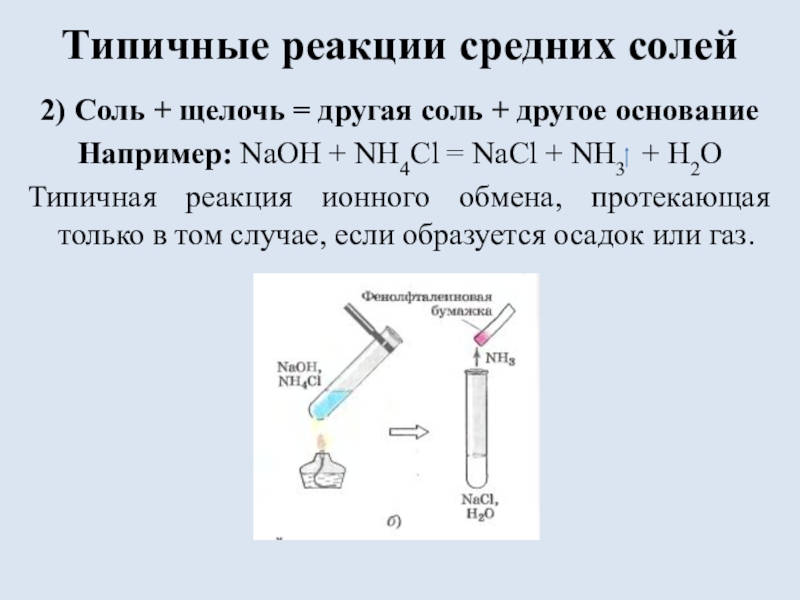
состоящих из ионов металла и ионов кислотного остатка.
(Например:
NaCl, NH4NO3, AgY)Солями называют электролиты, которые при диссоциации образуют катионы металла (или аммония NH4+) и анионы кислотных остатков.
(Например: K3PO4 = 3K+ + PO43- )