Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
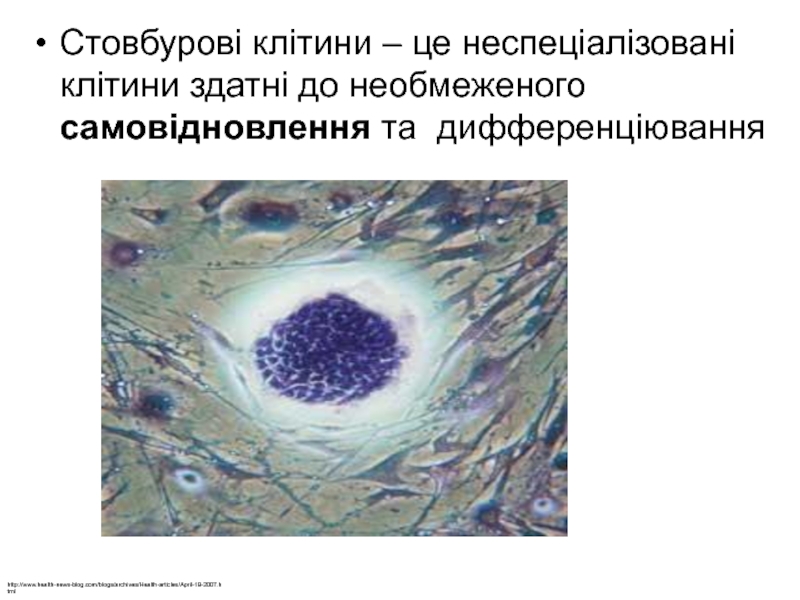
Стовбурові клітини – це неспеціалізовані клітини здатні до необмеженого
Содержание
- 1. Стовбурові клітини – це неспеціалізовані клітини здатні до необмеженого
- 2. Самовідновлення — здатність проходити величезну кількість
- 3. Існують дві досить широкі категорії стовбурових клітин
- 4. Класифікація стовбурових клітин людини
- 5. Ембріони, з яких виділяються людські ембріональні стовбурові
- 6. Отримання ембріональних стовбурових клітин Janet Rossant. Stem
- 7. Слайд 7
- 8. Стовбурові клітини з клітинами годувальникамиT.C. McDevitt and
- 9. Імунохірургія бластоцисти людиниSe-Pill Park, Young Jae Lee,
- 10. Потенціал стовбурових клітин— це можливість їхнього перетворення на диференційовані типи клітин.
- 11. Тотипотентна стовбурова клітина- унаслідок злиття
- 12. Плюрипотентні стовбурові клітини походять від тотипотентних
- 13. Мультипотентні стовбурові клітини можуть утворювати лише
- 14. Слайд 14
- 15. Реалізація програми розвитку детермінованої клітини
- 16. A — стовбурові клітини; B — клітина-попередник; C — дифференційована
- 17. Слайд 17
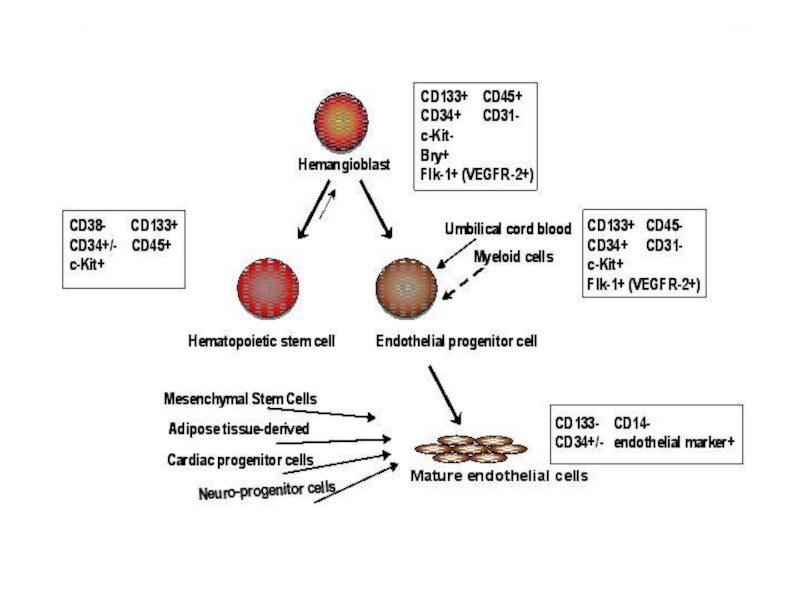
- 18. Постнатальні стовбурові клітини (Дорослі)Гемопоетичні СК: джерело
- 19. Маркери HSC
- 20. Слайд 20
- 21. Поверхневі маркери МСК людиниСпецифічні антигени: SH2,
- 22. Слайд 22
- 23. Приклад визначення фенотипу стовбурових клітин з використання
- 24. Мезенхімальні стовбурові клітини – плюрипотентні клітини, які
- 25. Мультипотентна диференціація мезенхімальних стовбурових клітинхондроцитиміоцитикардіоміоцитинейрониадипоцитиостеобласти
- 26. Слайд 26
- 27. У первинній культурі клітин, виділених з скелетної
- 28. У міокарді новонароджених щурів також виявлені
- 29. В первинних культурах кісткової тканини людини є кілька типів мультипотентних мезенхімальних клітин - попередників.
- 30. Культивування прогеніторних мезенхімальних клітин з використанням різних диференціюючих факторів.
- 31. Трансдиференціювання мезенхімальних стовбурових клітин кісткового мозку в
- 32. Мезенхімальні стовбурові клітини кісткового мозку піддаються індукованому
- 33. стовбурові клітини та канцерогенез:Пухлини виникають з певних
- 34. Ідентифікація пухлинних стовбурових клітин:late 1990 by Bonnet
- 35. Слайд 35
- 36. Ізоляція пухлинних стовбурових клітин:Метод:ALDEFLUOR assay. За активністю
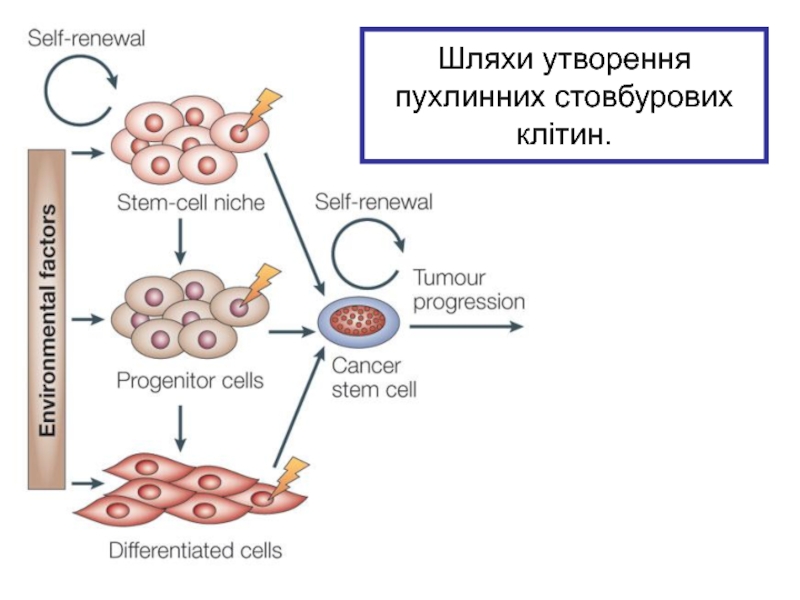
- 37. Шляхи утворення пухлинних стовбурових клітин.
- 38. Ніша клітин, як ключовий фактор канцерогенезу.
- 39. Слайд 39
- 40. Порівняння властивостей соматичних стовбурових клітин та пухлинних стовбурових клітин
- 41. запитанняІсторія відкриття стовбурових клітин.Ким вперше
- 42. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Стовбурові клітини – це неспеціалізовані клітини здатні до необмеженого самовідновлення
та дифференціювання
Слайд 2
Самовідновлення — здатність проходити величезну кількість клітинних циклів клітинного
поділу і залишатися недиференційованими.
Безмежні можливості — можливість диференціюватися у будь-який клітинний
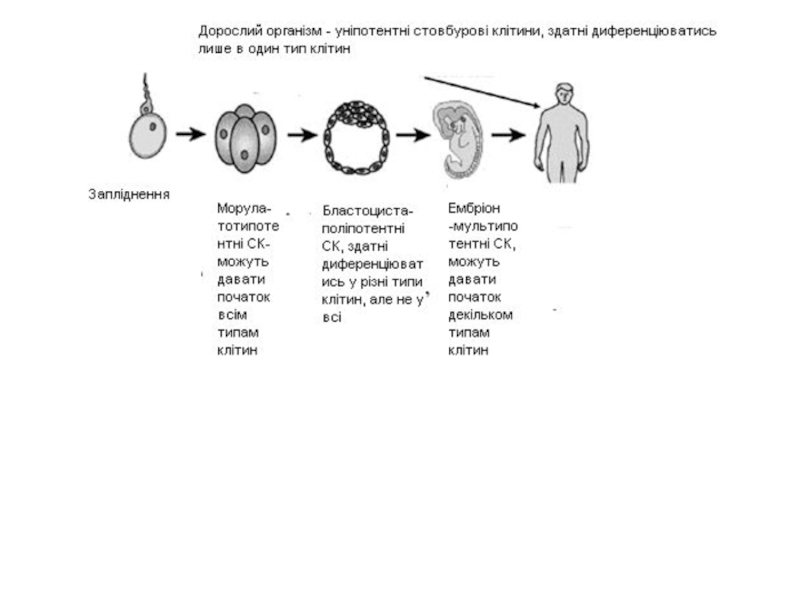
тип. Слайд 3Існують дві досить широкі категорії стовбурових клітин ссавців: ембріональні стовбурові
клітини, що походять безпосередньо від бластоцисти,
та стовбурові клітини дорослого
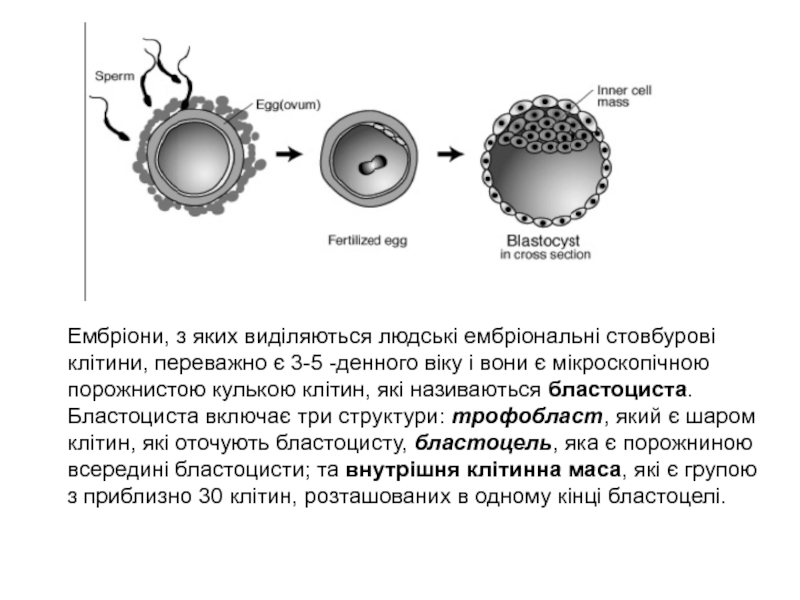
організму, що знаходяться у зрілих тканинах. Слайд 5Ембріони, з яких виділяються людські ембріональні стовбурові клітини, переважно є
3-5 -денного віку і вони є мікроскопічною порожнистою кулькою клітин,
які називаються бластоциста.Бластоциста включає три структури: трофобласт, який є шаром клітин, які оточують бластоцисту, бластоцель, яка є порожниною всередині бластоцисти; та внутрішня клітинна маса, які є групою з приблизно 30 клітин, розташованих в одному кінці бластоцелі.
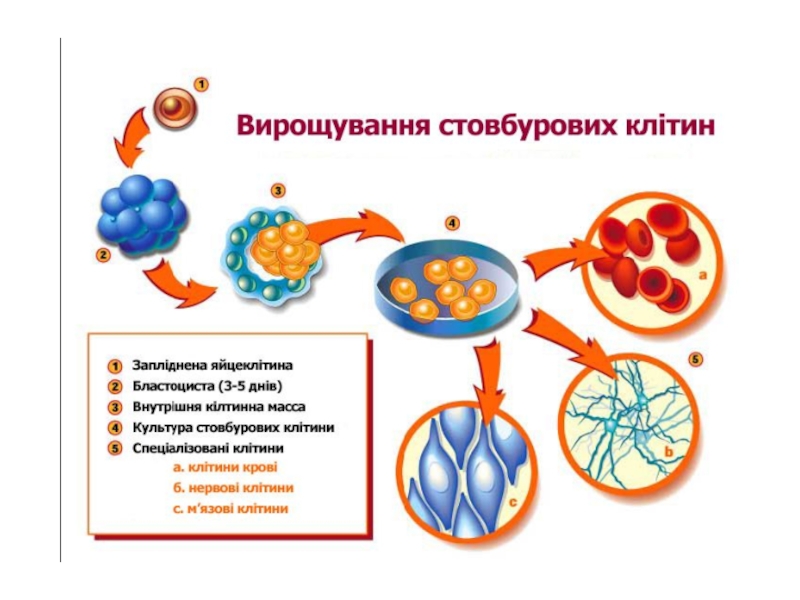
Слайд 6Отримання ембріональних стовбурових клітин
Janet Rossant. Stem Cells and Early
Lineage Development. Cell Volume 132, Issue 4, 22 February 2008,
Pages 527-531Слайд 8Стовбурові клітини з клітинами годувальниками
T.C. McDevitt and S.P. Palecek. Innovation
in the culture and derivation of pluripotent human stem cells.
Current Opinion in Biotechnology Volume 19, Issue 5, October 2008, pp. 527-533Se-Pill Park, Young Jae Lee, Keum Sil Lee, Hyun Ah Shin, Hwang Yoon Cho, Kil Saeng Chung, Eun Young Kim, and Jin Ho Lim. Establishment of human embryonic stem cell lines from frozen–thawed blastocysts using STO cell feeder layers. Human Reproduction, Vol. 19, No. 3, 676-684, March 2004
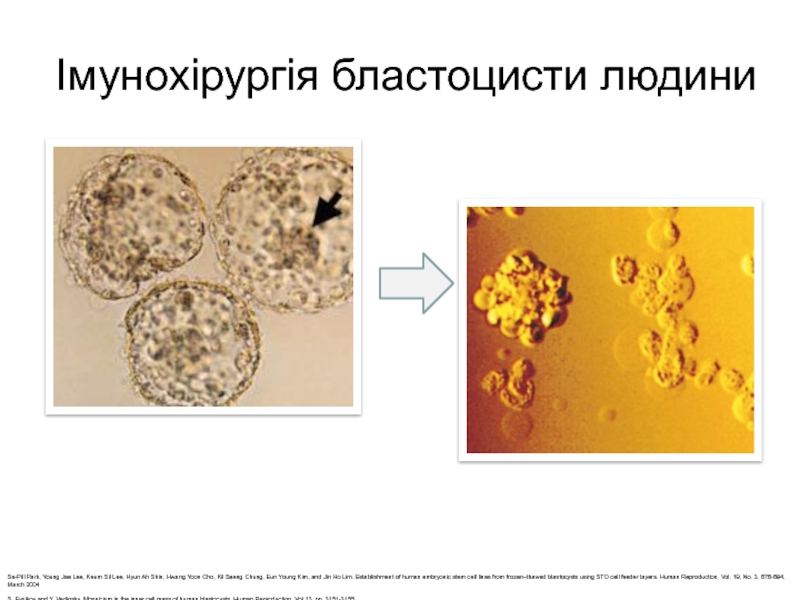
Слайд 9Імунохірургія бластоцисти людини
Se-Pill Park, Young Jae Lee, Keum Sil Lee,
Hyun Ah Shin, Hwang Yoon Cho, Kil Saeng Chung, Eun
Young Kim, and Jin Ho Lim. Establishment of human embryonic stem cell lines from frozen–thawed blastocysts using STO cell feeder layers. Human Reproduction, Vol. 19, No. 3, 676-684, March 2004S. Evsikov and Y. Verlinsky. Mosaicism in the inner cell mass of human blastocysts. Human Reproduction, Vol 13, pp. 3151-3155
Слайд 10 Потенціал стовбурових клітин—
це можливість їхнього перетворення на диференційовані
типи клітин.
Слайд 11 Тотипотентна стовбурова клітина- унаслідок злиття сперматозоїду з яйцеклітиною.
Клітини, що утворюються внаслідок декількох перших поділів заплідненої яйцеклітини
теж тотипотентні. Ці клітини можуть перетворитися на ембріональні та екстраембріональні (позаембріональні) типи клітин.
Слайд 12 Плюрипотентні стовбурові клітини походять від тотипотентних клітин, коли утворюється
морула, із якої формується бластоциста, яка містить вузлик зародкових клітин
- ембріобластів,Плюрипотентні клітини дають початок клітинам трьох зародкових шарів.
Слайд 13 Мультипотентні стовбурові клітини можуть утворювати лише близькі типи клітин
(наприклад, гематопоетичні стовбурові клітини утворюють червоні кров'яні тільця, білі кров'яні
тільця, тромбоцити, тощо).Уніпотентні стовбурові клітини можуть перетворитися лише на один тип клітин, але мають здатність до самовідтворення, що відрізняє їх від «не стовбурових» клітин.
Слайд 15 Реалізація програми розвитку детермінованої клітини з часом змінює морфологію
та функції клітини чи її потомків. Такі події відносять до
ДИФЕРЕНЦІЮВАННЯОТЖЕ, ДИФЕРЕНЦІЮВАННЯ – це послідовна зміна структури та функції клітини, яка обумовлена генетичною програмою розвитку і приводить до утворення високоспеціалізованих клітин з послідовними змінами біохімії та морфології клітин а) Диференціювання клітин призводить до утворення диферонів. Диферон –це сукупність клітинних форм (від стовбурової клітини до високодиференційованих), які складають певну лінію диференціювання. Наприклад, в кровотворній тканині - 8 диферонів: які починаються з однієї поліпотентної стовбурової клітини крові, а потім починаючи з уніпотентних стають різними
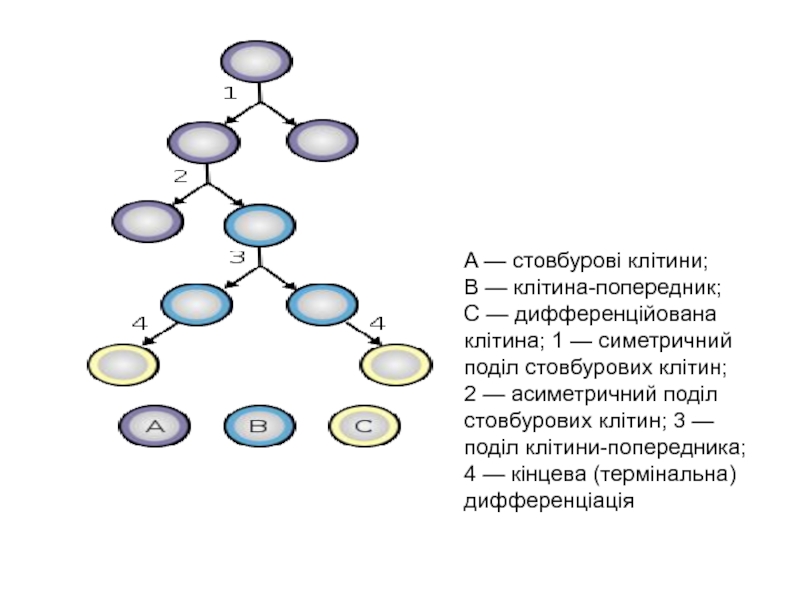
Слайд 16A — стовбурові клітини; B — клітина-попередник; C — дифференційована клітина; 1 — симетричний
поділ стовбурових клітин; 2 — асиметричний поділ стовбурових клітин; 3 — поділ
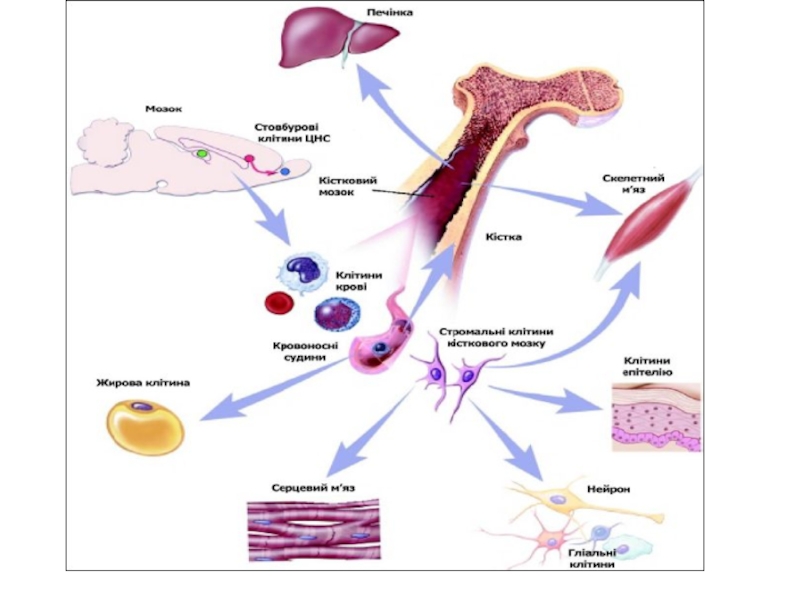
клітини-попередника; 4 — кінцева (термінальна) дифференціаціяСлайд 18 Постнатальні стовбурові клітини (Дорослі)
Гемопоетичні СК: джерело — кістковий мозок;
продуковані клітинні типи — клітини крові, ендотеліоцити, овальні клітини печінки,
міоцити.Нервові СК: джерело — мозок; продуковані клітинні типи — нейрони, астроцити, олігодендроцити, клітини крові.
Епітеліальні СК: джерело — кишечник, епідерміс; продуковані клітинні типи — всі клітини епітеліальних крипт та епідермальних шарів.
Мезенхімальні СК: джерело — кістковий мозок; продуковані клітинні типи — остеобласти, хондроцити, адипоцити, міоцити, кістковомозкова строма, нервові клітини.
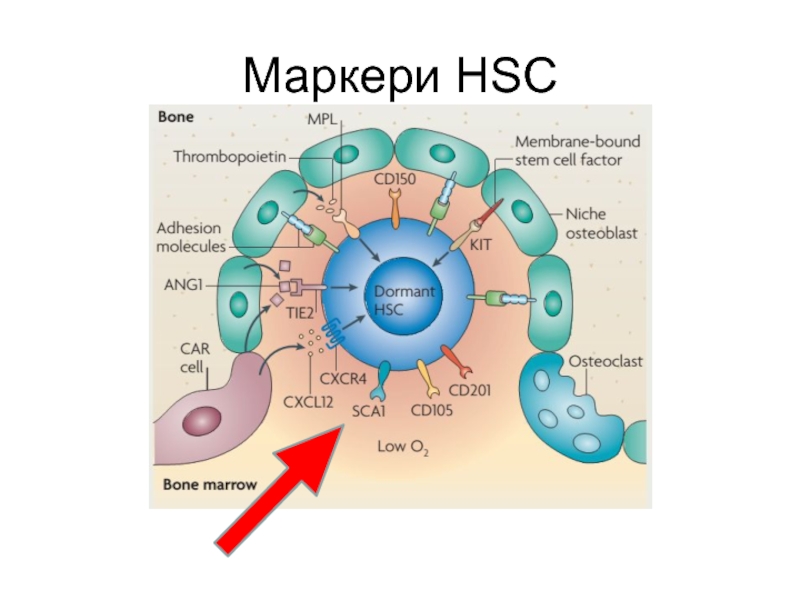
Слайд 21 Поверхневі маркери МСК людини
Специфічні антигени: SH2, SH3, SH4, STRO-1,
гладеньком'язовий α-актин, MAB1740, Thy-1
Рецептори цитокінів і факторів росту:
IL-1R, IL-3R,
IL-4R, IL-6R, IL-7R; LIFR, SCFR, G-CSFR, IFNgR, TGFbIR, TGFbIIR, TNFIR, TNFIIR, bFGFR, PDGFR, EGFR;Цитокіни і фактори росту: інтерлейкіни 11α, 6, 7, 8, 11, 12, 14 и 15, LIF, SCF, Flt3-ліганд, GM-CSF, G-CSF, M-CSF
Молекули адгезії: ICAM-1, ICAM-2, VCAM-1, ALCAM-1, ендоглін, CD44 (рецептор к гіалурону), інтегрини αVb3, αVb5, інтегринові ланцюги α1, α2, α3, α4, α5, αA, αV, b1, b2, b3, b4, LFA-3, L-селектин
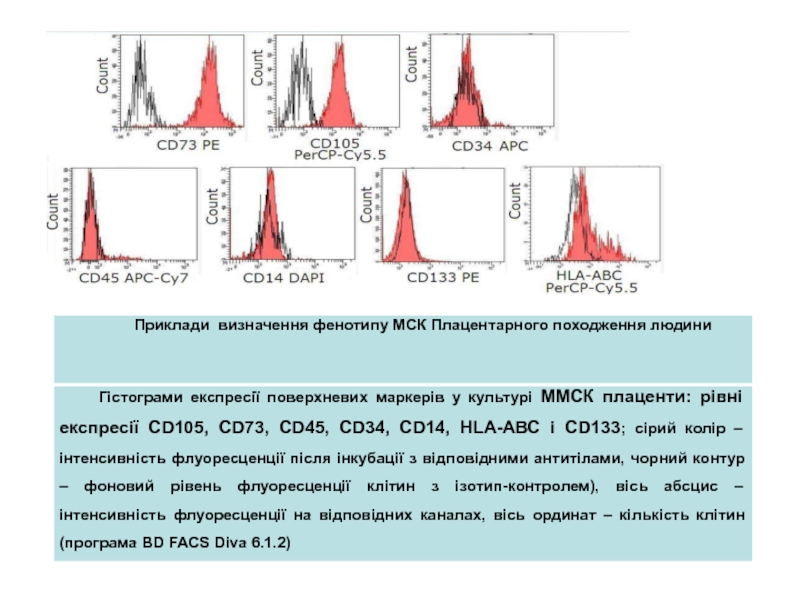
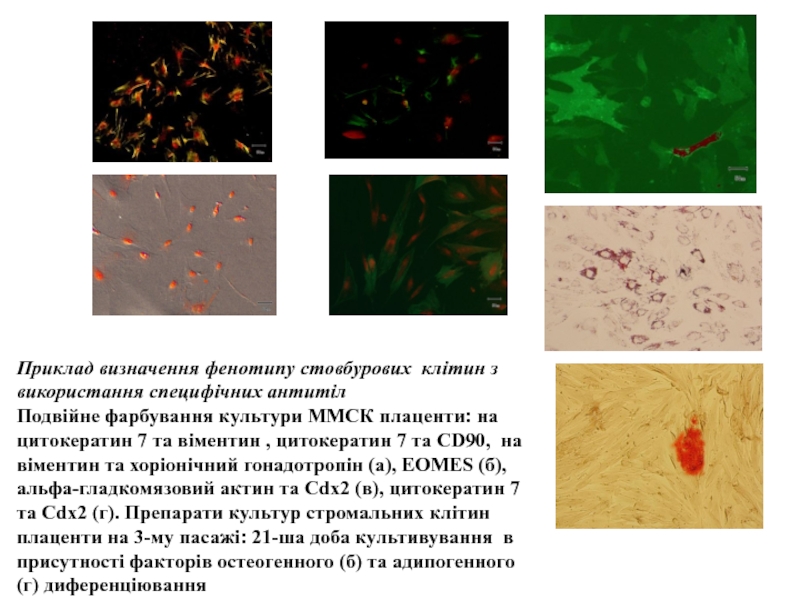
Слайд 23Приклад визначення фенотипу стовбурових клітин з використання специфічних антитіл
Подвійне фарбування
культури ММСК плаценти: на цитокератин 7 та віментин , цитокератин
7 та CD90, на віментин та хоріонічний гонадотропін (а), EOMES (б), альфа-гладкомязовий актин та Cdx2 (в), цитокератин 7 та Cdx2 (г). Препарати культур стромальних клітин плаценти на 3-му пасажі: 21-ша доба культивування в присутності факторів остеогенного (б) та адипогенного (г) диференціюванняСлайд 24Мезенхімальні стовбурові клітини – плюрипотентні клітини, які локалізовані в кістковому
мозку й дають початок різним типам клітин: остеоцитам, хондроцитам, адипоцитам.
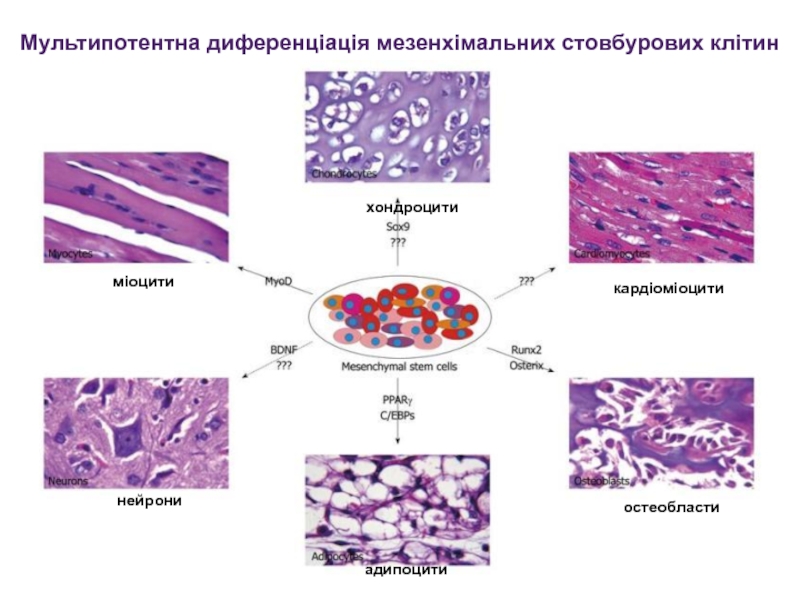
Окрім того була показано їх здатність диференціюватися в клітини серцевого м’язу та клітини скелетних м’язів.Слайд 25Мультипотентна диференціація мезенхімальних стовбурових клітин
хондроцити
міоцити
кардіоміоцити
нейрони
адипоцити
остеобласти
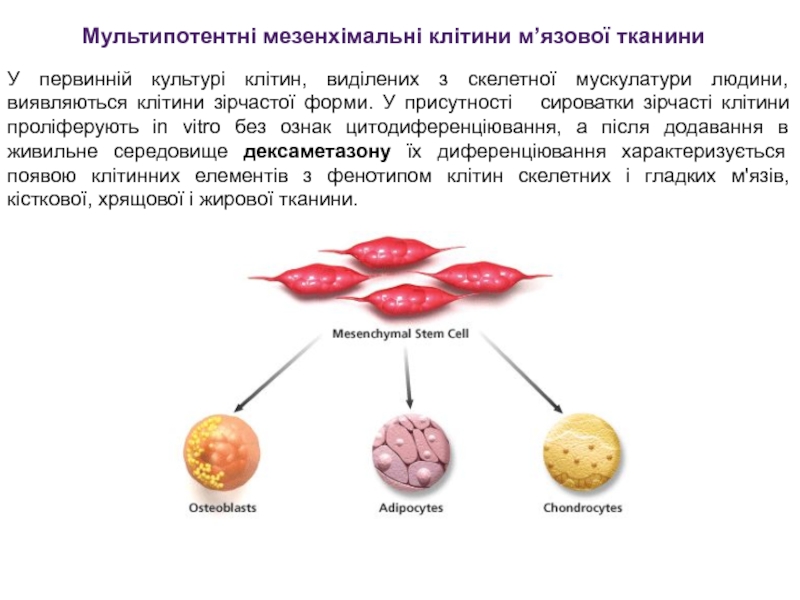
Слайд 27У первинній культурі клітин, виділених з скелетної мускулатури людини, виявляються
клітини зірчастої форми. У присутності сироватки зірчасті клітини проліферують
in vitro без ознак цитодиференціювання, а після додавання в живильне середовище дексаметазону їх диференціювання характеризується появою клітинних елементів з фенотипом клітин скелетних і гладких м'язів, кісткової, хрящової і жирової тканини.Мультипотентні мезенхімальні клітини м’язової тканини
Слайд 28 У міокарді новонароджених щурів також виявлені адгезивні зірчасті клітини,
які під впливом дексаметазону диференціюються в адипоцити, остеобласти, хондроцити, гладком'язові
клітини, міоцити скелетних м'язів і кардіоміоцити.Хрящова тканина має низький репаративний потенціал, обумовлений дефіцитом мультипотентних мезенхімальних клітин-попередників або диференціюючих і ростових факторів. Допускається, що прекомітовані до хондро- і остеогенезу мультипотентні мезенхімальні клітини-попередники надходять у хрящову тканину з інших тканинних джерел.
In vitro вдалося досягти спрямованого формування остеобластів шляхом додавання в середовище дексаметазону, ß-гліцерофосфату і аскорбінової кислоти, тоді як поєднання диференційованих сигналів дексаметазону та інсуліну індукує утворення адипоцитів.
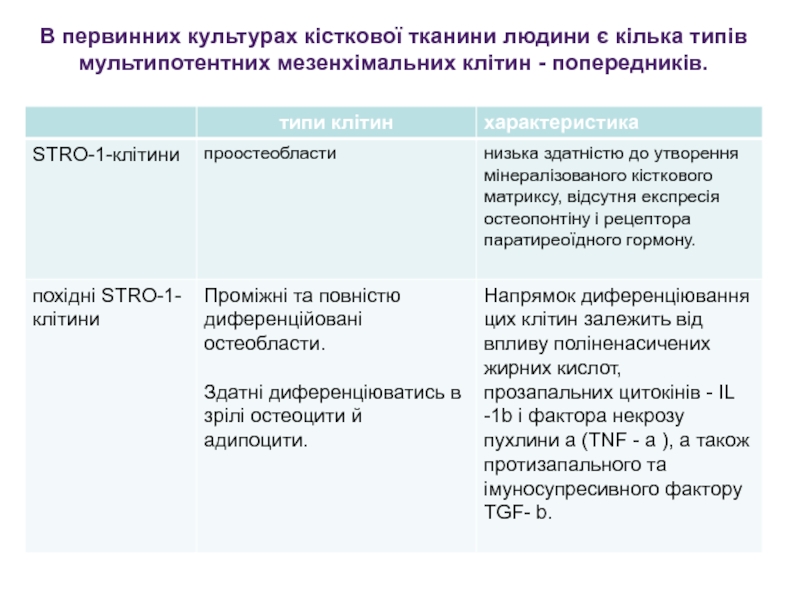
Слайд 29В первинних культурах кісткової тканини людини є кілька типів мультипотентних
мезенхімальних клітин - попередників.
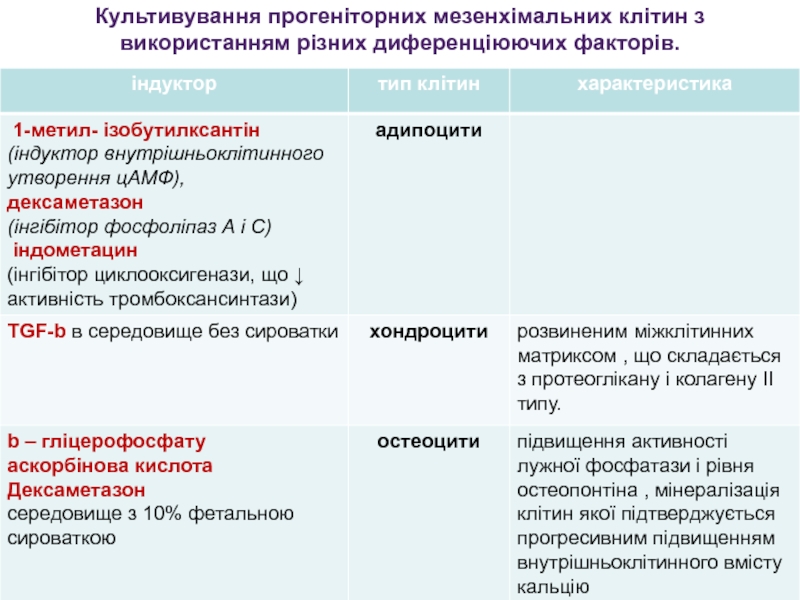
Слайд 30Культивування прогеніторних мезенхімальних клітин з використанням різних диференціюючих факторів.
Слайд 31Трансдиференціювання мезенхімальних стовбурових клітин кісткового мозку в клітини - попередники
нервової тканини та гепатоцитів.
Для диференціювання мезенхімальних клітин кісткового мозку
в нейробласти використовується кондиційне середовище, отримане шляхом тридобового культивування первинної культури ембріональних фібробластів миші, а також середовище DМЕМ/F12 ( 1/1) з 2% фетальною телячою сироваткою і додаванням ретиноєвої кислоти (нейроіндуктори, які застосовуються для нейрального диференціювання ембріональних стовбурових клітин миші і людини). Диференціювання мезенхімальних клітин кісткового мозку в клітини - попередники гепатоцитів індукують в кондиційному середовищі, створеному в результаті тридобового культивування первинної культури ембріональних клітин печінки миші в середовищі DМЕМ/F12 (1/1 ) з додаванням 10% фетальної телячої сироватки.
Слайд 32Мезенхімальні стовбурові клітини кісткового мозку піддаються індукованому нейрогенезу, в процесі
якого in vitro з нейробластів утворюються всі три основних типи
нейронів.Попередники нервових клітин були виявлені і під час культивування мезенхімальних клітин кісткового мозку протягом 3-4 діб в середовищі з 2% фетальної сироваткою і 20 нг / мл LIF. Але в цьому випадку стовбурові клітини ділилися дуже повільно, диференціювання нейробластів відбувалася тільки в 30% випадків без утворення нейрональної сітки.
Використовуючи в якості одного з індукторів диференціювання нервових клітин ретиноєву кислоту, автори отримали в культурі до 25-30% нервових клітин з переважанням гліальних елементів - астроцитів і олігодендроцитів. Нейрони становили лише 1/3 частину від всіх нервових клітин, хоча і були представлені всіма трьома типами: веретеноподібними, пірамідними і зірчастими клітинами. На 6 добу культивування клітин строми в середовищі з ретиноєвою кислотою нервові клітини ставали більш диференційованими, а у окремих пірамідних нейронів були виявлені аксони.
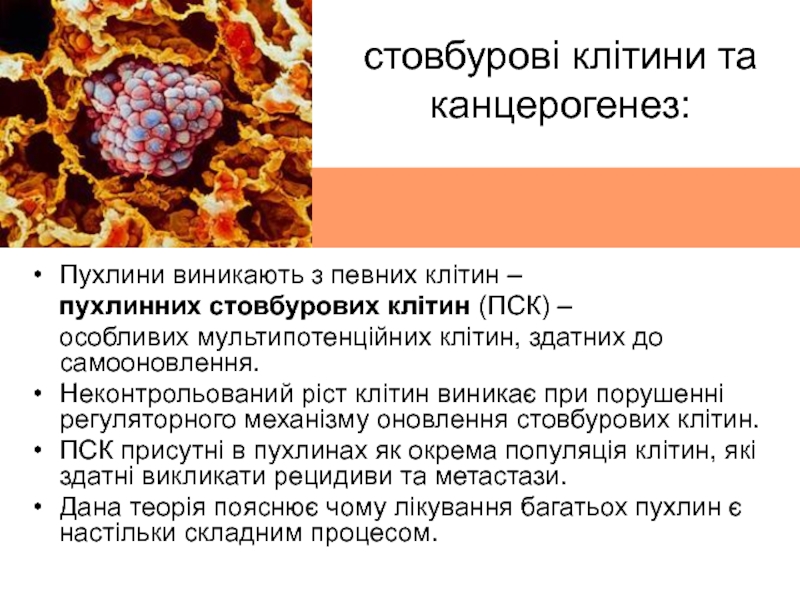
Слайд 33стовбурові клітини та канцерогенез:
Пухлини виникають з певних клітин –
пухлинних стовбурових клітин (ПСК) –
особливих мультипотенційних
клітин, здатних до самооновлення.Неконтрольований ріст клітин виникає при порушенні регуляторного механізму оновлення стовбурових клітин.
ПСК присутні в пухлинах як окрема популяція клітин, які здатні викликати рецидиви та метастази.
Дана теорія пояснює чому лікування багатьох пухлин є настільки складним процесом.
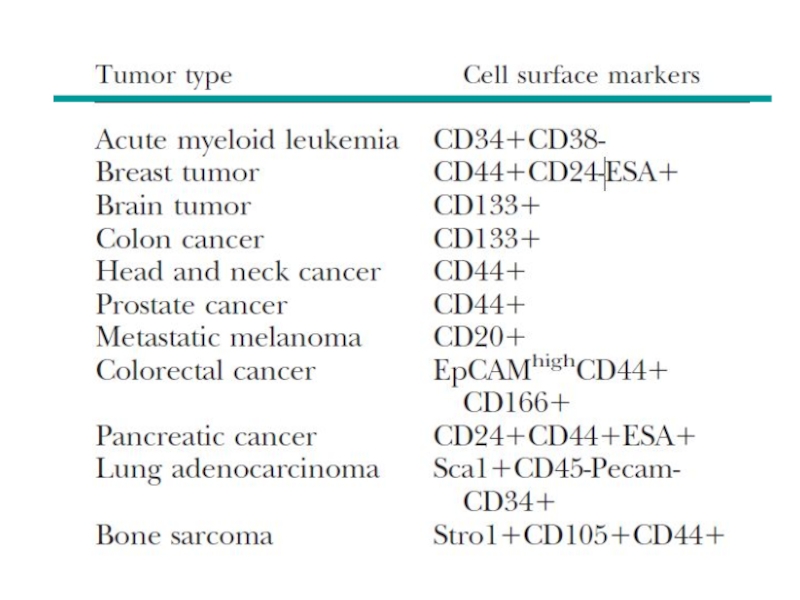
Слайд 34Ідентифікація пухлинних стовбурових клітин:
late 1990 by Bonnet et al –
CD34+CD38- leukemic stem cells,
2003 by Al-Hajj et al – CD24-CD44+
cells from human breast tumors 2005 by from lung Collins et al, Fang et al, Kim et al,
2006 by from head/neck Li et al,
2007 by from melanoma Dalerba et al, Gu et al, frrom prostate Prince et al.
Слайд 36Ізоляція пухлинних стовбурових клітин:
Метод:
ALDEFLUOR assay. За активністю альдегід дегідрогенази 1.
Проточна цитофлуометрія (fluorescence-activated cell sorting). Використовуючи специфічні антитіла до маркерів
пухлинних клітин.Слайд 41 запитання
Історія відкриття стовбурових клітин.
Ким вперше було введено поняття
«стовбурові клітини»?
Хто відкрив існування стовбурових клітин в кістковому мозку?
Чи відомі
Вам роботи вітчизняних вчених в галузі стовбурових клітин?Що таке поняття «прогенеторні» стовбурові клітини?
Яке значення в розвитку біології та медицини має відкриття стовбурових клітин?
Історія дослідження стовбурових клітин в Україні .
Чим обумовлений потенціал стовбурових клітин?
Які класифікації стовбурових клітин існують на сьогоднішній день?
Основні властивості стовбурових клітин
На скільки правомірно називати уніпотентні клітини стовбуровими?
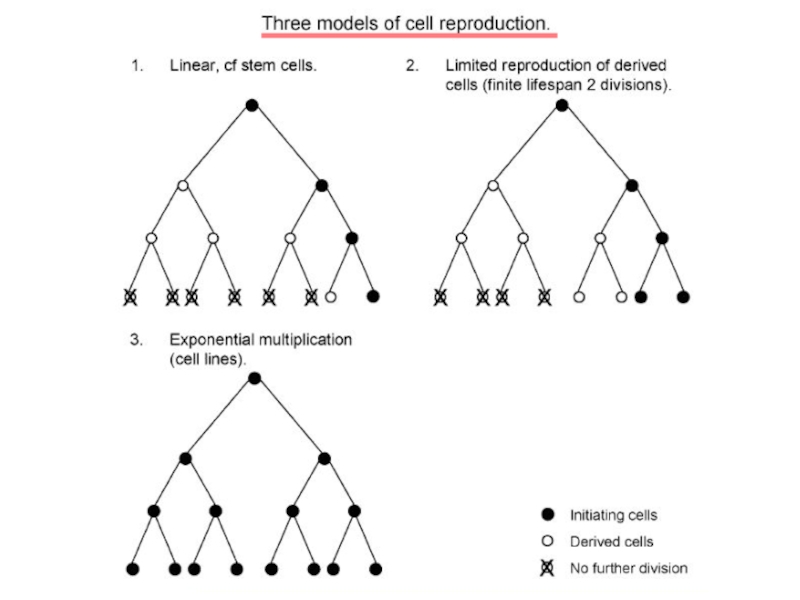
Схеми поділу стовбурових клітин
Дати визначення поняттям «диферон», «комітування», «генетично запрограмований розвиток стовбурової клітини»