Слайд 2Демокрит (Δημοκριτειο) из Абдеры во Фракии
(ок. 470/60 – 360-е
до н.э.)
В основе философии Демокрита лежит учение об атомах и
пустоте как двух принципах, порождающих многообразие космоса.
Атом есть мельчайшее «неделимое» тело, не подверженное никаким изменениям.
Всем атомам присуще свойство непрерывного движения, и даже внутри макротел, – которые образованы благодаря сцеплению атомов между собой, – они совершают колебательные движения. Первопричиной этого движения являются соударения атомов, начавшиеся во время спонтанного «Вихря», благодаря которому возник наш космос.
Друг от друга атомы, число которых бесконечно, отличаются тремя свойствами: «фигурой», «размером» и «поворотом» (положением в пространстве).
Демокрит одним из первых указал на зависимость качеств вещей от способа их познания.
Слайд 3Электрон. Первые указания о сложном строении атома были получены при
изучении процессов прохождения электрического тока через жидкости и газы. Опыты
выдающегося английского ученого М. Фарадея в 30-х гг XIX в навели на мысль о том, что электричество существует в виде отдельных единичных зарядов.
Величины этих единичных зарядов электричества были определены в более поздних экспериментах по пропусканию электрического тока через газы (опыты с так называемыми катодными лучами).
Было установлено, что катодные лучи — это поток отрицательно заряженных частиц, которые получили название электронов.
Слайд 4Модели строения атома
1903
1904
1907
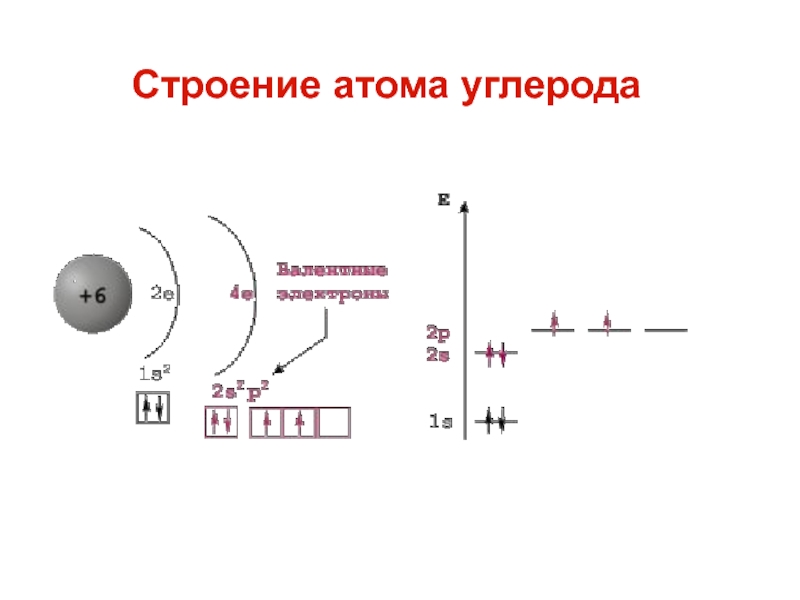
Слайд 6 Атом — электронейтральная система взаимодействующих элементарных частиц,
состоящая из ядра (образованного протонами и нейтронами) и
электронов.
Химические свойства элемента определяются строением его атома.
Хотя атомы образуются при взаимодействии всего лишь трех типов элементарных частиц, при их сочетании возникает большой набор разнообразных устойчивых или неустойчивых (радиоактивных!) систем.
Слайд 7Атомные частицы и их свойства
Атом состоит из трёх видов частиц:
Электрон
- (е) - заряд отрицательный,
q=-1,6 . 10-19Кл. Масса mе =9,1.10-31кг
Протон – (р)- заряд положительный .
q = 1,6 . 10-19Кл, Масса mр = 1840 mе
Нейтрон –(n)- не заряжен, . Масса mn≈ mр
Слайд 8Строение атома
Ядро атома - образование из протонов и нейтронов, находящееся
в центральной части атома. Содержит в себе весь положительный заряд
и большую часть массы атома (>99,95%).
Количество протонов в ядре, которое равно порядковому номеру элемента в Периодической системе Д.И.Менделеева и поэтому называется атомным номером элемента, определяет благодаря электронейтральности атома число электронов, а следовательно, электронное строение и определяемые им химические свойства элемента.
Количество нейтронов в ядрах атомов одного элемента может различаться; такие атомы называются изотопами этого элемента
Слайд 9Строение атома
Задание А1: число нейтронов в ядре атома изотопа углерода
с относительной атомной массой равной 12
1) 4; 2)12; 3)6;
4)2
Слайд 10Двойственная природа электрона
В основе современной теории строения атома лежат
следующие основные положения:
1. Электрон имеет двойственную (корпускулярно волновую) природу. Он
может вести себя и как частица, и как волна: подобно частице, электрон обладает определенной массой и зарядом; в то же время движущийся поток электронов проявляет волновые свойства, например характеризуется способностью к дифракции.
2. Для электрона невозможно одновременно точно измерить координату и скорость.
Чем точнее мы измеряем скорость, тем больше неопределенность в координате, и наоборот.
Слайд 113. Электрон в атоме не движется по определенным траекториям, а
может находиться в любой части околоядерного пространства, однако вероятность его
нахождения в разных частях этого пространства неодинакова.
Атомная орбиталь — область пространства вокруг ядра, в которой наиболее вероятно нахождение электрона.
Электроны, обладающие близкими значениями энергии образуют энергетический уровень. Он содержит строго определенное число электронов – максимально 2n2.
Энергетические уровни подразделяются на s-, p-, d- и f- подуровни; их число равно номеру уровня.
Слайд 12Квантовые числа.
Главное квантовое число n определяет общую энергию электрона
на данной орбитали. Оно может принимать целые значения, начиная с
единицы (n = 1, 2, 3,...).
В пределах определенных уровней энергии электроны могут отличаться своими энергетическими подуровнями.
Существование различий в энергетическом состоянии электронов, принадлежащих к различным подуровням данного энергетического уровня, отражается побочным (иногда его называют орбитальным) квантовым числом l. Это квантовое число может принимать целочисленные значения от 0 до n - 1 (l = 0, 1, ..., п - 1).
Побочное (орбитальное) квантовое число l характеризует различное энергетическое состояние электронов на данном уровне, определяет форму электронного облака, а также орбитальный момент р — момент импульса электрона при его вращении вокруг ядра (отсюда и второе название этого квантового числа — орбитальное)
Слайд 13
Обычно численные значения l принято обозначать буквенными символами.
Таким образом, электрон,
обладая свойствами частицы и волны, с наибольшей вероятностью движется вокруг
ядра, образуя электронное облако, форма которого в s-, p-, d- ,f-, g-состояниях различна.
Форма электронного облака зависит от значения побочного квантового числа l. Так, если l = 0 (s-орбиталь), то электронное облако имеет сферическую форму (шаровидную симметрию) и не обладает направленностью в пространстве. При l = 1 (р-орбиталь) электронное облако имеет форму гантели, т. е. форму тела вращения, полученного из “восьмерки”. Формы электронных облаков d- ,f- и g-электронов намного сложнее.
Слайд 14Формы атомных орбиталей
Расположение электронных облаков первых двух слоев в атоме
Слайд 15Движение электрического заряда (электрона) но замкнутой орбите вызывает появление магнитного
поля. Состояние электрона, обусловленное орбитальным магнитным моментом электрона (в результате
его движения по орбите), характеризуется третьим квантовым числом — магнитным ml. Это квантовое число характеризует ориентацию орбитали в пространстве, выражая проекцию орбитального момента импульса на направление магнитного поля.
Соответственно ориентации орбитали относительно направления вектора напряженности внешнего магнитного поля магнитное квантовое число ml может принимать значения любых целых чисел, как положительных, так и отрицательных, от -l до +l. включая 0, т.е. всего (2l + 1) значений.
Например, при l = 0 ml = 0; при l = 1 ml = -1, 0, +1;
при l = 3, например, магнитное квантовое число может иметь семь
(2l + 1 = 7) значений: -3, -2, -1, 0, +1, +2,+3.
Таким образом, ml характеризует величину проекции вектора орбитального момента количества движения на выделенное направление. Например, р-орбиталь (“гантель”) в магнитном поле может ориентироваться в пространстве в трех различных положениях, так как в случае l = 1 магнитное квантовое число может иметь три значения: -1, 0, +1. Поэтому электронные облака вытянуты по координатным осям х, у и z, причем ось каждого из них перпендикулярна двум другим.

Слайд 16На рис. 1 показан переход от электронной структуры молекулы к
электронной структуре вещества на примере щелочного металла.
Рис. 1.
Образование энергетической зоны
МО
в кристалле щелочного металла
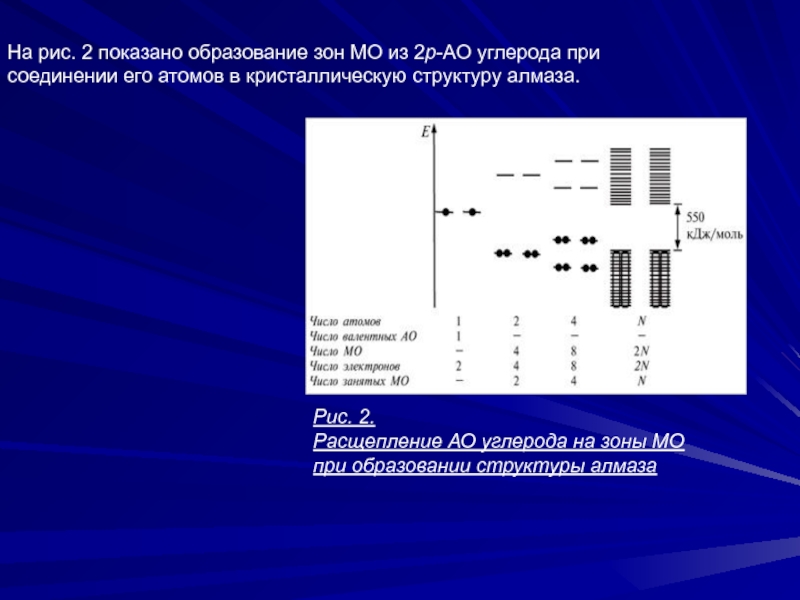
Слайд 17На рис. 2 показано образование зон МО из 2р-АО углерода
при соединении его атомов в кристаллическую структуру алмаза.
Рис. 2.
Расщепление
АО углерода на зоны МО
при образовании структуры алмаза
Слайд 18Зонное строение кристалла кремния, имеющего те же валентные электроны, что
и углерод, то же, что и у алмаза. Но атомы
кремния значительно больше, чем атомы углерода. Следовательно, разность энергий между занятой и свободной зонами МО (запрещенная зона) значительно меньше (около 100 кДж/моль). Электроны сравнительно легко ее преодолевают за счет тепловой энергии, и кремний обладает свойствами полупроводника. Его электронное строение, как у неметалла, и в то же время возможна электронная электропроводимость, как у металла (рис. 3).
Рис. 3.
Зонное строение полупроводника кремния
Слайд 19Для полного объяснения всех свойств атома была выдвинута гипотеза о
наличии у электрона так называемого спина.
Спин — это чисто
квантовое свойство электрона, не имеющее классических аналогов. Спин — это собственный момент импульса электрона, не связанный с движением в пространстве. Для всех электронов абсолютное значение спина всегда равно s = ½. Проекция спина на ось z (магнитное спиновое число ms) может иметь лишь два значения: ms = + ½ или ms = -1/2.
Первые три характеризуют движение электрона в пространстве, а четвертое - вокруг собственной оси.
Так как при химических реакциях ядра реагирующих атомов остаются без изменения (за исключением радиоактивных превращений), то физические и химические свойства атомов зависят, прежде всего, от строения электронных оболочек атомов.
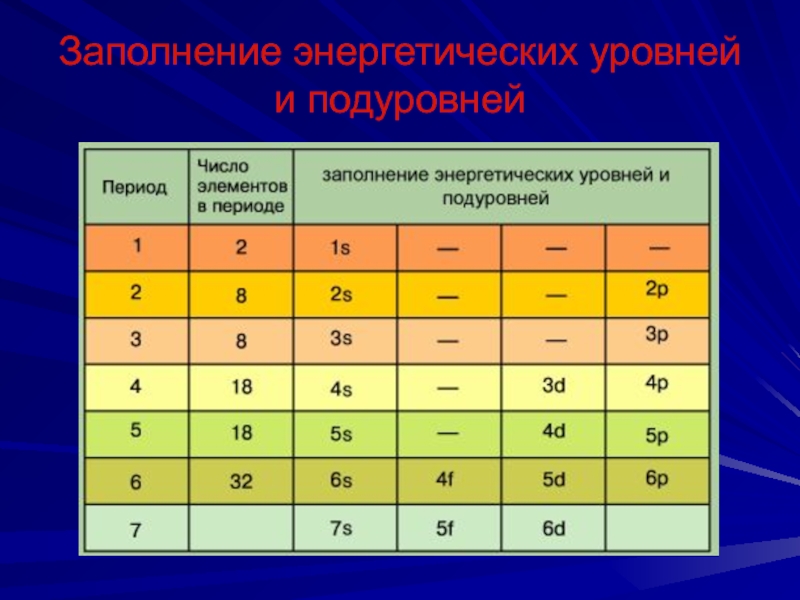
Слайд 20Заполнение энергетических уровней и подуровней
Слайд 21Правила заполнения энергетических уровней
Принцип минимума энергии
Электроны заполняют атомные орбитали, начиная
с
подуровня с меньшей энергией
Например, энергия электрона на подуровне 4s меньше,
чем на подуровне 3d, так как в первом случае
n + l = 4 + 0 = 4, а во втором n + l = 3 + 2 =5;
на подуровне 5s (n + l = 5 + 0 = 5) энергия меньше, чем на
4d (n + l = 4 + 2 = 6);
на 5р (n + l = 5 + 1 = 6) энергия меньше, чем на
4f (n + l = 4 + 3 = 7) и т.д.
Последовательность в нарастании энергии определяется рядом:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d
Слайд 22Правила заполнения энергетических уровней
Правило Клечковского (1961 г. )
Меньшей энергии электрона
отвечает состояние, которое характеризуется меньшей суммой главного и орбитального квантовых
чисел.
При равенстве сумм (n + l ) электрон заполняет орбиталь с меньшим значением n.
Например, на подуровнях Зd, 4р, 5s сумма значений
n и l равна 5.
В этом случае происходит сначала заполнение подуровней с меньшими значениями n, т.е. Зd - 4р – 5s и т.д.
Слайд 23Правила заполнения энергетических уровней
Запрет Паули
В атоме не может быть двух
электронов с одинаковым набором всех четырех квантовых чисел.
На одной АО
могут находится не более, чем два электрона, которые должны иметь различные спиновые квантовые числа.
Запрещено!
Разрешено
Слайд 24Правила заполнения энергетических уровней
Правило Хунда
При данном значении l (т.е. в пределах
определенного подуровня) электроны располагаются таким образом, чтобы суммарный спин был
максимальным.
Если, например, в трех
p-ячейках атома азота необходимо распределить три электрона, то они будут располагаться каждый в отдельной ячейке, т.е. размещаться на трех разных
p-орбиталях:
в этом случае суммарный спин равен 3/2.
Слайд 25Строение атомов элементов
I и II периодов
Слайд 27
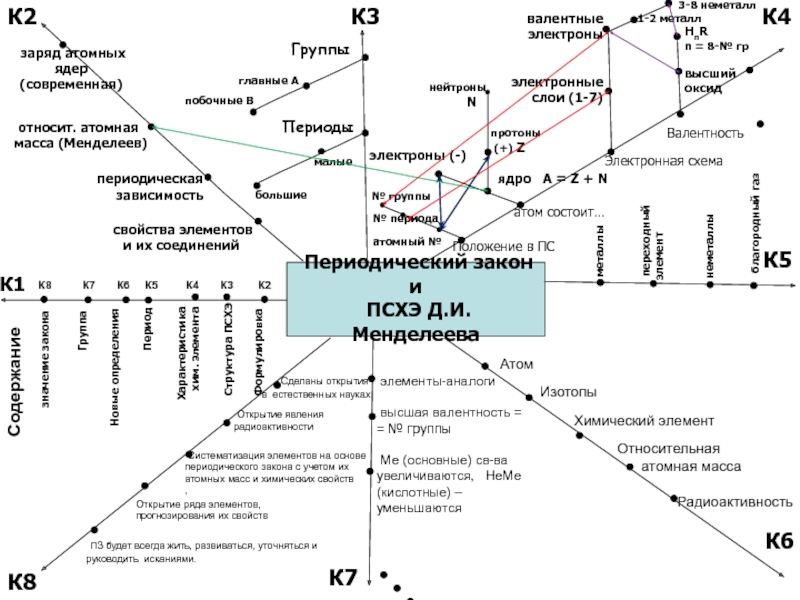
Периодический закон и
ПСХЭ Д.И. Менделеева
К2
К3
К4
К1
К5
К6
К8
Содержание
Группа
Формулировка
атом состоит…
Положение в ПС
Характеристика
хим. элемента
К8
К7 К6 К5 К4 К3 К2
свойства элементов
и их соединений
заряд атомных
ядер (современная)
Периоды
Группы
ПЗ будет всегда жить, развиваться, уточняться и руководить исканиями.
значение закона
К7
Валентность
Электронная схема
главные А
Новые определения
Период
Атом
Изотопы
Химический элемент
Относительная
атомная масса
Радиоактивность
элементы-аналоги
высшая валентность = = № группы
Ме (основные) св-ва увеличиваются, НеМе (кислотные) – уменьшаются
Систематизация элементов на основе
периодического закона с учетом их
атомных масс и химических свойств
,
Открытие явления
радиоактивности
Сделаны открытия
в естественных науках
Открытие ряда элементов,
прогнозирования их свойств
периодическая зависимость
относит. атомная
масса (Менделеев)
побочные В
Структура ПСХЭ
большие
малые
атомный №
№ периода
№ группы
нейтроны
N
протоны
(+) Z
ядро A = Z + N
электроны (-)
переходный
элемент
металлы
неметаллы
благородный газ
валентные электроны
электронные слои (1-7)
3-8 неметалл
1-2 металл
HnR
n = 8-№ гр
высший оксид
Слайд 28Строение атома
Составьте электронную формулу химического элемента № 17
Слайд 29Строение атома
1. Элемент № 17 называется хлор и имеет химический
символ Cl.
2. Элемент хлор находится в третьем периоде.
3. Внешним энергетическим
уровнем в атоме хлора является уровень под номером 3.
4. Элемент хлор находится в группе номер VII.
5. Хлор входит в подгруппу А.
6. На внешнем электронном уровне атома хлора имеется 7 электронов.
7. Заряд ядра атома элемента хлора равен +17.
8. На трёх энергетических уровнях атома хлора располагаются 17 электронов.
9. На первом энергетическом уровне атома хлора располагаются 2 электрона.
10. Первый электронный уровень любого атома периодической системы, кроме атома водорода, можно представить так: 1s2.
Слайд 30Строение атома
11. На втором энергетическом уровне атома хлора находится 8
электронов.
17 - (2 + 7) = 8
12. На втором энергетическом
уровне имеются два подуровня s и р.
13. Число электронов в атоме хлора на втором s - подуровне равняется 2.
14. Число электронов в атоме хлора на втором р - подуровне равняется 6.
8 - 2 = 6
15. Число электронов находящихся на одной р -орбитали не может быть больше чем 2.
16. На втором энергетическом уровне в атоме хлора имеется три р - орбитали, расположенных перпендикулярно друг-другу.
17. Расположение электронов на втором энергетическом уровне можно записать так: 2s22p6. Если прибавить эту запись к ранее сделанной записи первого энергетического уровня, то получится:
1s22s22p6
Слайд 31Строение атома
18. На третьем энергетическом уровне в атоме хлора имеется
три подуровня s, р, d. Из них заполняется семью электронами
только два s и р, d - подуровень остаётся пустым.
19. Расположение электронов на третьем энергетическом уровне можно записать так: 3s23p5. Если добавить эту запись к ранее сделанной записи первого и второго энергетического уровней, то получится электронная формула атома хлора:
1s22s22p63s23p5
Ответ: электронная формула атома хлора 1s22s22p63s23p5.
Слайд 32Строение атома
Напишите электронную формулу атома технеция. Сколько электронов находится на
d-подуровне предпоследнего электронного слоя? К какому электронному семейству относится элемент?
Слайд 33Строение атома
Атом Tc в таблице Менделеева имеет порядковый номер 43. Следовательно, в его оболочке
содержится 43 электрона. В электронной формуле распределяем их по подуровням согласно порядку заполнения
(в соответствии с правилами Клечковского) и учитывая емкость подуровней:
Tc1s22s22p63s23p63d104s24p64d55s2. При этом порядок заполнения подуровней следующий:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d.
Последний электрон располагается на 4d-подуровне, значит, технеций относится к семейству d-элементов. На d-подуровне предпоследнего (4-го) слоя находится 5 электронов.
Ответ: 5, d.
Слайд 34Строение атома
Атом какого элемента имеет электронную конфигурацию 1s22s22p63s23p63d104s24p64d105s25p1?
Слайд 35Строение атома
Решение.
Количество электронов в оболочке нейтрального атома составляет 49. Поэтому
его заряд ядра и, следовательно, порядковый номер, также равны 49.
В периодической системе Д.И.Менделеева находим, что этот элемент – индий.
Ответ: In.
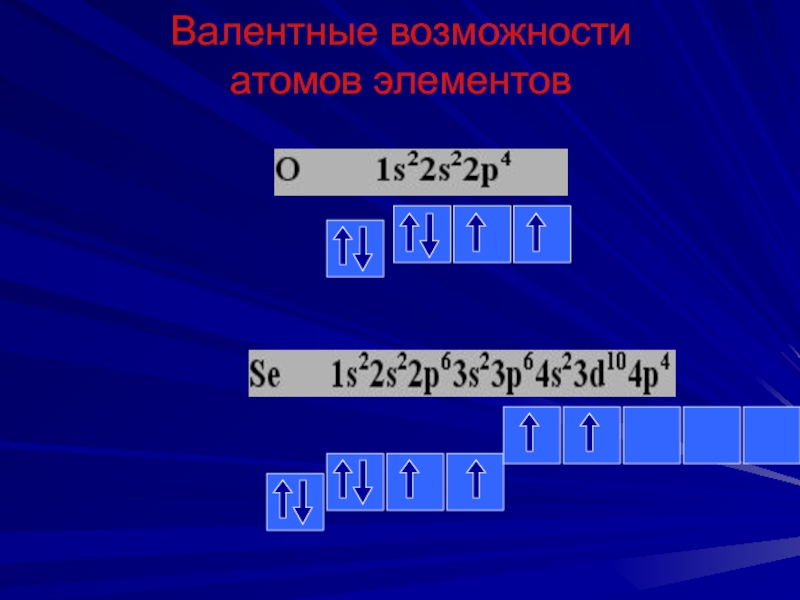
Слайд 36Валентные возможности
атомов элементов
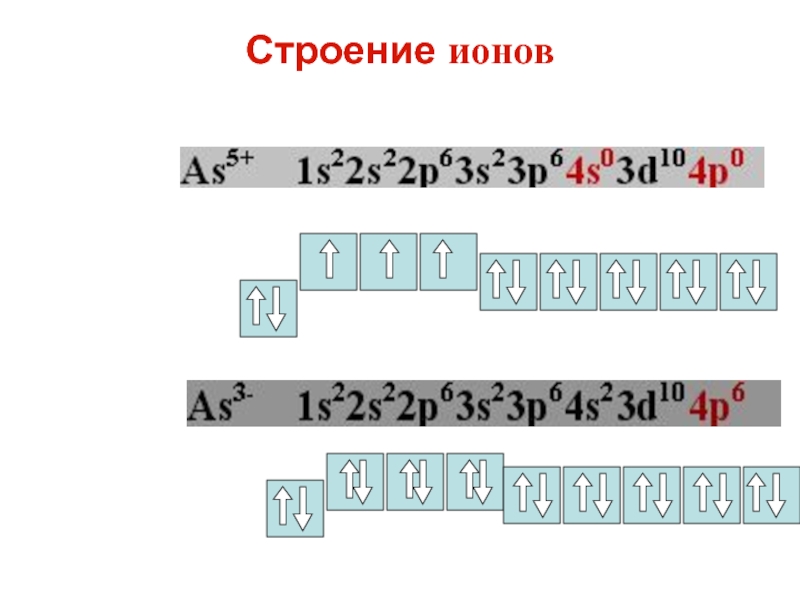
Слайд 38Строение ионов
электронная формула иона Br-
1)… 2)…. 3)… 4)…
Слайд 39Строение ионов
электронная формула атома брома Br0 1s22s22p63s23p63d104s24p5
атома брома Br0
превращается в ион брома Br – присоединяя 1 e
электронная формула
иона брома Br- 1s22s22p63s23p63d104s24p6
Слайд 40Строение атома
Атом металла имеет электронную конфигурацию 1s2 2s2 2p6 3s2,
формула оксида, гидроксида и сульфата этого элемента
1)ЭО; Э(ОН)2;ЭSO4 2) Э2О;
ЭОН;Э2SO4
3)ЭО; ЭОН;ЭSO4 4)Э 2 О 2; Э(ОН)2;Э 2 SO4
Слайд 41Строение атома
1s2 2s2 2p6 3s2
Э+2
1)Э+2О-2; Э+2 (ОН)-2;Э+2SO4-2
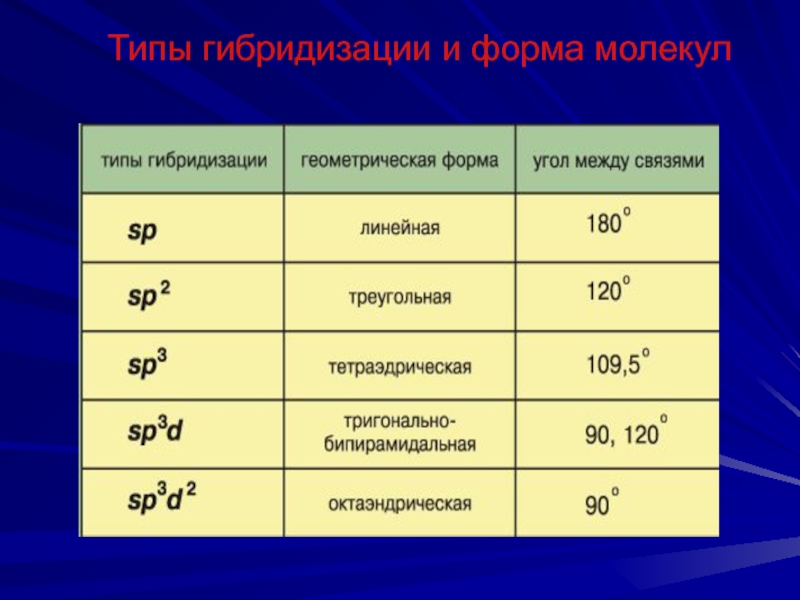
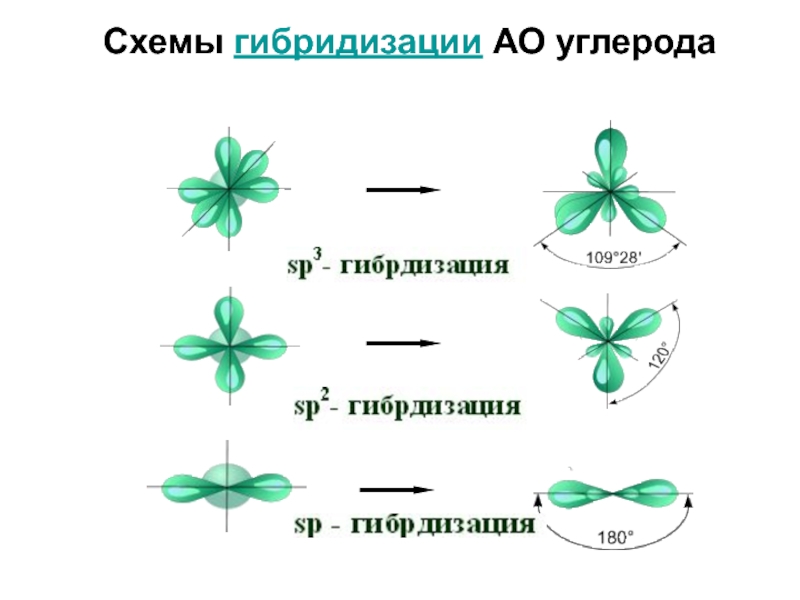
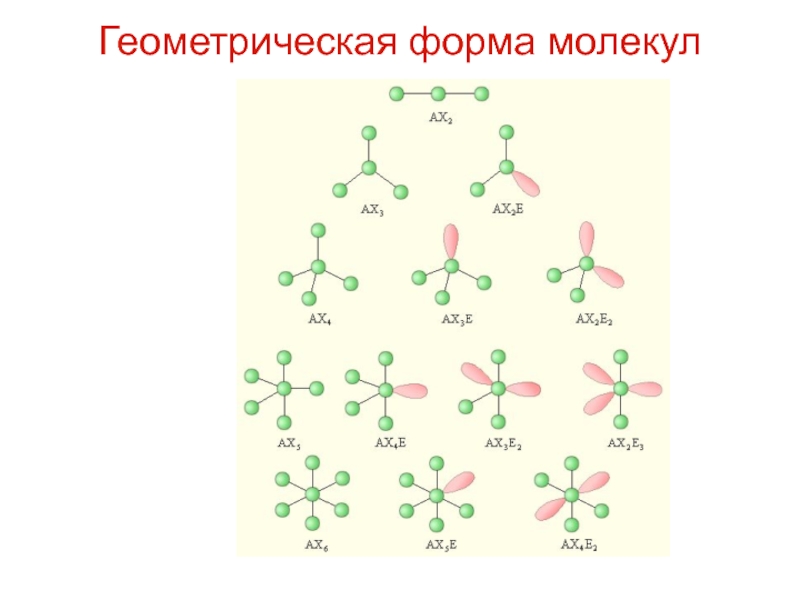
Слайд 42Типы гибридизации и форма молекул
Слайд 45Типы гибридизации и форма молекул
Укажите тип гибридизации орбиталей бора в молекуле BBr3.
Слайд 46Типы гибридизации и форма молекул
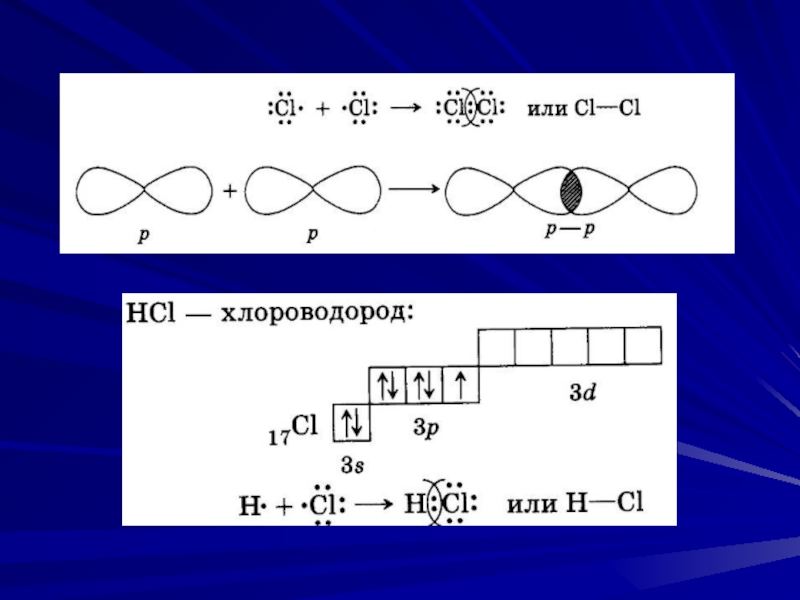
В образовании трех ковалентных связей между бором и
атомами брома участвуют одна s- и две p-орбитали атома бора, свойства которых различаются. Поскольку все
химические связи в молекуле BBr3 равноценны, атом бора подвергается гибридизации. В ней принимают участие указанные выше три орбитали внешнего электронного слоя. Следовательно, тип гибридизации – sp2.
Ответ: sp2.
Слайд 47Виды химической
связи
Под химической связью
понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы,
радикалы, кристаллы
При образовании химической связи атомы стремятся приобрести устойчивую восьмиэлектронную (или двухэлектронную) внешнюю оболочку, соответствующую строению атома ближайшего инертного газа.
Различают следующие виды химической связи:
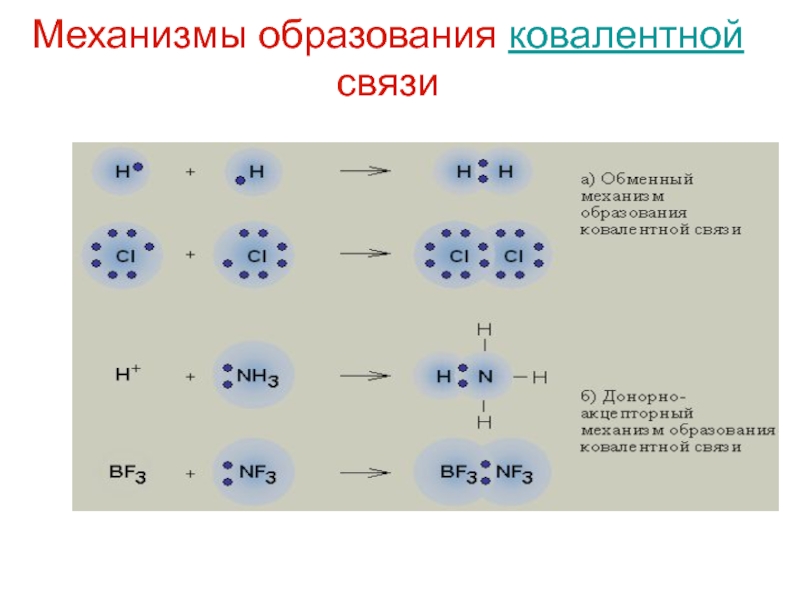
ковалентная (полярная и неполярная; по обменному и донорно-акцепторному механизмам),
ионная,
водородная,
металлическая.
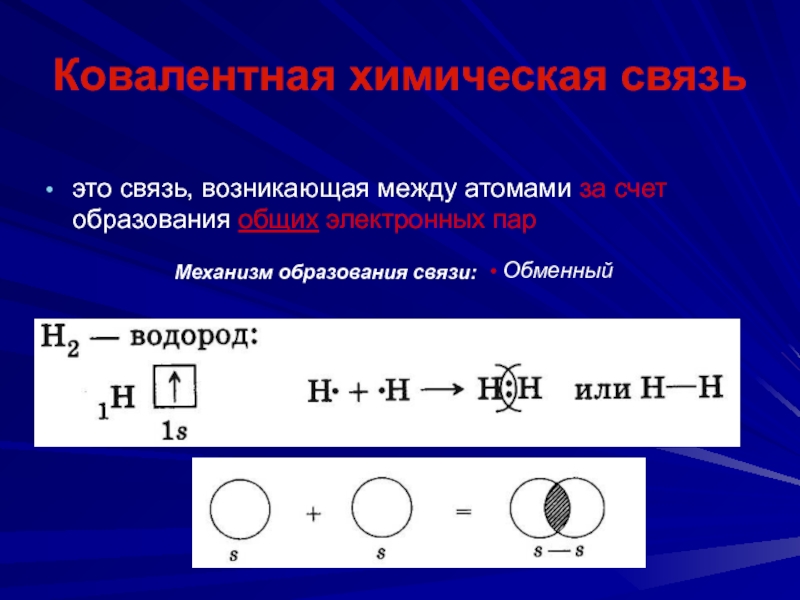
Слайд 48Ковалентная химическая связь
это связь, возникающая между атомами за счет образования
общих электронных пар
Обменный
Механизм образования связи:
Слайд 49Полярность ковалентной связи
степень смещённости общих электронных пар к одному из
связанных ими атомов
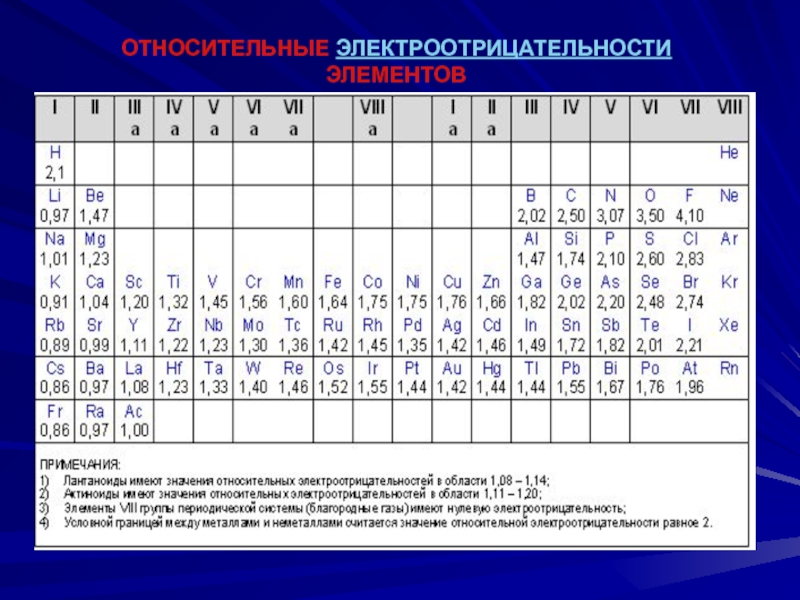
электроотрицательность (ЭО) — свойство оттягивать к себе
валентные электроны от других атомов
между атомами с одинаковой электроотрицательностью
образуется между атомами с разной электроотрицательностью
H H
H СL
Слайд 50ОТНОСИТЕЛЬНЫЕ ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ ЭЛЕМЕНТОВ
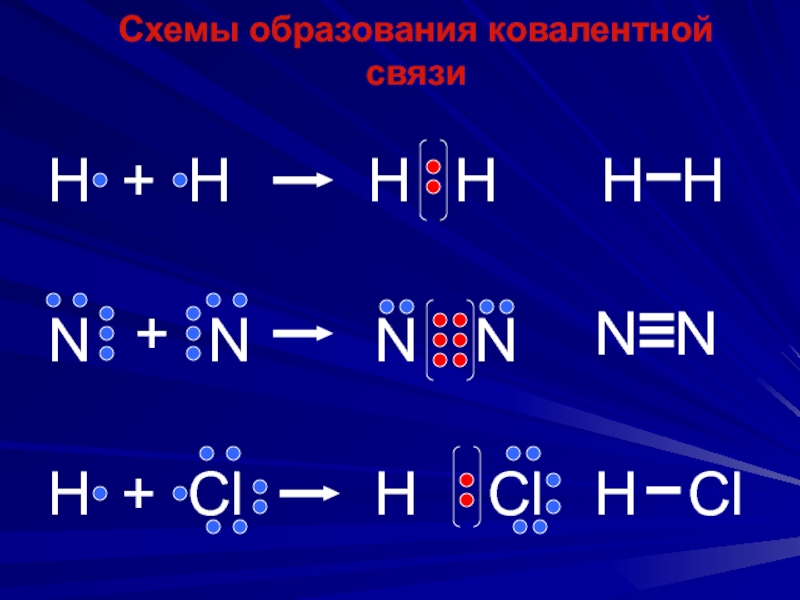
Слайд 51Схемы образования ковалентной связи
Н
+
Н
Н
Н
Н
Н
+
N
N
N
N
H
+
H
Cl
H
Cl
Слайд 53Кратность ковалентной связи
число общих электронных пар, связывающих атомы
CO2
оксид углерода(IV)
о=с=о
N2
азот
N
N
H2
водород
H-H
Слайд 54Механизмы образования ковалентной связи
Слайд 55ИОННАЯ СВЯЗЬ
Если разность электроотрицательностей атомов велика, то электронная пара, осуществляющая
связь, переходит к одному из атомов, и оба атома превращаются
в ионы.
Na
+
S
Na
Na
S
Na
[
]
+
+
2-
Ионная связь образуется только между атомами таких элементов, которые значительно отличаются по своей электроотрицательности (разность >1,7). Однако полного перехода электронов от одних атомов к другим не происходит.
Слайд 56Ионная химическая связь
это связь, образовавшаяся за счет
электростатического притяжения
катионов к анионам
Задание:
Выпишите формулы веществ с ионной связью.
РСl3; С2Н2; Na3P; ССl4, MgCl2; СН4; K3N; NaBr.
Слайд 57Металлическая связь
связь в металлах и сплавах, которую выполняют относительно свободные
электроны между ионами металлов в металлической кристаллической решетке
о п+
М — пе М
Схема образования металлической связи:
Задание:
Выпишите формулы веществ, в которых присутствует металлическая связь
Na, KF, NH3, C2H2, CH3-COOH, H2S, AL, NaCl.
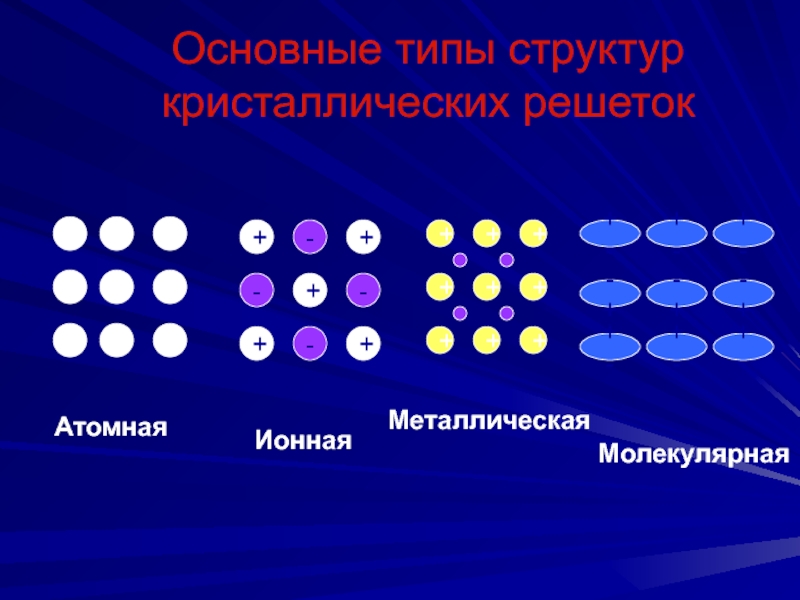
Слайд 58Основные типы структур кристаллических решеток
+
+
-
+
-
+
+
-
-
+
+
+
+
+
+
+
+
+
Атомная
Ионная
Металлическая
Молекулярная
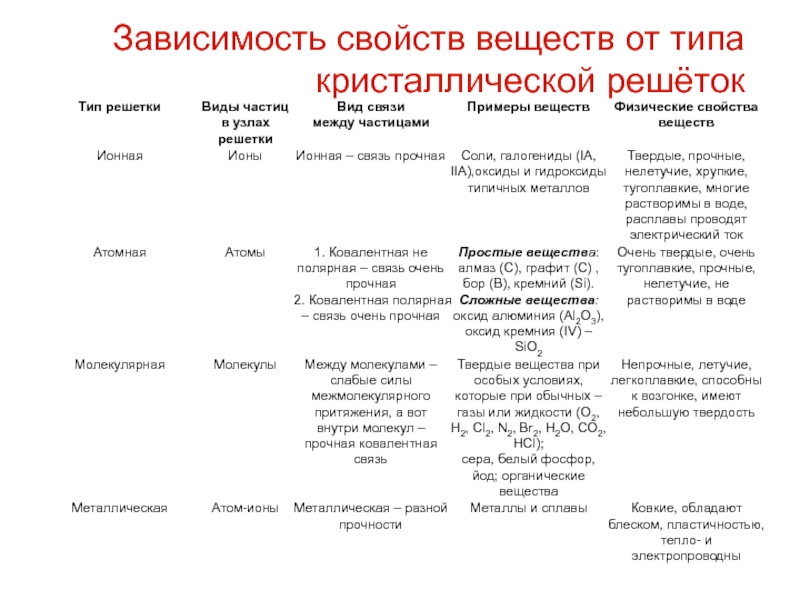
Слайд 59Зависимость свойств веществ от типа кристаллической решёток
Слайд 60Водородная связь
Это связь между положительно заряженным атомом водорода одной молекулы
и отрицательно заряженным атомом другой молекулы. Водородная связь имеет частично
электростатический, частично донорно-акцепторный характер.
Наличие водородных связей объясняет высокие температуры кипения воды, спиртов, карбоновых кислот.
Слайд 61
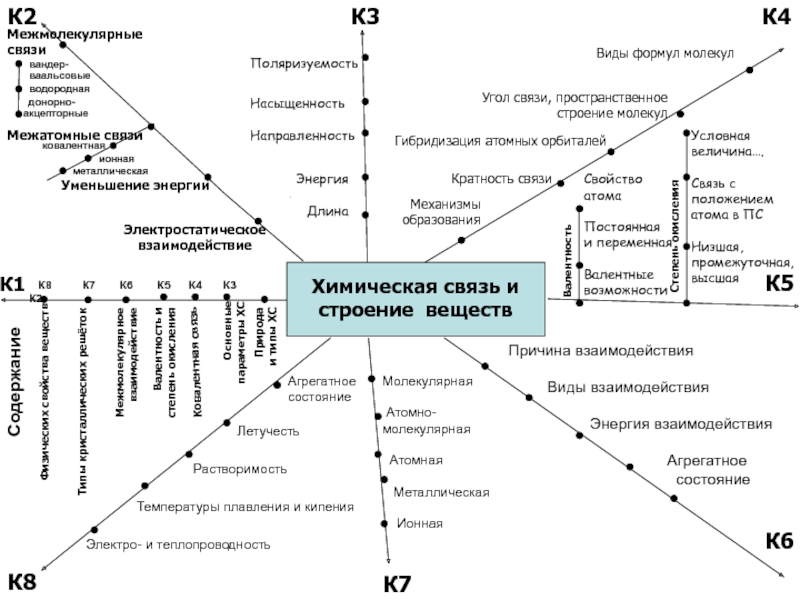
Химическая связь и
строение веществ
К2
К3
К4
К1
К5
К6
К8
Содержание
Кратность связи
Типы кристаллических решёток
Природа
и
типы ХС
Механизмы образования
Общие
электр. пары
Ковалентная связь
К8
К7 К6 К5 К4 К3 К2
Электростатическое взаимодействие
Межмолекулярные связи
Энергия
Длина
Насыщенность
Направленность
Поляризуемость
Электро- и теплопроводность
Физических свойства веществ
К7
По полярности
Основные параметры ХС
Металлическая связь
Ионная связь
пр. в-ва Ме, сплавы
Ме0 - ne- Ме+n
общие электроны
электронный газ
Молекулярная
Атомная
Металлическая
Ионная
Хорошо растворимы
Летучие (запах)
Легкоплавкие
Малые прочность
и твёрдость
Уменьшение энергии
Межатомные связи
металлическая
ковалентная
ионная
А0– или + ne- И +-
Me0 + НеМе0 Ме+n НеМе-m
Между ат. НеМе
Электро-
отрицательность
по группе умен-ся
по периоду увел-ся
неполярная
полярная
м-лы полярные или неполярные
сл. в-ва
пр. в-ва
неполярные м-лы
ФЕ
Между ионами
Ионные кристаллы
Соединения Ме
Слайд 62
Химическая связь и
строение веществ
К2
К3
К4
К1
К5
К6
К8
Содержание
Гибридизация атомных орбиталей
Типы кристаллических решёток
Природа
и типы ХС
Кратность связи
Механизмы
образования
Ковалентная связь
К8
К7 К6 К5 К4 К3 К2
Электростатическое взаимодействие
Межмолекулярные связи
Энергия
Длина
Насыщенность
Направленность
Поляризуемость
Электро- и теплопроводность
Физических свойства веществ
К7
Угол связи, пространственное
строение молекул
Виды формул молекул
Основные параметры ХС
Межмолекулярное взаимодействие
Валентность и
степень окисления
Причина взаимодействия
Виды взаимодействия
Энергия взаимодействия
Агрегатное
состояние
Свойство
атома
Постоянная
и переменная
Валентные возможности
Молекулярная
Атомно-молекулярная
Атомная
Металлическая
Ионная
Растворимость
Летучесть
Агрегатное
состояние
Температуры плавления и кипения
Уменьшение энергии
донорно-акцепторные
водородная
Межатомные связи
металлическая
ковалентная
вандер-ваальсовые
ионная
Валентность
Степень окисления
Условная величина….
Связь с положением атома в ПС
Низшая, промежуточная, высшая
Слайд 63Самостоятельная работа
1) Выпишите отдельно структурные формулы веществ с ковалентной полярной
и неполярной связью. Укажите при помощи стрелки полярность.
Вг2; НСl; КВг;
H2SO4; Ba; SO3; Li3N; P4; C2H4.
2) Определите типы химических связей между атомами в веществах.
CaВг2; НСl; К; H2SO3; BaO; SO2; LiNО3;
S2; C2H2; Na; HCОOК.
Слайд 64Виды химической связи
Какие виды химической связи имеются в молекуле NH4I ?
Слайд 65Виды химической связи
Молекула NH4I состоит из ионов NH4+ и I–, между
которыми имеется ионная связь. В ионе NH4+ четыре связи являются ковалентными полярными, причем
одна из них образована по донорно-акцепторному типу.
Ответ: ионная, ковалентная полярная, донорно-акцепторная.