Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Свойства неорганических веществ
Содержание
- 1. Свойства неорганических веществ
- 2. Свойства неорганических веществ(задание 37 ЕГЭ по химии)От названий к формуламХарактеризуем веществаУстанавливаем последовательность превращенийСвойства неорганических веществ
- 3. От названий к формулам
- 4. От названий к формулам
- 5. От названий к формулам
- 6. От названий к формулам
- 7. От названий к формуламMnO2 (диоксид марганца) – пиролюзитCrO3 (оксид хрома (VI)) – хромовый ангидрид
- 8. Термины, используемые при описании экспериментаНавеска — это
- 9. Термины, используемые при описании экспериментаФильтрат — это
- 10. Термины, используемые при описании экспериментаУпаривание — это
- 11. Наиболее характерные признаки газов, растворов, твердых веществГАЗЫ:Окрашенные:
- 12. ОКРАШЕННЫЕ РАСТВОРЫ:
- 13. ОКРАШЕННЫЕ ОСАДКИ,ПОЛУЧАЮЩИЕСЯ ПРИ ВЗАИМОДЕЙСТВИИ РАСТВОРОВ
- 14. ДРУГИЕ ОКРАШЕННЫЕ ВЕЩЕСТВА
- 15. ДРУГИЕ ОКРАШЕННЫЕ ВЕЩЕСТВА
- 16. Последовательность превращенийЧёрный порошок, который образовался при длительном
- 17. Последовательность превращенийСuCuOСuSO4Cu(OH)2[Сu(NH3)4](OH) 21) 2Сu + O2 =
- 18. Последовательность превращенийВещество красного цвета, которое используется в
- 19. Последовательность превращенийВещество красного цвета, которое используется в
- 20. Свойства неорганических веществЗадание 37 требует от участника
- 21. Свойства неорганических веществНеобходимо обратить внимание на окислительно-восстановительные
- 22. Свойства неорганических веществОкислительные свойства солей трехвалентного железа:2FeCl3+Cu=CuCl2+2FeCl22FeCl3+Fe=3FeCl2
- 23. Свойства неорганических веществВосстановительные свойства аммиака:NH3+O2=NH3+O2=NH3+CuO=NH3+Br2=NH3+KMnO4=kat
- 24. Свойства неорганических веществВосстановительные свойства аммиака:4NH3+3O2=2N2+6H2О4NH3+5O2=4NO+6H2О2NH3+3CuO=N2+3Cu+3H2О8NH3+3Br2=N2+6NH4Br2NH3+2KMnO4=N2+2MnO2+2KOH+2H2Оkat
- 25. Свойства неорганических веществМалохарактерные для него окислительные свойства
- 26. Свойства неорганических веществТрудными оказываются уравнения реакций, которые
- 27. Свойства неорганических веществТрудными оказываются уравнения реакций, которые
- 28. Кислоты. Основания. Соли. Оксиды.Для получения азотной кислоты
- 29. Кислоты. Основания. Соли. Оксиды.Для получения бромоводорода из
- 30. Схема 1: Азотная кислота
- 31. Схема 2: Серная кислота
- 32. Окислительные свойства азотной и серной кислот в
- 33. Окислительные свойства азотной и серной кислот в
- 34. Кислоты. Основания. Соли. Оксиды.HI + H2SO4 (конц.) =HBr + H2SO4 (конц.) =P + H2SO4 (конц.) =
- 35. Кислоты. Основания. Соли. Оксиды.Серная кислота окисляет галогеноводороды
- 36. Кислоты. Основания. Соли. Оксиды.Кислоты взаимодействуют с солями
- 37. Кислоты. Основания. Соли. Оксиды.Ортофосфорная кислота по первой
- 38. Кислоты. Основания. Соли. Оксиды.Фосфат калия можно получить
- 39. Кислоты. Основания. Соли. Оксиды.Чтобы получить из основной
- 40. Кислоты. Основания. Соли. Оксиды.Более сильное основание вытесняет
- 41. Кислоты. Основания. Соли. Оксиды.Определенную трудность могут представлять
- 42. Термическое разложение солей.Разложение нитратовNaNO3 = NaNO2 +
- 43. Термическое разложение солей.Разложение солей аммонияНа аммиак и
- 44. Термическое разложение солей.Разложение солей угольной кислотыНе разлагаются
- 45. Термическое разложение солей.Разложение кислородосодержащих солей – окислителей:2KClO3
- 46. Окислительно-восстановительные процессы с участием наиболее важных окислителей и восстановителей
- 47. Окислительно-восстановительные процессы с участием наиболее важных окислителей и восстановителей
- 48. Окислительно-восстановительные процессы с участием наиболее важных окислителей
- 49. Окислительно-восстановительные процессы с участием наиболее важных окислителей
- 50. Электролиз
- 51. ЭлектролизЭлектролиз растворов солей металлов, стоящих в ряду
- 52. ЭлектролизПри электролизе солей, образованных металлами, находящимися в
- 53. Электролиз солей карбоновых кислотCH3CH2COONa CH3CH2COO- +
- 54. Электрохимический ряд напряжения металловЧем ближе стоит металл
- 55. Электрохимический ряд напряжения металловМеталлы, стоящие до магния
- 56. ГидролизПри сливании растворов солей, содержащих катион слабого
- 57. ГидролизОсобую трудность вызывают сложные случаи взаимодействия растворов
- 58. Гидролиз бинарных соединенийAl4C3 + Н2О =Al2S3 +
- 59. Гидролиз бинарных соединенийAl4C3 + 12Н2О = 4Аl(ОН)3
- 60. Амфотерностьв раствореZn(OH)2 + KOH = ZnO +
- 61. Амфотерностьв раствореZn(OH)2 + 2KOH = K2[Zn(OH)4]ZnO +
- 62. АмфотерностьСлабо амфотерные гидроксиды железа (III) и хрома
- 63. АмфотерностьМеталлы, оксиды и гидроксиды которых амфотерны, также
- 64. Способы разрушения комплексных солей При действии избытка
- 65. Способы разрушения комплексных солей При действии углекислого
- 66. НЕОРГАНИЧЕСКАЯ ХИМИЯОксид азота (I), оксид диазота, закись
- 67. НЕОРГАНИЧЕСКАЯ ХИМИЯОксид азота (IV), диоксид азотаNO2 +
- 68. НЕОРГАНИЧЕСКАЯ ХИМИЯОксид азота (IV), диоксид азота4NO2 +
- 69. НЕОРГАНИЧЕСКАЯ ХИМИЯПолучение:16HCl + 2KMnO4 =5Cl2 + 2MnCl2
- 70. НЕОРГАНИЧЕСКАЯ ХИМИЯВзаимодействие с водой:Cl2 + H2O =
- 71. НЕОРГАНИЧЕСКАЯ ХИМИЯГалогены не взаимодействуют с кислотами. Только
- 72. НЕОРГАНИЧЕСКАЯ ХИМИЯОсобым свойством серы является взаимодействие ее
- 73. НЕОРГАНИЧЕСКАЯ ХИМИЯОксид серы (IV) может быть доокислен
- 74. НЕОРГАНИЧЕСКАЯ ХИМИЯполучение фосфора:Са3(Р04)2 + 5С + 3SiO2
- 75. НЕОРГАНИЧЕСКАЯ ХИМИЯПри взаимодействии железа с галогенами образуются
- 76. НЕОРГАНИЧЕСКАЯ ХИМИЯОксид железа (II) FeO обладает основными
- 77. НЕОРГАНИЧЕСКАЯ ХИМИЯГидроксид железа (II) Fe(OH)2 проявляет основные
- 78. НЕОРГАНИЧЕСКАЯ ХИМИЯСоли Fe3+ сильно гидролизуются, поэтому активные
- 79. НЕОРГАНИЧЕСКАЯ ХИМИЯОксид хрома (II) CrO черного цвета,
- 80. НЕОРГАНИЧЕСКАЯ ХИМИЯХроматы устойчивы в щелочной среде, а
- 81. НЕОРГАНИЧЕСКАЯ ХИМИЯОкислительные свойства соединений хрома(VI) наиболее сильно
- 82. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Свойства неорганических веществ
(задание 37 ЕГЭ по химии)
От названий
к формулам
Характеризуем
вещества
Слайд 7От названий к формулам
MnO2 (диоксид марганца) – пиролюзит
CrO3 (оксид хрома
(VI)) – хромовый ангидрид
Слайд 8Термины, используемые при описании эксперимента
Навеска — это просто некоторая порция
вещества определенной массы (её взвесили на весах).
Прокалить — нагреть
вещество до высокой температуры и греть до окончания химических реакций. «Взорвали смесь газов» — это значит, что вещества прореагировали со взрывом. Обычно для этого используют электрическую искру. Отфильтровать — отделить осадок от раствора.
Профильтровать — пропустить раствор через фильтр, чтобы отделить осадок.
Слайд 9Термины, используемые при описании эксперимента
Фильтрат — это профильтрованный раствор.
Растворение вещества
— это переход вещества в раствор. Оно может происходить без
химических реакций (например, при растворении в воде поваренной соли NaCl получается раствор поваренной же соли NaCl, а не щелочь и кислота отдельно), либо в процессе растворения вещество реагирует с водой и образует раствор другого вещества (при растворении оксида бария получится раствор гидроксида бария). Растворять можно вещества не только в воде, но и в кислотах, в щелочах и т.д.Выпаривание — это удаление из раствора воды и летучих веществ без разложения содержащихся в растворе твёрдых веществ.
Слайд 10Термины, используемые при описании эксперимента
Упаривание — это просто уменьшение массы
воды в растворе с помощью кипячения.
Сплавление — это совместное нагревание
двух или более твёрдых веществ до температуры, когда начинается их плавление и взаимодействие. Осадок и остаток. Очень часто путают эти термины. Хотя это совершенно разные понятия. «Реакция протекает с выделением осадка» — это означает, что одно из веществ, получающихся в реакции, малорастворимо. «Остаток» — это вещество, которое осталось, не истратилось полностью или вообще не прореагировало. Например, если смесь нескольких металлов обработали кислотой, а один из металлов не прореагировал — его могут назвать остатком.
Слайд 11Наиболее характерные признаки газов, растворов, твердых веществ
ГАЗЫ:
Окрашенные: Cl2 – желто-зеленый;
NO2 – бурый; O3 – голубой (все имеют запахи). Все
ядовиты, растворяются в воде, Cl2 и NO2 реагируют с ней.Бесцветные без запаха: Н2, N2, O2, CO2, CO (яд), NO (яд), инертные газы. Все плохо растворимы в воде.
Бесцветные с запахом: HF, HCl, HBr, HI, SO2 (резкие запахи), NH3(нашатырного спирта) –хорошо растворимы в воде и ядовиты,
PH3(чесночный), H2S(тухлых яиц) - мало растворимы в воде, ядовиты.
Слайд 16Последовательность превращений
Чёрный порошок, который образовался при длительном нагревании металла красного
цвета в избытке воздуха, растворили в 10%-ной серной кислоте и
получили раствор голубого цвета. В раствор добавили щёлочь и выпавший осадок отделили и растворили в избытке концентрированного раствора аммиака.Сu
CuO
СuSO4
Cu(OH)2
[Сu(NH3)4](OH) 2
Слайд 17Последовательность превращений
Сu
CuO
СuSO4
Cu(OH)2
[Сu(NH3)4](OH) 2
1) 2Сu + O2 = 2CuO
2) CuO +
H2SO4 = СuSO4 + H2O
3) СuSO4 + 2NaOH =Cu(OH)2↓ +
Na2SO44) Cu(OH)2 +4NH4OH = [Сu(NH3)4](OH) 2+ 4H2O
Слайд 18Последовательность превращений
Вещество красного цвета, которое используется в производстве спичек, сожгли
в избытке воздуха и продукт при нагревании растворили в большом
количестве воды. Раствор нейтрализовали негашеной известью. Образовавшееся вещество используют для получения двойного суперфосфата. Напишите уравнения описанных реакций.P P2O5 H3PO4 Ca3(PO4)2 Ca(H2PO4)2
Слайд 19Последовательность превращений
Вещество красного цвета, которое используется в производстве спичек, сожгли
в избытке воздуха и продукт при нагревании растворили в большом
количестве воды. Раствор нейтрализовали негашеной известью. Образовавшееся вещество используют для получения двойного суперфосфата. Напишите уравнения описанных реакций.1) 4P +5O2 = 2P2O5
2) P2O5+ 3H2O = 2H3PO4
3) 2H3PO4 + 3CaO =Ca3 (PO4)2↓ + 3H2O
4) Ca3 (PO4)2 +4H3PO4 = 3Сa(H2PO4)2
Слайд 20Свойства неорганических веществ
Задание 37 требует от участника ЕГЭ знание свойств
разнообразных неорганических веществ, связанных с протеканием как ОВР между веществами,
так и обменных реакций, протекающих в растворах.Реакция лития или магния с азотом:
6Li+N2=2Li3N
3Mg+N2=Mg3N2
Горение магния в углекислом газе:
2Mg+CO2=2MgO+C
Особое свойство плавиковой кислоты:
SiO2 + 4HF = 2H2O+ SiF4
Слайд 21Свойства неорганических веществ
Необходимо обратить внимание на окислительно-восстановительные реакции с участием
озона, которые встречаются в материалах ЕГЭ:
Na2S + 4O3 = Na2SO4+4O2
При
подготовке к ЕГЭ необходимо помнить, что железо, реагируя с фтором, хлором и бромом, окисляется до степени окисления +3 и образует галогениды FeF3, FeCl3, FeBr3, но в реакции с иодом оно дает иодид железа (II) FeI2Слайд 22Свойства неорганических веществ
Окислительные свойства солей трехвалентного железа:
2FeCl3+Cu=CuCl2+2FeCl2
2FeCl3+Fe=3FeCl2
Слайд 23Свойства неорганических веществ
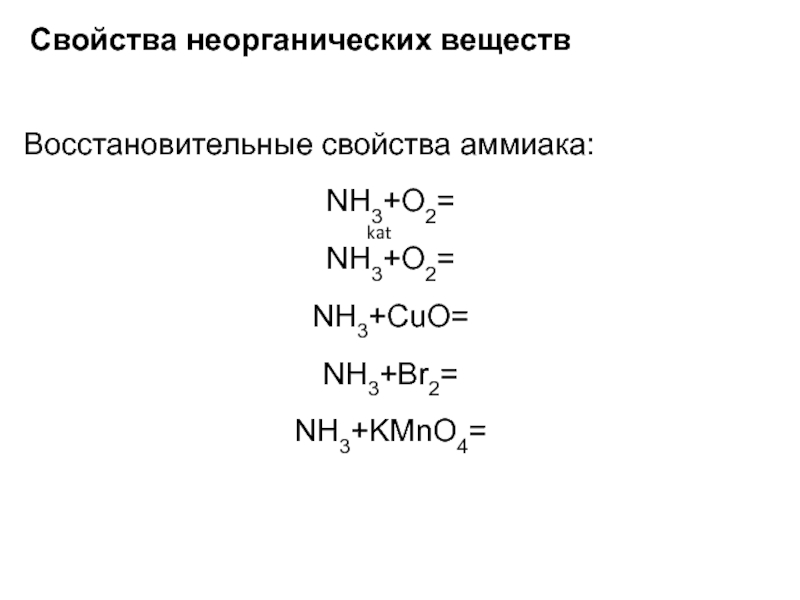
Восстановительные свойства аммиака:
NH3+O2=
NH3+O2=
NH3+CuO=
NH3+Br2=
NH3+KMnO4=
kat
Слайд 24Свойства неорганических веществ
Восстановительные свойства аммиака:
4NH3+3O2=2N2+6H2О
4NH3+5O2=4NO+6H2О
2NH3+3CuO=N2+3Cu+3H2О
8NH3+3Br2=N2+6NH4Br
2NH3+2KMnO4=N2+2MnO2+2KOH+2H2О
kat
Слайд 25Свойства неорганических веществ
Малохарактерные для него окислительные свойства аммиак проявляет в
реакциях с активными металлами:
2NH3+6Mg=2Mg3N2+3H2
2NH3+2Al=2AlN+3H2
Могут пригодиться знания об аммиачных комплексах:
CuSO4+4NH3=[Cu(NH3)4]SO4
AgCl+2NH3=[Ag(NH3)2]Cl
Слайд 26Свойства неорганических веществ
Трудными оказываются уравнения реакций, которые редко записывают или
вообще не употребляют в учебном процессе:
K2SО4 + Н2 =
Ag2SО4
+ Н2 =BaSО4 + Н2 =
Na2SО4 + C =
BaSО4 + C =
Na2SO3 + S =
Ca3(РО4)2 + Al =
Слайд 27Свойства неорганических веществ
Трудными оказываются уравнения реакций, которые редко записывают или
вообще не употребляют в учебном процессе:
K2SО4 + 4Н2 = К2S
+ 4Н2ОAg2SО4 + Н2 = 2Ag + Н2SО4
BaSО4 + 4Н2 = BaS + 4Н2О
Na2SО4 + 4C = Na2S + 4CО
BaSО4 + 4C = BaS + 4CО
Na2SO3 + S = Na2S2O3
3Ca3(РО4)2 + 16Al = 3Ca3Р2 + 8Al2О3
Слайд 28Кислоты. Основания. Соли. Оксиды.
Для получения азотной кислоты оксид азота (IV)
должен быть доокислен, например кислородом воздуха:
4NO2 + O2 + 2H2О
= 4HNO3Лабораторный способ получения хлороводорода: к твердому хлориду натрия приливают концентрированную серную кислоту
NaCl (тв.) + H2SO4(конц.) = NaHSO4 + HCl
Слайд 29Кислоты. Основания. Соли. Оксиды.
Для получения бромоводорода из бромида натрия, концентрированная
серная кислота не подойдет, так как выделяющийся бромоводород будет загрязнен
парами брома. Можно использовать концентрированную фосфорную кислоту:NaBr+ H3PO4 (конц.) = NaH2PO4 + HBr
Кислоты-неокислители реагируют с металлами, стоящими в ряду активности металлов до водорода, с выделением водорода и образованием соответствующей соли:
Fe + 2HCl = FeCl2 + H2
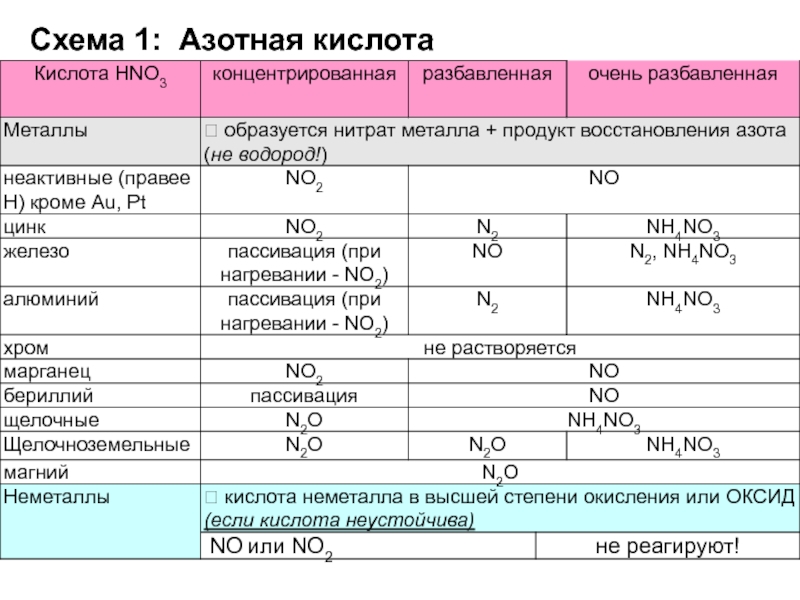
Слайд 32Окислительные свойства азотной и серной кислот в реакциях с неметаллами
P
+ HNO3 (конц.) =
S + HNO3 (конц.) =
H2S +
HNO3 (конц.) = FeS2 + HNO3 (конц.) =
Слайд 33Окислительные свойства азотной и серной кислот в реакциях с неметаллами
P
+ 5HNO3 (конц.) = H3PO4 + 5NO2 + H2O
S +
6HNO3 (конц.) = H2SO4 + 6NO2 + 2H2OH2S + 8HNO3 (конц.) = H2SO4 + 8NO2 + 4H2O
FeS2 + 8HNO3 (конц.) = Fe(NO3)3 + 2H2SO4 + 5NO + 2H2O
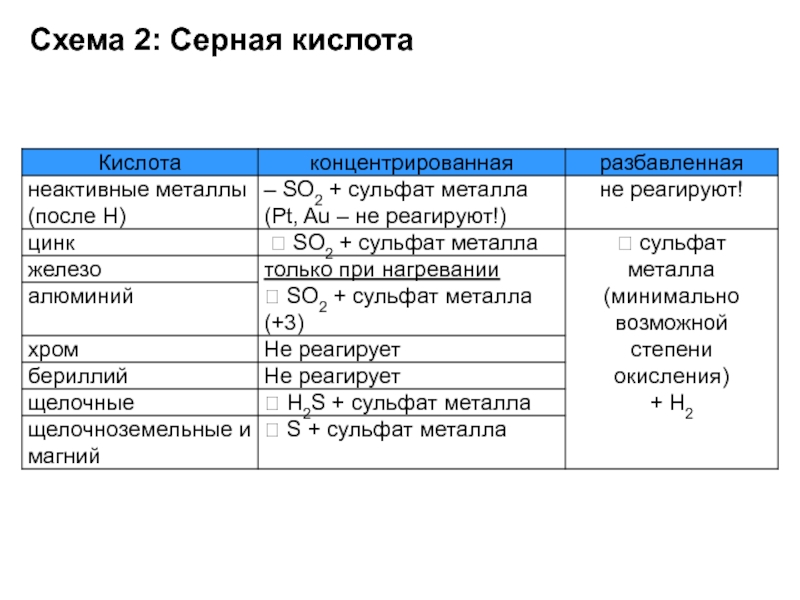
Слайд 34Кислоты. Основания. Соли. Оксиды.
HI + H2SO4 (конц.) =
HBr + H2SO4
(конц.) =
P + H2SO4 (конц.) =
Слайд 35Кислоты. Основания. Соли. Оксиды.
Серная кислота окисляет галогеноводороды HI и HBr
( но не HCl) до свободных галогенов, а неметаллы –
до соответствующих им кислот:8HI + H2SO4 (конц.) = H2S + 4I2 + 4H2O
2HBr + H2SO4 (конц.) = SO2 + Br2 + 2H2O
2P + 5H2SO4 (конц.) =2H3PO4 + 5SO2 + 2H2O
Слайд 36Кислоты. Основания. Соли. Оксиды.
Кислоты взаимодействуют с солями более слабых и
более летучих кислот:
Нелетучая, хотя и не самая сильная, серная кислота
вытесняет все кислоты из их солей, а ее не может вытеснить ни одна кислота.Исключение:
CuSO4+H2S=CuS+ Н2SO4
Слайд 37Кислоты. Основания. Соли. Оксиды.
Ортофосфорная кислота по первой стадии диссоциирует как
кислота средней силы, по второй - как слабая, а по
третьей стадии диссоциация настолько незначительна, что в растворе ничтожно мало ионов РО43-. Поэтому в ее растворе из анионов преобладают H2PO4-, в меньшем количестве присутствуют HPO42-.По этой причине фосфат калия в кислотной среде не образуется
Н3РО4 + КОН = КН2РО4 + Н2О
2Н3РО4 + 2К = 2КН2РО4 + Н2
Слайд 38Кислоты. Основания. Соли. Оксиды.
Фосфат калия можно получить лишь при избытке
щелочи:
Н3РО4 + 3КОН(изб.) = К3РО4 + 3Н2О
Продуктом реакции аммиака с
фосфорной кислотой может также быть кислая соль:NH3 + H3PO4 = NH4H2PO4
Избыток щелочи переводит кислые соли в средние:
Na2НРО4 + NaОН (изб.) = Na3РО4 + Н2О
Слайд 39Кислоты. Основания. Соли. Оксиды.
Чтобы получить из основной соли среднюю соль
нужно подействовать кислотой:
MgOHCl + HCl = MgCl2 + H2O
При
добавлении сильной кислоты все соли ортофосфорной кислоты превращаются в дигидрофосфаты, которые растворимы в воде:Na3РО4 + 2НCl = NaН2РО4 + 2NaCl
РО43-+ 2Н+= Н2РО4-
Общее свойство всех нерастворимых фосфатов – их растворимость в растворах сильных кислот:
Ca3(РО4)2 + 4HNО3 = Са(H2РО4)2 + 2Ca(NО3)2
Слайд 40Кислоты. Основания. Соли. Оксиды.
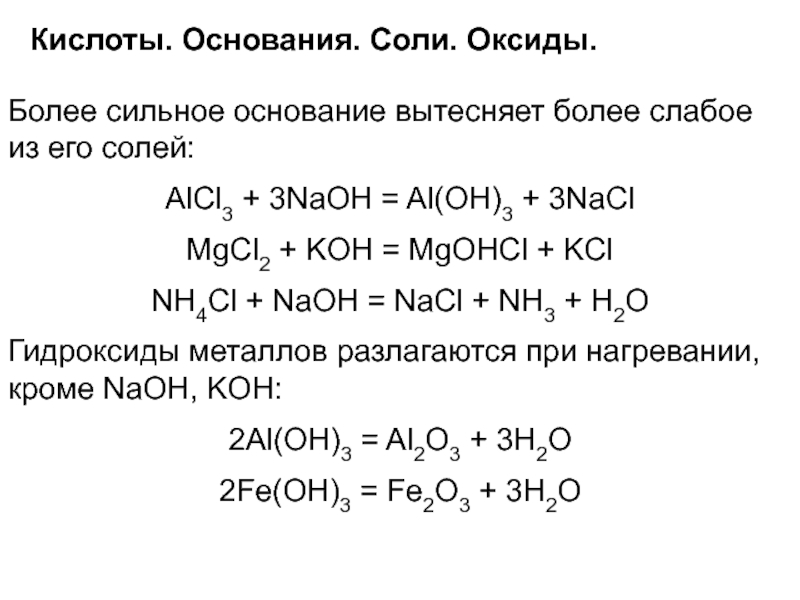
Более сильное основание вытесняет более слабое из
его солей:
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl
MgCl2 + KOH
= MgOHCl + KClNH4Сl + NaOH = NaCl + NH3 + H2O
Гидроксиды металлов разлагаются при нагревании, кроме NaOH, KOH:
2Al(OH)3 = Al2O3 + 3H2O
2Fe(OH)3 = Fe2O3 + 3H2O
Слайд 41Кислоты. Основания. Соли. Оксиды.
Определенную трудность могут представлять окислительно-восстановительные реакции щелочей
с неметаллами:
Cl2 + 2KOH = KCl + H2O + KClO
(на холоду)(аналогично с Br2, I2)
Cl2 + 6KOH = 5KCl + KClO3 + 3H2O (при нагревании)
(аналогично с Br2, I2)
Si + 2KOH+ H2O = K2SiO3 + 2H2
3S + 6KOH = K2SO3 + 2K2S+ 3H2O
8P + 3Ba(OH)2+ 6H2O = 3Ba(H2PO2)2 + 2PH3
гипофосфит бария
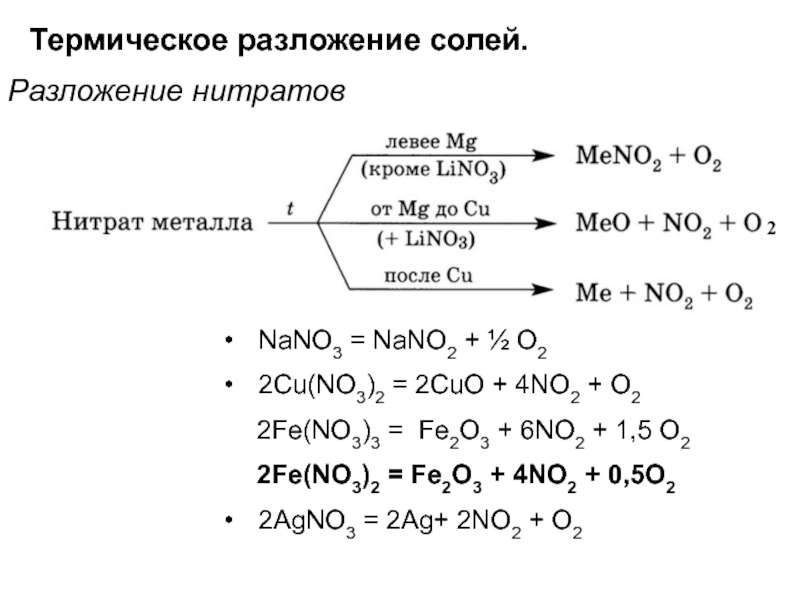
Слайд 42Термическое разложение солей.
Разложение нитратов
NaNO3 = NaNO2 + ½ O2
2Cu(NO3)2 =
2CuO + 4NO2 + О2
2Fe(NO3)3 = Fe2O3
+ 6NO2 + 1,5 O22Fe(NO3)2 = Fe2O3 + 4NO2 + 0,5O2
2AgNO3 = 2Ag+ 2NO2 + O2
Слайд 43Термическое разложение солей.
Разложение солей аммония
На аммиак и соответствующую кислоту разлагаются
при нагревании только те соли аммония, которые содержат анион, не
обладающий окислительными свойствами:(NH4)2CO3 = 2NH3 + CO2+ H2O
(NH4)2HPO4 = 2NH3 + H3PO4
Чем сильнее кислота, тем труднее разложить соль:
(NH4)2SO4 = 2NH3 + NH4HSO4
Если анион соли обладает окислительными свойствами, то аммиак не образуется:
NH4NO3 = N2O + 2H2O
NH4NO2 = N2 + 2H2O
(NH4)2Cr2O7 = N2 + Cr2O3+ 4H2O
Слайд 44Термическое разложение солей.
Разложение солей угольной кислоты
Не разлагаются при нагревании карбонаты
щелочных металлов (кроме Li2CO3).
Все остальные карбонаты и карбонат лития разлагаются
на оксид металла и углекислый газ:Li2CO3= Li2O + CO2
СaCO3= CaO + CO2
Все гидрокарбонаты разлагаются сначала до карбонатов:
Ca(HCO3)2 = СaCO3 + CO2+ H2O
При дальнейшем нагревании образовавшийся карбонат разлагается, как показано выше.
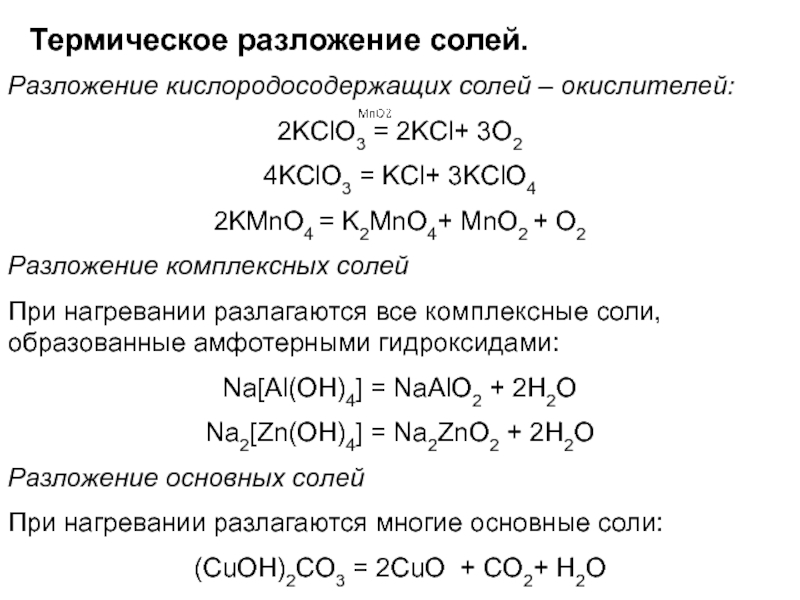
Слайд 45Термическое разложение солей.
Разложение кислородосодержащих солей – окислителей:
2KClO3 = 2KCl+ 3O2
4KClO3 = KCl+ 3KClO4
2KMnO4 = K2MnO4+ MnO2 + O2
Разложение
комплексных солей При нагревании разлагаются все комплексные соли, образованные амфотерными гидроксидами:
NaAl(OH)4 = NaAlO2 + 2H2O
Na2[Zn(OH)4] = Na2ZnO2 + 2H2O
Разложение основных солей
При нагревании разлагаются многие основные соли:
(CuOH)2CO3 = 2CuO + CO2+ H2O
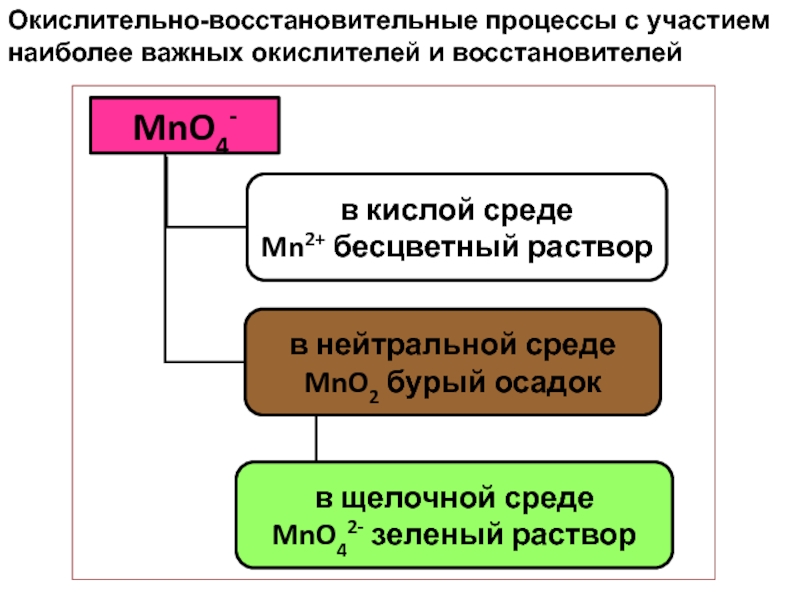
Слайд 46Окислительно-восстановительные процессы с участием наиболее важных окислителей и восстановителей
Слайд 47Окислительно-восстановительные процессы с участием наиболее важных окислителей и восстановителей
Слайд 48Окислительно-восстановительные процессы с участием наиболее важных окислителей и восстановителей
кислотная среда:
5Na2SО3
+ 2КМnО4 + 3H2SO4 = 2MnSO4 +K2SO4 + 5Na2SО4 +
ЗН2Ощелочная среда:
Na2SО3 + 2КМnО4 + 2KOH =2 K2MnO4 + Na2SО4 + Н2О
нейтральная среда:
3Na2SО3 + 2КМnО4 + H2O = 2MnO2 + 3Na2SО4 +2 KOН
Примеры:
P + КМnО4 + H2SO4 =
NH3 + KMnO4 =
K2Cr2O7 + C + H2SO4 =
Слайд 49Окислительно-восстановительные процессы с участием наиболее важных окислителей и восстановителей
Примеры:
P +
2КМnО4 + H2SO4 = 2MnSO4 + KH2PO4
2NH3 + 2KMnO4 =
N2 + 2MnO2 + 2KOH + 2H2O2K2Cr2O7 + 3C + 8H2SO4 = 3CO2 +2Cr2(SO4)3+2K2SO4+ 8H2O
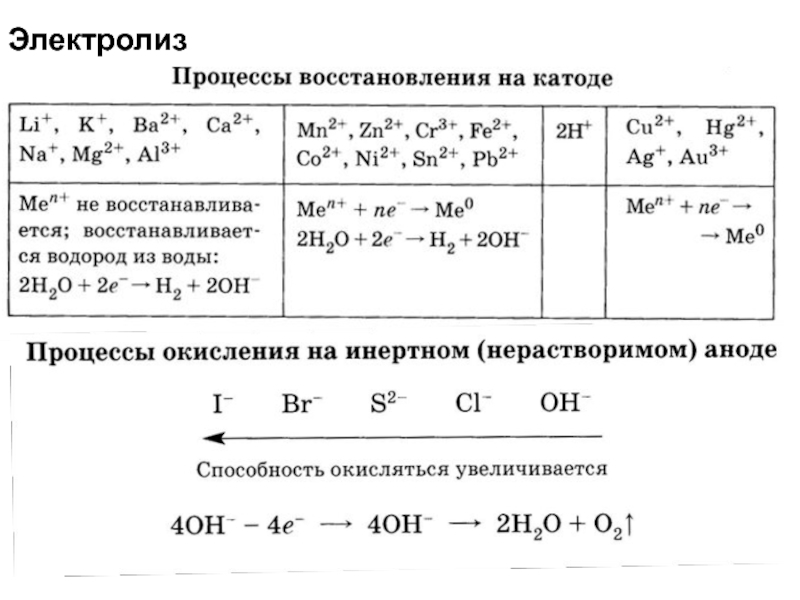
Слайд 51Электролиз
Электролиз растворов солей металлов, стоящих в ряду напряжения
после водорода:
2HgSO4
+ 2H2O = 2Hg + О2 + 2H2SO4
1) на катоде:
Hg2+ + 2e = Hg°2) на аноде: 2Н2О – 4е = О2 + 4Н+
до водорода:
СаI2 + 2Н2О = Н2 + I2 + Са(ОН)2
1) на катоде: 2Н2О + 2e = 2ОН + Н2
2) на аноде: 2I- - 2e = I2
электролиз раствора сульфата натрия:
1) на катоде: 2H2O + 2e = H2 + 2OH–
2) на аноде: 2H2O – 4e = O2 + 4H+
3) Составлено общее уравнение электролиза:
2H2O = 2H2 + O2
Слайд 52Электролиз
При электролизе солей, образованных металлами, находящимися в ряду активности между
алюминием и водородом
4FeCl3 + 6 H2O = 3H2 +
2 Fe + 6Cl2 + 2Fe (OH)3на катоде происходит конкурирующие восстановление катиона металла и воды, в результате на катоде выделяются металл и водород, а в растворе образуется гидроксид соответствующего металла; на аноде происходит окисление анионов бескислородных кислот, в частности выделяется Cl2.
Слайд 53Электролиз солей карбоновых кислот
CH3CH2COONa CH3CH2COO- + Na+
H2O
-К
Na+:
-A
CH3CH2COOO- - ē = CH3CH2COO· свободный радикал, неустойчив
H2O:
Анод = графит – инертный!
2H2O + 2ē = H20 + 2OH-
CH3CH2COO· = CO2 + C2H5· свободный радикал, неустойчив
CH3CH2· + C2H5· = CH3CH2–CH2CH3
2CH3CH2COONa + 2H2O =
= H2 + 2NaOH + 2CO2 + CH3CH2-CH2CH3
Слайд 54Электрохимический ряд напряжения металлов
Чем ближе стоит металл к началу ряда,
тем сильнее его восстановительные свойства и тем слабее окислительная способность
его ионов.Металлы, стоящие до водорода, способны вытеснять его из растворов кислот. Но следует иметь в виду, что свинец, стоящий перед водородом, не может вытеснить его из раствора серной кислоты, так как при контакте с этой кислотой на поверхности металла сразу же образуется защитный слой нерастворимого сульфата PbSO4. Этот слой изолирует металл от кислоты.
Слайд 55Электрохимический ряд напряжения металлов
Металлы, стоящие до магния (щелочные и щелочно
– земельные), вытесняют водород также из воды и любого водного
раствора. По этой причине уравнения реакций между этими металлами и растворами кислот- неокислителей (HCl, HBr, HI, H2SO4 (разб.)) не записывают.По этой же причине не записывают уравнения реакций щелочных и щелочно – земельных металлов с растворами солей. Щелочной металл не вытесняет менее активный металл из раствора его соли.
Электрохимический ряд напряжений характеризует восстановительную способность металлов в водных растворах солей и не применим к расплавам солей.
Например: 2Al + 3CaCl2 = 2AlCl3 + 3Ca
расплав
Слайд 56Гидролиз
При сливании растворов солей, содержащих катион слабого основания и анион
слабой кислоты, соль не образуется, так как идет гидролиз и
по катиону, и по аниону:Al2(SO4)3 + 3K2CO3 + 3H2O = 2Al(OH)3 + 3CO2 + 3K2SO4
2FeCl3 + 3K2CO3 + 3H2O = 2Fe(OH)3 + 3CO2 + 6KCl
2AlBr3 + 3K2CO3 + 3H2O = 2Al(OH)3 + 3CO2 + 6KBr
2AlCL3 + 3Na2S + 6H2O = 2Al(OH)3 + 3H2S + 6NaCl
Гидролиз следует учитывать, рассматривая реакции металлов с растворами солей.
Mg + 2NН4Cl = MgCl2 + 2NH3+ 2H2
Растворы солей, имеющие кислую реакцию среды, вследствие гидролиза, способны растворять активные металлы, например, магний или цинк:
Mg+MgCl2+2H2O=2MgOHCl+H2
Слайд 57Гидролиз
Особую трудность вызывают сложные случаи взаимодействия растворов веществ солей подвергающихся
гидролизу. Так для взаимодействия раствора сульфата магния с карбонатом натрия
можно записать целых три уравнения возможных процессов:MgSO4+Na2CO3=MgCO3+Na2SO4
2MgSO4+2Na2CO3+H2O=(MgOH)2CO3+2Na2SO4+CO2
2MgSO4+2Na2CO3+2H2O=2Mg(OH)2+2Na2SO4+2CO2
Составление подобных уравнений реакций может потребоваться при выполнении заданий № 37 ЕГЭ по химии.
3K[Al(OH)4] + AlCl3 = 3KCl + 4Al(OH)3
3Cl2 + 3K2CO3 = KClO3 + 3CO2 + 5KCl
Слайд 58Гидролиз бинарных соединений
Al4C3 + Н2О =
Al2S3 + Н2О =
BaS+ Н2О
=
CaC2 + Н2О =
Ca3P2 + Н2О =
CaH2 + Н2О
= SiH4 + Н2О =
Mg3N2 + Н2О =
PCl3 + H2O =
PCl5 + H2O =
Слайд 59Гидролиз бинарных соединений
Al4C3 + 12Н2О = 4Аl(ОН)3 + ЗСН4
Al2S3 +
6Н2О = 2Аl(ОН)3 + ЗН2S
BaS+ 2Н2О = Ba(ОН)3 + Н2S
CaC2
+ 2Н2О = Ca(ОН)2 + С2Н2Ca3P2 + 6Н2О = 3Ca(ОН)2 + 2PН3
CaH2 + 2Н2О = Ca(ОН)2 + 2Н2
SiH4 + 2Н2О = SiО2 + 4Н2
Mg3N2 + 6Н2О = 3Mg(ОН)2 + 2NH3
PCl3 + 3H2O = H3PO3 + 3HCl
PCl5 + 4H2O = H3PO4 + 5HCl
Не гидролизуются: SF6, NF3, CF4, CS2, AlN, Si3N4, SiC, Li4Si
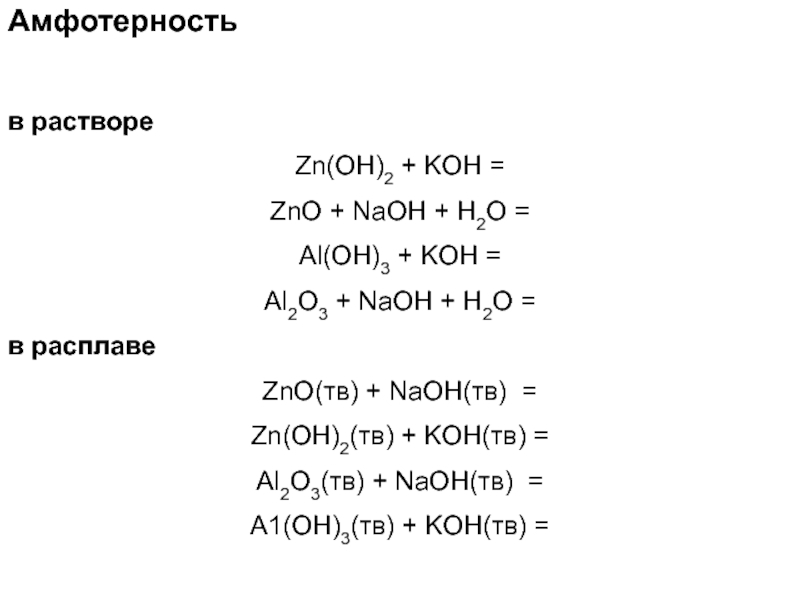
Слайд 60Амфотерность
в растворе
Zn(OH)2 + KOH =
ZnO + NaOH + H2O
=
Al(OH)3 + KOH =
Al2O3 + NaOH + H2O =
в расплаве
ZnO(тв) + NaOH(тв) =
Zn(OH)2(тв) + KOH(тв) =
Al2O3(тв) + NaOH(тв) =
A1(OH)3(тв) + KOH(тв) =
Слайд 61Амфотерность
в растворе
Zn(OH)2 + 2KOH = K2[Zn(OH)4]
ZnO + 2NaOH + H2O
= Na2[Zn(OH)4]
Al(OH)3 + KOH = K[Al(OH)4]
Al2O3 + 2NaOH +
3H2O = 2Na[Al(OH)4] в расплаве
ZnO(тв) + 2NaOH(тв) = Na2ZnО2 + H2O
Zn(OH)2(тв) + 2KOH(тв) = K2ZnО2 + 2H2O
Al2O3(тв) + 2NaOH(тв) = 2NaAlO2 + H2O
A1(OH)3(тв) + KOH(тв) = NaAlO2 + 2H2O
Слайд 62Амфотерность
Слабо амфотерные гидроксиды железа (III) и хрома (III) реагируют лишь
с расплавами щелочей или с концентрированными растворами щелочей:
с расплавами щелочей
Cr(OH)3(тв)
+ KOH(тв) = KCrО2 + 2H2OFe(OH)3(тв) + KOH(тв) = KFeO2 + 2H2O
с концентрированными растворами щелочей
Cr(OH)3 + 3KOH(конц.) = K3[Cr(OH)6]
Fe(OH)3 + 3KOH(конц.) = K3[Fe(OH)6]
Заметим, что в материалах ЕГЭ можно встретить и такое уравнение реакции:
Fe(OH)3 + KOH = K[Fe(OH)4]
Слайд 63Амфотерность
Металлы, оксиды и гидроксиды которых амфотерны, также могут реагировать и
с кислотами, и со щелочами:
Be + 2NaOH + 2H2O =
Na2[Be(OH)4] + H2Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Для хрома и железа подобная реакция не характерна.
При гидролизе солей, полученных из амфотерных соединений, образуются комплексные соли:
KAlO2 + 2H2O = K [Al(OH)4]
Амфотерные оксиды при сплавлении реагируют с карбонатами активных металлов:
Al2O3 + K2CO3 = 2KAlO2 + CO2
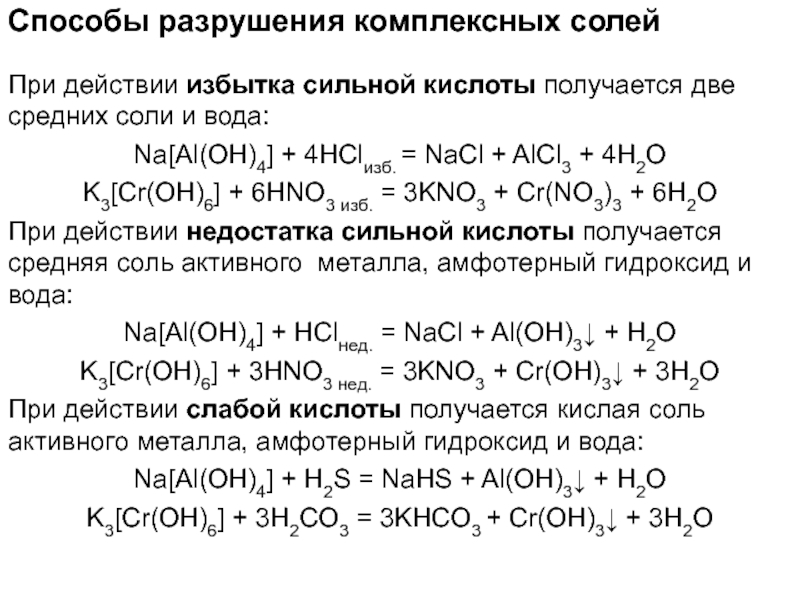
Слайд 64Способы разрушения комплексных солей
При действии избытка сильной кислоты получается
две средних соли и вода:
NaAl(OH)4 + 4HClизб. = NaCl +
AlCl3 + 4H2OK3Cr(OH)6 + 6HNO3 изб. = 3KNO3 + Cr(NO3)3 + 6H2O
При действии недостатка сильной кислоты получается средняя соль активного металла, амфотерный гидроксид и вода:
NaAl(OH)4 + HClнед. = NaCl + Al(OH)3 + H2O
K3Cr(OH)6 + 3HNO3 нед. = 3KNO3 + Cr(OH)3 + 3H2O
При действии слабой кислоты получается кислая соль активного металла, амфотерный гидроксид и вода:
NaAl(OH)4 + H2S = NaHS + Al(OH)3 + H2O
K3Cr(OH)6 + 3H2CO3 = 3KHCO3 + Cr(OH)3 + 3H2O
Слайд 65Способы разрушения комплексных солей
При действии углекислого или сернистого газа
получается кислая соль активного металла и амфотерный гидроксид:
NaAl(OH)4 + CO2
= NaHCO3 + Al(OH)3K3Cr(OH)6+ 3SO2 = 3KHSO3 + Cr(OH)3
При действии солей, образованных сильными кислотами и катионами Fe3+, Al3+ и Cr3+ происходит взаимное усиление гидролиза, получается два амфотерных гидроксида и соль активного металла:
3NaAl(OH)4 + FeCl3 = 3Al(OH)3 + Fe(OH)3 + 3NaCl
K3Cr(OH)6 + Al(NO3)3 = Al(OH)3 + Cr(OH)3 + 3KNO3
При нагревании выделяется вода:
NaAl(OH)4 = NaAlO2 + 2H2O
K3Cr(OH)6 = KCrO2 + 2H2O + 2KOH
Слайд 66НЕОРГАНИЧЕСКАЯ ХИМИЯ
Оксид азота (I), оксид диазота, закись азота, «веселящий газ»
слабый
окислитель:
2N2O =2N2 + O2
N2O +H2 =N2 + H2O
6N2O + P4
= 6N2 + P4O62N2O + C (графит) = 2N2 + CO2
слабый восстановитель:
N2O + H2SO4(конц., гор.) = 2NO + SO2+ H2O
Оксид азота (II), монооксид азота.
2NO + O2 = 2NO2
2NO + C(графит) = N2+ CO2
2NO + 2Mg = N2+ 2MgO
Азот
Слайд 67НЕОРГАНИЧЕСКАЯ ХИМИЯ
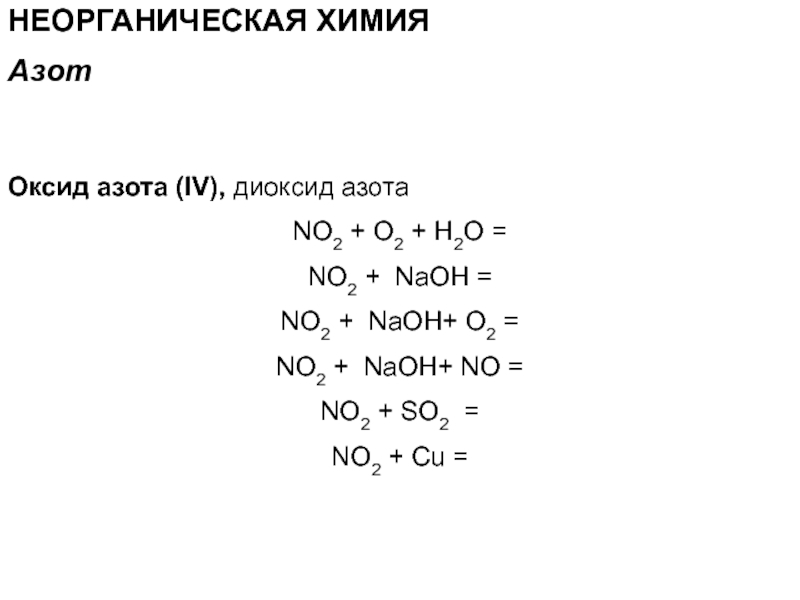
Оксид азота (IV), диоксид азота
NO2 + O2 + H2О
=
NO2 + NaOH =
NO2 + NaOH+ O2 =
NO2
+ NaOH+ NO =NO2 + SO2 =
NO2 + Cu =
Азот
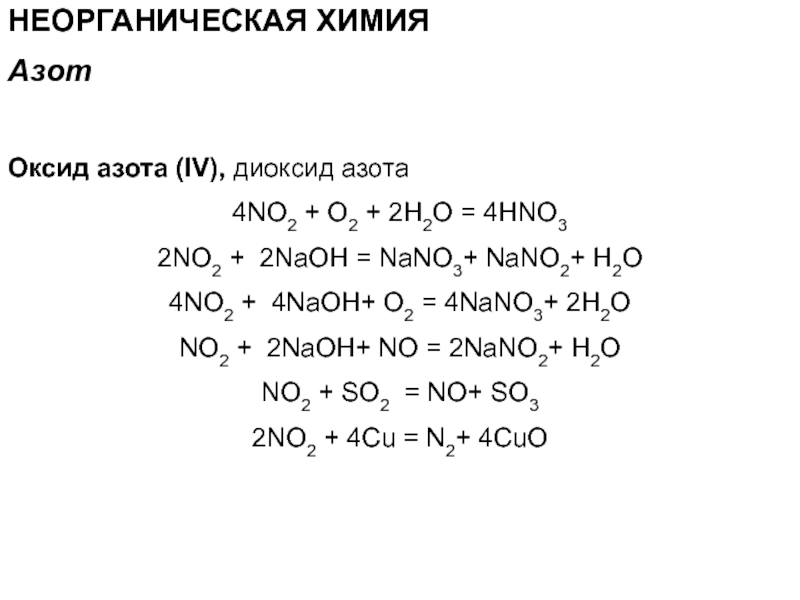
Слайд 68НЕОРГАНИЧЕСКАЯ ХИМИЯ
Оксид азота (IV), диоксид азота
4NO2 + O2 + 2H2О
= 4HNO3
2NO2 + 2NaOH = NaNO3+ NaNO2+ H2O
4NO2 + 4NaOH+
O2 = 4NaNO3+ 2H2ONO2 + 2NaOH+ NO = 2NaNO2+ H2O
NO2 + SO2 = NO+ SO3
2NO2 + 4Cu = N2+ 4CuO
Азот
Слайд 69НЕОРГАНИЧЕСКАЯ ХИМИЯ
Получение:
16HCl + 2KMnO4 =5Cl2 + 2MnCl2 + 2KCl +
8H2O
4HCl + MnO2 =Cl2 + MnCl2 + 2H2O
Cвойства
С менее электроотрицательными
неметаллами:2P + 5Cl2 = 2PCl5
2P + 3PCl5 = 5PCl3
2S + Cl2 = S2Cl2
S2Cl2 + Cl2 = 2SCl2
Важно отметить, что непосредственно с азотом и кислородом хлор не взаимодействует.
Галогены
Слайд 70НЕОРГАНИЧЕСКАЯ ХИМИЯ
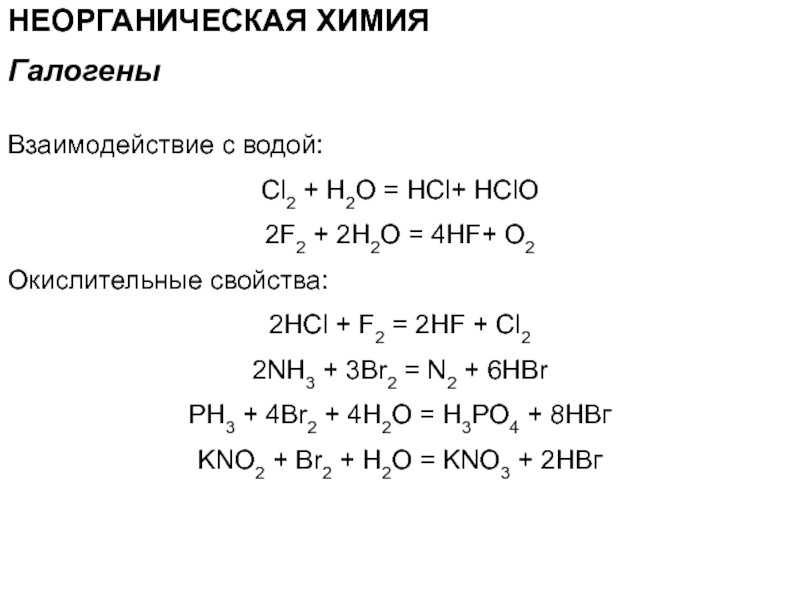
Взаимодействие с водой:
Cl2 + H2O = HCl+ HClO
2F2 +
2H2O = 4HF+ O2
Окислительные свойства:
2HCl + F2 = 2HF +
Cl22NH3 + 3Br2 = N2 + 6HBr
PH3 + 4Br2 + 4Н2О = Н3РО4 + 8НВг
KNO2 + Br2 + Н2О = KNO3 + 2НВг
Галогены
Слайд 71НЕОРГАНИЧЕСКАЯ ХИМИЯ
Галогены не взаимодействуют с кислотами.
Только I2 при взаимодействии
с концентрированной азотной кислотой образует иодноватую кислоту HIO3:
I2 +
10HNO3 (конц.) = 2HIO3 + 10NO2+ 4H2OГалогеноводороды
Восстановительные свойства (кроме HF):
6HCl + 2HNO3 (конц.) = 3Cl2 + 2NO+ 4H2O
4HI + MnO2 = I2 + MnI2 + 2H2O
2HBr + H2SO4 = Br2 + SO2 + 2H2O
8HI + H2SO4 = 4I2 + H2S + 4H2O
2HI + Br2 = 2HBr + I2
Галогены
Слайд 72НЕОРГАНИЧЕСКАЯ ХИМИЯ
Особым свойством серы является взаимодействие ее с сульфитами и
образование тиосульфатов, солей несуществующей в свободном состоянии тиосерной кислоты H2S2O3:
Na2SO3
+ S = Na2S2O3При действии на тиосульфаты кислот происходит их разложение с образованием серы и сернистого газа:
Na2S2O3 + H2SO4 = Na2SO4 + SO2 + S + H2O
Сера
Слайд 73НЕОРГАНИЧЕСКАЯ ХИМИЯ
Оксид серы (IV) может быть доокислен кислородом:
2SO2 + O2
= 2SO3
2SO2 + O2 + 2H2O = 2H2SO4
и выступать в
роли окислителя:SO2 + 2H2S = 3S + 2H2O
и в роли восстановителя:
SO2 + PbO2 = PbSO4
SO2 + Br2 + 2H2O = H2SO4+ 2НBr
SO2 + NO2 + H2O = H2SO4+ NO
3SO2 + 2КМnО4 + 2H2O = 2H2SO4+ 2MnO2+ K2SО4
окислительные свойства оксида серы (VI):
5SO3 + 2P = 5SO2+ P2O5
Сера
Слайд 74НЕОРГАНИЧЕСКАЯ ХИМИЯ
получение фосфора:
Са3(Р04)2 + 5С + 3SiO2 = 3CaSiO3 +
5СО + 2Р
взаимодействие с азотной кислотой:
3P + 5HNO3 + 2H2O
= 3H3PO4 + 5NOсо щелочами:
4P + 3NaOH + 3H2O = 3NaH2PO2 + PH3
с солями – окислителями:
6P + 5KClO3 = 3P2O5 + 5KCl (со взрывом).
Фосфор
Слайд 75НЕОРГАНИЧЕСКАЯ ХИМИЯ
При взаимодействии железа с галогенами образуются галогениды состава FeF3,
FeCl3, FeBr3, но в реакции с иодом - FeI2
Fe +
I2 = FeI2Железо пассивируется концентрированными серной и азотной кислотами, но при нагревании реагирует с ними:
2Fe + 6H2SO4(конц.) = Fe2(SO4)3 + 3SO2+ 6H2O
Fe + 6HNO3(конц.) = Fe(NO3)3 + 3NO2+ 3H2O
Железо взаимодействует со щелочными расплавами окислителей:
Fe + 3KNO3 + 2KOH = K2FeO4 + 3KNO2+ H2O
Металлы побочных подгрупп. Железо.
Слайд 76НЕОРГАНИЧЕСКАЯ ХИМИЯ
Оксид железа (II) FeO обладает основными и восстановительными свойствами.
FeO
+ 2HI = FeI2 +H2O
FeO + 4HNO3(конц.) = Fe(NO3)3 +
NO2+ 2H2OОксид железа (III) обладает слабоамфотерными свойствами:
Fe2O3 + 6HNO3 = 2Fe(NO3)3+ 3H2O
С растворами щелочей он не взаимодействует. При сплавлении со щелочами и карбонатами щелочных металлов образуются ферриты:
Fe2O3 + 2NaOH = 2NaFeO2+ H2O
Fe2O3 + Na2CO3 = 2NaFeO2+ CO2
Для него характерны также окислительные свойства:
Fe2O3 + 6HI = 2FeI2+ I2+3H2O
(реакция обмена невозможна, так как Fe+3 – окислитель, I-1 – восстановитель; по той же причине FeI3 – не существует).
Металлы побочных подгрупп. Железо.
Слайд 77НЕОРГАНИЧЕСКАЯ ХИМИЯ
Гидроксид железа (II) Fe(OH)2 проявляет основные и восстановительные свойства:
Fe(OH)2 + 2HCl = FeCl2 + 2H2O
2Fe(OH)2 + H2O2 =
2Fe(OH)34Fe(OH)2 + O2 = 4FeO(OH)+ 2H2O
Fe(OH)2 + 2Br2 + 6NaOH = Na2FeO4+ 4NaBr+ 4H2O
В материалах ЕГЭ встречается такая запись состава гидроксида железа(III): FeO(OH) – метагидроксид железа (III). Он проявляет слабоамфотерные и окислительные свойства:
2FeO(OH) + 3H2SO4= Fe2(SO4)3 + 4H2O
FeO(OH) + 3NaOH(конц.)+H2O= Na3[Fe(OH)6] + 4H2O
2FeO(OH) + 6HI= 2FeI2 + 4H2O + I2
Металлы побочных подгрупп. Железо.
Слайд 78НЕОРГАНИЧЕСКАЯ ХИМИЯ
Соли Fe3+ сильно гидролизуются, поэтому активные металлы растворяются в
них с выделением водорода:
FeCl3 + 2H2O + Zn = Fe(OH)2Cl
+ ZnCl2+ H2Соли Fe3+ - окислители, соли Fe2+ - восстановители:
2FeCl3 + Fe = 3FeCl2
3FeCl3 + Cu = 2FeCl2 + CuCl2
2FeCl2 + Cl2 = 2FeCl3
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Ферраты – сильные окислители:
2Na2FeO4+ 16HCl = 3Cl2 + 4NaCl+ 2FeCl3 + 8H2O
Обратим внимание на реакции соединений железа, где в окислительно-восстановительном процессе участвуют три элемента:
FeS2 + 8HNO3 = Fe(NO3)3 + 5NO+2H2SO4+2H2O
Металлы побочных подгрупп. Железо.
Слайд 79НЕОРГАНИЧЕСКАЯ ХИМИЯ
Оксид хрома (II) CrO черного цвета, соответствующий гидроксид Cr(OH)2
– желтого.
Оксид хрома (III) Cr2O3 в виде порошка темно-зеленого
цвета, в кристаллическом состоянии он черный с металлическим блеском. Гидроксид хрома (III) Cr(OH)3 – серо-зеленый. Оба соединения амфотерны. Реагируя с избытком щелочи, гидроксид хрома (III) образует изумрудно-зеленое соединение состава Na3Cr(OH)6.Оксид хрома (VI) CrO3 – это кислотный оксид темно-красного цвета. При его растворении в воде образуются две кислоты: хромовая H2CrO4 и дихромовая H2Cr2O7. Это сильные кислоты, дихромовая существует только в растворе. Соли хромовой кислоты – хроматы (K2CrO4, Na2CrO4 – желтого цвета, соли дихромовой кислоты – дихроматы (K2Cr2O7, Na2Cr2O7 – оранжевого цвета.
Металлы побочных подгрупп. Хром.
Слайд 80НЕОРГАНИЧЕСКАЯ ХИМИЯ
Хроматы устойчивы в щелочной среде, а дихроматы – в
кислотной.
Na2Cr2O7 +2KOH = Na2CrO4 + K2CrO4+ H2O
2K2CrO4 +H2SO4 = K2Cr2O7
+ K2SO4+ H2OПри действии на дихроматы концентрированной серной кислотой образуется оксид хрома (VI):
K2Cr2O7 +2H2SO4 = 2CrO3 +2KHSO4+ H2O
Оксид хрома (VI) и дихроматы – сильнейшие окислители. Хроматы – окислители более слабые, чем дихроматы:
2K2CrO4 +2H2O+3H2S= 2Cr(OH)3 + 3S+ 4KOH
K2Cr2O7 +H2O+3H2S= 2Cr(OH)3 + 3S+ 2KOH
Металлы побочных подгрупп. Хром.
Слайд 81НЕОРГАНИЧЕСКАЯ ХИМИЯ
Окислительные свойства соединений хрома(VI) наиболее сильно выражены в кислотной
среде, а восстановительные свойства соединений хрома (III) - в щелочной:
K2Cr2O7
+H2SO4+ 3SO2 = Cr2(SO4)3 +K2SO4+ H2OCr2(SO4)3 +3H2O2+ 10NaOH = 2Na2CrO4+3Na2SO4+ 8H2O
Металлы побочных подгрупп. Хром.















 21) 2Сu + O2 = 2CuO2) CuO + H2SO4 Последовательность превращенийСuCuOСuSO4Cu(OH)2[Сu(NH3)4](OH) 21) 2Сu + O2 = 2CuO2) CuO + H2SO4 = СuSO4 + H2O3) СuSO4 +](/img/thumbs/945801a55d84c8904fbd5ca5440b65d0-800x.jpg)


































![Свойства неорганических веществ Амфотерностьв раствореZn(OH)2 + 2KOH = K2[Zn(OH)4]ZnO + 2NaOH + H2O = Амфотерностьв раствореZn(OH)2 + 2KOH = K2[Zn(OH)4]ZnO + 2NaOH + H2O = Na2[Zn(OH)4] Al(OH)3 + KOH = K[Al(OH)4]Al2O3](/img/thumbs/fa8d6ebcfeba8a5a689a9bbc6240acda-800x.jpg)