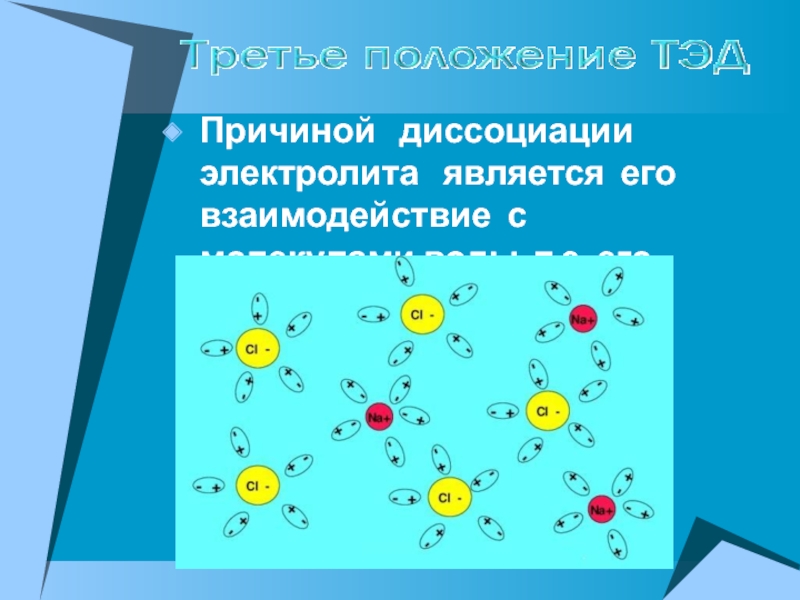
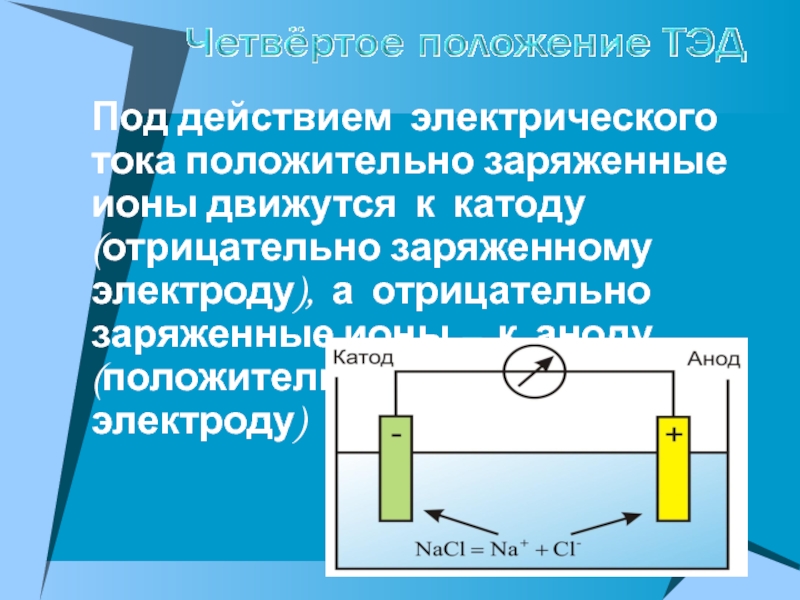
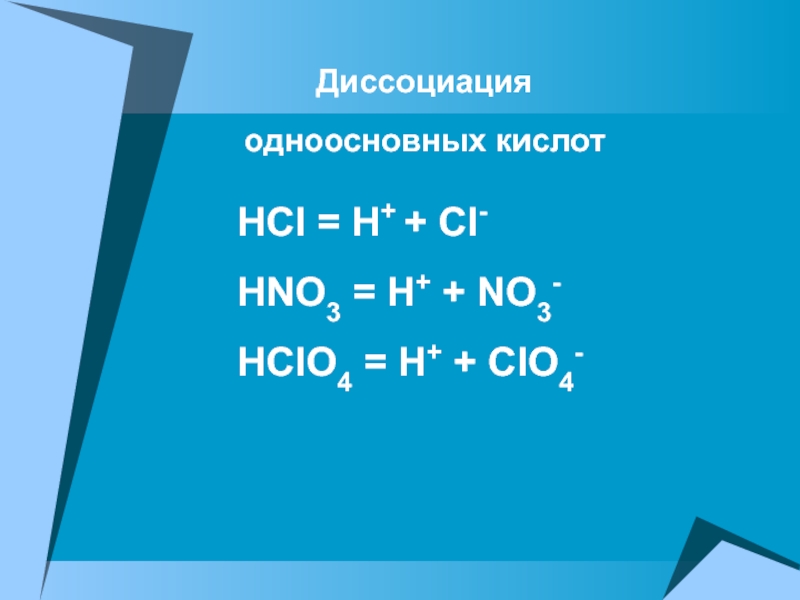
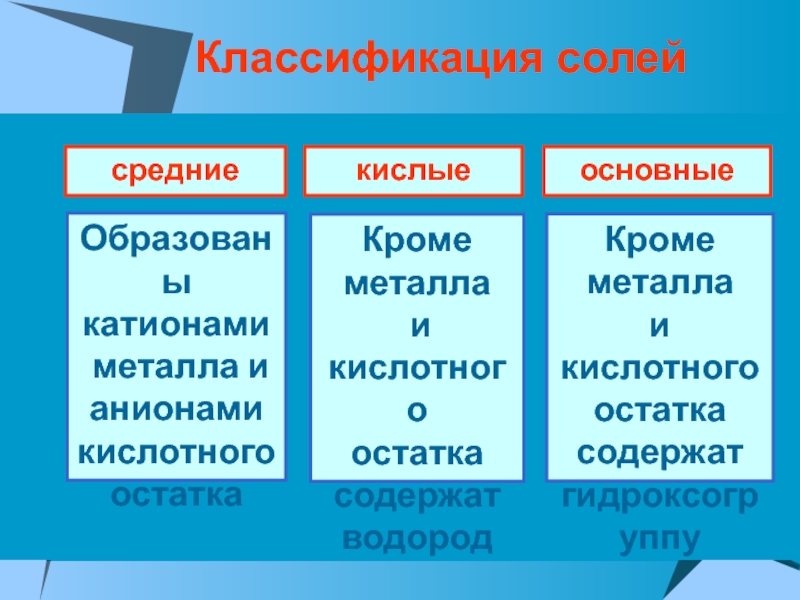
ПРОВОДЯТ электрический ток
их растворы
или расплавы
НЕ ПРОВОДЯТ электрический ток
Вид
химической связиИонная или ковалентная
сильно полярная
Ковалентная неполярная
или мало полярная